模拟增温与增雨对克氏针茅光合作用的影响
闫玉龙,张立欣,万志强,谷 蕊,苏力德,杨 劼,高清竹(1.内蒙古大学生命科学学院,内蒙古呼和浩特010021;2.中国农业科学院农业环境与可持续发展研究所,北京100081;.内蒙古林业科学研究院,内蒙古呼和浩特010021)
模拟增温与增雨对克氏针茅光合作用的影响
闫玉龙1,2,张立欣3,万志强1,2,谷蕊1,2,苏力德1,2,杨劼1*,高清竹2*
(1.内蒙古大学生命科学学院,内蒙古呼和浩特010021;2.中国农业科学院农业环境与可持续发展研究所,北京100081;3.内蒙古林业科学研究院,内蒙古呼和浩特010021)
本文在全球气候变化的背景下,利用开顶式生长室(OTC,open top chamber)于2011与2012年进行模拟增温,同时实施降水量增加的处理,研究增温与增水处理及其交互作用对内蒙古典型草原优势植物克氏针茅光合作用的影响。于2012年生长季使用Li-6400对克氏针茅叶片的各光合作用特征参数进行测量。结果表明,增温明显降低克氏针茅的叶片光合速率(Pn)与气孔导度(Gs),并存在明显季节变化趋势。在7月与9月增温分别使Pn降低17%和27%,使Gs分别降低24%和32%。同时增温降低克氏针茅蒸腾速率(Tr)、叶绿素含量、核酮糖-1,5-二磷酸(Ru BP)羧化的最大速率(Vcmax)、RuBP再生能力的最大速率(Jmax)、表观量子效率(AQE)与最大光合速率(Pnmax),但使水分利用效率(WUE)增加16.5%。降水增加对高温条件下的光合作用具有补偿效应。降水增加促进了克氏针茅的Pn、Gs、Tr、叶绿素含量、Vcmax、Jmax、AQE与Pnmax,但对WUE影响不明显。温度水分对克氏针茅光合作用与WUE的影响,是由气孔开合与非气孔因素共同引起的。增温与增水条件下克氏针茅气孔导度在光合速率与蒸腾速率间存在权衡。温度与降水增加显著影响克氏针茅叶片各光合特性参数,但二者交互作用对植物光合作用无显著影响。
全球变化;光合作用;克氏针茅;典型草原;模拟增温与增雨
http://cyxb.lzu.edu.cn
闫玉龙,张立欣,万志强,谷蕊,苏力德,杨劼,高清竹.模拟增温与增雨对克氏针茅光合作用的影响.草业学报,2016,25(2):240-250.
YAN Yu-Long,ZH ANG Li-Xin,WAN Zhi-Qiang,GU Rui,SU Li-De,YANG Jie,GAO Qing-Zhu.Effects of simulated warming and precipitation enhancement on photosynthesis of Stipa krylovii.Acta Prataculturae Sinica,2016,25(2):240-250.
光合作用是陆地生态系统物质循环与能量流动的基础[1],易受植物自身的生长状况(如Gs、Vcmax与Jmax)[2-6]和外界环境条件(如光照、温度和水分等)的影响[7-12]。以降水格局变化和温度升高为主要特征的全球气候变化已成为不争的事实。研究表明,增加降水会促进植物光合速率、气孔导度和蒸腾速率,但植物水分利用效率降低[13-14]。而水分减少会降低植物光合速率和气孔导度,但植物水分利用效率升高[15-16]。中度增温可以增加植物光合速率及水分利用效率[17-18],但过度增温会导致植物光合速率的下降[19-21]。全球气候变化背景下,在气温升高的同时,常常伴随水分胁迫的发生[14]。
内蒙古典型草原地处干旱半干旱区,对气候变化非常敏感[22],并且降水与温度有明显的变化[23]。以克氏针茅(Stipa krylovii)为建群种的草原是一类重要的草地资源,在畜牧业生产中占有重要地位[24]。针对克氏针茅的研究大多集中在群落尺度上评价群落结构和生产力方面[25-27],而基于叶片层次的光合作用对温度增加与降水变化的适应性方面的研究较少。在研究全球变化与陆地生态系统关系中,长期的模拟增温与降水[28]控制试验能较好地模拟气候变化所导致的环境因素变化对植物生理生态的影响[24],并能够为生态模型提供参数估计和模型验证[29]。
本文利用OTC模拟增温与降水增加过程,从而探讨两者与其交互作用对内蒙古典型草原克氏针茅叶片各光合特征参数的影响,有助于增进克氏针茅对气候变化的响应与适应机制的认识,为典型草原科学应对气候变化和草地畜牧业可持续发展提供依据。
1 材料与方法
1.1研究区概况
实验区位于锡林浩特市毛登牧场内蒙古大学草地生态学研究基地(44°09′N,116°29′E,海拔1102 m)。土壤类型为栗钙土,属温带草原区栗钙土亚区。该区年平均气温2.6℃,极端高温为24.9℃,极端低温为-23.8℃。年平均降水量约271.42 mm。降水量的季节和年际变化很大,降水主要集中于5-9月,占全年降水量的87.33%。年蒸发量1600~1800 mm,蒸发量远远大于降水量。多冬春降雪,稳定降雪日数90 d左右。无霜期从每年的5月初到9月初,约120 d。克氏针茅、羊草(Leymus chinensis)为优势种,其他物种有大针茅(Stipa grandis)、糙隐子草(Cleistogenes squarrosa)、冷蒿(Artemisia frigida)、瓣蕊唐松草(Thalictrum petaloideum)、防风(Saposhnikovia divaricata)、芨芨草(Achnatherum sp lendens)、阿尔泰狗娃花(Heteropappus altaicus)等。
1.2实验设计与温湿度监测
OTC设计:开顶式生长室(open-top chamber,OTC)顶部与底部直径分别为0.7 m与1.2 m,高为0.4 m,制作材料为聚氯乙烯塑料,圆台型框架用细钢筋制作[30]。
实验设计:在试验样地共设16个实验小区,分4个不同处理,将安有风扇可与外界进行气体循环的OTC作为增温(W)处理,在增温处理基础上增加降水作为增温增雨(WP)处理,自然状态设为对照(CK)处理,与自然状态下增加降水为(P)处理,每个处理4个重复。试验小区采用随机区组设计。增温幅度根据当地50年(1961-2010)生长季温度增幅(表1)与IPCC (2007)报告而定为2℃,以OTC内空气温度和CK样地空气温度差值进行设定,当差值≥2℃时,风扇自动运行进行空气流通来降低温度,保证温度的增幅在2℃内。试验按本地50年平均降水量为准,降水增幅为月平均降水量的20%(表1),在每个月的月初月末固定时间分两次于晚上6:00施加,施水后48 h开始各参数测量。
温湿度监测:用温湿度数据采集器记录地下10 cm土壤温湿度与距地表20 cm的地表空气温度。从2011年5月初至2012年9月末每隔15 min自动记录1次温湿度数据,计算OTC的增温效果。
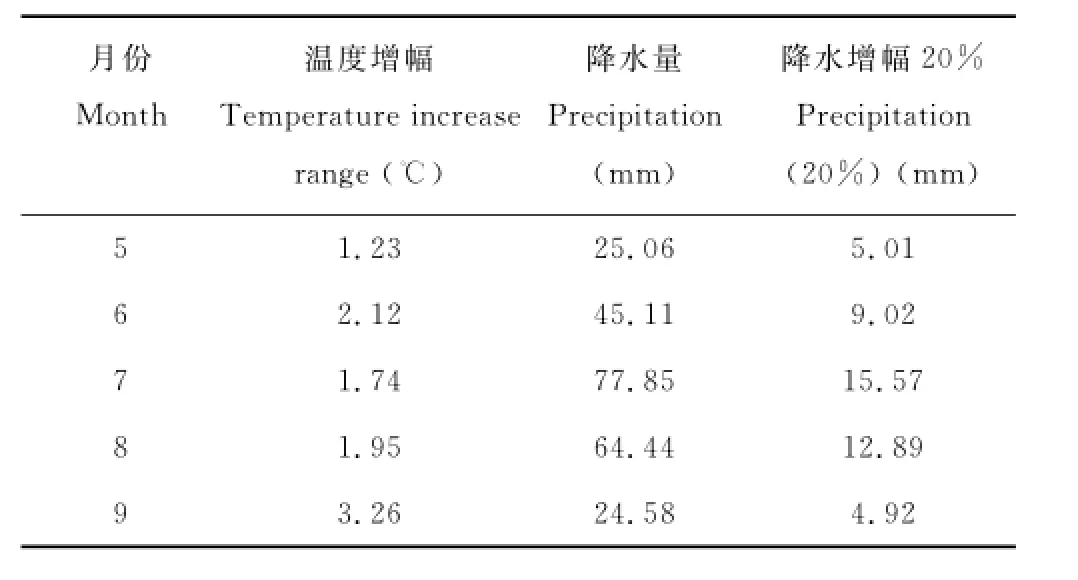
表1 过去50年(1961—2010)月平均温度增幅、月平均降水量与施加降水量Table1 Monthly mean temperature and precipitation in the past 50 years(1961—2010)and increased amount of precipitation
1.3参数测定
(1)植物光合速率、气孔导度与蒸腾速率测定。
于2012年生长季,每月月初与月末选择晴朗天气,自6:00至20:00每隔2 h使用Li-6400便携式光合仪(Li-Cor Inc.,Lincoln,NE,USA)对各处理长势良好的克氏针茅进行光合速率、气孔导度与蒸腾速率的测量。每个处理4个重复,每个重复选取3组叶片进行测量,Photoshop软件对测量叶片面积进行计算。每月选择1个晴朗天气于上午9:00-11:00进行光合月动态和季节动态测量,方法同上。
(2)二氧化碳响应曲线的测定。
2012年7月中旬,利用Li-6400在25℃条件下对不同处理克氏针茅的CO2响应曲线进行测量。CO2浓度依次设为1500,1200,1000,750,375,200,100,50μmol/mol。
Farquhar等[3](1980)根据Rubisco在体外的动力学变化及光合作用中与CO2和O2浓度变化的相互关系提出了C3植物光合作用的生化模型(公式1、2、3):
低CO2浓度下,光合速率受RuBP碳羧化反应制约,此时的光合速率(Pc)与胞间CO2浓度(Ci)有以下关系:

式中:Pc为光合速率;Vcmax指Ru BP羧化的最大速率;Kc、Ko分别是Rubisco的CO2、O2的Michaelis-Menten常数;O是O2浓度;Г*是不考虑线粒体呼吸的CO2补偿点。
高CO2浓度下,光合速率(Pr)受RuBP再生反应的制约:

式中:Pr为光合速率;Jmax指RuBP再生速率(表示电子传递的速率)的最大值。
而实际的光合速率为:

式中:Rd表示暗呼吸速率(Rdark)。
(3)光响应曲线的测定。
2012年7月中旬,利用Li-6400在控温25℃条件下对不同处理内克氏针茅的光响应与CO2响应曲线进行测量。光强梯度分别设为2000,1800,1500,1200,1000,800,600,400,200,100,50,25,0μmol/(m2·s)。光响应非直角双曲线模型[31]:
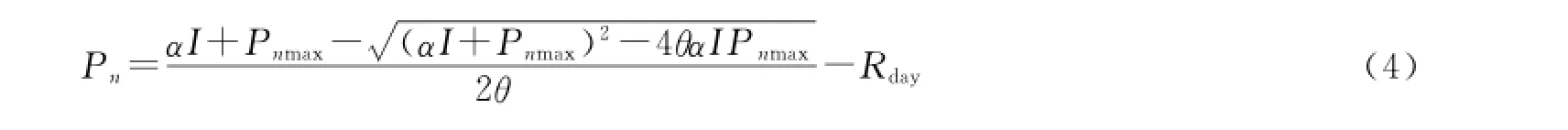
式中:Pn为净光合速率;Pnmax为没有光强限制时的最大净光合速率;θ为曲线的曲率,表示总物理阻力与CO2扩散力的比率;I为光合有效辐射;α为表观量子效率(AQE),表示低光强时光合作用的光化学效率;Rday为有光时的呼吸速率。
根据公式1、2、3、4计算Vcmax、Jmax与Pnmax等光合参数。
(4)植物叶片水分利用效率测定。
使用Li-6400测得9:00-11:00净光合速率(Pn)与蒸腾速率(Tr)数据,计算克氏针茅的水分利用效率(WUE)[32]。

(5)叶绿素含量测定。
于植物生长旺季(7月底8月初)使用叶绿素测定仪(Minolta SPAD-502;KonicafiMinolta Sensing,INC.)对各处理克氏针茅叶绿素含量进行测定,每个处理4个重复,每个重复选取3组叶片进行测量。
1.4数据统计
使用Excel 2003和PASW Statistics 18(SPSS Inc.,Chicago,IL,USA)对数据进行统计分析。
2 结果与分析
2.1温度与湿度的变化特征
分析2011和2012年生长季温湿度数据显示,增温(W)与增温增雨(WP)处理明显改变了空气温度与土壤含水量(图1A,B),W与WP处理使全天平均空气温度分别增加1.90与1.64℃(图1C),并分别与对照(CK)达到显著差异(P<0.05)。2个生长季白天平均空气温度分别增加3.14与1.89℃,夜晚平均空气温度分别增加0.27 与0.03℃。其中W与WP处理不同程度降低地下10 cm土层土壤的含水量(图1D),W处理与CK处理土壤相对含水量达到显著差异(P<0.05),而与WP处理却无显著差异,是因为增温引起土壤的蒸发,说明增温造成了土壤含水量的下降。
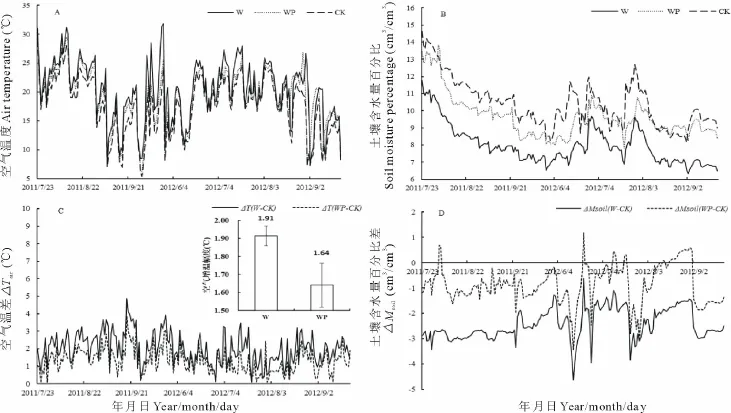
图1 增温与增温增水对空气温度(A)、土壤含水量(B)、空气温差(ΔTair)(C)与土壤含水量差(ΔMsoil)(D)的影响Fig.1 Effects of warming and warming&precipitation enhancement on air temperature(A),soil moisture(B),air temperature different(ΔTair)(C)and soil moisture different(ΔMsoil)(D)
2.2增温和增水处理对光合速率与气孔导度的影响
各处理中克氏针茅净光合速率(net photosynthetic rate,Pn)日变化均呈典型的双峰曲线(图2A,B),具有明显的“午休”(12:00-14:00)现象。第1个峰值出现在上午的10:00-12:00,第2个峰值出现在下午14:00-16:00。生长旺季与生长季末,W处理使克氏针茅的Pn明显降低,特别是在植物“午休”与两个峰值时段(P<0.01)。P处理明显促进了克氏针茅“午休”与峰值时段Pn(P<0.05)。在25℃,各处理Pn表现为:P>WP>CK >W,而在增温处理条件下,各处理Pn表现为:P>CK>WP>W,说明W处理是由于造成水分胁迫而降低植物Pn。WP处理与CK处理克氏针茅的Pn无显著差异,说明增加降水解除或缓解增温造成的水分胁迫作用,从而影响克氏针茅Pn对温度的响应特征。例如,与在W处理下的Pn下降相比,WP处理下的Pn变化不明显。增温与增加降水的交互作用对克氏针茅Pn没有产生显著差异(表2)。
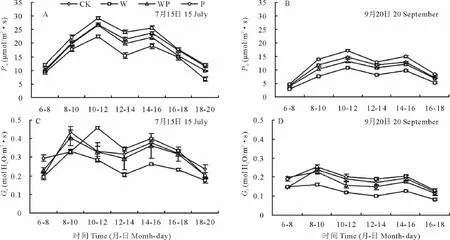
图2 各处理7月15日(A,C)与9月20日(B,D)净光合速率(Pn)与气孔导度(Gs)日变化(均值±标准误差)Fig.2 Diurnal changes in net photosynthetic rate(Pn)and stomatal conductance (Gs)of each treatment on 15 July(A,C)and 20 September(B,D)

图3 各处理光合速率(Pn)季节动态Fig.3 Seasonal changes in photosynthetic rate(Pn)
气孔导度(stomatal conductance,Gs)日变化规律与Pn日变化规律相似,呈双峰曲线趋势,但其第一个峰值除7月15日的P处理外都出现在上午8:00-10:00。整个生长季,与CK处理相比,W处理降低了克氏针茅的Gs(图2C,D),在Gs最大最小时段更加显著(P<0.01),P处理增大了植物Gs,但未达到显著性差异。CK与WP处理间无显著性差异(表2),说明温度增加情况下水分对克氏针茅的Gs变化有明显补偿作用。
各处理间Pn与Gs的差异随季节而增大,7月15 日P处理Pn分别比W、WP与CK高26%,11%与9%,P处理的最大Gs分别比W、WP与CK高30%,13%与6%。而9月20日P处理的Pn分别比W、WP与CK高44%,27%与17%,而P处理的最大Gs分别是W、WP与CK的39%,11%与7%。
如图3所示,整个生长季,各处理克氏针茅的Pn在5月末至6月末快速增加,7月初至8月初缓慢增加,至8月初达到最大,然后又急速下降。各处理对克氏针茅最大Pn出现的时间影响不明显。在6月末至8月初期间与CK比较,P处理明显促进了植物Pn(P<0.05),而W处理使植物Pn明显下降(P<0.01),WP处理使植物光合速率略微下降,但未达到显著性差异(P>0.05)。整个生长季,P处理的Pn分别比W、WP与CK高34%,17% 与13%。
2.3增温和增雨处理对Vcmax、Jmax、AQE与Pnmax的影响
从光响应与二氧化碳响应曲线由公式1、2、3、4计算得出Vcmax、Jmax、AQE与Pnmax等参数并分析(图4),W处理明显降低克氏针茅的Vcmax(图4A)(P<0.05)与Jmax(图4B)(P<0.05),P明显增加克氏针茅的Vcmax(P<0.05)、Jmax(P<0.05),W和P处理分别降低与增加克氏针茅的AQE与Pnmax,但未达到显著水平。WP处理对各参数却无明显的影响(表3)。
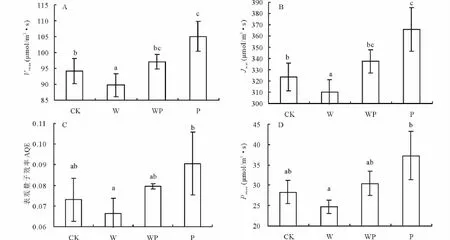
图4 各处理对最大净光合速率Vc max(A),最大电子传递速率Jmax(B),表观量子效率AQE(C),最大净光合速率Pn max(D)的影响Fig.4 Effects of each treatment to maximum net photosynthetic rate(Vc max)(A),maximum electron transfer rate(Jmax)(B),apparent quantum efficiency(AQE)(C)and maximum net photosynthetic rate(Pn max)(D)
2.4增温和增水处理对蒸腾与瞬时水分利用效率的影响
在植物的整个生长周期中,克氏针茅蒸腾速率(transpiration rates,Tr),呈现单峰趋势,并在8月4日达到最大,生长旺季各处理克氏针茅的Tr显著高于生长季其他时段(P<0.05)。整个生长季,克氏针茅的Tr始终都是P>CK>W,在8月4日植物的Tr达到最大,与CK处理相比,W与P处理均有显著差异(P<0.05),说明增温会降低克氏针茅的Tr,而增加降水可以促进植物的Tr(图5 A)。生长旺季,W处理使克氏针茅的Tr下降17%,而P处理使Tr上升了5%。整个生长季,W处理使克氏针茅Tr下降27%,而P处理使Tr上升了15%。但WP与CK处理间却无显著性差异(表2),说明增加降水可有效缓解增温造成水分胁迫对植物Tr的影响。
整个生长季克氏针茅水分利用效率(water-use efficiency,WUE)呈现先增大后减少再增大的趋势,与CK相比W处理除7月15日外均增加克氏针茅WUE(图5B)。整个生长季W处理使克氏针茅WUE增加16.5%,而在6月30日与8月25日W处理分别使克氏针茅WUE增加19.7%与51.9%,并与其他处理都达到极显著差异(P<0.01),说明增温有助于植物的水分利用。P处理与WP处理对克氏针茅WUE影响不明显。增温增雨对克氏针茅的Tr与WUE无交互作用(表2)。
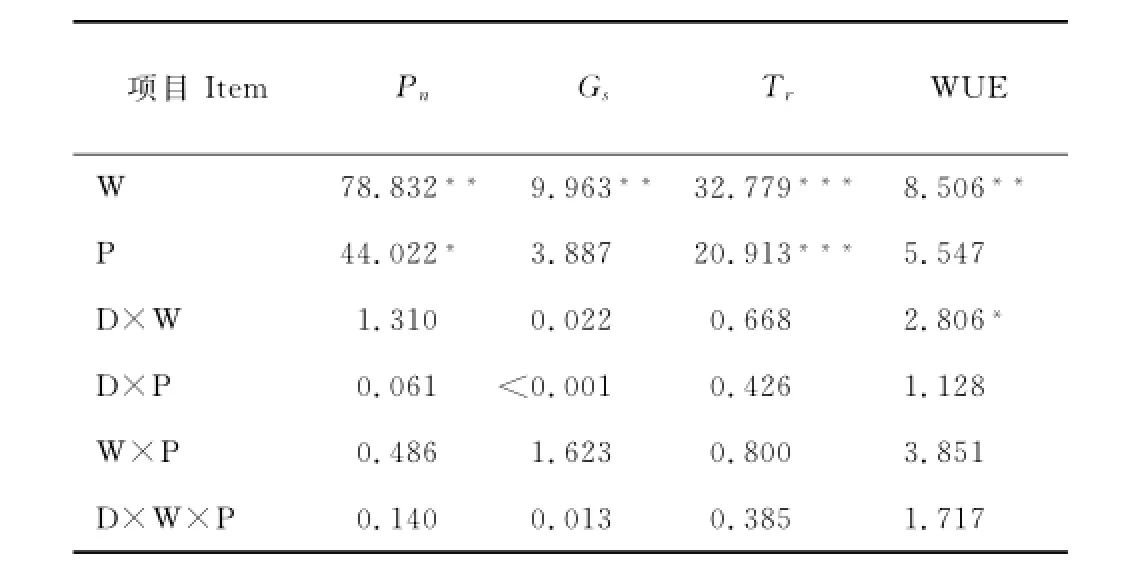
表2 日期(D)、增加降水(P)与增加温度(W)对植物光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)与水分利用效率(WUE)的影响(三因素方差分析)Table2 Effects of date(D),precipitation enhancement(P)and warming(W)on Pn,Gs,Trand WUE (three-way ANOVAs)

图5 降水与温度增加对植物蒸腾速率(A)与水分利用效率(B)的影响Fig.5 The effects of precipitation enhancement and warming to transpiration rate and water-use efficiency

表3 增温(W)与增加降水(P)对Vc max、Jmax、AQE、Pn max与叶绿素含量的影响,双因素方差分析Table3 Effects of precipitation enhancement(P)and warming(W)on Vc max,Jmax,AQE,Pn maxand chlorophyll,two-way ANOVAs
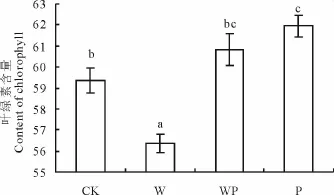
图6 各处理对植物叶绿素含量的影响Fig.6 Effects of each treatment to the content of chlorophyll
2.5增温和增雨处理对叶绿素含量的影响
在植物生长最旺季(7月底8月初)对克氏针茅叶绿素含量测定显示(图6),W处理明显降低克氏针茅叶绿素含量(P<0.001),而P处理明显增加克氏针茅叶绿素含量(P<0.01),WP处理即增温与增加降水交互作用对叶绿素含量无明显的影响(表3)。
3 讨论
目前,温度对植物光合速率的影响仍然存在争议,温度增加对植物光合作用或促进[33-34]、或抑制[15-16,35]、或无影响[36-38]。在内蒙古典型草原,有研究发现增温促进了克氏针茅的Pn[2,33],但本文研究发现增温降低了克氏针茅的Pn(图2A,B,图3),并且随着季节变化降低程度有所加大。由于温度增加常常引起植物其他环境或其他方面的变化,如叶片叶绿素含量的变化。本研究使用增温装置为OTC,在干旱与半干旱的典型草原,整个生长季OTC对白天空气增温幅度较大,增温通过加大克氏针茅的Tr(图5A)与蒸散而降低了克氏针茅生长环境的土壤水分含量(图1B,D)[38],进而对植物光合作用产生胁迫。而Wan等[33]和Niu等[29]利用红外辐射器加热的方法,对土壤水分含量影响较小,没有造成对植物光合作用产生胁迫的影响。在本研究中,增温降低土壤水分含量与克氏针茅Gs的同时也降低了克氏针茅叶绿素的含量(图6)、Vcmax、Jmax与AQE(图4A,B,C)。这些变化与增温的共同作用导致了克氏针茅Pn的下降。
温度增加,会使叶片气孔关闭[39],使Gs下降[15],从而使植物Tr下降。这与本研究结果相同(图2C,D,图5A)。同在内蒙古典型草原,Niu等[29]发现,温度增加对植物个体叶片的WUE无影响,Xu和Zhou[35]却发现增温使植物WUE降低,但本研究发现温度增加使克氏针茅的WUE增加,其可能原因是温度增加降低克氏针茅Tr,同时也降低了其Pn。由于OTC白天对空气增温效果较大,植物本身存在自我反馈调节功能,通过降低Gs来减小植物Tr的幅度要大于降低Pn的幅度,从而使克氏针茅的WUE增加(图5B)。
水分是影响干旱和半干旱地区植物生长与生产力的主要环境因子[40-41]。本研究发现,增加降水明显促进克氏针茅的Pn,这与Niu等[14]的研究相同,与增温降低植物Pn一样,增加降水对Pn的影响分为气孔和非气孔因素,P处理增加克氏针茅Gs的同时也增加了磷酸三碳糖的消化能力、光合磷酸化过程中磷再生能力与叶绿素含量(图6,图4A,B),说明水分增加对光合的影响既有气孔因素也有非气孔因素。Gu等[28]同样发现,水分胁迫下藏北紫花针茅(Stipa purpurea)Pn降低的原因可能是缺水导致叶片光合结构的损害,而非单纯由气孔闭合所导致。
植物生长的水分条件可影响植物叶片Gs、Tr与WUE,王英宇等[42]发现灌溉增大了高羊茅(Festuca arundinacea)与早熟禾(Poa pratensis)等草地植物光合作用的同时,也增大叶片Gs与Tr。而周秋平等[43]对本氏针茅(Stipa bungeana)的研究发现,干旱胁迫下植物叶片Gs和Tr明显下降,WUE则升高。在本研究中,P处理促进Gs的同时,也加大了叶片的Tr,但植物叶片WUE无显著变化(图5A,B),可能是由于对Pn与Tr增加速率不同造成,王慧等[13]研究发现增加降水使Pn增加速率小于Tr从而使短花针茅WUE降低。
水分是限制植物叶片的关键因素。当外界温度增加,植物通过反馈调节采取气孔闭合的方式来减少蒸腾引起的水分丧失。根据Case和Barrett[2]研究发现,植物对水分充足与胁迫等不同条件采用不同气孔行为,水分胁迫下植物在最大限度减少水分丧失的前提下促进CO2的吸收,即单位CO2收获下最小的水分散失。而在水分条件良好的情况下,植物会保证单位失水下最大的CO2收获。所以当植物处于水分胁迫条件时,就可能对保水与CO2吸收进行权衡,从而达到对环境的最大适应。本研究证实了这一点,P处理增加Pn与Gs同时,也加大了Tr。即植物保证单位失水下最大的CO2收获。而CT处理对植物造成了水分胁迫,使克氏针茅Pn、Gs与Tr都有所降低,植物此时的权衡策略是单位CO2收获下最小的水分散失。同时,增温或增加降水改变了磷酸三碳糖的消化能力、光合磷酸化过程中磷再生能力、表观量子效率与叶绿素含量等非气孔因素,这些共同引起了植物Pn的变化。WUE代表CO2同化与水分丧失的比例[30],植物在对两者权衡时,温度与降水引起的气孔与非气孔因素变化就会共同影响植物的WUE。
在全球变化背景下,在干旱与半干旱地区温度增加抑制光合作用[15,33],本研究也证实了这一点。但增加降水可有效缓解增温造成水分胁迫对植物光合作用的影响,说明降水是影响本研究区植物光合作用的主要因素,这与Knapp等[40]和Weltzin等[41]研究结果一致。
4 结论
(1)增温引起水分胁迫而降低克氏针茅的Pn,增加降水将导致克氏针茅的Pn增大。增温与增水的交互作用对克氏针茅的Pn无显著影响。
(2)增加降水可有效缓解增温造成水分胁迫对植物Pn与Tr的影响,同时,各光合参数对增加降水的响应易受温度的影响。
(3)温度和水分对克氏针茅光合作用与WUE的影响,是由气孔开合与非气孔因素共同引起的。
(4)增温与增水条件下克氏针茅的Gs对Pn与Tr存在权衡,温度上升造成植物水分胁迫而降低Gs与Tr,但增加降水增加Gs与Tr。增温使植物WUE增加,但增加降水对克氏针茅WUE无明显影响。
References:
[1]Jiang G M.Plant Ecophysiology[M].Beijing:Higher Education Press,2004:43-44.
[2]Case A L,Barrett S C H.Ecological differentiation of combined and separate sexes of Wurmbeadioica(Colchicaceae)in sympatry.Ecology,2001,82:2601-2616.
[3]Farquhar G D,Von C S,Berry J A.A biochemical model of photosynthetic CO2assimilation in leaves of C3plants.Planta,1980,149:78-90.
[4]Pan R C.Plant Physiology[M].Beijing:Higher Education Press,1982:101-111.
[5]Mae T.Physiological nitrogen efficiency in rice:Nitrogen utilization,photosynthesis,and yield potential.Plant Soil,1997,196:201-210.
[6]Makino A,Osmond B.Effects of nitrogen nutrition on pea and wheat.Plant Physiol,1991,96:355-362.
[7]Mo Y W,Guo Z F,Xie J H.Effects of temperature stress on chlorophyll fluorescence parameters and photosynthetic rates of Stylosanthes guianensis.Acta Prataculturae Sinica,2011,20:96-101.
[8]Zhang J Z,Zhang Q Y,Sun G F,et al.Effects of drought stress and re-watering on growth and photosynthesis of Hosta.Acta Prataculturae Sinica,2014,23:167-176.
[9]Yu G R,Wang Q F.Ecophysiology of Plant Photosynthesis,Transpiration,and Water Use[M].Beijing:Science Press,2010,64:171-172.
[10]Zheng Y Y,Xie Z X,Rimmington G M,et al.Elevated CO2accelerates net assimilation rate and enhance growth of dominant shrub species in a sand dune in central Inner Mongolia.Environmental and Experimental Botany,2010,68:31-36.
[11]Lee J S.Combined effect of elevated CO2and temperature on the growth and phenology of two annual C3and C4weedy species.Agriculture,Ecosystems and Environment,2011,140:484-491.
[12]Morgan J A,Lecain D R,Pendall E,et al.C4grasses prosper as carbon dioxide eliminates desiccation in warmed semi-arid grassland.Nature,2011,476:202-205.
[13]Wang H,Zhou G S,Jiang Y L,et al.Interactive effects of changing precipitation and elevated CO2concentration on photosynthetic parameters of Stipa breviflora.Chinese Journal of Plant Ecology,2012,36:597-606.
[14]Niu S L,Yuan Z Y,Zhang Y F,et al.Photosynthetic responses of C3and C4species to seasonal water variability and competition.Journal of Experimental Botany,2005,56:2867-2876.
[15]Shah N H,Paulsen G M.Interaction of drought and high temperature on photosynthesis and grain-filling of wheat.Plant and Soil,2003,257:219-226.
[16]Hamerlynck E P,Huxman T E,Michael E L,et al.Effects of extreme high temperature,drought and elevated CO2on photosynthesis of the Mojave Desert evergreen shrub,Larreatridentata.Plant Ecology,2000,148:183-193.
[17]Berry J,Bjorkman O.Photosynthetic response and adaptation to temperature in higher plants.Annual Review Plant Physiology,1980,31:491-643.
[18]Lee B H,Won S H,Lee H S,et al.Expression of the chloroplast-localized small heat shock protein by oxidative stress in rice.Gene,2000,245:283-290.
[19]Delgado E,Mitchell R A C,Parry M A J,et al.Interacting effects of CO2concentration,temperature and nitrogen supply on photosynthesis and composition of winter wheat leaves.Plant Cell and Environment,1994,17:1205-1213.
[20]Taub D R,Seemann J R,Coleman J S.Growth in elevated CO2protects photosynthesis against high temperature damage.Plant Cell and Environment,2000,23:649-656.
[21]Wollenweber B,Porter J R,Schellberg J.Lack of interaction between extreme high-temperature events at vegetative and reproductive stages in wheat.Journal of Agronomy and Crop Science,2003,189:142-150.
[22]Christensen L,Coughenour M B,Ellis J E,et al.Vulnerability of the Asian typical steppe to grazing and climatic change. Climatic Change,2004,63:351-368.
[23]Gong D Y,Shi P J,Wang J A.Daily precipitation changes in the semiarid region over northern China.Journal of Arid Environments,2004,59:771-784.
[24]Bai Y F.Influence of seasonal distribution of precipitation on primary productivity of Stipa krylovii community.Chinese Journal of Plant Ecology,1999,2:60-65.
[25]Bai Y F,Xu Z X,Li D X.Study on a diversity of four Stipa communities in Inner Mongolia Plateau.Chinese Biodiversity,2000,8:353-360.
[26]Bai Y F,Li L H,Huang J H,et al.The influence of plant diversity and functional composition on ecosystem stability of four Stipa communities in the Inner Mongolia Plateau.Acta Botanica Sinica,2001,43:280-287.
[27]Zhao D L,Liu Z L,Yang G X,et al.Grazing impact on distribution pattern of the plant communities and populations in Stipa krylovii steppe.Acta Pratculturae Sinica,2010,19:6-13.
[28]Gu R,Chao L M,Zhang L X,et al.The influence of hydrothermal factor on the soil respiration and soil temperature sensitivity of Stipa krylovii steppe,Inner Mongolia,China.Acta Prataculturae Sinica,2015,24(4):21-29.
[29]Niu S L,Han X G,Ma K P,et al.Field facilities in global warming and terrestrial ecosystem research.Chinese Journal of Plant Ecology,2007,31:262-271.
[30]Wan Y F,You S C,Li Y E,et al.Influence of elevated atmospheric CO2concentration and temperature on growth and yield of early rice.Journal of Agro-Environment Science,2014,33:1693-1698.
[31]Ye Z P,Li J S.Comparative investigation light response of photosynthesis on non-rectangular hyperbola model and modified model of rectangular hyperbola.Journal of Jinggangshan University,2010,3:38-44.
[32]Niu S L,Xing X R,Zhang Z,et al.Water-use efficiency in response to climate change:from leaf to ecosystem in a temperate steppe.Global Change Biology,2001,17:1073-1082.
[33]Wan S Q,Xia J Y,Liu W X,et al.Photosynthetic overcompensation under nocturnal warming enhances grassland carbon sequestration.Ecology,2009,90:2700-2710.
[34]ChapinⅢF S,Shaver G R.Physiological and growth responses of arctic plants to a field experiment simulating climatic change.Ecology,1996,77:822-840.
[35]Xu Z Z,Zhou G S.Effects of water stress and high nocturnal temperature on photosynthesis and nitrogen level of a perennial grass Ley mus chinensis.Plant and Soil,2005,269:131-139.
[36]Llorens L,Pefnuelas J,Estiarte M.Ecophysiological responses of two Mediterranean shrubs,Erica multiflora and Globulariaalypum,to experimentally drier and warmer conditions.Physiology Plantarum,2005,119:231-243.
[37]Llorens L,Pefnuelas J,Beier C,et al.Effects of an experimental and drought on the photosynthetic performance of two ericaceous shrubs species along a North-South European gradient.Ecosystems,2004,7:613-624.
[38]Loik M E,Redar S P,Harte J.Photosynthetic responses to a climate-warming manipulation for contrasting meadow species in the Rocky Mountains,Colorado,USA.Functional Ecology,2000,14:166-175.
[39]Mansfield T A,Hetherington A M,Atkinson C J.Some current aspects of stomatal physiology.Annual Review of Plant Physiology,1990,41:55-75.
[40]Knapp A K,Fay P A,Blair J M,et al.Rainfall variability,carbon cycling,and plant species diversity in a mesic grassland. Science,2002,298:2202-2205.
[41]Weltzin J F,Loik M E,Schwinning S,et al.Assessing the response of terrestrial ecosystems to potential changes in precipitation.Bioscience,2003,53:941-952.
[42]Wang Y Y,Yang J,Han L B.Effects of different irrigation volume on photosynthesis of turfgrass.Journal of Beijing Forestry University,2006,S1:26-31.
[43]Zhou Q P,Cheng J M,Wan H E,et al.Study on the diurnal variations of photosynthetic characteristics and water use efficiency of Stipa bungeana Trin.under drought stress.Acta Agrestia Sinica,2009,4:510-514.
[1]蒋高明.植物生理生态学[M].北京:高等教育出版社,2004:43-44.
[4]潘瑞炽.植物生理学[M].北京:高等教育出版社,1982:101-111.
[7]莫亿伟,郭振飞,谢江辉.温度胁迫对柱花草叶绿素荧光参数和光合速率的影响.草业学报,2011,20:96-101.
[8]张金政,张起源,孙国峰,等.干旱胁迫及复水对玉簪生长和光合作用的影响.草业学报,2014,23:167-176.
[9]于贵瑞,王秋凤.植物光合蒸腾与水分利用生理生态学[M].北京:科学出版,2010:171-172.
[13]王慧,周广胜,蒋延玲,等.降水与CO2浓度协同作用对短花针茅光合特性的影响.植物生态学报,2012,36:597-606.
[24]白永飞.降水量季节分配对克氏针茅草原群落初级生产力的影响.植物生态学报,1999,2:60-65.
[25]白永飞,许志信,李德新.内蒙古高原针茅草原群落α多样性研究.生物多样性,2000,8:353-360.
[26]白永飞,李凌浩,黄建辉,等.内蒙古高原针茅草原植物多样性与植物功能群组成对群落初级生产力稳定性的影响(英文).植物学报,2001,43:280-287.
[27]赵登亮,刘钟龄,杨桂霞,等.放牧对克氏针茅草原植物群落与种群格局的影响.草业学报,2010,19:6-13.
[28]谷蕊,潮洛濛,张立欣,等.水热因子对克氏针茅草原土壤呼吸及其土壤温度敏感性的影响.草业学报,2015,24(4):21-29.
[29]牛书丽,韩兴国,马克平,等.全球变暖与陆地生态系统研究中的野外增温装置.植物生态学报,2007,31:262-271.
[30]万运帆,游松财,李玉娥,等.CO2浓度和温度升高对早稻生长及产量的影响.农业环境科学学报,2014,33:1693-1698.
[31]叶子飘,李进省.光合作用对光响应的直角双曲线修正模型和非直角双曲线模型的对比研究.井冈山大学学报(自然科学版),2010,3:38-44.
[42]王英宇,杨建,韩烈保.不同灌溉量对草坪草光合作用的影响.北京林业大学学报,2006,S1:26-31.
[43]周秋平,程积民,万惠娥,等.干旱胁迫下本氏针茅光合特性和水分利用效率日动态研究.草地学报,2009,4:510-514.
Effects of simulated warming and precipitation enhancement on photosynthesis of Stipa krylovii
YAN Yu-Long1,2,ZHANG Li-Xin3,WAN Zhi-Qiang1,2,GU Rui1,2,SU Li-De1,2,YANG Jie1*,GAO Qing-Zhu2*
1.School of Life Sciences,Inner Mongolia University,Hohhot 010021,China;2.Institute of Environment and Sustainable Development in Agriculture,Chinese Academy of Agricultural Sciences,Beijing 100081,China;3.Inner Mongolia Academ y of forestry,Hohhot 010021,China
This study was conducted to examine the interactive effects of climate warming and changing precipitation on photosynthetic parameters of Stipa krylovii to evaluate the effects of future climate change on a typical steppe environment.Open top chambers(OTCs)were used to simulate warming+2℃,based on the local temperature increase from 1961 to 2010(IPCC,2007)and precipitation enhancement of+20%,based on the local average monthly precipitation from 1961-2010.The photosynthetic parameters were measured by a porTablegas exchange system(LI-6400)in the growing season of 2012.Warming significantly reduced the photosynthetic rate(Pn)and stomatal conductance(Gs)of S.krylovii,and there was a clear seasonal trend.Warming reduced Pn17%and 27%and reduced Gsby 24%and 32%in July and September,respectively.Warming also reduced the transpiration rate(Tr),chlorophyll content,the maximum ribulose 1,5-bisphosphate(RuBP)carboxylation rate(Vcmax),RuBP regeneration capacity(Jmax),apparent quantum efficiency(AQE)and the maximum photosynthetic rate(Pnmax)of S.krylovii.Conversely,water use efficiency(WUE)increased by 16.5%.Precipitation enhancement produced compensatory effects on photosynthesis responses to warming. Precipitation enhancement promote Pn,Gs,Tr,chlorophyll content,Vcmax,Jmax,AQE and the Pnmaxof S.krylovii but had did not affect WUE.The effects of temperature and precipitation on photosynthesis and WUE of S.krylovii was caused by stomatal and non-stomatal factors.Under warm conditions and precipitation enhancement,Gsinfluenced both Pnand Tr.No interactive effects were observed.
global change;photosynthesis;Stipa krylovii;typical steppe;warming and precipitation enhancement
10.11686/cyxb2015163
2015-03-27;改回日期:2015-06-29
国家科技支撑计划项目(2013BAC09B03)和农业部项目“国家牧草现代产业技术体系”(CARS-35)资助。
闫玉龙(1988-),男,内蒙古赤峰人,硕士。E-mail:15904881017@163.com
Corresponding author.E-mail:yangjie@imu.edu.cn,gaoqingzhu@caas.cn

