肿瘤靶向细胞穿膜肽的设计合成及活性检测*
马少丹,曾跃彬,薛艺抒,袁秋儿,严艳花,邝慧娴,陈婷婷,陈艺瑛,杜宝玲△(.广州医科大学,广东广州508;.广州市增城区人民医院,广东508)
肿瘤靶向细胞穿膜肽的设计合成及活性检测*
马少丹1,曾跃彬2,薛艺抒1,袁秋儿1,严艳花1,邝慧娴1,陈婷婷1,陈艺瑛1,杜宝玲1△
(1.广州医科大学,广东广州510182;2.广州市增城区人民医院,广东510182)
目的合成一种可活化细胞穿膜肽(ACPPs)并初步探索其穿膜活性及亚细胞分布。方法应用化学合成方法合成ACPPs,采用流式细胞仪检测ACPPs穿膜活性,免疫荧光法及全波长酶标仪检测表达ACPPs的肿瘤靶向性穿膜作用,用荧光显微镜观察ACPPs在细胞内的定位及ACPPs-pc-Ad.egfp复合物的亚细胞分布。结果成功合成了ACPPs,ACPPs-异硫氰酸荧光素(FITC)组较牛血清清蛋白-FITC组荧光量大,差异有统计学意义(F=4 656.600,P=0.000),ACPPs具有肿瘤靶向性穿膜活性,人肺癌细胞A549、人结肠癌细胞SW480、人卵巢癌细胞OVCAR3细胞质内荧光量较人支气管上皮细胞HBE大,差异有统计学意义(F=37 947.676,P=0.000);ACPPs定位于细胞质并介导ACPPs-pc-Ad.egfp复合物分布于细胞质。结论成功合成了ACPPs,ACPPs具有肿瘤靶向性穿膜活性并分布于细胞质。
肿瘤/治疗;亚细胞部分;大分子物质;细胞穿膜肽;靶向
细胞穿膜肽(cell penetrating peptides,CPPs)是目前最强、最快的跨膜转运分子,具有水溶性、低裂解性并通过非吞噬作用进入各种细胞膜等特点[1-5],给肿瘤的治疗带来新的机遇。在CPPs基础上改造而成的发夹状复合CPPs称为肿瘤靶向性CPPs,又称为可活化CPPs (activatable cellpenetrating peptide,ACPPs)。Jiang等[6]研究发现,ACPPs具有运载“货物”范围广、可操作性强的特点,无须通过表达系统进行表达及纯化,人工合成即可,简便易行,不仅可作为独立的肿瘤靶向分子给药,还可与多种合成分子连接后共同给药。因而已逐渐应用于细胞生物学、基因治疗、药物体内转运等领域[6-9]。本研究设计了新的ACPPs,通过检测其肿瘤靶向性及亚细胞分布以获得能分布于细胞质的靶向性跨膜转运分子,以期克服大分子药物治疗固有的细胞摄取障碍,旨在为提高大分子药物治疗的有效性提供有价值的实验依据。
1 材料与方法
1.1材料
1.1.1细胞株与腺病毒人支气管上皮细胞HBE(简称HBE)、人肺癌细胞A549(简称A549)及SPCA1(简称SPCA1)、人结肠癌细胞SW480(简称SW480)、人卵巢癌细胞OVCAR3(简称OVCAR3)、人肝癌细胞HepG2(简称HepG2)均为广州医科大学病理实验室保存。重组腺病毒载体——Ad.egfp为广州医科大学病理教研室保存。
1.1.2主要试剂低相对分子质量蛋白标准购自Takara公司,异硫氰酸荧光素(fluorescein fluorescein,FITC)及四甲基偶氮唑蓝购自威佳生物工程公司,1640培养基、杜氏改良Eagle培养基及胎牛血清均为美国Gibco公司产品,青霉素、链霉素及琼脂均为Sigma公司产品,高分子载体——聚N-(2-羟丙基)甲基丙烯酰胺[poly N-(2-hydroxypropyl methacrylamide),pHPMA]为华西医科大学黄园教授赠送。
1.2方法
1.2.1靶向分子ACPPs的合成及荧光素标记靶向分子ACPPs(EEEEEEEEE-PLGLAG-RRRRRRRRN)的合成由英韦创津公司完成。取ACPPs 10 μmol用FITC标记,观察生成淡黄色絮状沉淀后4℃10 000 r/min离心10 min,弃上清液,用冰乙醚洗3次,低温、低压干燥,-20℃保存备用。
1.2.2荧光显微镜观测ACPPs穿透肿瘤细胞膜能力收集对数生长期A549、OVCAR3、SW480、HepG2并计数,用培养基重悬细胞,以每孔5×105个细胞数量加入到6孔培养板中,以20 μmol/L FITC标记ACPPs,37℃作用4 h;分别用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤、甲醇固定10 min后用含50%甘油的PBS封片,于倒置荧光显微镜下观察、照相。
1.2.3流式细胞仪检测ACPPs穿透细胞能力收集每毫升5×105个A549,以每管1 mL分装至13个离心管中,分别加入FITC标记的ACPPs和FITC标记的牛血清清蛋白(bovine serum albumin,BSA),同时设置不加蛋白的阴性对照管,37℃孵育后分别于1、2、3、4、5、6 h取样,4℃离心后用4%台盼蓝溶液重悬细胞团,用流式细胞仪检测荧光强度,以荧光强度为纵坐标,以取样时间为横坐标作时间反应曲线。
1.2.4细胞免疫荧光染色法检测基质金属蛋白酶(matrix metalloproteinase,MMP)2蛋白表达将A549、HBE爬片加入到6孔培养板中,每种细胞分为空白组及加药组。分别用培养基及终质量浓度为10 mg/L强力霉素(多西环素,MMP抑制剂)培养48 h;然后用4%多聚甲醛固定,分别用兔抗人MMP-2单克隆抗体(1∶100)及荧光素标记羊抗兔免疫球蛋白G于37℃分别孵育120、60 min,加入终质量浓度为10 μg/mL二脒基苯基吲哚(diamidino-phenyl-indole,DAPI)避光染核15min,于倒置荧光显微镜下观察、照相。
1.2.5荧光显微镜观测ACPPs肿瘤靶向性穿膜作用将5×105个A549、SW480、OVCAR3、HepG2、HBE加入到6孔培养板中,每种细胞分为空白组及加药组。分别加入培养基及终质量浓度为10 mg/L强力霉素并加入终浓度为20 μmol/L FITC标记ACPPs作用4 h;洗涤、固定、封片后于倒置荧光显微镜下观察、照相。
1.2.6全波长酶标仪检测ACPPs肿瘤靶向性穿膜活性取对数生长期A549、SW480、OVCAR3、HBE消化后计数,加入到96孔细胞培养板中,每孔5 000个细胞,以A549、SW480、OVCAR3为研究组,以HBE为对照组,分别在96孔培养板中加入4、6、8、10、20、40、100 μmol/L ACPPs,每种药物浓度设3个平行孔。吸弃培养基,每孔用PBS洗3次后用全波长酶标仪测定488 nm吸光度值。
1.2.7荧光显微镜观测ACPPs在肿瘤细胞中的定位收集对数生长期A549及SPCA1,以每孔5×105个细胞数量加入到6孔培养板中,37℃培养过夜,加入终浓度为20 μmol/L FITC标记ACPPs,37℃作用4 h后洗涤、固定,加入终质量浓度为1μg/mLDAPI,室温避光反应30min;用PBS洗3次,加入400 μL含50%甘油的PBS封片,于倒置荧光显微镜下观察、照相。
1.2.8荧光显微镜观测ACPPs-药物复合物在细胞质的表达取终质量浓度为10 mg/mL pHPMA溶液加入1010vp Ad.egfp后4℃反应2 h形成pc-Ad.egfp(pc-Ad.egfp组),加入终质量浓度为100 ng/mL ACPPs,4℃继续反应10h形成最终接合物(ACPPs-pc-Ad.egfp组)。反应完成后取5 μL产物,与无血清1640培养基培养的A549孵育,同时加入等量Ad.egfp作为对照(Ad.egfp组),2 h后吸弃上清液,用PBS洗3次,加入含10%血清1640培养基继续培养24 h后于倒置荧光显微镜下以488 nm波长激发蓝光,观察并照相。
1.2.9荧光显微镜观测ACPPs-药物复合物在肿瘤细胞中的共定位取终质量浓度为10 mg/mL pHPMA溶液加入Ad.Egfp后4℃反应2 h,加入100 ng/mL ACPPs,4℃反应10 h。产物以104vp将(FITC)ACPPs-pc-Ad.egfp[碘化丙啶(propidium iodide,PI)]感染A549 4 h,于倒置荧光显微镜下λex 488nm与λem538nm检测ACPPs-FITC,λex 540、λem 625 nm检测pc-Ad.egfp(PI),观察并照相。
1.3统计学处理应用SPSS13.0统计软件进行数据分析,计量资料以x±s表示,细胞内FITC荧光量比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1ACPPs的合成及荧光素标记ACPPs氨基酸序列为EEEEEEEEE-PLGLAG-RRRRRRRRN,分子式为C116H200N48O41,其结构见图1。ACPPs与FITC在碳酸氢钠缓冲溶液反应完成后经冰乙醚洗涤沉淀并干燥后得淡黄色粉末。
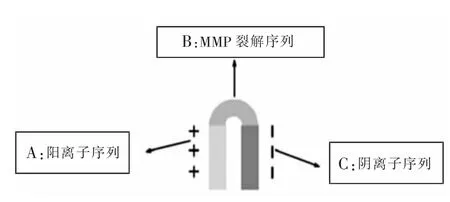
图1 ACPPs结构图
2.2ACPPs穿透肿瘤细胞膜能力与ACPPs-FITC孵育后A549、SW480、OVCAR3、HepG2内部均有较强绿色荧光,见图2。
2.3ACPPs穿透细胞能力ACPPs-FITC组较BSA-FITC组荧光量大,差异有统计学意义(F=4 656.600,P=0.000),见图3。
2.4A549与HBE MMP-2蛋白表达比较空白组A549细胞质内可见绿色荧光,HBE细胞质内仅见微弱绿色荧光,A549 MMP-2蛋白表达较HBE强;加药组A549、HBE细胞质内绿色荧光均较弱,见图4。
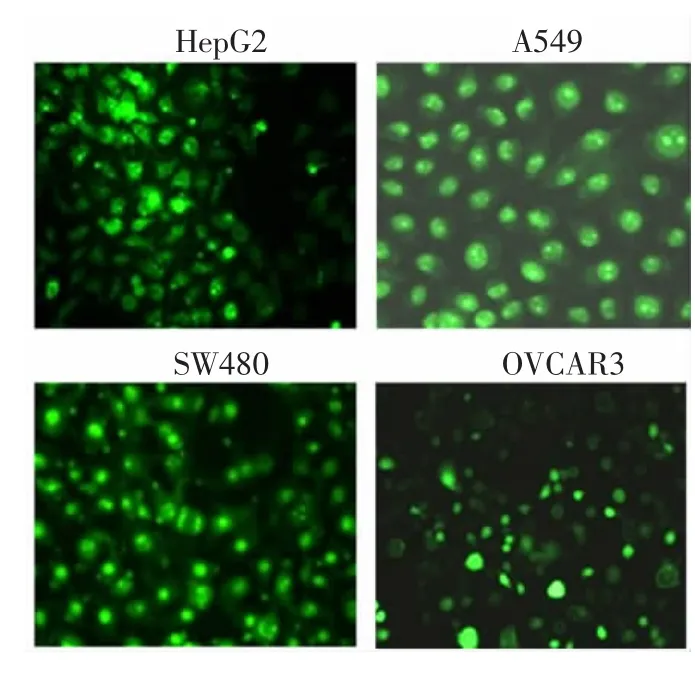
图2 各肿瘤细胞孵育4 h荧光图(200×)
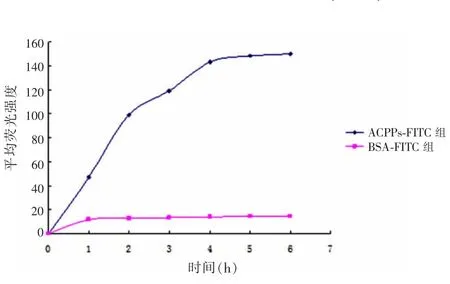
图3 ACPPs-FITC组与BSA-FITC组荧光量比较
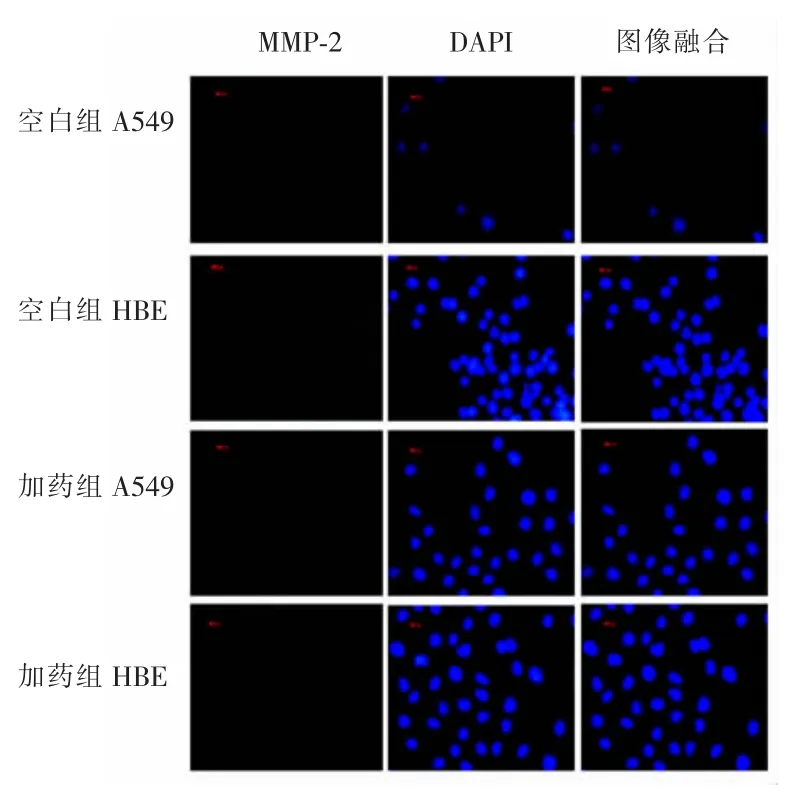
图4 A549与HBE MMP-2蛋白表达比较(200×)
2.5ACPPs肿瘤靶向性穿膜作用空白组A549、SW480、OVCAR3内均有较强绿色荧光,HBE内仅见较弱绿色荧光;加药组A549、SW480、OVCAR3、HBE内均未见明显绿色荧光,见图5。
2.6ACPPs肿瘤靶向性穿膜活性A549、SW480、OVCAR3内荧光量较HBE大,差异有统计学意义(F= 37 947.676,P=0.000)。4、6、8、10、20、40、100 μmol/LACPPs干预下A549、SW480、OVCAR3、HBE内荧光量比较,差异有统计学意义(F=71 140.350,P=0.000),见图6。

图5 空白组及加药组A549、SW480、OVCAR3、HBE孵育4 h后荧光图(100×)
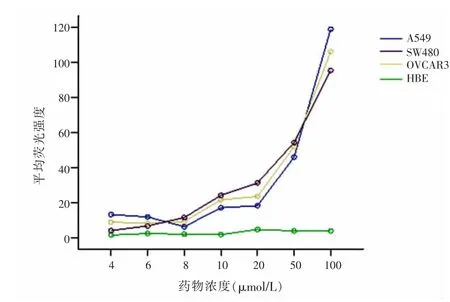
图6 A549、SW480、OVCAR3、HBE内荧光量比较
2.7ACPPs在肿瘤细胞中的定位A549、SPCA1内均有较强绿色荧光,则主要存在于细胞质中,同时细胞核中也有较弱绿色荧光,见图7。
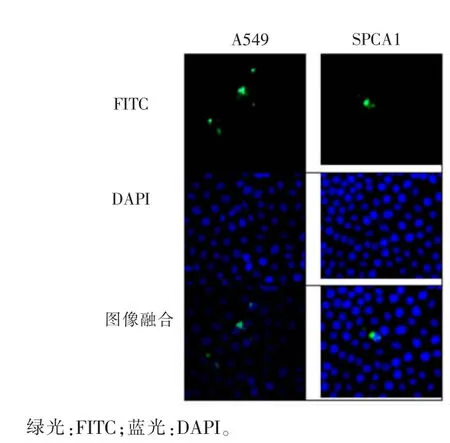
图7 A549、SPCA1孵育4 h后荧光图(400×)
2.8ACPPs-药物复合物细胞质内表达pc-Ad.egfp组仅见微量绿色荧光蛋白表达,ACPPs-pc-Ad.egfp、Ad. egfp组均可见强烈绿色荧光蛋白表达,见图8。

图8 ACPPs共价修饰pHPMA并感染细胞后Ad.egfp表达
2.9ACPPs-药物复合物亚细胞分布ACPPs-FITC、pc-Ad.egfp(PI)2种荧光分布于相同区域,见图9。
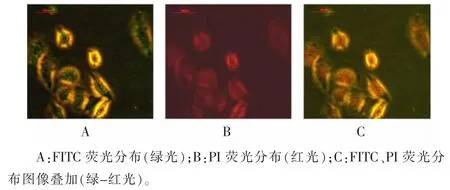
图9 ACPPs-FITC与pc-Ad.egfp(PI)的细胞内共定位
3 讨 论
ACPPs结构特征:(1)具有细胞膜穿透功能的活性中心CPPs区(RRRRRRRRN);(2)具有穿膜功能抑制区(EEEEEEEEE);(3)MMP识别区PLGLAG。由于MMP-2多表达于恶性肿瘤细胞内,肿瘤细胞分泌的MMP可识别并切断PLGLAG序列,使CPPs恢复活性并穿膜进入肿瘤细胞。由于肿瘤细胞高表达MMP,因而ACPPs穿膜作用具有肿瘤选择性。本研究FITC荧光检测结果显示,肿瘤细胞内FITC荧光较强,正常细胞内FITC荧光较弱;且肿瘤细胞内荧光强度随时间延长明显增加,而HBE荧光强度随时间延长并无明显增加。验证了ACPPs肿瘤靶向性的特性。MMP-2/MMP-9是肿瘤特异性酶中最常见的一种,可表达于多种恶性肿瘤细胞内,参与肿瘤的侵入与转移[10-14],因而,本研究合成的ACPPs可适用于多种肿瘤。
CPPs还可通过共价或非共价连接与药物分子形成复合物,增强药物分子的肿瘤靶向性。本研究结果显示,ACPPs-FITC与肿瘤细胞37℃孵育4 h后就能观察到明显的绿色荧光,与BSA-FITC组比较,差异有统计学意义(P<0.05);DAPI染色显示,绿色荧光主要存在于细胞质中;ACPPs-pc-Ad.egfp组可见大量绿色荧光蛋白表达,证明ACPPs-pc-Ad.egfp感染了A549并表达腺病毒绿色荧光蛋白;腺病毒的亚细胞分布显示,ACPPs-FTTC与pc-Ad.egfp(PI)荧光在细胞质中富集,证明ACPPspc-Ad.egfp通过ACPPs的穿膜作用进入细胞质的现象。
总之,本研究设计合成了肿瘤靶向肽——ACPPs,并将其与药物分子结合形成复合物,提高了药物的肿瘤靶向性,加速了药物内化进入细胞质,改善了药物的跨膜运输及亚细胞分布。
[1]Green M,Loewenstein PM.Autonomous functional domains of chemically synthesized human immunodeficiency virus tat trans-activator protein[J]. Cell,1988,55(6):1179-1188.
[2]Elliott G,O′Hare P.Intercellular trafficking and protein delivery by a herpesvirus structural protein[J].Cell,1997,88(2):223-233.
[3]Oess S,Hildt E.Novel cell permeable motif derived from the PreS2-domain of hepatitis-B virus surface antigens[J].Gene Ther,2000,7(9):750-758.
[4]Thorén PE,Persson D,Lincoln P,et al.Membrane destabilizing properties of cell-penetrating peptides[J].Biophys Chem,2005,114(2-3):169-179.
[5]Jewell CM,Fuehs SM,FlessnerRM,et al.Multilayered films fabricated from an oligoarginine-conjugated protein promote efficient surface-mediated protein transduction[J].Biomaeromolecules,2007,8(3):857-863.
[6]Jiang T,Olson ES,Nguyen QT,et al.Tumor imaging by means of proteolytic activation of cell-penetrating peptides[J].Proc Natl Acad Sci USA,2004,101(51):17867-17872.
[7]Shi NQ,Gao W,Xiang B,et al.Enhancing cellular uptake of activable cell-penetrating peptide-doxorubicin conjugate by enzymatic cleavage[J]. Int J Nanomedicine,2012,7:1613-1621.
[8]Olson ES,Jiang T,Aguilera TA,et al.Activatable cell penetrating peptides linked to nanoparticles as dual probes for in vivo fluorescence and MR imaging of proteases[J].Proc Natl Acad Sci USA,2010,107(9):4311-4316.
[9]Sawant RR,Patel NR,Torchilin VP.Therapeutic delivery using cellpenetrating peptides[J].European Journal of Nanomedicine,2013,5(3):111-167.
[10]McCawley LJ,Matrisian LM.Matrixmetalloproteinases:multifunctional contributors to tumor progression[J].MolMed Today,2000,6(4):149-156.
[11]Schoedel KE,Tyner VZ,Kim TH,et al.HGF,MET,and matrix-related proteases in hepatocellular carcinoma,fibrolamellar variant,cirrhotic and normal liver[J].Mod Pathol,2003,16(1):14-21.
[12]Takeuchi H,Bilchik A,Saha S,et al.c-MET expression level in primary colon cancer:a predictor of tumor invasion and lymph node metastases[J]. Clin Cancer Res,2003,9(4):1480-1488.
[13]Huh CG,Factor VM,Sánchez A,et al.Hepatocyte growth factor/c-met signaling pathway is required for efficient liver regeneration and repair[J]. Proc Natl Acad Sci USA,2004,101(13):4477-4482.
[14]Christensen JG,Burrows J,Salgia R.c-Met as a target for human cancer and characterization of inhibitors for therapeutic intervention[J].Cancer Lett,2005,225(1):1-26.
Design and synthesis of tumor targeted cell penetrating peptides and its activity detection*
Ma Shaodan1,Zeng Yuebin2,Xue Yishu1,Yuan Qiuer1,Yan Yanhua1,Kuang Huixian1,Chen Tingting1,Chen Yiying1,Du Baoling1△(1.Guangzhou Medical University,Guangzhou,Guangdong 510182,China;2.Zengcheng District People's Hospital of Guangzhou City,Guangzhou,Guangdong 510182,China)
ObjectiveTo synthesize a activable cell-penetrating peptides(ACPPs)and to preliminarily investigate its cell-penetrating activity and subcellular distribution.MethodsACPPs was synthesized by the chemical synthesis method;the cell-penetrating activity of ACPPs was detected by the flow cytometry;the tumor-targeted cell-penetrating effect expressing ACPP was measured by the immunofluorescence and multiskan spectrum microplate spectrophotometer;the intracellular location of ACPP and the subcellular distribution of ACPPs-pc-Ad.egfp compound were examined by inverted fluorescence microscopy.ResultsACPPs was successfully synthesized,the fluorescence value in the ACPPs-FITC group was much high than that in the bovine serum albumin-FITC group,the difference was statistically significant(F=4 656.600,P=0.000);ACPP had the tumor-targeted cell-penetrating activity,the fluorescence value in human lung cancer A549,cell human colon cancer cell SW480 and human ovarian cancer cell OVCAR3 was much high than that in human bronchial epithelial cell HBE,the difference was statistically significant(F=37 947.676,P=0.000);ACPP was located in cytoplasm and mediated the ACPPs-pc-Ad.egfp compound to be distributed in cytoplasm.ConclusionACPPs is successfully synthesized,which exhibits the cell-penetrating activity and is distributed in cytoplasm.
Neoplasms/therapy;Subcellular fractions;Macromolecular substances;Activatable cellpenetrating peptide;Targeted
10.3969/j.issn.1009-5519.2016.06.008
A
1009-5519(2016)06-0823-04
广州医科大学科学研究基金项目(2011C18)。
马少丹(1994-),在读本科学生,主要从事肿瘤生物治疗研究。
△,E-mail:bl_d2002@hotmail.com。
(2015-12-25)

