肺癌患者癌组织及血清缺氧诱导因子-1α表达分析的临床价值*
陈 雯,赛文莉,杨绪莉,蔡 胤,顾娟娟,王 理,吴 玮,姚登福△(南通大学附属医院:.检验科;.临床医学研究中心;.医学信息中心,江苏南通600)
肺癌患者癌组织及血清缺氧诱导因子-1α表达分析的临床价值*
陈雯1,赛文莉2,杨绪莉2,蔡胤2,顾娟娟2,王理3,吴玮2,姚登福2△
(南通大学附属医院:1.检验科;2.临床医学研究中心;3.医学信息中心,江苏南通226001)
目的检测肺癌患者癌组织及血清缺氧诱导因子-1α(HIF-1α)表达水平并分析其临床价值。方法选取2012年1月至2015年2月该院收治的肺癌患者115例作为肺癌组,选取同期住院肺部感染的肺炎患者30例作为肺炎组、健康体检者30例作为健康对照组。收集115例肺癌患者术后癌及癌旁组织标本,提取总RNA分析组织核酸代谢水平;采用组织芯片和免疫组织化学法分析HIF-1α表达状态与胞内分布;采用酶联免疫吸附试验法定量检测血清HIF-1α及血管内皮生长因子(VEGF)水平。结果肺癌组患者血清HIF-1α水平[(138.3±28.8)μg/L]明显高于健康对照组[(24.1±3.3)μg/L]和肺炎组[(58.8±14.5)μg/L],差异均有统计学意义(P<0.01),且与血清VEGF水平呈显著正相关(r=0.937,P<0.01);肺癌总RNA质量分数[(1.52±1.14)μg/mg]显著高于癌周组织[(0.58±0.33)μg/mg],差异有统计学意义(t=8.494,P<0.01);不同性别、肿瘤直径、分化程度及有无淋巴结转移患者肺癌组织HIF-1α表达阳性率比较,差异均有统计学意义(P<0.05)。结论肺癌组织HIF-1α表达与组织核酸代谢水平和血管形成密切相关,且有助于肺癌的诊断与鉴别。
肺肿瘤/诊断;缺氧诱导因子1,α亚基;核酸类/代谢;酶联免疫吸附测定
近年来,肺癌患者生存情况改善有限,确诊后存活5年及以上者约为16%;Ⅰ期肺癌患者如及时手术治疗10年生存率可达90%以上[1-2]。随肺癌瘤体增大、耗氧量增加,组织缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)过表达,刺激血管形成等相关物质表达[3],且影响放、化疗的疗效,使癌细胞更具侵袭性[4-5]。组织缺氧与新血管生成相关的血管内皮生长因子(vascularendothelial growth factor,VEGF)的相互关系值得探讨,有可能成为影响肺癌患者预后的重要因素[6]。本研究分析了115例患者肺癌组织及血清HIF-1α表达状态、临床病理学特征及其与VEGF表达的相互关系和临床价值,现报道如下。
1 资料与方法
1.1资料
1.1.1研究对象选取2012年1月至2015年2月本院收治的肺癌患者115例,其中男58例,女57例;年龄39~77岁,中位年龄58岁;115例患者均有完整随访资料,符合2011年版肺癌诊疗规范。收集115例患者术后新鲜肺癌组织及癌旁组织(与癌组织距离大于3.0 cm且病理检查无癌细胞)标本,病理组织学检查(苏木精-伊红染色)均为非小细胞肺癌,置-80℃保存。选取同期住院肺部感染的肺炎患者30例作为肺炎组、健康体检者30例作为健康对照组,肝、肾功能,血脂,血糖等均正常。本研究经医学伦理委员会同意。
1.1.2主要试剂VEGF兔多克隆抗体(BA0407)、HIF-1α兔多克隆抗体(PB0245)和小鼠抗兔免疫球蛋白(immunoglobulin,Ig)G-生物素标记小鼠抗兔 IgG二抗(BM2004)均购自武汉博士德生物工程有限公司。二步法免疫组化试剂盒购自北京中山生物技术公司。
1.1.3主要仪器Bio-Ⅱ-A生物安全柜 EN-12469-2000型(西班牙Telstar公司),超低温冰箱MDF-U71V型、KUBOTA高速冷冻离心机6900型(日本SANYO公司),聚合酶链反应(polymerase chain reaction,PCR)扩增仪TC-412型(英国Techne公司),PowerPac高电流电泳仪、Mini Trans-Blot转印槽、凝胶成像分析仪、核酸蛋白分析仪170-2525型(美国BIO-RAD公司),MegaBACE DNA测序仪等。
1.2方法
1.2.1肺组织总RNA制备及定量检测精确称取肺组织50 mg,置于无RNA酶匀浆器中。加入RNA快速制备试剂(MRC公司,USA)总RNA抽提试剂——TRIzol 1.0mL,匀浆2min,再按试剂盒说明书提取总RNA,采用核酸蛋白分析仪检测260 nm波长吸光度(A值),换算总RNA质量分数,即每毫克湿质量肺癌组织中的总RNA质量分数(μg/mg),经鉴定制备的RNA未被污染和降解后置于-80℃保存。
1.2.2cDNA合成、引物设计、扩增及测序
1.2.2.1HIF-1α cDNA合成以第1链cDNA合成试剂盒(Fermentas公司)合成HIF-1α cDNA,按照试剂盒说明书操作。
1.2.2.2引物设计及PCR扩增按基因库人HIF-1α序列(NM_001530),以PrimerPremier5.0软件设计PCR引物,由上海英骏生物公司合成。引物HIF-1α(F):5′-CTCATCCAAGAAGCCCTAAC-3′(nt2452-2471);HIF-1α (R):5′-TCATAACTGGTCAGCTGTGG-3′(nt2781-2800),扩增片段349 bp。以甘油醛-3-磷酸脱氢酶(GAPDH,NM-002046)作为内参,GAPDH(F):5′-CACTGGCGTCTTCACCACCAT-3′(nt396-416);GAPDH(R):5′-GTGCAGGAGGCATTGCTGAT-3′(nt541-560),扩增片段165 bp。取HIF-1α cDNA 1.0 μL,10 μmoL/L上、下游引物各1.0μL,PremixTaq DNA多聚酶(日本TaKaRa公司)12.5 μL,加双蒸水(double distilled water,ddH2O)至20 μL,于94℃预变性5 min,94℃10 s、55℃30 s、72℃60 s,扩增35个循环后72℃10 min,4℃保存。经琼脂糖凝胶电泳,扫描并拍照。
1.2.2.3DNA测序采用MontageTmDNA装置(4℃,9 000 r/min离心10 min),以DYEnamic ET Dye末端循环测序试剂(美国 Bioscienee公司)从目的凝胶制备DNA。将待测DNA 1.0 μg、2 pmol/μL测序引物2.5 μL、脱氟核糖核苷三磷酸混合试剂8.0 μL加ddH2O 20 μL。于95℃30 s后95℃20 s、50℃15 s、60℃1 min扩增30个循环,15℃保存。经醋酸铵、乙醇沉淀,采用Mega BACE DNA测序仪测序,应用Mega BACE系统软件(Version3.0)分析,并与GenBank源序列比对。
1.2.3组织芯片制备及免疫组织化学(免疫组化)法检测构建一个20×12点阵的组织芯片蜡块,厚度为4 μm切片,并将其黏附于涂有多聚赖氨酸的载玻片上,以每一肺癌组织取4个点,非癌组织取2个点,对HIF-1α进行免疫组化染色(S-P法)。按试剂盒说明书操作进行免疫组化检测:组织切片常规脱蜡及水化后以乙二胺四乙酸缓冲液冲洗后微波修复10 min,加入HIF-1α或VEGF一抗,室温孵育1 h,用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤3次后加入聚合体增强剂,室温孵育20 min,PBS洗涤3次后再加入二抗,室温孵育30 min,PBS洗涤3次后经0.1%二氨基联苯胺辣根过氧化物酶显色5 min,自来水充分冲洗、复染、脱水、透明、封片。以0.01 mol/L PBS(pH=7.5)替代一抗、二抗作为阴性对照。
1.2.4免疫组化结果判定结果判定以染色强度结合阳性细胞数百分比计分;以多数细胞染色特性计分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞百分比即某类细胞5个视野阳性细胞平均数:0~<5%为0分,5%~<25%为1分,25%~<50%为2分,50%~<75%为3分,≥75%为4分。将二者计分乘积作为免疫组化检测结果,最终分为低表达(1~4分)、中表达(5~8分)、高表达(9~12分)。
1.2.5蛋白质印迹法将50 mg湿质量肺组织经高速匀浆离心制备HIF-1α,采用2,2-联喹啉-4,4-二甲酸二钠法定量检测蛋白表达水平;在10%十二烷基磺酸钠-聚丙烯酰胺凝胶上加50 μg蛋白进行常规电泳,结束后转膜,封闭。再加入鼠抗人HIF-1α抗体溶液或内参肌动蛋白抗体溶液、辣根过氧化物酶标记兔抗鼠IgG二抗溶液继续孵育,最后采用增强化学发光显色并摄取照片。
1.2.6酶联免疫吸附试验(ELISA)法检测血清VEGF、HIF-1α水平采用ELISA KIT/96T检测试剂盒(优尔生,武汉)。VEGF(SEA143Hu,优尔生,武汉)检测范围:15.63~1 000.00 pg/mL,HIF-1α(SEA798Hu,优尔生,武汉)检测范围:0.156~10.000 ng/mL。按试剂盒说明书操作,于酶标仪在450 nm波长测吸光度(A值),根据各自标准曲线计算VEGF和HIF-1α水平。
1.3统计学处理应用 Graphpad Prism5.0软件和SPSS18.0统计软件绘图并进行数据分析,计量资料以±s表示,组间比较采用t检验、单因素方差分析(One-Way ANOVA);采用直线相关分析HIF-1α与VEGF表达的关系。P<0.05为差异有统计学意义。
2 结 果
2.1血清HIF-1α、VEGF水平及其相关性肺癌组患者血清HIF-1α水平显著高于肺炎组和健康对照组,肺炎组患者血清HIF-1α水平显著高于健康对照组,差异均有统计学意义(P<0.05)。肺癌患者血清HIF-1α和VEGF水平明显升高,若二者分别以100.0、280.0 μg/L作为临界值,肺癌组阳性率分别为90.4%、99.1%,肺炎组分别为0、13.3%,健康对照组均无异常。肺癌患者血清HIF-1α水平与VEGF水平明显相关(r=0.937,P<0.01),见表1。

表1 血清HIF-1α、VEGF水平及其相关性
2.2肺癌组织及癌周组织HIF-1α基因和蛋白表达水平比较肺癌组织总RNA质量分数[(1.52±1.14)μg/mg]显著高于癌周组织[(0.58±0.33)μg/mg],差异有统计学意义(t=8.494,P<0.01);经PCR扩增基因片段大小为349bp,经测序与GenBankHIF-1α源序列完全一致,见图1。

图1 肺癌组织及癌周组织HIF-1α基因和蛋白表达水平比较
2.3肺癌组织HIF-1α强势表达组织芯片构建图可见组织点阵排列整齐,免疫组化S-P染色所有组织无掉片、移位,无组织扭曲,所取组织满足分析。肺癌组织及癌围组织HIF-1α表达呈深棕黄色,颗粒状,主要定位于细胞质和细胞核。肺癌组织中HIF-1α表达较均匀,坏死区周围及肿瘤浸润边缘HIF-1α表达增多,靠近肿瘤边缘被压扁的组织中HIF-1α表达明显。癌组织HIF-1α阳性表达、强度与计分均显著高于癌周组织,见图2。
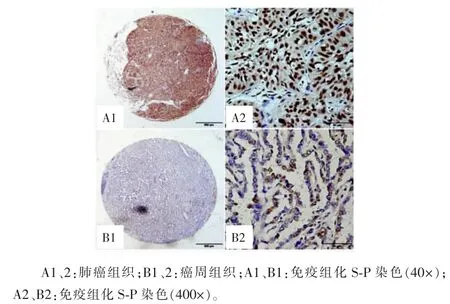
图2 肺癌组织及癌周组织HIF-1α蛋白表达的组织芯片分析
2.4肺癌组织HIF-1α表达的临床病理学特征115例肺癌组织HIF-1α阳性87例(75.65%);不同年龄、TNM分期和是否存活5年患者肺癌组织HIF-1α阳性率比较,差异均无统计学意义(P>0.05);而不同性别、肿瘤直径、分化程度及有无淋巴结转移患者肺癌组织HIF-1α表达阳性率比较,差异均有统计学意义(P<0.05),见表2。
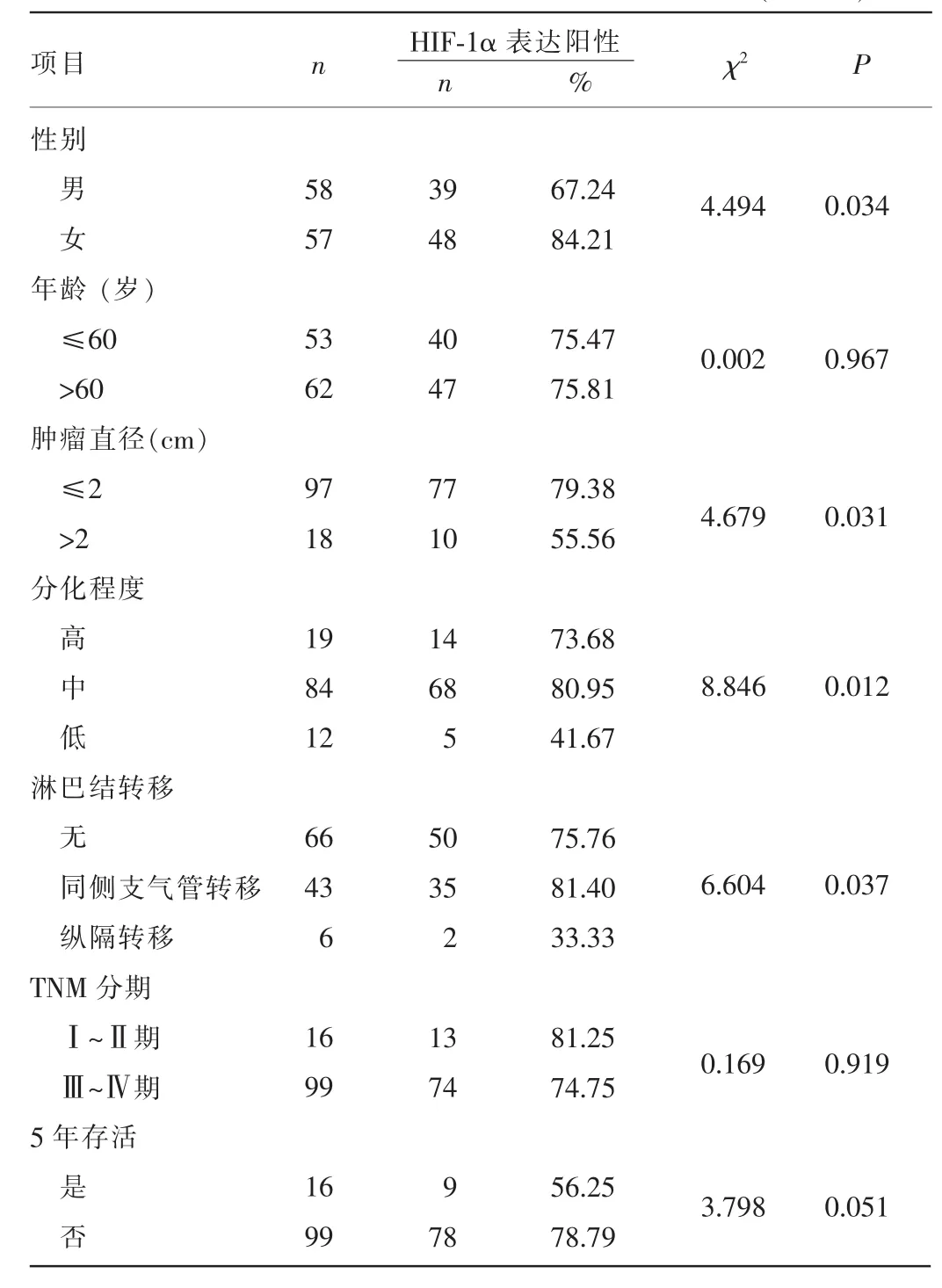
表2 肺癌组织HIF-1α表达的临床病理学特征(n=115)
3 讨 论
肺癌预后的影响因素复杂,直接与患者早期症状不明显、早期诊断技术缺陷、患者就诊意识低等相关,肺癌确诊时已基本属于中、晚期,传统治疗方式为手术切除,放、化疗[7]。血管期肺癌患者瘤内出现新的毛细血管并促使肿瘤细胞分裂、生长和转移,其中肿瘤血管来源于血管生成、血管套叠式生长和内皮祖细胞[8]。处于无血管期患者肿瘤细胞团在缺氧等因素的作用下使瘤细胞和巨噬细胞等产生大量血管生成因子而诱导血管生成是肺癌生长、进展的关键[9]。本研究从基因转录和蛋白表达水平分析了肺癌组织和血清HIF-1α表达水平与改变,评价了其对肺癌预后评估的临床价值。
肺癌进展与微环境及新血管生成密切相关。随着肺癌细胞增殖、瘤体增大,癌组织中耗氧量显著增加,造成缺氧致HIF-1α过表达,使癌细胞分泌血管生成因子而诱导血管生成。本研究结果显示,肺癌患者若以血清HIF-1α>100.0μg/L为临界值,肺癌组阳性率为90.4%,肺炎组和健康对照组均未见异常;以血清VEGF>280.0 μg/L为临界值,肺癌组和肺炎组阳性率分别为99.1%、13.3%,HIF-1α和VEGF水平显著升高且呈正相关,二者均是反映肺癌进展和有助于诊断的血清学标志物。在蛋白水平上显示,肺癌组织HIF-1α阳性表达呈棕黄色,颗粒状,主要定位于细胞质和细胞核;肺癌组织HIF-1α阳性率及表达强度均明显高于癌周组织,与文献[10]研究结果一致;不同年龄、TNM分期和是否存活5年患者肺癌组织HIF-1α表达阳性率比较,差异均无统计学意义(P>0.05);而不同性别、肿瘤直径、分化程度及有无淋巴结转移患者肺癌组织HIF-1α表达阳性率比较,差异均有统计学意义(P<0.05),提示HIF-1α基因可能是肺癌治疗的有用靶目标[11]。
综上所述,本研究从基因转录和蛋白表达水平探讨了人肺癌组织和血清HIF-1α表达与改变,结果显示,肺癌组织HIF-1α过表达调节了VEGF转录与新生血管生成,相互协同、依赖,形成正反馈机制,其水平进行性增加可反映癌变的发生和进展。肺癌组织HIF-1α和 VEGF过表达可分泌入血,检测血清HIF-1α和VEGF水平有助于肺癌的诊断[12];另外抑制HIF-1α表达或抑制VEGF与受体结合、抑制血管内皮细胞增殖将有助于肺癌的治疗。
[1]Xie SS,Li M,Zhou CC,et al.Prophylactic cranial irradiation may impose a detrimental effect on overall survival of patients with nonsmall cell lung cancer:a systematic review and meta-analysis[J].PLoS One,2014,9(7):e103431.
[2]Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011:the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4):212-236.
[3]杨士军,郑云会,张金华,等.血清CEA、NSE、CYFRA21-1联合支气管活检对周围型肺癌的诊断价值[J].临床检验杂志,2014,32(12):912-914.
[4]Almendros I,Wang Y,Gozal D.The polymorphic and contradictory aspects of intermittent hypoxia[J].Am J Physiol Lung Cell Mol Physiol,2014,307 (2):L129-140.
[5]Wan J,Chai H,Yu Z,et al.HIF-1α effects on angiogenic potential in human small cell lung carcinoma[J].J Exp Clin Cancer Res,2011,30:77.
[6]Wang Q,Hu DF,Rui Y,et al.Prognosis value of HIF-1α expression in patients with non-small cell lung cancer[J].Gene,2014,541(2):69-74.
[7]Farnsworth RH,Lackmann M,Achen MG,et al.Vascular remodeling in cancer[J].Oncogene,2014,33(27):3496-3505.
[8]Cuninghame S,Jackson R,Zehbe I.Hypoxia-inducible factor 1 and its role in viral carcinogenesis[J].Virology,2014,456/457:370-383.
[9]Secker GA,Harvey NL.VEGFR signaling during lymphatic vascular development:From progenitor cells to functional vessels[J].Dev Dyn,2015,244(3):323-331.
[10]Chen P,Zhu J,Liu DY,et al.Over-expression of survivin and VEGF in small-cell lung cancer may predict the poorer prognosis[J].Med Oncol,2014,31(1):775.
[11]Ren W,Mi D,Yang K,et al.The expression of hypoxia-inducible factor-1α and its clinical significance in lung cancer:a systematic review and metaanalysis[J].Swiss Med Wkly,2013,143:w13855.
[12]Sanmartín E,Sirera R,Usó M,et al.A gene signature combining the tissue expression of three angiogenic factors is a prognostic marker in early-stage non-small cell lung cancer[J].Ann Surg Oncol,2014,21(2):612-620.
Clinical values on analysis of cancerous tissue or circulating hypoxia-inducible factor-1α expression levels in patients with lung cancer*
Chen Wen1,Sai Wenli2,Yang Xuli2,Cai Yin2,Gu Juanjuan2,Wang Li3,Wu Wei2,Yao Dengfu2△(1.Department of Clinical Laboratory;2.Research Center of Clinical Medicine;3.Center of Medical Informatics,Affiliated Hospital of Nantong University,Nantong University,Nantong,Jiangsu 226001,China)
ObjectiveTo investigate the hypoxia-inducible factor-1α(HIF-1α)expression levels in cancer tissue and serum of the patients with lung cancer and to analyze its clinical values.MethodsTotally 115 patients with lung cancers in our hospital from January 2012 to February 2015 were selected as the lung cancer group,contemporaneous 30 cases of pneumonia as the pneumonia group and 30 individuals undergoing the physical examination as the control group.The postoperative cancerous and paracancerous tissues in 115 cases of lung cancer were collected for extracting total RNA and analyzing the tissue nucleic acid metabolic level The status of tissue HIF-1α expression and intercellular distribution were observed by adopting the tissue microarray with immunohistochemistry.The serum HIF-1α and VEGF levels were detected by using the enzyme-linked immunosorbent assay(ELISA).ResultsThe serum HIF-1α level in the lung cancer group was(138.3±28.8)μg/L,which was significantly higher than(24.1±3.3)μg/L in the control group and(58.8±14.5)μg/L in the pneumonia group,the differences were statistically significant(P<0.01),moreover had significant positive correlation with serum VEGF level(r=0.937,P<0.01).The total RNA mass fraction in lung cancer was(1.52±1.14)μg/mg,which was significantly higher than(0.58±0.33)μg/mg in the paracancer ous tissue,the difference was statistically significant(t=8.494,P<0.01);the lung cancer tissue HIF-1α expression positive rate had statistical differences among difference genders,tumor sizes,differentiation degrees and whether having lymph node metastasis,the differences were statistically significant(P<0.05).ConclusionLung cancer tissue HIF-1α expressions is closely correlated to the tissue nucleic acid metabolic level and angiogenesis,moreover is helpful to the diagnosis and identification of lung cancer.
Lung neoplasms/diagnosis;Hypoxia-inducible factor 1,alpha subunit;Nucleic acids/metabolism;Enzyme-linked immunosorbent assay
10.3969/j.issn.1009-5519.2016.06.002
A
1009-5519(2016)06-0804-04
江苏省“六大人才”项目(WSW-011);南通市应用研究科技计划项目(BK2013048)。
陈雯(1966-),副主任检验师,主要从事恶性肿瘤早期诊断的研究。
△,E-mail:yaodf@ahnmc.com。
(2015-12-18)

