microRNA-221在结直肠癌中的表达及其对癌细胞迁移的影响
王刚,解寒冰(河南省郑州人民医院 .急诊科,.普通外科,河南 郑州 450003)
临床论著
microRNA-221在结直肠癌中的表达及其对癌细胞迁移的影响
王刚1,解寒冰2
(河南省郑州人民医院 1.急诊科,2.普通外科,河南 郑州 450003)
目的研究上皮-间质转化(EMT)相关的微小R NA(microR NA,以下简称miR NA)-221在结直肠癌患者中的表达水平,并探索其对结直肠癌细胞迁移水平的影响。方法选取该院40例结直肠癌患者为研究组,选取同期体检的40例健康人群为对照组。采用实时定量R T-PCR法检测结直肠癌患者癌组织以及癌旁组织中miR NA-221表达水平,同时对比结直肠癌患者及正常人血浆中miR NA-221表达水平。对结直肠细胞采用miR NA-221的mimic及inhibitor分别高、低表达miR NA-221后,采用transwell法分别检测细胞的侵袭水平以及EMT相关蛋白表达。结果miR NA-221在直肠癌组织的表达水平显著高于癌旁组织,差异有统计学意义(P<0.05);miR NA-221在直肠癌患者血浆中的表达水平显著高于健康对照人群,差异有统计学意义(P<0.05)。干扰结直肠癌HT-29细胞株中miR NA-221后,结直肠癌细胞迁移能力显著降低(均P<0.05),且细胞中EMT相关的上皮钙黏蛋白(E-cad)的表达水平降低;而过表达HT-29细胞株中miR NA-221,结直肠癌细胞迁移能力显著增加,且细胞中EMT相关的上皮钙黏蛋白(E-cad)的表达水平增加。结论结直肠癌患者高表达的miR NA-221通过促进结直肠癌细胞的迁移水平来参与结直肠癌发生发展的进程。
microR NA-221;结直肠癌;上皮钙黏蛋白;迁移
结直肠癌(colorectal cancer,CRC)是全球消化道最常见的恶性肿瘤之一,根据WHO国际癌症研究机构数据显示,近年来,结直肠癌的发病率和死亡率呈现逐渐上升的趋势[1]。而在中国,由于饮食结构西方化、生活行为方式改变及精神紧张等很多因素,结直肠癌死亡率居恶性肿瘤第5位[2-3]。因此,研究结直肠癌的发病机制对结直肠癌的预防和治疗有着重要的临床意义。上皮-间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞在特定的生理和病理情况下向间质细胞发生转化的现象。研究发现,EMT现象与肿瘤的侵袭、转移等密切相关,在多种癌症的原位浸润和远处转移中发挥着极其重要作用[4]。
微小RNA(microRNA,以下简称miRNA)是一类新近发现的长度约为22个核昔酸的非编码单链小分子RNA。研究发现,miRNA在肿瘤的EMT过程中发挥着重要的作用:miRNA-194能够通过靶向FoxM1抑制胃癌的EMT过程[5];miRNA-124通过调节TNF-a参与调节前列腺癌的EMT[6];高表达的miRNA-9参与乳腺癌的EMT过程[7]。miRNA-221是一类近年来发现的与前列腺癌EMT中密切相关的新分子[8]。然而到目前为止,EMT相关的miRNA-221在结直肠癌患者组织及血浆内的表达水平以及对结直肠癌细胞潜在作用的研究报道尚少。本研究对比了miRNA-221在结直肠癌患者组织及血浆内的表达水平,并观察其对结直肠癌细胞的迁移能力的影响。
1 材料与方法
1.1临床资料
所有组织样本来源于2013年1月-2015年1月郑州人民医院行手术治疗的40例结直肠癌患者的手术切除标本,病理诊断均为结直肠癌。患者年龄23~69岁。术前均未接受化疗、放疗。癌组织标本离体时间控制在30 min内,并分别取癌旁组织(距离癌组织大约4 cm)。对照组选取本院体检的正常40例健康人群,年龄22~63岁。其中,男性16例,女性24例。两组人群在性别、年龄方面差异无统计学意义,具有可比性(P>0.05)。
1.2实验方法
1.2.1组织以及血浆标本总R NA提取、逆转录反应及检测清晨空腹时抽取正常人群与结直肠癌患者5 ml外周静脉血,加入EDTA抗凝剂,2 h内于4℃条件下4000r离心5min。离心后提取上层血浆
放入-80℃冰箱保存备用。结直肠癌组织及癌旁组织手术切除标本取出后立即放入液氮,并储存于-80℃冰箱。总RNA提取、逆转录反应及实时定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR):取约100mg组织或100μl血浆,加入1 ml Trizol(购于美国Gibco公司)后采用匀浆仪进行匀浆,抽提总RNA,所得RNA溶于20μl的DEPC水中,采用逆转录试剂盒(Thermo Fisher公司)对所抽提的RNA进行逆转录得到cDNA。PCR反应条件:95℃变性20 s,然后60℃ 20 s和70℃ 1 s进行40个循环。miRNA-221探针引物:5'-GAAACCCAG CAGACAATGTAGCT-3'[9];U6内参:5'-CTCGCTTCG GCAGCACA-3'以及5'-AACGCTTCACGAATTTGCG T-3'。PCR使用ABI公司的7300型号Real-Time PCR仪器,结果采用2-ΔΔCt法进行相对定量分析[10]。
1.2.2细胞转染人大肠癌细胞株HT-29(上海拜力生物科技有限公司)采用高糖DMEM(美国Hyclone公司)+10%FBS(美国Gibico公司)传代培养,如图1所示。待HT-29细胞汇合率生长到60%~70%左右时,采用脂质体2000(美国Invitrogen公司)对株HT-29分别采用miRNA-221的mimic及inhibitor转染,高、低表达miRNA-221,于48 h检测其干扰效率。miRNA-221的模拟物与抑制物由广州锐博生物科技有限公司设计合成。分组情况:A组空白组(未加任何序列质粒);B组对照组(加入对照无意义序列);C组实验组(mimic及inhibitor转染组)。

图1 细胞培养图 (×200)
1.2.3细胞迁移实验取对数生长期HT-29细胞制备细胞悬液,调整细胞密度至5×l05个/ml,按0.1 ml/孔加入到transwell(美国Corning公司)小室的上层,小室下层加入1ml的10%血清的培养液(完全DMED)。培养24h时间后,取出transwell小室,吸去上层的培养液,使小室于室温下自然干燥。无水乙醇固定后,采用0.1%结晶紫于室温下染色30min,倒置显微镜(德国蔡司,CFM-500)下观察己迁移至小室下层的细胞。随机选取5个视野(×200倍),计数小室下层的细胞数。本实验重复3次,每次每样三复孔。
1.3免疫印迹检测蛋白水平
转染后收集HT-29细胞,加入1×SDS细胞裂解液,SDS-PAGE电泳,120 V电压转膜100 min,37℃封闭 80 min,加兔抗人的上皮钙黏蛋白(E-cadherin,E-cad)(美国Cell Signaling公司)4℃孵育过夜后,HRP标记的小鼠抗兔二抗(南京生兴生物)(1∶2000稀释)37℃孵育30min,ECL发光检测。内参蛋白选用Sigma公司的兔抗人β-actin (1∶3 000稀释)。用Image-Pro-plus图像分析软件系统对蛋白条进行扫描并分析结果,以β-actin为参照,E-cad表达的相对含量以目的条带与内参条带灰度值的比值表示。
1.4统计学方法
采用SPSS 17.0统计学软件进行统计分析。观测资料均为计量数据,经正态性检验通过,以均数±标准差(±s)描述。多组间的比较,为单因素方差分析+LSD多重比较;两组间的差异比较,为成组t检验,P<0.05认为差异有统计学意义。
2 结果
2.1结直肠癌患者组织中miRNA-221 mRNA的表达水平
miRNA-221 mRNA在结直肠患者组织中的表达水平为(3.02±1.19),显著高于癌旁组织的(1.18±0.27),差异有统计学意义(t=11.682,P= 0.000)。
2.2结直肠癌患者血浆中miRNA-221 mRNA的表达水平
结直肠癌患者血浆中miRNA-221 mRNA表达水平为(3.18±1.81),显著高于正常健康人群的(1.31±0.53),差异有统计学意义(t=6.345,P= 0.000)。
2.3低表达miRNA-221对结直肠癌细胞迁移能力及EMT相关蛋白水平影响
由表1可见,3个指标的3个组间整体差异有统计学意义(P<0.05)。遂进行多重比较,比较结果显示:结直肠癌细胞转染miRNA-221的抑制物(inhibitor)后,miRNA-221的mRNA水平显著降低(P<0.05)(见图2A)。低表达结直肠癌细胞中miRNA-221后,HT-29细胞的迁移能力显著降低(P<0.05)(见图2B)。此外,本研究还发现,与转染对照组比较,低表达miRNA-221的结直肠癌细胞中EMT相关的上皮钙黏蛋白(E-cad)的表达水平降低(图2C、2D),差异也有显著性意义(P<0.05)。
2.4高表达miRNA-221对结直肠癌细胞迁移能力及EMT相关蛋白水平影响
由表2可见,3个指标的3个组间整体差异也均有统计学意义(P<0.05)。再进行多重比较,比较结果显示:结直肠癌细胞转染miRNA-221的模拟物(mimic)后,miRNA-221的mRNA水平表达增加(见图3A),差异有统计学意义(P<0.05)。高表达结直肠癌细胞中miRNA-221后,HT-29细胞且迁移能力也显著增加(见图3B)(P<0.05)。此外,与转染对照组比较,过表达miRNA-221的结直肠癌细胞中EMT相关的E-cad的表达水平增加(见图3C、3D),差异有统计学意义(P<0.05)。
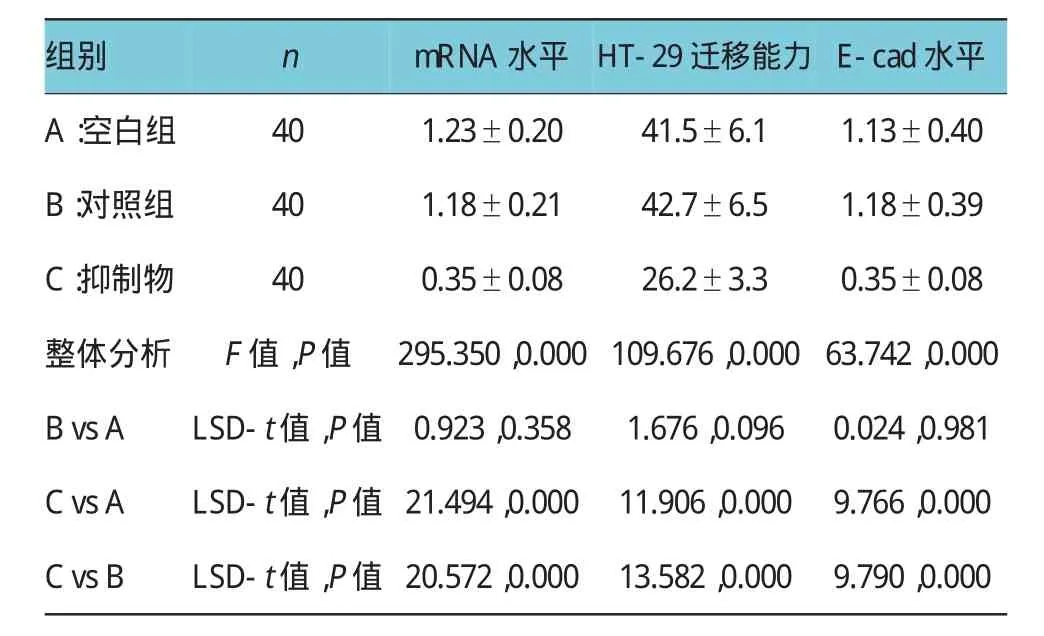
表1 干扰miRNA-221对结直肠癌细胞迁移影响比较
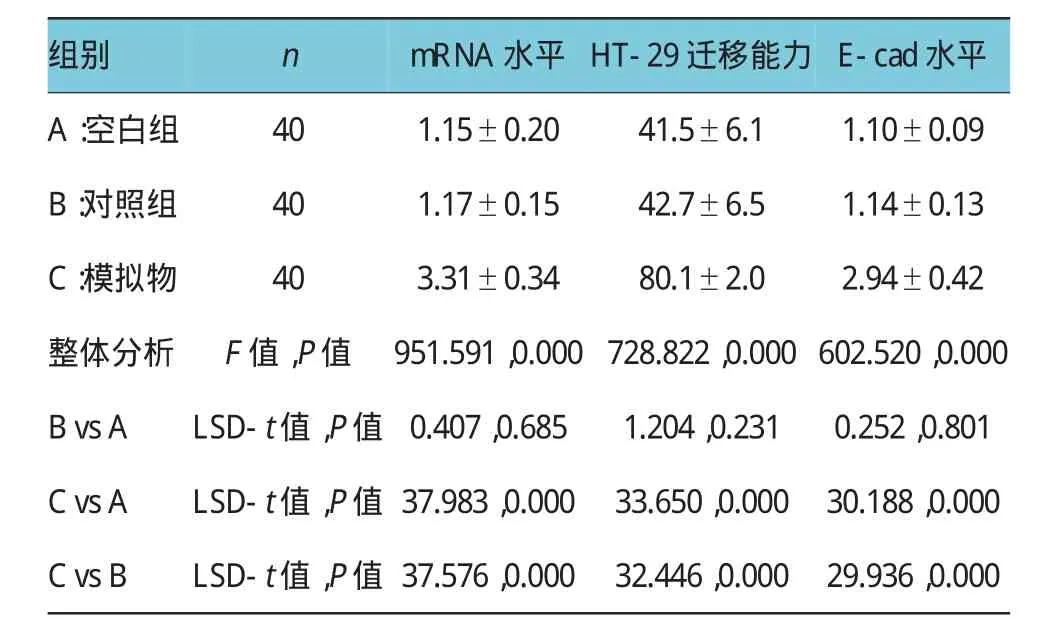
表2 过表达miRNA-221对结直肠癌细胞迁移影响比较
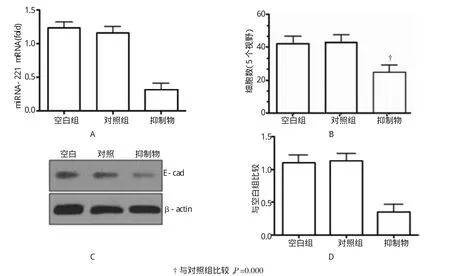
图2 低表达miRNA-221对结直肠癌细胞迁移能力及EMT相关蛋白水平影响

图3 高表达miRNA-221对结直肠癌细胞迁移能力及EMT相关蛋白水平影响
3 讨论
结直肠癌是一种常见的消化道恶性肿瘤,其发病与生活方式、遗传及大肠腺瘤等关系密切。结直肠癌的发生及发展是一个多因素、复杂的过程,而肿瘤转移是结直肠癌高死亡率的主要原因之一[11]。结直肠癌的EMT过程包含细胞骨架重排、上皮细胞解除细胞间黏附结构及细胞极性改变等,导致细胞变形、伸出丝状伪足及细胞极性的丧失等,从而在结直肠癌的发生发展中发挥极其重要的作用[12]。因此,寻找特异性早期诊断EMT相关的分子标志物(如基因标志)以及基因靶向治疗的新策略成为结直肠癌的基础与临床研究的热点问题。
microRNA(miRNA)通过引起特异靶mRNA降解抑制蛋白合成,在转录后水平负性调控特异基因表达,是一种新的基因表达调控分子。研究认为,miRNAs既可作为癌基因又可作为抑癌基因,广泛参与肿瘤细胞的侵袭、转移等多种病理过程[13-17]。大量的研究认为,miRNA在结直肠肿瘤的发生、发展、诊断和预后等方面发挥重要作用[11,18-19]。Hansen等[11]发现在结直肠癌细胞系中miRNA-126显著上调,并与结直肠癌的转移密切相关。而Geng等[20]发现,miRNA-103在结直肠癌组织中表达上调,且能够促进结直肠癌的迁移。然而至今,结直肠癌患者中miRNA-221的表达水平及其功能的研究尚少报道。
本结果发现,miRNA-221在结直肠癌患者组织中表达水平显著高于癌旁组织,且miRNA-221在结直肠癌患者血浆中的表达水平高于正常人群,说明了miRNA-221在结直肠癌患者中可能参与结直肠癌的发生、进展和转移。Qin等[21]学者发现miRNA-221在结直肠癌细胞系HT29中高表达,且其可以通过靶向RECK分子促进结直肠癌细胞的转移;从另一方面支持了本研究在结直肠癌组织中的结果。
此外,结果还发现,低表达miRNA-221的结直肠癌细胞的迁移水平显著降低,而高表达miRNA-221的结直肠癌细胞的迁移水平显著增加,表明miRNA-221能够促进结直肠癌细胞的迁移,从而提示了miRNA-221可能通过影响结直肠癌细胞的迁移参与结直肠癌的进程,这与Qin等[23]研究的结果一致[21]。研究表明,直肠癌的EMT过程在分子生物学方面典型表现为E-cad蛋白等上皮标志物的缺失或减弱。本研究结果亦发现,低表达miRNA-221的结直肠癌细胞的EMT相关蛋白E-cad表达水平显著降低;而高表达miRNA-221的结直肠癌细胞中EMT相关蛋白E-cad表达水平显著增加,从而提示了miRNA-221可能通过调控E-cad来参与结直肠癌的EMT进程。
综上所述,miRNA-221在结直肠癌中可能发挥促进肿瘤的功能,其主要是通过影响乳结直肠癌细胞的迁移来参与肿瘤的进程,并与结直肠癌的EMT相关蛋白E-cad密切有关。结直肠癌患者组织及血浆中miRNA-221的检测对结直肠癌的临床治疗及预后可能具有一定的指导意义。
[1]Brenner H,Kloor M,Pox CP.Colorectal cancer[J].Lancet,2014, 383(9927):1490-1502.
[2]Zheng ZX,Zheng RS,Zhang SW,et al.Colorectal cancer incidence and mortality in china,2010[J].Asian Pac J Cancer Prev, 2014,15(19):8455-8460.
[3]Liang Y,Tang W,Huang T,et al.Genetic variations affecting serum carcinoembryonic antigen levels and status of regional lymph nodes in patients with sporadic colorectal cancer from Southern China[J].PLoS One,2014,9(6):e97923.
[4]Hao J,Zhang Y,Deng M,et al.MicroRNA control of epithelial-mesenchymal transition in cancer stem cells[J].Int J Cancer, 2014,135(5):1019-1027.
[5]Li Z,Ying X,Chen H,et al.MicroRNA-194 inhibits the epithelial-mesenchymal transition in gastric cancer cells by targeting FoxM1[J].Dig Dis Sci,2014,59(9):2145-2152.
[6]Qin W,Pan Y,Zheng X,et al.MicroRNA-124regulates TGF-alpha-induced epithelial-mesenchymal transition in human prostate cancer cells[J].Int J Oncol,2014,45(3):1225-1231.
[7]Gwak JM,Kim HJ,Kim EJ,et al.MicroRNA-9 is associated with epithelial-mesenchymal transition,breast cancer stem cell phenotype,and tumor progression in breast cancer[J].Breast Cancer Res Treat,2014,147(1):39-49.
[8]Su A,He S,Tian B,et al.MicroRNA-221 mediates the effects of PDGF-BB on migration,proliferation,and the epithelial-mesenchymal transition in pancreatic cancer cells[J].PloS One,2013, 8(8):e71309.
[9]Gramantieri L,Ferracin M,Fornari F,et al.Cyclin G1 is a target of miR-122a,a microRNA frequently down-regulated in human hepatocellularcarcinoma[J].Cancer Res,2007,67(13): 6092-6099.
[10]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C (T))Method[J].Methods,2001,25(4):402-408.
[11]Hansen TF,Christensen R,Andersen RF,et al.MicroRNA-126 and epidermal growth factor-like domain 7-an angiogenic couple of importance in metastatic colorectal cancer.Results from the Nordic ACT trial[J].Br J Cancer,2013,109(5):1243-1251.
[12]Zhu QC,Gao RY,Wu W,et al.Epithelial-mesenchymal transition and its role in the pathogenesis of colorectal cancer[J]. Asian Pac J Cancer Prev,2013,14(5):2689-2698.
[13]张益,周总光,王玲,等.miR-21和miR-125在结直肠癌中的表达及其与临床病理指标的关系[J].中华胃肠外科杂志,2009,12(6): 623-626.
[14]Du J,Yang S,An D,et al.BMP-6 inhibits microRNA-21 expression in breast cancer through repressing deltaEF1 and AP-1 [J].Cell Res,2009,19(4):487-496.
[15]Zhang JG,Wang JJ,Zhao F,et al.MicroRNA-21(miR-21) represses tumor suppressor PTEN and promotes growth and in-vasion in non-small cell lung cancer(NSCLC)[J].Clin Chim Acta,2010,411(11-12):846-852.
[16]Bae HJ,Noh JH,Kim JK,et al.MicroRNA-29c functions as a tumor suppressor by direct targeting oncogenic SIRT1 in hepatocellular carcinoma[J].Oncogene,2014,33(20):2557-2567.
[17]Fan DN,Tsang FH,Tam AH,et al.Histone lysine methyltransferase,suppressor of variegation 3-9 homolog 1,promotes hepatocellular carcinoma progression and is negatively regulated by microRNA-125b[J].Hepatology,2013,57(2):637-647.
[18]Liu L,Chen L,Xu Y,et al.microRNA-195 promotes apoptosis and suppresses tumorigenicity of human colorectal cancer cells [J].Biochem Biophys Res Commun,2010,400(2):236-240.
[19]Liu Y,Zhou Y,Feng X,et al.Low expression of microRNA-126 is associated with poor prognosis in colorectal cancer [J].Genes Chromosomes Cancer,2014,53(4):358-365.
[20]Geng L,Sun B,Gao B,et al.MicroRNA-103 promotes colorectal cancer by targeting tumor suppressor DICER and PTEN [J].Int J Mol Sci,2014,15(5):8458-8472.
[21]Qin J,Luo M.MicroRNA-221 promotes colorectal cancer cell invasion and metastasis by targeting RECK[J].FEBS Lett,2014, 588(1):99-104.
[22]Ohdaira H,Sekiguchi M,Miyata K,et al.MicroRNA-494 suppresses cell proliferation and induces senescence in A549 lung cancer cells[J].Cell Prolif,2012,45(1):32-38.
[23]Xiong H,Hong J,Du W,et al.Roles of STAT3 and ZEB1 proteins in E-cadherin down-regulation and human colorectal cancer epithelial-mesenchymal transition[J].J Biol Chem,2012, 287(8):5819-5832.
(张蕾编辑)
Expression of microRNA-221 in colorectal carcinoma and its impact on cancer cells'migration
Gang Wang1,Han-bing Xie2
(1.Department of Emergency Medicine;2.Department of General Surgery,Zhengzhou People's Hospital,Zhengzhou,Henan 450003,China)
Objective To study miRNA-221 expression in colorectal tissue and plasma of cancer patients,and to explore the mechanism about its migration of colorectal cancer.Methods 40 cases of colorectal cancer patients in our hospital as the study group,40 cases of healthy people as the control group,we used RT-PCR to detect the mRNA levels in peripheral blood or tissue between of two groups;in addition,after overexpression or knockdown of microRNA-221,we detected the migration of cancer cells.Results The expression of microRNA-221 in colorectal cancer tissues was significantly higher than the adjacent tissues(P<0.05);in addition,the expression of microRNA-221 in plasma of colorectal cancer patients was significantly higher than the normal population(P<0.05).Knockdown of microRNA-221 in colorectal cancer cell line reduced cell invasion and E-cad expression significantly(P<0.05);whereas overexpression of microRNA-221 in colorectal cancer cell line improved cell invasion and E-cad expression significantly(P<0.05).Conclusion High expression of microRNA-221 in colorectal cancer patients participated in the development of colorectal cancer by promoting the migration of colorectal cancer cells.
microRNA-221;colorectal cancer;E-cad;migration
R 735.3
A
10.3969/j.issn.1005-8982.2016.04.012
1005-8982(2016)04-0058-06
2015-11-16

