三维手术模拟系统在复杂性肝脏肿瘤精准肝切除中的应用
张新俊,莫一我,王彦坤,王晓云,陈磊,王梓俞,胡磊,杨超,戴已禾,高波(.云南省第一人民医院 肝胆外科,云南 昆明 65003;.昆明医科大学,云南 昆明 650500)
临床论著
三维手术模拟系统在复杂性肝脏肿瘤精准肝切除中的应用
张新俊1,莫一我1,王彦坤1,王晓云1,陈磊1,王梓俞1,胡磊1,杨超1,戴已禾1,高波2
(1.云南省第一人民医院 肝胆外科,云南 昆明 650032;2.昆明医科大学,云南 昆明 650500)
目的总结肝脏三维手术模拟系统在复杂性肝脏肿瘤精准肝切除中的应用价值。方法回顾分析2009年5月-2014年6月云南省第一人民医院肝胆外科收治的85例复杂性肝脏肿瘤患者的临床资料。前瞻性研究对所有患者术前行肝脏CTA检查,应用三维手术模拟系统进行术前评估,分别计算模拟切除的肝脏体积、剩余肝脏体积和手术切缘,并与术后实际切除肝脏体积和实际手术切缘进行比较,最后通过软件虚拟肝切除功能优化手术方案。结果三维手术模拟系统可以清晰地显示和三维重建正常肝脏组织、肿瘤组织和肝内血管。患者模拟切除肝脏体积与实际切除肝脏体积统计学上具有相关性(P<0.01)。两者均值的差异无统计学意义(P=0.068)。模拟手术切缘与实际手术切缘统计学上也具有相关性(P<0.01),两者均值的差异也无统计学意义(P=0.256)。结论三维手术模拟系统可准确评估和模拟肝脏手术情况,为精准肝切除复杂性肝脏肿瘤提供手术数据和依据。
三维手术模拟系统;精准肝切除;虚拟肝切除
目前,肝脏肿瘤的外科治疗有了很大发展,取得了良好的临床治疗效果。但是,对于巨大的原发性肝脏肿瘤和比邻于第二、三肝门、紧贴下腔静脉的复杂性肝脏肿瘤,手术切除仍有一定的风险和难度。如何应用现代先进的影像技术为外科医师提供克服这一手术技术瓶颈的依据,对于复杂性肝脏肿瘤的治疗具有重要的价值和意义。
复杂性肝肿瘤是指位于下腔静脉(inferior vena cava,IVC)周围及第二、三肝门附近的巨块型肝脏肿瘤,包括左右半肝及中央型的肿瘤。中央型肝脏肿瘤根据目前世界流行的九段分区法,指实体肿瘤位于Ⅰ、Ⅳ、Ⅴ、Ⅷ及Ⅸ段的肿瘤[1-2]。其手术操作难点在于:首先,肿瘤位置毗邻进出肝的大管道,且肿瘤巨大,常常挤压肝门,造成肝门位移,甚至形成包绕,术中极易引发大出血而危及生命,术中出血较多及过多地切除肿瘤周围有效肝组织极易引起术后肝功能衰竭;其次,我国肝癌患者大多合并有肝炎后性肝硬化,多数在发现时已合并门静脉癌栓、肝静脉或胆管癌栓[3],极大地增加了手术的难度和风险,手术切除率低,预后差。所以复杂性肝脏肿瘤的手术切除是肝脏外科临床研究中的重点及难点。就手术切除的安全性,存在以下3个难点:①如何正确评估肝脏肿瘤切除的可能性;②如何控制术中大出血;③如何最大限度地保留有效残余肝组织、降低术后肝衰竭及死亡的发生率。目前,利用三维可视化技术,根据患者影像资料,针对个体特征,对肝脏及肿瘤进行重建,进行手术模拟、制订合理的手术方案,对于肝脏肿瘤切除具有重要意义,为手术医师术中操作提供依据。
1 资料与方法
1.1一般临床资料
收集云南省第一人民医院2009年5月-2014 年6月行手术切除的85例复杂性肝脏肿瘤患者的临床病例资料。其中,男性54例,女性31例,男∶女为2∶1;年龄22~67岁,平均53岁。肿瘤大小按最大直径计算,中位直径10cm(8~15cm)。HBsAg阳性者占74.1%(63/85),阴性者占25.9%(22/85)。术前AFP阳性者占71.8%(61/85),阴性者占28.2% (24/85)。肝硬化无或轻度者占80.0%(68/85),中、重度者占20.0%(17/85)。术前Child-Pugh评分A级有56例,B级有22例(肿瘤压迫肝内胆管所致胆红素升高),C级有7例(合并胆管癌栓所致黄疸)。吲哚菁绿15min潴留率(ICGR 15 min)<10%56例,10% ~20%29例。
1.2术前评估
1.2.1肝脏功能评估所有患者术前除了常规的肝功能检测外,还采用ICGR 15 min判断肝脏储备功能。
1.2.2肝脏影像学评估及三维手术计划分析所有患者术前行上腹部螺旋CT、磁共振(MR)检查,了解肿瘤的部位、数量、肿瘤生物学特性(包膜完整性、卫星灶、肝内外转移)、与周围脉管的关系及瘤栓。应用64排螺旋CT三期成像后的CT资料导入三维手术计划系统进行分析,该系统对肝脏的分割采用半自动方式,操作者在一个扫描层面选择CT资料中的正常肝脏和病变组织后,三维手术模拟系统(Myrian XP-Liver)可自动分割全部正常肝脏和病变区域并进行三维重建,必要时可在每4、5个扫描层面进行手动标记以保证重建的准确性。同样的方法可对肝内血管进行重建。该系统还带有虚拟手术功能,通过设置不同的切割平面和切割线,实现对手术的模拟,以便及时调整手术方案。整个过程中利用软件可计算肿瘤体积、切除肝脏体积及剩余肝脏体积。
1.3手术方法
1.3.1切口选择与入路采用右上腹L型切口进腹。常规切除肿瘤方法:充分游离、切断肝周各韧带,显露肝脏,然后断肝切除肿瘤。对于部分巨块型肝肿瘤,或肿瘤浸润邻近解剖结构(如腹后壁、横膈、右侧肾上腺等),使游离、翻起肝右叶困难,或当肿瘤直接压迫下腔静脉,而常规肝脏切除术有潜在危险性时,或尽管可以游离肝脏但翻转肝右叶可能扭转肝蒂引起对侧肝脏缺血时,采用前入路法肝脏切除技术。本组病例采用前入路法5例。
1.3.2第一肝门的处理①选择性半肝血流阻断。保留健侧半肝的血流。充分显露左右肝管汇合部,解剖患侧肝蒂,用直角钳钝性分离,在鞘内解剖出患侧的肝动脉和门静脉悬吊处理,甚至可以更精准到右前或右后分支。右半肝血流阻断用于肿瘤主要位于右半肝,左半肝血流阻断用于肿瘤主要位于左半肝。②交替半肝血流阻断。适用于较大的中肝叶肿瘤切除,行肿瘤左侧缘切除时阻断左肝门,保持右肝门通畅,切断中肝静脉后改行肿瘤右侧缘切除时阻断存肝蒂,松开左肝门,本组病例均使用上述方法。
1.3.3第二、三肝门的处理先将肝脏向下牵拉,从肝膈面显露第二肝门,仔细分开肝上下腔静脉前方的疏松组织,凹陷处即为腔静脉窝。再向下分离出右肝静脉根部的内侧。将肝脏脏面向上掀起,游离肝脏右冠状韧带,右三角韧带,直达下腔静脉的侧面,显露第三肝门,沿肝后下腔静脉前壁切断数支肝短静脉及Makuuchi韧带,显露右肝静脉的根部,游离出右肝静脉,预置阻断带备用。若肿瘤位于左半肝,游离切开肝胃韧带,于静脉韧带前缘、左肝静脉后方、左尾叶尖部有一间隙,沿此间隙向腔静脉窝方向分离,在腔静脉前方分离出肝左、中静脉的共干,预置阻断带备用。本组使用肝静脉阻断共21例。部分复杂肝肿瘤切除及需经前入路切除时,紧贴尾状叶的后方、下腔静脉前方,沿其中线伸入长止血钳,小心向头侧腔静脉陷窝方向分离推进约5~7 cm后形成隧道,用止血钳牵引8F导尿管穿过此隧道,将导尿管的两头提起,环绕肝脏,向前提拉就能把肝脏提起。使用本法共有9例。
1.3.4肝脏的离断本组病例全部使用超声吸引刀(CUSA)或钳夹法进行肝脏离断。用电刀切开肝包膜,然后用CUSA或钳夹法分离肝实质,由浅入深分离。一般所遇见的细小管道可用电刀或双极电凝处理,2mm以上管道则需钛夹钳夹或结扎,肿瘤局部侵犯下腔静脉者采用了局部切除血管修复技术。
1.4统计学方法
采用SPSS 13.0统计软件进行数据分析。数据以均数±标准差(±s)表示,手术切除体积和手术切缘的实际值与模拟值的比较采用t检验,实际值与模拟值的相关分析采用Pearson相关分析。P< 0.05为差异有统计学意义。
2 结果
本组病例平均手术时间为350min(210~440min),半肝血流阻断时间平均为43 min(8~57 min),术中平均出血量为570ml(250~1600ml),平均输血量为180 ml(0~1 000 ml),谷丙转氨酶恢复正常平均时间为7 d(3~11 d),总胆红素恢复正常平均时间为4d (3~5d),平均住院时间为10d(6~14d)。全组患者无死亡及肝功能衰竭发生,无腹腔内大出血及腹腔感染,术后有6例发生轻度胆漏。
2.1患者术后一般情况
85例患者3例患者术后出现腹水,2例出现胸水,4例术后5 d漏胆,均经对症处理后好转。85例患者住院时间为6~25d(平均15d),住院期间无死亡病例。
2.2三维手术模拟系统对切肝体积和手术切缘模拟的准确性
术前对85例患者的切肝体积和手术切缘进行了模拟,与术后实际切肝体积和实际手术切缘进行比较。结果显示:模拟与实际切肝体积有明显的相关性(P<0.01),两者均值(896.7ml和819.1ml)差异无统计学意义(P=0.068)。模拟和实际的手术切缘也具有明显的相关性(P<0.01),两者均值(12.2 mm和11.9mm)差异无统计学意义(P=0.26)。
2.3三维手术模拟系统在复杂性肝切除中的应用
患者术前影像学检查提示肝Ⅶ、Ⅷ段肿瘤(图1A)。术前检查提示患者有轻度肝硬变,肝功能Child-Pugh分级为A级,1CGR15<10%。应用三维手术模拟系统进行三维重建,可清晰显示荷瘤肝段的门静脉分支(图1A),对肝静脉的重建显示了肿瘤与肝中静脉、肝右静脉的关系(图1B、1C)。利用手术模拟功能进行虚拟肝Ⅶ、Ⅷ段切除(图1D)。结果显示模拟肝脏切除体积393.6 ml,剩余肝脏体积占全肝的56.1%,模拟手术切缘为12.5 cm,肝Ⅵ段的供血和回流血管可保留。根据术前模拟的情况,对患者施行右肝Ⅶ、Ⅷ段精准肝切除,术中肝内解剖情况与术前模拟情况一致,完整保留肝右静脉和肝中静脉(图1E、1F、1G、1H)。术后实际切除肝脏体积为402.1ml,实际手术切缘为11.2cm。
2.4三维手术模拟系统在巨大肝肿瘤切除术中的应用
患者术前影像学检查提示右肝Ⅶ、Ⅷ、Ⅸ段巨大血管瘤(图2)。术前检查提示无肝硬变。肝功能Child-Pugh分级为A级,ICGR 15min<10%。利用三维手术模拟软件行三维重建(图2A),可清晰显示肿瘤与血管间的关系。对患者行虚拟的传统右半肝切除术(图2B)。模拟发现保留的部分Ⅴ、Ⅵ段由与肿瘤毗邻的右肝动脉、右门静脉前支供血,术中需注意保护此血管。此方案模拟切除肝脏体积为687.6 ml,剩余肝脏体积为895.5 ml,占全肝体积56.6%,提示术后发生严重肝功能不全的可能性大大降低。按此方案行保留Ⅴ、Ⅵ段的右肝Ⅶ、Ⅷ及Ⅸ段精准肝切除术(图2C),术中小心分离和保留了右门静脉主干。经计算,模拟肝脏切除体积为1223.8ml,剩余肝脏体积为430.3 ml,仅为全肝体积的26.0%,提示术后发生严重肝功能不全的可能性较大。在保证切除肿瘤的前提下,为保留更多肝实质,本研究模拟了保留肝Ⅴ、Ⅵ段的右肝Ⅶ、Ⅷ及Ⅸ段切除术(图2D)。实际切肝体积为711ml,与模拟切肝体积相近。患者术后无出血、胆漏等并发症,无严重肝功能不全,术后1周痊愈出院。
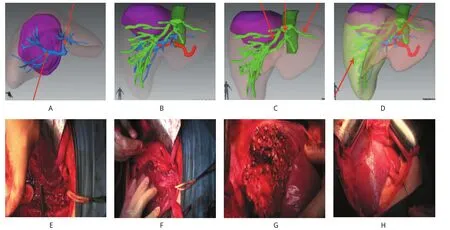
图1 三维手术模拟系统(Myrian XP-Liver)在肝脏Ⅶ、Ⅷ段肿瘤精准肝切除中的应用图解

图2 三维手术模拟系统(Myrian XP-Liver)在肝脏Ⅶ、Ⅷ、Ⅸ段巨大血管瘤中的应用图解
3 讨论
3.1术前评估的临床意义
我国肝脏切除术的安全性和有效性已有显著提高,手术死亡率<1%,手术并发症发生率<12%[4]。让肝脏切除术更加安全,患者更快恢复并取得更好的预后,是肝脏切除术的目标。这就要求术前仔细的评估、术中精细的操作、围手术期精心的管理。对于复杂性巨大肝脏肿瘤手术切除,术前应对患者的一般情况和肝脏储备功能进行评估,并通过影像学检查充分判断肝脏肿瘤的可切除性和了解肿瘤与大血管的关系及剩余肝体积的大小。笔者的经验是,肝功能Child分级结合ICGR 15 min试验[5-8]来决定是否行手术治疗和手术方式,肝脏剩余体积不足是肝功能衰竭的直接原因,虽然无瘤肝组织一般都有代偿性地增大,但对于特大肿瘤及肝硬变较严重的患者,术前应仔细评估,术中最大限度地保留足够的功能性残留肝脏体积,从而达到减少术后并发症的发生,缩短住院时间,最快康复。
对于肝脏手术,传统的术前评估依靠二维的CT及经验有一定的局限性.根据循证医学的要求,本研究中使用的三维手术模拟软件可将二维的CT资料整合重建,形成可视的三维图像,并对病变区域的体积和长度进行计算,对外科医生术前准确了解患者情况,制定适宜的手术方案提供准确的数据和依据。根据Abdalla等[9]的研究,个体间肝脏体积差异较大,肝癌患者常合并肝功能障碍[10]。残肝体积越小,术后发生严重肝功能不全和感染的机会越高。因此,对于肝癌患者,尤其是合并肝硬变的患者,术前进行精确的评估有着重要的意义。本研究使用的三维手术模拟软件可对全肝体积、切除肝脏体积和剩余肝脏体积进行自动计算,模拟切肝体积与实际结果有统计学的相关性,模拟结果平均比实际体积大77.6 ml,由此可见,三维手术模拟软件为术前制定精准肝切除手术计划提供重要数据和依据,通过准确预计手术切缘可制定适宜的手术切除范围,最大限度地保留残余肝脏的功能,减少术后并发症,降低手术死亡率。
三维手术模拟软件信息采自西门子64排螺旋CT,扫描层面薄。重建后的图像可清晰显示肝内血管的分布。肝内血管肝动脉、肝静脉还是门静脉都可能存在变异[11-13],因此,术前准确了解肿瘤和血管的解剖关系具有重要意义。利用该软件的各种辅助功能,外科医生术前可准确了解肝内复杂的解剖,模拟术中可能出现的情况,以便及时调整手术方案。本研究中右肝Ⅶ、Ⅷ段巨大肿瘤患者,拟行标准右半肝切除术,但经过术前模拟,残肝体积只有全肝的26.0%,术后发生肝功能衰竭的可能性较大,因此调整手术方案,改行保留Ⅴ、Ⅵ段的右肝Ⅶ、Ⅷ段精准切除,保证残肝体积超过全肝的30%。术后患者未出现肝功能衰竭,1周痊愈出院。
3.2术中选择性阻断入肝血流的价值
选择性半肝入肝血流阻断[14-16]合并同侧肝静脉主干阻断仅阻断患侧肝脏血供及血液回流,甚至超选至肝叶的入肝血流,保证预留肝脏组织的血流通畅,可以允许更长时间的血流阻断,并能达到无血切肝,对肝功能损伤小,减少肿瘤细胞的扩散,可降低术后肝功能衰竭的发生率;同时门静脉血液通过健侧肝脏回流至体循环,可避免因胃肠道瘀血而造成肠内细菌移位及内毒素血症。同侧肝静脉主干阻断也可减少空气栓塞的发生率。本组病例半肝血流阻断时间平均为180 min(120~270 min),既有效地控制了出血的风险,又避免了健侧肝功能的损害。
3.3前入路肝切除的优点
对于肿瘤巨大、肿瘤侵犯周围组织和器官,常规方法不能游离及某些肝尾状叶或肝门部的肿瘤患者,结合前入路肝切除术是一种合理的选择。应用前入路肝切除术的优点有[17-19]:①肝切除过程中很少挤压肿瘤,减少了医源性肿瘤脱落转移或血行转移的机会;②在分离、切除肝肿瘤前先切断需要切除肝叶的出入血流和胆管,进一步避免了术中血行转移可能;③增加了肝癌切除率,使累及横膈、腹后壁、右肾上腺或与这些组织紧密粘连的肝肿瘤患者得到了肿瘤切除机会;④在肝切除过程中不需要反复翻转肝脏,减少肝实质的缺血,最大程度地保持残留肝脏的功能;⑤减少术中出血量,避免大量出血造成的全身及肝功能的损害。但是前入路肝切除术也存在一定的风险和缺点,特别是在分离肝实质的过程中损伤肝静脉造成大出血,往往出血凶猛。Liu等[17]认为,前入路肝切除术适合于有一定肝切除术经验的手术者,离断肝实质时需要非常仔细,有静脉出血时应及时采用细针缝合止血。Belghiti等[20]介绍的肝脏悬吊法前入路肝切除术对减少和处理肝静脉损伤出血有一定帮助,但在下腔静脉和肝脏之间放置吊带仍存在引起出血的风险。笔者的经验是应用前入路法必须熟悉解剖,断肝时最好使用肝脏悬吊法,这样能够避免盲目断离误伤肝静脉和下腔静脉等大血管,引起难以控制的出血。
3.4精准肝切除对预后的影响
传统切肝术中因创面出血常致显露欠佳,易导致大出血,或者肝断面处管系结构在术中因显露差,处理常欠满意,易导致术后出血、胆漏、膈下感染等并发症。超声吸引刀等新的肝脏切除技术能够明显减少手术损伤,显著降低肝脏切除主要并发症的发生率[21-23]。由于失血量和输血量少,术中避免了对肿瘤的挤压等原因,降低肿瘤患者术后的复发转移率,从而提高患者的3年及5年生存率[24]。从本组病例观察得知,肝叶切除术后,不仅引流液量少,而且引流液颜色也较淡,这也说明了肝脏断面渗血和漏胆较少。总之,术前进行正确的评估,术中方法应用得当,围手术期处理适宜,复杂巨大肝脏肿瘤精准切除安全、可行,患者创伤小,肿瘤切除彻底,恢复快,术后并发症少,是今后肝脏切除的主流方式。
[1]Bismuth H.Surgical anatomy and anatomical surrgery of the liver [J].Word J Surg,1982,6(1):3-9.
[2]吴孟超.肝脏解剖[A].见:吴孟超.肝脏外科学[M],第2版.上海:上海科学技术文献出版社,2000,14-15.
[3]陈汉,吴孟超,王义,等.累及第二肝门区巨大肝癌55例手术切除体会[J].中华普通外科杂志,2000,15(9):524-526.
[4]严律南,陈晓理,李志辉,等.肝癌肝切除术围手术期处理的临床研究 (附2143例报告)[J].中国普外基础与临床杂志,2005,12(2)t 162-166.
[5]杜正贵,李波,冯曦,等.脉搏染料光密度法吲哚氰绿排泄试验对评价肝癌切除术后肝功能不全的价值[J].中国普外基础与临床杂志,2009,16(2):133-136.
[6]劳向明,张亚奇,林小军,等.吲哚靛青绿潴留率判断切肝量及其与肝癌术后肝功能不全的关系[J].癌症,2005,24(3):337-340.
[7]Lau H,Man K,Fan ST,et al.Evaluation of preoperative hepatic function in patients with hepatocellular carcinoma us-dergoing hepatectomy[J].Br J Surg,1997,84(9):1255-1259.
[8]Hemming AW,Scudamore CH,Shackleton CR,et al.Indocyanine green clearance as a predictor of successful hepatic re-section in cirrhotic patients[J].Am J Surg,1992,163(5):515-518.
[9]Abdalla EK,Denys A,Chevalier P,et al.Total and segmen-tal Iiver volume variations:implications for Iiver surgery[J].Surgery, 2004,135(4):404-410.
[10]Schutte K,Bornschein J,Malfertheiner P.Hepatocellular carcinoma-epidemiological trends and risk factors[J].Dig Dis,2009, 27(2):80-92.
[11]Takayasu K,Okuda K.Anatomy of the Live//Takayasu K,Okuda K,eds.Imaging in Liver Disease[M].Oxford:Ox-ford University Press,1997:1-45.
[12]王宏光,张煊,董家鸿.腹腔镜肝切除技术的优化[J].中国普外基础与临床杂志,2010,17(6):538-542.
[13]Atri M,Bret PM,Fraser-Hill MA.Intrahepatic portal venous variation:prevalence with US[J].Radiology,1992,184(1):157-158.
[14]Makuuchi M,Mori T,Gunv6n P,et a1.Safety of hemihepatic vascular occlusion during resection of the liver[J].Surg Gynecol Obstet,1987,164(2):155-158.
[15]文天夫,严律南.肝切除术中肝脏血流阻断技术的研究进展[J].中国普外基础与临床杂志,2008,15(4):299-302.
[16]陆森,黄新立,李相成,等.吲哚氰绿清除试验在半肝切除术中应用的价值[J].中国普外基础与临床杂志,2010,17(6):543-546.
[17]Liu CL,Fan ST,Lo CM,et al.Anterior approach for major right hepatic resection for large hepatocellular carcinoma[J].Ann Surg,2000,232(I):25-31.
[18]Azoulay D,Matin-hargreaves G,Castaing D,et al.The an-terior approachl the right way for tight massive hepatectomy[J].J Am CollSurg,2001,192(3):412-417.
[19]耿小平.前入路肝切除术口[J].临床外科杂志,2009,17(9):586-588.
[20]Belghiti J,Guevara OA,Noun R,et al.Liver hanging ma-neuver:a Safe approach to right hepatectomy without liver mobilization[J].J Am Coll Surg,2001,193(I):109-111.
[21]温浩,张金辉,曹峻.螺旋水刀和超声刀在肝叶切除术中的应用[J].肝胆外科杂志,2005,13(6):410-411.
[22]陈钟,常仁安,唐伟东.新型超声刀在腹部开放手术中的应用体会[J].中国现代手术学杂志,2009,13(4):257-260.
[23]Une Y,Uchino J,Shimamura T,et al.Water jet scalpel for liver resection in hepatoceiiular carcinoma whh or without cirrhosis[J].Int Surg,1996,81(1):45-48.
[24]Nakayama H,Masuda H,Shibata M,et al.Incidence of bile Leakage after three types of hepatic parenchymal transaction[J]. Hepatogastroenterology,2003,50(53):1517-1520.
(张西倩编辑)
Application of 3D surgery simulation system in precise hepatectomy for patients with complicated liver tumor
Xin-jun Zhang1,Yi-wo Mo1,Yan-kun Wang1,Xiao-yun Wang1,Lei Chen1,Zi-yu Wang1,Lei Hu1,Chao Yang1,Yi-he Dai1,Bo Gao2
(1.Department of Hepatobiliary Surgery,the First People's Hospital of Yunnan,Kunming,Yunnan 650032,China;2.Kunming Medical University,Kunming,Yunnan 650500,China)
Objective To investigate the clinical value of three-dimensional surgery simulation system in precise hepatectomy for patients with complex liver tumor.Methods 85 patients underwent complex liver tumor resection in our hospital from May 2009 to June 2014 were retrospectively analyzed.All patients received preoperative liver CTA and then three-dimensional simulation for resected liver volume,the remnant one and surgical margin.By comparing with the actual operation data,the optimized virtual procedure for liver resection was investigated.Results The three-dimensional surgery simulation system can accurately reconstruct and display the demarcation of the tumor and its relationship with adjacent vessels.Virtual resected liver volume was statistically correlated with the actual one(P<0.01)and the average resected volume has no difference(P=0.068).Besides,the simulated surgical margin related to the actual margin(P<0.01)with equal means(P=0.256).Conclusions The three-dimensional surgery simulation system can precisely evaluate and simulate the procedure of liver surgery preoperatively,providing operation data and guidance for precise complicated tumor resection.
three-dimensional surgery simulation system;precise hepatectomy;virtual liver resection
R 735.7
A
10.3969/j.issn.1005-8982.2016.04.010
1005-8982(2016)04-0048-06
2015-11-03
高波,E-mail:gbzhxw@sohu.com

