干旱胁迫对枇杷生理特性及生长的影响
王 丹,龚荣高,荣 毅
(四川农业大学 园艺学院,成都 611130)
干旱胁迫对枇杷生理特性及生长的影响
王丹,龚荣高*,荣毅
(四川农业大学 园艺学院,成都 611130)
以3年生‘大五星’枇杷嫁接苗为试验材料,通过盆栽控水试验设置4个水分处理梯度:对照(CK)、轻度胁迫(LS)、中度胁迫(MS)和重度胁迫(SS),研究不同程度土壤干旱对枇杷幼树的生长和生理特性的影响。结果显示:(1)枇杷的株高、地上和地下生物量随干旱胁迫的增强呈下降趋势。(2)在轻度和中度胁迫下叶片叶绿素含量增加,随着土壤水分的减少,叶绿素含量和叶片相对含水量(LRWC)均显著下降。(3)叶片净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)随着干旱胁迫的加剧均显著下降,其中Gs下降幅度最大,而胞间CO2浓度(Ci)则表现为先下降后上升,重度胁迫时叶片的水分利用率(WUE)最低。(4)干旱的加重使叶片超氧化物歧化酶(SOD)和过氧化物酶(POD)的活性呈现先增加后降低的趋势,过氧化氢酶(CAT)活性在轻度胁迫下最为活跃但在重度胁迫时显著降低,丙二醛(MDA)含量在中度胁迫第10天开始显著升高。(5)随干旱胁迫的加剧游离脯氨酸(Pro)含量增加且在重度胁迫第10天达到最大值,而可溶性蛋白(SP)含量在胁迫后期与对照无显著差异,可溶性糖(SS)含量在重度胁迫后期达到峰值且与对照差异显著。研究表明,在轻度和中度干旱胁迫下,枇杷叶片光合作用受到抑制,但能够积极调控抗氧化酶的活性和渗透调节物质的含量等来增强耐受性,而重度胁迫下,叶片膜系统和光合系统受到损伤,枇杷生长受到严重抑制。
枇杷;干旱胁迫;生长;光合特性;抗氧化酶活性;渗透调节
枇杷(EriobotryajaponicaLindl.)是亚热带果树中比较重要的一种,稍耐阴,喜温暖气候和肥水湿润的土壤,在中国有着丰富的枇杷种植资源和优良品种[1]。枇杷对干旱有一定的耐受性,但在生长过程中易发生花期、幼果期和果实成熟期旱害,而且枇杷一般种植在山坡地带,保水能力弱,灌溉条件差,导致枇杷的坐果率和产量严重降低,因此季节性干旱是制约枇杷单产提高的主要因素[2-3]。
干旱是影响植物生长、发育最重要的非生物胁迫之一,随着全球气温持续的增高和水资源分配的不均,使得水分缺乏与干旱危害日趋加剧,极大程度地影响作物的产量[4]。植物抵御干旱的机制复杂多样,干旱胁迫下,植株形态结构发生改变,生长受到抑制,光合速率下降,气孔导度降低[5-6];植物体内抗氧化酶活性增加,各种抗氧化酶协调作用以保护植物细胞免受氧化胁迫伤害,从而提高植物的抗旱性;植物体还可以通过积累脯氨酸和可溶性糖等有机渗透调节物质来维持细胞膨压,抵御或减少干旱胁迫造成的伤害[7-8]。现阶段枇杷的研究主要集中在冷害[9]和果实贮藏保鲜[10]等方面,而关于枇杷根系、叶片响应干旱的生理研究[11-13]结果表明,随着胁迫程度的加强,枇杷生长受到抑制,叶片的光合及蒸腾作用减弱,叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)活性增强;也有研究表明,轻度的干旱有助于诱导枇杷早期开花,使果实成熟期提前,对枇杷的生长有促进作用[14-15],但这些研究均未全面阐述不同程度土壤干旱胁迫对枇杷的影响以及枇杷对干旱的耐受极限。而干旱胁迫往往逐渐发生,植物应对干旱的反应也随胁迫时间的延长而不断发生变化,开展不同程度土壤干旱胁迫下枇杷对干旱环境的响应机制的研究显得尤为重要。
因此,本研究以‘大五星’枇杷为材料,通过测定不同土壤干旱程度下植株的生长指标,叶片的气体交换参数、叶片相对含水量、叶绿素、丙二醛、可溶性糖等渗透调节物质的含量以及抗氧化酶活性的动态变化规律,探究枇杷响应干旱胁迫的生理调节机制,为指导制定高效合理的枇杷栽培措施提供理论依据。
1 材料和方法
1.1试验材料
试验材料为四川龙泉驿区长势良好的3年生‘大五星’枇杷嫁接苗,定植于口径40 cm、高30 cm的花盆中,每盆种植1株。所用土壤为菜园土和沙壤土适量混合,并加入10%腐熟的有机肥和0.1%的复合肥,后期处理过程中不再施肥。待驯化后选取高度、长势一致的材料进行干旱胁迫控制性试验。
1.2试验设计
试验于2014年6~9月在四川农业大学农场进行。当试验开始时将材料移至大棚,每盆充分灌溉,使土壤含水量一致,停止灌溉后采用自然耗水进行干旱胁迫处理。以土壤含水量(占田间持水量的百分数)设置正常供水(对照,CK;田间持水量的61%~65%)、轻度干旱胁迫(Light Stress,LS;田间持水量的50%~54%)、中度干旱胁迫(Moderate Stress,MS;田间持水量的39%~43%)和重度干旱胁迫(Severe Stress,SS;田间持水量的28%~32%)4个水分处理。每个处理20盆,共80盆。8月初,所有试验盆达到预定含水量后,用称重法和土壤水分测定仪HH2(ML2x, GBR, England)控水,使各处理土壤含水量保持在设定的水平,并在各处理的第0天、5天、10天、15天、20天测定枇杷的生长指标、叶片气体交换参数,并采集新梢中部约第2~4片成熟叶,用冰袋保存带回实验室,擦拭叶片表面污渍,除去叶脉后,进行生理指标测定。
1.3测定指标及方法
1.3.1生长指标枇杷株高用直尺测量。测定植株干重时:将整株取出并冲洗干净,先在105 ℃下杀青30 min,后在80 ℃下烘干至恒重,分别称取地上和地下部分重量,3次重复。
1.3.2气体交换参数选取各处理枇杷的成熟功能叶,采用Li-6400便携式光合测定系统(Lo-Cor Inc,USA)测定其净光合速率(Pn)及影响因子,包括气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)并计算水分利用率(WUE=Pn/Tr),测定时间为上午9:00~11:00,光合有效辐射强度为1 500 mol·m-2·s-1,3次重复。
1.3.3生理指标叶片相对含水量(LRWC)采用烘干法测定;叶片叶绿素含量用丙酮-乙醇混合法[16]测定;超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光还原法[17];过氧化物酶(POD)活性测定采用愈创木酚法;过氧化氢酶(CAT)活性采用紫外吸收法。游离脯氨酸(Pro)含量测定用磺基水杨酸法;丙二醛(MDA)含量测定用硫代巴比妥酸(TAB)法;可溶性糖含量测定采用蒽酮比色法;可溶性蛋白含量测定采用考马斯亮蓝法[18]。以上指标均设3次重复。
1.4数据分析
用Microsoft Excel 2010进行数据统计和作图,SPSS 19.0进行方差分析及显著性检验(Duncan法)。
2 结果与分析
2.1干旱胁迫对枇杷生长的影响
由表1可知,枇杷株高在轻度胁迫和对照条件下随处理时间的延长缓慢增加,在胁迫末期比第0天增加了5.0%和9.7%,但二者之间差异不显著,而中度和重度胁迫下枇杷株高减少6.6%和7.9%,与对照差异显著;在胁迫第20天,枇杷株高在中度和重度胁迫下分别比对照显著下降了20.1%和23.0%。地上生物量在轻度胁迫时呈现先上升后下降的趋势,在第5天达到最大值21.11 g,但与对照差异不显著;而中度和重度胁迫下,地上生物量均显著下降;胁迫第20天,轻度、中度和重度胁迫下的地上生物量分别比第0天下降了12.2%、29.9%和37.2%。地下生物量在轻度胁迫第5天达到最大值,从中度胁迫后期开始,地下生物量逐渐下降且与对照差异显著;重度胁迫第20天,地下生物量达到最小值,比对照减少41.1%。轻度和中度胁迫下的根冠比增加,只在第10天和15天与对照有显著性差异,其余胁迫时间下处理均与对照无显著差异。可见,轻度干旱并没有影响枇杷的生长。
注:同一胁迫时间下凡是有不同字母者表示处理间在0.05水平差异显著(Duncan’s法); CK、LS、MS、SS分别表示正常供水(对照)、轻度胁迫、中度胁迫和重度胁迫处理;下同
Note: The different normal letters within the same stress time indicate significant difference between the treatments at 0.05 level; CK, LS, MS and SS stand for the control, light stress, moderate stress and severe stress, respectively; The same as below
2.2干旱胁迫对枇杷叶片相对含水量和叶绿素含量的影响
LRWC可以反映土壤缺水时植物体内水分的亏缺程度,是衡量植物耐旱性的一个重要指标。从表2可知,随着土壤水分的减少,三个胁迫的LRWC均不同程度的下降且从第5天开始到胁迫末期均与对照有显著性差异;在第20天,轻度胁迫的LRWC比第0天下降了5.83%,而中度和重度胁迫分别下降了21.3%和37.2%,表明枇杷叶片在轻度干旱时水分散失缓慢,但在中度和重度干旱时保水能力减弱。而叶绿素含量直接反映植物的光合能力。轻度和中度胁迫下,叶绿素含量随胁迫时间的延长呈现幅度较小的“升-降-升”趋势,但与对照的叶绿素含量差异不显著;整个胁迫期间,叶绿素含量在轻度和中度胁迫下增加了1.9%和16.8%,而重度胁迫下却减少了25.0%,表明轻度胁迫对枇杷叶绿素含量影响不大;重度胁迫下的叶绿素含量较对照、轻度和中度胁迫分别显著下降了39.6%、40.4%和40.0%,说明此时叶绿素合成严重受阻且分解加快。
2.3干旱胁迫对枇杷叶片气体交换参数的影响
由表3可知,随着干旱胁迫程度的加剧和胁迫时间的延长,叶片Pn、Tr、Gs均呈下降趋势。Pn在不同干旱状态的下降程度有所不同,轻度、中度和重度胁迫下分别比胁迫初期降低了13.2%、48.4%、61.5%且不同胁迫时间下各胁迫处理均与对照差异显著,说明Pn在重度胁迫下受到影响最大。在整个胁迫期间,中度胁迫下的Tr下降幅度最大,为54.3%,而轻度和重度胁迫分别下降了34.7%和13.3%。轻度、中度和重度胁迫下的Gs下降的幅度分别达到了61.6%、69.8%、64.7%,各水分处理间差异显著;重度胁迫在胁迫第0天比对照下降了86.8%,第20天比对照下降了95.3%,说明枇杷叶片Gs比Pn和Tr对干旱胁迫更敏感。而随着胁迫时间的增加,Ci在不同的胁迫程度下呈现出不同的变化规律。Ci在轻度胁迫第15天转变为上升,随着气孔的进一步关闭,Pn、Tr、Gs继续降低,Ci在中度胁迫下呈递增趋势,上升幅度最大达到了25.0%,在重度胁迫第10天达到峰值421.34 μmol·mol-1,比对照显著增加49.1%;同一胁迫时间下Ci表现为重度胁迫>中度胁迫>轻度胁迫且均与对照差异显著。WUE在轻度和中度胁迫下随胁迫时间的延长而增加,第20天较第0天分别增加了33.0%和13.0%,而在重度胁迫时WUE呈下降趋势,在第20天达到最小值2.69,此时水分利用率最低。
2.4干旱胁迫对枇杷叶片保护酶活性和MDA含量的影响
SOD、POD和CAT是植物体内清除活性氧自由基的3种关键酶,而活性氧的清除能力是衡量植物抗逆性的关键指标。由图1可知,随着土壤水分的减少,三个胁迫处理的SOD活性变化趋势为:中度胁迫>轻度胁迫>重度胁迫,且三个胁迫均与对照差异显著。中度胁迫SOD活性在胁迫前期显著上升且在第10天达到最大值452.4 U·g-1,比对照高出43.3%,说明此时SOD活性发挥到最大。在整个胁迫期间,轻度胁迫SOD活性上升了6.6%,中度和重度胁迫分别下降了8.7%和10.9%。而干旱处理期间,三个胁迫处理的POD活性变化趋势相同,均为先升高后降低,在重度胁迫第5天到达峰值;在第20天,轻度、中度和重度胁迫的POD活性比初期上升了48.4%、31.9%、2.1%,但三者之间差异不显著。与此同时,随着胁迫时间的增加,轻度胁迫CAT活性呈先上升后下降趋势且在第20天比胁迫初期上升了63.5%,在第15天达到最大值,比对照、中度和重度胁迫高出116.0%、43.1%和573.1%,表明此时CAT活性最活跃,而中度和重度胁迫时又下降了5.7%和67.9%,说明CAT活性在重度胁迫下受到抑制。可见,干旱胁迫下枇杷叶片通过抗氧化酶的协同作用共同抵御自由基造成的损伤。
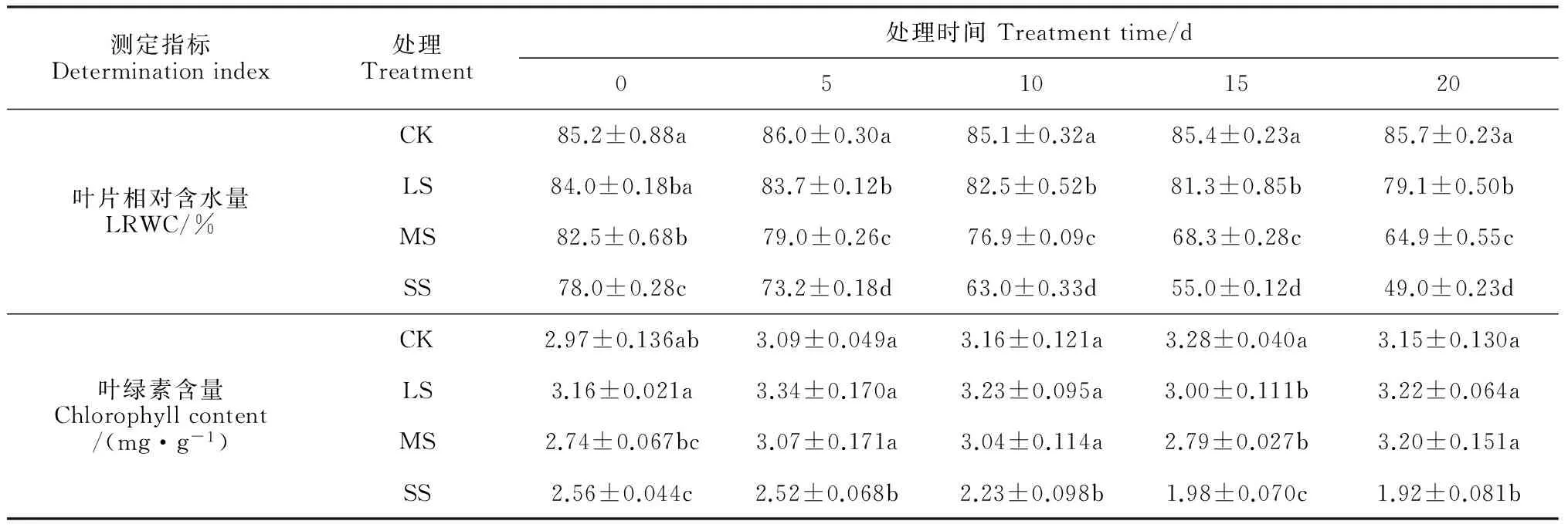
表2 干旱胁迫对枇杷叶片相对含水量和叶绿素含量的影响

表3 干旱胁迫对枇杷叶片气体交换参数的影响
而MDA是膜脂过氧化的主要产物之一,其含量可反映植物的逆境伤害程度。由图1可知,随着干旱程度的加重,MDA含量逐渐增加。随着胁迫时间的增加,轻度胁迫下MDA含量增加了4%,与对照无显著性差异;而中度和重度胁迫下MDA含量呈现先上升后下降的趋势且从第10天开始比对照高出了63.5%和97.7%,差异显著;在胁迫末期,中度和重度胁迫MDA含量分别上升了27.2%和20%,说明从中度胁迫中期开始枇杷叶片的细胞膜系统已经遭受损伤。
2.5不同土壤干旱对枇杷叶片渗透调节物质含量的影响
由图2可知,随干旱胁迫程度的加重,三个胁迫处理的Pro含量逐渐增加且与对照差异显著。在干旱胁迫期间,轻度胁迫Pro含量上升了46.6%,说明干旱诱导Pro的产生;而中度、重度胁迫下Pro则呈“上升-下降”趋势,在第20天Pro含量分别上升了25.5%和19.5%,且在重度胁迫第10天Pro含量达到最大值340.5 mg·g-1,比对照高出389.6%。随着干旱时间的增加,各胁迫处理的SP含量呈现“升高-降低-升高”趋势,且均在第5天达到峰值,此时轻度、中度和重度胁迫分别比第0天上升了17.2%、16.1%、29.0%,在整个胁迫期间SP含量均表现为重度>中度>轻度>对照但各水分处理之间差异不显著。轻度和中度胁迫下的SS含量变化趋势较平缓且含量相差不大,在胁迫末期比对照增加了50.0%和37.5%且差异显著,而重度胁迫下SS含量在第5天开始迅速上升并在第20天达到最大值2.1 mg·g-1,比对照高出151.2%,说明SS在重度胁迫时大量积累。
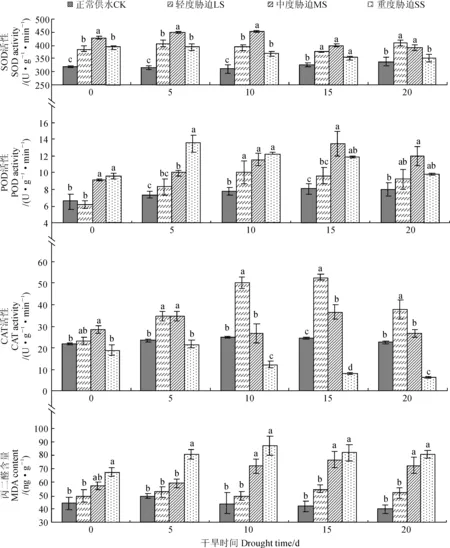
图1 干旱胁迫对枇杷叶片保护酶活性和MDA含量的影响Fig. 1 Effects of drought stress on protective enzyme activities and MDA content of loquat leaves
3 讨 论
干旱导致植物的形态和生理生化特性发生变化,从而影响植物的生长发育进程,而植物的抗旱性是一个复杂的综合性状,受到各种因素的影响[19-20]。本研究发现,中度和重度干旱胁迫抑制了枇杷的株高和地上生物量,避免植物因蒸腾造成水分的大量散失,有利于维持整株植物的水分平衡[21];重度干旱下,叶片碳同化作用停止,无法再满足植株其他部位对有机同化物的需求,但叶片本身含有大量的营养物质,地上部分生物量的减少可以提高资源的利用率,有助于植物存活时间的延长[22]。然而轻度胁迫下根系生物量却上升、根冠比增大,表明根系作为植物吸收水分和养分的重要功能器官对干旱有一定的抵抗能力,同时植物通过减少地上生物量抑制蒸腾,调整同化物在根冠间的分配以增大根冠比,因此干旱对地下生物量的影响较滞后[23]。
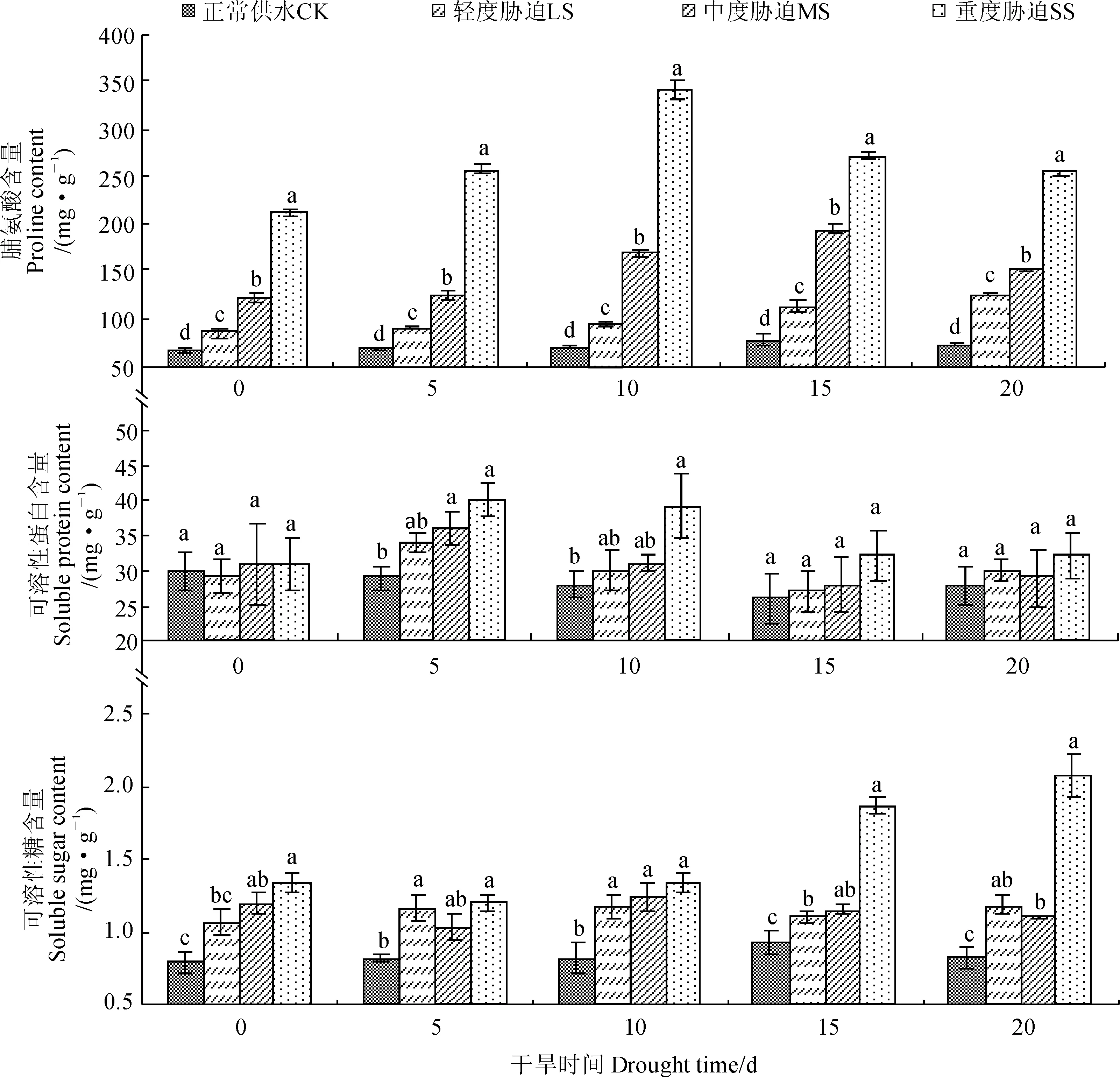
图2 干旱胁迫对枇杷叶片脯氨酸、可溶性蛋白和可溶性糖含量的影响Fig. 2 Effects of drought stress on proline, soluble protein and soluble sugar contents of loquat leaves
叶片相对含水量可以反映植物组织水分亏缺程度,叶绿素则是植物进行光合作用的主要色素,二者都是衡量植物耐旱能力的重要生理指标[24]。研究结果表明,叶绿素含量在干旱初期略微增加,可能是由于水分胁迫使叶片含水量降低、叶片扩展生长受阻,产生浓缩效应所致,也可能与植物对环境因子的补偿和超补偿效应有关[25]。在干旱时枇杷叶片叶绿素含量上升保证光合作用的正常进行从而适应干旱环境,说明枇杷具有较强抗旱性,而重度干旱下叶绿素减少是因为叶绿素合成受阻而分解加快[26]。
而光合作用是植物最重要的合成代谢过程之一,植物受到干旱胁迫首先是通过关闭气孔以减少蒸腾作用,进而阻碍CO2的进入,叶片可通过气孔和非气孔因素影响植物光合作用[27]。轻度胁迫时,Pn随着Ci和Gs的降低而降低,是因为叶片相对含水量下降会引起气孔关闭,导致气孔导度的降低,说明此时Pn的降低是由于气孔限制因素影响[28]。而中度和重度胁迫时,Gs迅速降低而Ci却呈上升趋势,说明此时非气孔限制是光合速率下降的主导因素,即叶肉细胞光合能力下降。水分利用率在中度干旱时虽然有所下降,但仍大于对照,表明枇杷具有较强的维持细胞膨压的能力和较高的耐旱性,而在重度胁迫后期水分利用率急速下降,说明叶片功能已被破坏[29-30]。
逆境胁迫促使植物体内超氧阴离子和过氧化氢(H2O2)等活性氧(ROS)增加,低浓度的ROS可诱导抗氧化酶基因的表达,从而构建植物防御体系。而高浓度的ROS可使细胞膜、蛋白质和DNA造成损伤,使细胞膜过氧化进而产生MDA[31]。SOD是抵御氧化损伤的第一道防线,可通过Haber-Weiss反应清除植物体内多余的超氧阴离子[32],而POD和CAT则进一步将H2O2分解为H2O和O2,清除活性氧物质并减轻膜脂过氧化造成的伤害,维持植物体内的活性氧离子代谢的动态平衡[33-34]。本研究中,SOD活性在中度胁迫时较早到达峰值,而SOD活性与植物抗氧化能力呈正相关[35],与此同时,CAT活性与SOD活性的变化趋势相似,且轻度胁迫下MDA含量较对照相差不大,因此结果表明,SOD和CAT能在逆境初期协同作用积极响应干旱从而增强枇杷的抗氧化能力。随着干旱胁迫加重,POD活性逐渐增加且在干旱胁迫后期依然保持较高水平,表明POD在干旱加剧时发挥主要作用,而同时MDA含量快速增加,在重度胁迫时叶片内大量累积活性氧,此时自由基的产生和清除失衡,植物的主动防御系统受到破坏,这与崔豫川[36]关于栓皮栎的研究结果一致。虽然3种酶对干旱的响应存在差异,但却相互配合来应对干旱带来的伤害。
干旱胁迫下,植物通过提高渗透调节物质的含量来降低渗透势从而维持体内水分平衡和细胞间膨压基本不变,以此增强植物的抗旱能力[37]。Pro、SS和SP是植物体内最重要的渗透调节物质。Pro具有偶极性,其疏水端与蛋白质连接,亲水端与水分子结合,从而使蛋白质通过Pro束缚更多的水;另一方面,胁迫加快有机物的形成、转化和运输,使得营养器官内积累较多的SS,它能在细胞表面形成独特的保护膜,有效地保护蛋白质、核酸等生物大分子的结构,从而维持生命过程,SP具有与其相似的功能[38]。研究表明,随着胁迫程度的加重,Pro含量的增加幅度大于SP,说明Pro比SP发挥着更大的调节作用。而在重度胁迫的后期,SS含量显著上升,与其他渗透调节物质相比表现出一定的滞后性,表明糖的渗透调节能力高于其他渗透调节物质,SS在重度干旱时积累可能是因为它能够作为能量或碳氮来源迅速被利用,加快植物的恢复进程[39]。
综上所述,枇杷叶片在轻、中度干旱胁迫下通过减少地上生物量,抑制蒸腾作用,提高抗氧化酶的活性和增加渗透调节物质的含量等措施保护自身免遭干旱胁迫的伤害,表现出了一定的耐旱性和适应性。但重度胁迫下枇杷叶片光合作用受到严重抑制,细胞结构和功能受到损害难以恢复,超出了枇杷的耐性阈值。
[1]CARBONELL F B, BARRACHINA A C, ROIG A V,etal. Effects of irrigation water quality on loquat plant nutrition: Sensitivity of loquat plant to salinity[J].JournalofPlantNutrition, 1997,20(1): 119-130.
[2]罗华建,刘星辉. 水分胁迫条件下枇杷若干生理指标的变化[J].亚热带植物科学, 2004,33(1): 19-21
LUO H J, LIU X H. Changes of several physiological determinations in loquat leaves under water stress[J].SubtropicalPlantScience, 2004,33(1): 19-21.
[3]STELLFELDT A, HUESO J J, CUEVAS J. No need for further fruit thinning in water-deprived loquat trees at preharvest[J].ScientiaHorticulturae, 2013, 162: 144-149.
[4]ASHRAF M. Inducing drought tolerance in plants: recent advances[J].BiotechnologyAdvances, 2010.28(1): 169-183.
[5]YAO X Q, CHU J Z, WANG G Y. Effects of drought stress and selenium supply on growth and physiological characteristics of wheat seedlings[J].ActaPhysiol.Plant, 2009, 31: 1 031-1 036.
[6]GIBBS J. GREENWAY H. Analysis of inhibition of photosynthesis under water stress in the C4speciesAmaranthuscruentusandZeamays: electron transport, CO2fixation and carboxylation capacity[J].FunctionalPlantBiology, 2003,30 (1): 1-47.
[7]金雅琴,李冬林,陈小霞,等. 不同种源乌桕幼苗对干旱胁迫的生理响应[J].西北植物学报, 2012,32(7): 1 395- 1 402.
JIN Y Q, LI D L, CHEN X X,etal. Physiological response ofSapiumsebiferumseedlings from different provenances to drought stress[J].ActaBot.Boreal.-OccidentSin., 2012,32(7): 1 395-1 402.
[8]VANAJA M, MAHESWARI M, SATHISH P,etal. Genotypic variability in physiological, biomass and yield response to drought stress inpigeonpea[J].Physiol.Mol.Biol.Plants, 2015,21(4): 541-549.
[9]WANG P, ZHANG B, LI X,etal. Ethylene signal transduction elements involved in chilling injury in non-climacteric loquat fruit[J].JournalofExperimentalBotany, 2010,61(1): 179-190.
[10]SHAN L L, LI X, WANG P,etal. Characterization of cDNAs associated with ligniwcation and their expression profiles in loquat fruit with different lignin accumulation[J].Planta, 2008, 227: 1 243-1 254.
[11]罗华建, 刘星辉, 谢厚钗. 水分胁迫对枇杷叶片活性氧代谢的影响[J].福建农业大学学报, 1999,28(1): 33-37.
LUO H J, LIU X H, XIE H C. Effects of water stress on activated oxygen metabolism in loquat leaves[J].JournalofFujianAgriculturalUniversity, 1999,28(1): 33-37.
[12]杨再强, 谢以萍, 张旭东,等. 水分胁迫对枇杷果实发育阶段的光合特性和果实品质的影响[J]. 灌溉排水学报, 2007,26 (6): 89-92.
YANG Z Q, XIE Y P, ZHANG X D,etal. Effects of water stress on photosynthetic characteristics in fruit development stage and fruit qualities of loquat[J].JournalofIrrigationandDrainage, 2007,26 (6): 89-92.
[13]CUI S M, CHEN L G, NII N. Effects of water stress on sorbitol production and anatomical changes in the nuclei of leaf and root cells of young loquat trees[J].J.Japan.Soc.Hort.Sci., 2003,72(5): 359-365.
[14]FERNANDEZ M D, HUESO J J, CUEVAS J. Water stress integral for successful modification of flowering dates in ‘Algerie’ loquat[J].Irrig.Sci., 2010, 28: 127-134.
[15]JUAN J. CUEVAS H J, Loquat as a crop model for successful deficit irrigation[J].IrrigSci, 2008, 26: 269-276.
[16]明华, 胡春胜, 张玉,等. 浸提法测定玉米叶绿素含量的改进[J].玉米科学, 2007,15(4): 93- 95, 99.
MING H, HU C S, ZHANG Y,etal. Improved extraction methods of chlorophyll from maize[J].JournalofMaizeScience, 2007,15(4): 93-95, 99.
[17]张蜀秋. 植物生理学实验技术教程[M].北京:科学出版社, 2011.
[18]李合生. 现代植物生理学[M].北京:高等教育出版社, 2002.
[19]WANG W X, VINOCUR B, ALTMAN A. Plant responses to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance[J].Planta, 2003, 218: 1-14.
[20]SUN J, GU J, ZENG J. Changes in leaf morphology, antioxidant activity and photosynthesis capacity in two different drought-tolerant cultivars of chrysanthemum during and after water stress[J].ScientiaHorticulturae, 2013, 161: 249-258.
[21]MUNNE B, ALEGRE L. Die and let live: leaf senescence contributes to plant survival under drought stress[J].FunctionalPlantBiology, 2004, 31: 203-216.
[22]ONO K, NISHI Y, WATANABE A,etal. Possible mechanisms of adaptive leaf senescence[J].PlantBiology, 2001, 3: 234-243.
[23]LAWLOR D W, CORNIC G. Photosynthetic carbon assimilation and associated metabolism in relation to water deficits in higher plants[J].Plant,CellandEnvironment, 2002,25(2): 275-294.
[24]庄国庆, 陈万才,李锐,等. 干旱胁迫对厚朴幼苗生理生化影响的研究[J].种子, 2013,32(2): 12-15.
ZHUANG G Q, CHEN W C, LI R,etal. Effect of peg on the physiological and biochemical characteristics ofMagnoliaofficinalisseedlings[J].Seed, 2013,32(2): 12-15.
[25]冯慧芳, 薛立, 任向荣,等. 4种阔叶幼苗对PEG模拟干旱的生理响应[J].生态学报, 2011,31(2): 371-382.
FENG H F, XUE L, REN X R,etal. Physiological responses of four broadleaved seedlings to drought stress simulated by PEG[J].ActaEcologicaSinica, 2011,31(2): 371-382.
[26]ANJUM S A, XIE X, WANG L C,etal. Morphological, physiological and biochemical responses of plants to drought stress[J].AfricanJournalofAgriculturalResearch, 2011, 6: 2 026-2 032.
[27]TEZARA W,MITCHELL V J,DRISCOLL S D,etal. Water stress inhibits plant photosynthesis by decreasing coupling factor and ATP[J].Nature,1999,1 401: 914- 917.
[28]CORNIC G. Drought stress inhibits photosynthesis by decreasing stomatal aperture-not by affecting ATP synthesis[J].TrendsPlantScience, 2000, 5: 187-188.
[29]KANASHIRO C H, VZQUEZ C C, LACLETTE E I,etal. Analysis of gene expression and physiological responses in three Mexican maize landraces under drought stress and recovery irrigation[J].PLoSOne, 2009,4(10): 1-19.
[30]SAPETA H, COSTA J M, LOURENCQ T,etal. Drought stress response inJatrophacurcas: growth and physiology[J].EnvironmentalandExperimentalBotany, 2013, 85: 76-84.
[31]WEIR T L, PARKS W, VIVANCO J M. Biochemical and physiological mechanisms mediated by allelochemicals[J].CurrentOpinioninPlantBiology, 2004,7(4): 472-479.
[32]胡义,胡庭兴,陈洪,等. 干旱胁迫及复水对香樟幼树生理特性及生长的影响[J].西北植物学报, 2015,35(2): 294-301.
HU Y, HU T X, CHEN H,etal. Physiological properties and growth ofCinnamomumCamphorasaplings under drought stress on growth and rewatering[J].ActaBot.Boreal.-OccidentSin, 2015,35(2): 294-301.
[33]SUN J, GU J, ZENG J,etal. Changes in leaf morphology, antioxidant activity and photosynthesis capacity in two different drought-tolerant cultivars of chrysanthemum during and after water stress[J].ScientiaHorticulturae, 2013, 161: 249-258.
[34]GIRON I F, CORELL M, GALINDO A,etal. Changes in the physiological response between leaves and fruits during a moderate water stress in table olive trees[J].AgriculturalWaterManagement.2015, 148: 280-286.
[35]WOO E J, DUNWELL J M, GOODENOUGH P W,etal. Germin is a manganese containing homohexamer with oxalate oxidase and superoxide dismutase activities[J].NatureStructuralBiology, 2000,7(11): 1 036-1 040.
[36]崔豫川,张文辉, 李志萍. 干旱和复水对栓皮栎幼苗生长和生理特性的影响[J].林业科学, 2014,7(50):66-73.
CUI Y C, ZHANG W H, LI Z P. Effects of drought stress and re-watering on growth and physiological characteristics ofQuercusvariabilisseedlings[J].ScientiaSilaveSinicae, 2014,7(50):66-73.
[37]SINGH R, PANDEY N, NASKAR J,etal, Physiological performance and differential expression profiling of genes associated with drought tolerance in contrasting varieties of two Gossypium species[J].Protoplasma, 2015, 252: 423-438.
[38]赵春桥, 陈敏, 侯新村,等. 干旱胁迫对柳枝稷生长与生理特性的影响[J].干旱区资源与环境, 2015,29(3): 126-130.
ZHAO C Q, CHEN M, HOU X C,etal. Effect of drought stress on the growth and physiological characteristics ofPanicumvirgatumL.[J].JournalofAridLandResourcesandEnvironment,29(3): 126-130.
[39]安玉艳, 梁宗锁, 郝文芳. 植物应对干旱胁迫的阶段性策略[J].生态学报, 2011,31(3): 716- 725.
AN Y Y, LIANG Z S, HAO W F. Growth and physiological responses of thePeriplocasepiumBungeseedlings to drought stress[J].ActaEcologicaSinica, 2011,31(3): 716-725.
(编辑:裴阿卫)
Physiological Characteristics and Growth of Loquat under Drought Stress
WANG Dan, GONG Ronggao*, RONG Yi
(College of Horticulture, Sichuan Agriculture University, Chengdu 611130 China)
In order to explore the effects on physiological characteristics and growth of loquat under drought stress, we conducted a pot experiment of 4 treatments which were CK, light stress (LS), moderate stress (MS) and severe stress (SS) by using 3-year-old ‘Dawuxing’ loquat. The results showed that: (1) Plant height, stem leaf biomass and root biomass were inhibited under drought stress. (2) The chlorophyll contents increased under light and moderate drought stress, the leaf relative water content (LRWC) and chlorophyll contents decreased significantly following the lack of the relative water content of soil. (3) Net photosynthetic rate (Pn), transpiration rate (Tr) and stomatal conductance (Gs) showed decreasing trends significantly andGswas the most sensitive one to drought stress. However, intercellular CO2concentration (Ci) increased and then declined with increasing drought stress. Water use efficiency (WUE) got the minimum under severe stress. (4) With water stress intensifying, superoxide dismutase (SOD) activity and peroxidase (POD) activity decreased after an initial increase. Catalase (CAT) played a pivotal role at light stress, while reduced at severe stress. Malondialdehyde (MDA) content enhanced significantly under moderate stress for 10 days. (5) Free proline (Pro) content increased when drought stress was fortified and was the highest after severe stress for 10 days. However, soluble protein (SP) content had no significant difference under the late of drought stress. The soluble sugar content peaked in the later of severe stress and had significant difference with the contrast. The results proved that loquat leaves enhanced their tolerance and adaptability by controlling the activities of antioxidant enzymes and osmotic adjustment and protective enzyme system under light or moderate stress, though the water deficit restrained its photosynthesis. The membrane system and photosynthetic system of loquat were damaged and enzyme activities affected so that the growth of loquat were badly inhibited with the increase of drought stress.
loquat; drought stress; growth; photosynthetic properties; antioxidant enzyme activity; osmotic regulation
1000-4025(2016)07-1399-09
10.7606/j.issn.1000-4025.2016.07.1399
2015-12-25;修改稿收到日期:2016-06-15
国家农业科技成果转化项目(2010GB2F000408)
王丹(1992-),女,在读硕士研究生,主要从事逆境生理生态研究。E-mail:wander154536252@163.com
龚荣高,副教授,主要从事逆境生理生态研究。E-mail:gongronggao@tom.com
Q945.79;S667.3
A

