一株产1-脱氧野尻霉素(DNJ)枯草芽孢杆菌黑色变种的诱变育种研究
白 豆,龙 玲,朱乃硕,3
(1. 复旦大学 生命科学学院 微生物学与微生物工程系,上海 200438;2. 复旦大学 遗传工程国家重点实验室,上海 200438;3. 复旦大学 生物医学研究院,上海 200438)
一株产1-脱氧野尻霉素(DNJ)枯草芽孢杆菌黑色变种的诱变育种研究
白豆1,2,龙玲1,2,朱乃硕1,2,3
(1. 复旦大学 生命科学学院 微生物学与微生物工程系,上海 200438;2. 复旦大学 遗传工程国家重点实验室,上海 200438;3. 复旦大学 生物医学研究院,上海 200438)
1-脱氧野尻霉素(1-Deoxynojirimycin, DNJ)是一种哌啶生物碱,是α-葡萄糖苷酶的强抑制剂,具有降低餐后血糖、抗肿瘤转移和抗病毒等作用.目前工业生产的DNJ主要是从桑叶中提取的,价格昂贵.为了获得DNJ的稳定高产菌株,本文通过对产DNJ枯草芽孢杆菌黑色变种(Bacillussubtilisvar.niger)分别采用紫外线诱变、亚硝基胍诱变和60Coγ射线诱变方法,得到发酵培养液DNJ表达量达20.7mg/L的菌株,其表达量较初始菌株产量提高了27.7%,并对细菌的DNJ合成代谢相关基因进行了克隆和测序,菌株命名为B-231.
1-脱氧野尻霉素; 枯草芽孢杆菌黑色变种; 诱变育种
1-脱氧野尻霉素(1-Deoxynojirimycin, DNJ)是一种哌啶生物碱,化学名称为3,4,5-三羟基-2-羟甲基四氢吡啶.是一种存在于植物、微生物及蚕体中[1-3]的天然糖类似物,自然界以桑树中含量最高,也可通过化学合成或半合成方法得到[4],为强效的糖代谢酶抑制剂(比如α-葡萄糖苷酶、己糖激酶、葡萄糖醛酸酶和糖原磷酸酶等),可显著延缓多糖的降解过程,降低餐后血糖的峰值,稳定空腹血糖[5].并且,还有减肥及增加胰岛敏感性、抗病毒、抗肿瘤转移[6-8]等作用,在医药和保健品有广泛的应用.此外,DNJ也可用于食品领域,以桑叶为原料的食品,作为功能性降糖的产品在日本等东亚国家已经允许在市场上销售[9],显示出DNJ在保健食品领域的广阔前景.
目前,医药上所用的DNJ基本上都是从桑叶提取的,一方面天然产物中DNJ含量较低,另一方面,DNJ的分离纯化较为复杂,再加上提取过程中的损失,产量很低.而人工DNJ合成难度较大,成本高,不适于大规模的生产.故目前DNJ商品价格十分昂贵,含量20%的粗提物售价即可高达2000元/kg.而微生物生产DNJ方面,仅限于产DNJ菌株的筛选与鉴定,没有开展大规模微生物发酵制备DNJ方面的报道.鉴于微生物发酵生产DNJ具有投资小、见效快、方法简单等优点,故可通过微生物大规模发酵实现DNJ的大规模生产.
枯草芽孢杆菌黑色变种(Bacillussubtilisvar.niger)菌株是本实验保存的一株生产DNJ的菌株,经检测发酵液中的DNJ浓度为16.2mg/L.该菌株是野生型菌株,发酵产物含量较低,还不能满足工业化生产的要求,本文分别采用紫外线诱变、以亚硝基胍(NTG)为诱变剂的化学诱变和60Coγ射线诱变技术对枯草芽孢杆菌黑色变种进行诱变处理,以期获得DNJ稳定高产的菌株.
1 材料与方法
1.1菌种、试剂与仪器
枯草芽孢杆菌黑色变种Bacillussubtilisvar.niger(FSCC115051),本实验室保存;1-脱氧野尻霉素(DNJ),上海世峰生物科技有限公司;芴甲氧羰酰氯(FMOC-Cl),J&K Chemical;乙腈(色谱纯),Sigma公司;α-葡萄糖苷酶溶液,0.8%的大鼠小肠丙酮粉溶解于0.1mol/L的PBS(pH 6.8)中,离心,取上清备用;对硝基苯酚-a-D-吡喃葡萄糖苷(pNPG),1.25mmol/L;其余试剂为分析纯,水为实验室自制超纯水.高效液相色谱仪Ultimate3000,美国戴安公司,色谱柱为Phenomenex luna C18柱(250mm×4.6mm,5μm),检测器为DIONEX RF-3000紫外检测器;荧光多功能酶标仪Spectrum M5,Molecular Device公司等.
1.2方法
1.2.1发酵液中DNJ的含量的检测
用α-葡萄糖苷酶活性抑制实验间接半定量检测细菌发酵液中DNJ的含量,并且可以对诱变后的细菌进行大批量的初步筛选.将DNJ标准品稀释为0.002,0.004,0.008,0.016,0.032,0.064,0.128mg/mL的7个标准浓度,参考Kyung等[10]的方法,在96孔板中依次加入缓冲液PBS、底物对硝基苯-α-D-吡喃葡萄糖苷pNPG、待检测细菌培养液上清/DNJ、α-葡萄糖苷酶溶液,总体积200μL,置于隔水式恒温培养箱中,37℃反应1h,最后加入终止液Na2CO3,终止反应.后把96孔板置于荧光多功能酶标仪中,在405nm处扫描其吸光度.根据公式如下公式,计算抑制率:

1.2.2RT-HPLC测定细菌发酵液中DNJ的含量
取DNJ标准液(浓度为0.0025,0.005,0.01,0.02,0.04,0.08,0.16,0.32mg/mL)和菌液各50μL于1.5mL的EP管中,加入0.4mol/L的K3BO3(pH 8.5)20μL,再加入5mmol/L的衍生化试剂FMOC-Cl(溶解于50%乙腈中)50μL,立即混匀.25℃恒温干式金属浴中反应25min,再加体积分数为1%的醋酸溶液800μL,反应液经过0.22μm的微孔滤膜过滤,滤液进行色谱分析,流动相为乙腈∶0.1%醋酸(体积比=11∶16),流速为1.0mL/min,进样量100μL.
1.2.3存活率与致死率计算
存活率与致死率的计算采用如下公式:
存活率=0.1mL诱变后菌液中的活菌数÷0.1mL对照菌液中的活菌数;
死亡率=(0.1mL对照菌液中的活菌数-0.1mL诱变后菌液中的活菌数)/0.1mL对照菌液中的活菌数.
1.3诱变
1.3.1紫外线诱变
取2次5mL发酵液于10mL离心管中,以3000r/min 4℃离心10min,弃去上清液.加入生理盐水9mL,振荡洗涤3次,离心10min,弃去上清液.加入生理盐水9mL,振荡均匀,调整悬液的浓度为108CFU/mL.将原液稀释,取10-3、10-4、10-5、10-64个浓度,每个浓度取5mL稀释液于直为9cm的平皿中,放入一无菌磁力搅拌子,然后置磁力搅拌器上、15W紫外线下30cm处,然后开启皿盖正式在搅拌下照射0.5,1,2,3,5min,操作均应在红灯下进行,或用黑纸包住,避免白炽光.取未经紫外线灯照射的菌液为对照,每个处理重复3次.
1.3.2亚硝基胍诱变
在用紫外线诱变处理枯草芽孢杆菌黑色变种的基础上,通过pNPG法初步筛选表现出较高α-糖苷酶抑制能力的菌株,然后采用亚硝基胍进一步对细菌进行诱变.取10mL发酵液于10mL离心管中,以6000r/min 4℃离心10min,弃去上清液.加入生理盐水9mL,振荡洗涤3次,离心10min,弃去上清液.加入0.1mol/L磷酸缓冲液9mL,振荡均匀,调整悬液的浓度为108/mL.吸取NTG母液1mL,然后用pH 6.0磷酸缓冲液配制母液,使母液浓度为1mg/mL,将菌悬液和NTG母液进行混合,使混合液中亚硝基胍的浓度分别问为0.05,0.1,0.2,0.3,0.4mg/mL.接着将混合液放在摇床上,在37℃,100r/min中处理30min,菌悬液4℃离心,用冷的无菌水洗涤3次以终止诱变.再加入相同体积的LB培养基,培养2h,度过生理延时期.
1.3.360Coγ射线辐射诱变
在用紫外线诱变处理枯草芽孢杆菌黑色变种的基础上,通过pNPG法初步筛选表现出较高α-糖苷酶抑制能力的菌株,然后采用60Coγ射线进一步对细菌进行诱变.取10mL发酵液于10mL离心管中,以6000r/min 4℃离心10min,弃去上清液.加入生理盐水9mL,振荡洗涤3次,离心10min,弃去上清液.加入无菌水9mL,振荡均匀,调整悬液的浓度为107/mL.将原液稀释,取10-3、10-4、10-5、10-64个浓度,每个浓度分别吸取1mL于1.5mL EP管中.采用60Co产生的γ射线进行诱变处理.辐射源为第二军医大学辐射中心的60Co源装置,在相同的辐射剂量率20Gy/min下,分别采用100,200,400,600,800,1000,1500,2000Gy 12个剂量.
1.4DNJ合成相关基因扩增与序列分析
Kang等[11]报道了BacillussubtilisMORI 3K-85中与1-脱氧野尻霉素合成有关的基因GabT1,Yktc1,GutB1分别编码转氨酶、磷酸酶和氧化还原酶.本实验以参考Myung等[12]的方法分别合成引物及进行基因扩增,引物序列见表1.以菌液为模板进行PCR扩增,扩增产物送上海生工测序,将测序结果在http:∥www.ncbi.nlm.nih.gov/BLAST/上进行Blast比对.

表1 DNJ合成相关基因GabT1,Yktc1,GutB1引物
2 结果与讨论
2.1pNPG法测定1-脱氧野尻霉素标准品
以DNJ浓度为横坐标,吸光度为纵坐标做a-糖苷酶方法检测的标准曲线.如图1所示,标准曲线方程为y=0.0945x+0.918其线性回归系数R2=0.9929,线性关系良好.
2.2RT-HPLC法测定细菌发酵液中DNJ含量
反向高效液相色谱-紫外检测法(RT-HPLC)分别测定DNJ标准品溶液(浓度40mg/mL)和枯草芽孢杆菌黑色变种出发菌株发酵液中DNJ的含量,在吸收图谱中,图2(a)为DNJ标准品溶液,在第7.94min和16.70min处出峰分别为FMOC-DNJ和FMOC-OH;图2(b)为细菌发酵液,在第8.01min和16.86min处出峰分别为FMOC-DNJ和FMOC-OH.检测诱变前细菌发酵液中的DNJ含量为16.2mg/L.
2.3紫外线的诱变效应
取标记好序号的未照射的制备菌液和照射菌液各0.1mL均匀涂布,37℃暗箱培养24h,计数活菌数.在未照射对照组,浓度为10-3的菌液的平板成片无法计数,而10-6的菌液的平板菌落太少,故选择10-5、10-4两个浓度梯度进行下一步实验.
2.3.1死亡率的计算
以10-4稀释和10-5稀释的菌液进行的紫外诱变结果如下表,随着紫外照射时间的延长致死率也在不断的提高,到5min时,死亡率已达到100%,为了得到较满意的诱变效果,我们选择致死率约80%,90%两个照射时间的菌株.
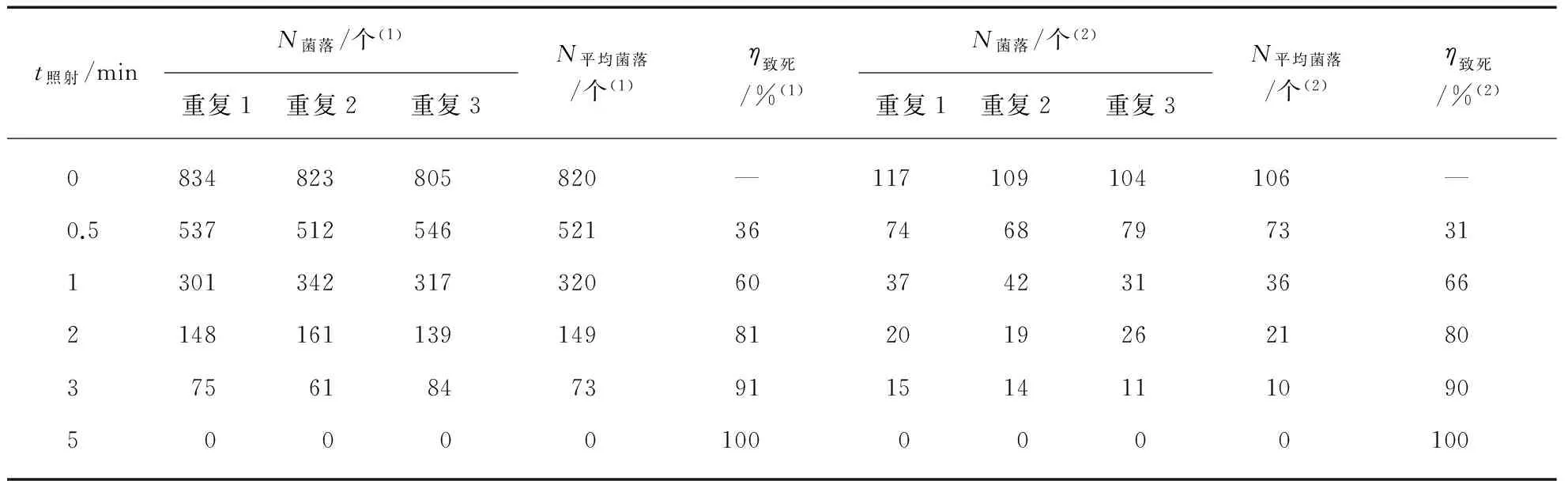
表2 不同时间紫外线照射处理后枯草芽孢杆菌黑色变种的死亡率
(1) 10-4稀释菌液,(2) 10-5稀释菌液.
2.3.2紫外线诱变后细菌生产DNJ能力鉴定
我们从菌悬液浓度分别为10-4、10-5的,诱变时间各为2min、3min的平板上各挑选24个单菌落分别置于有3mL LB液体12孔细胞培养板内培养60h.按照1.2的方法,对菌株生产DNJ的能力进行了鉴定,发现紫外线诱变的菌株中其中有3个菌株表现出较大的的α-葡萄糖苷酶抑制能力,其抑制率分别为33.9%、34.7%、34.9%,其他的诱变菌株抑制α糖苷酶效果不明显,还有出现一些负突变的菌株(数据未附上).对产DNJ菌株的具体的产能进行计算,细菌上清液中的DNJ含量分别为17.4mg/L、17.9mg/L、18.1mg/L,平均值为17.8mg/L.
2.4亚硝基胍诱变效应
2.4.1死亡率的计算
亚硝基胍处理后,不同剂量的亚硝基胍处理后菌株的存活率如表3(见第108页)所示,亚硝基胍的致死率相当高,从菌株死亡率来看,亚硝基胍诱变的死亡率非常高,浓度为0.05mL/mL时死亡率已达到75.4%,0.03mL/mL 时死亡率已到达98.8%.
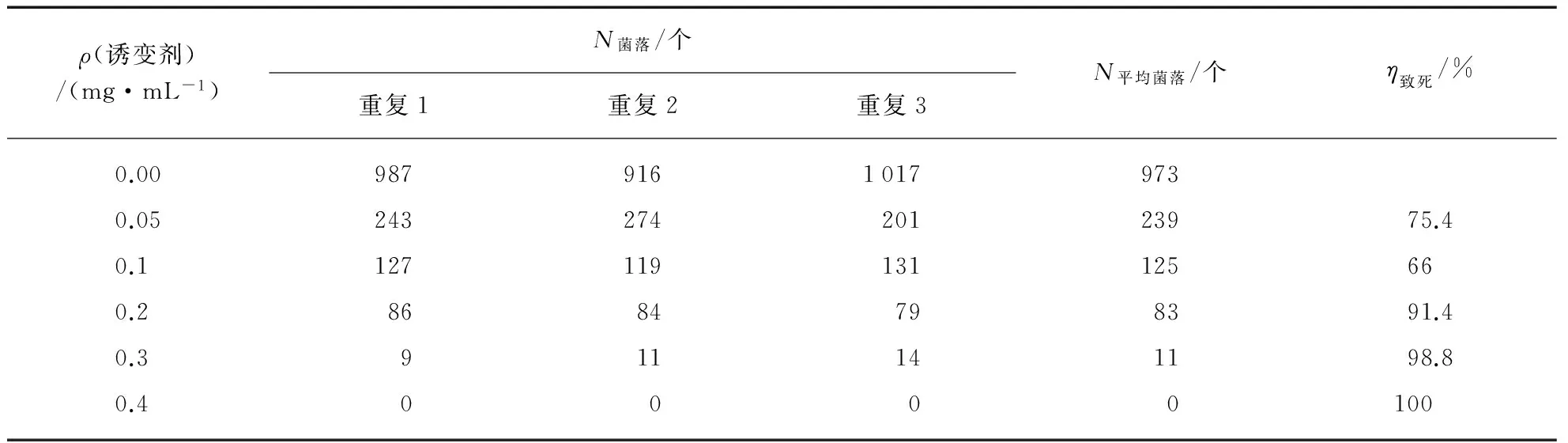
表3 不同剂量的亚硝基胍处理后枯草芽孢杆菌的死亡率
2.4.2亚硝基胍诱变后细菌生产DNJ能力鉴定
参照文献,我们从诱变剂量为0.2mg/mL,91.4%致死率平板上各挑选24个单菌落分别置于有3mL LB液体12孔细胞培养板内培养60h.按照1.2的方法,对菌株生产DNJ的能力进行了鉴定.亚硝基胍诱变的菌株中有其中2个菌株的α-葡萄糖苷酶抑制率分别为35.1%、35.4%.细菌上清液中的DNJ含量分别为18.3mg/L、18.5mg/L.其余突变菌株抑制α糖苷酶效果没有明显增加(数据未附上).
2.560Coγ射线辐射诱变
2.5.1死亡率的计算
60Coγ射线辐射诱变后,10-4稀释度菌株的致死率,如表4所示,从菌株死亡率来看,当诱变剂量为100Gy时,致死率为10.5%,随着诱变剂量的增大,死亡率也不断上升,到1000Gy时,死亡率已达88.3%.
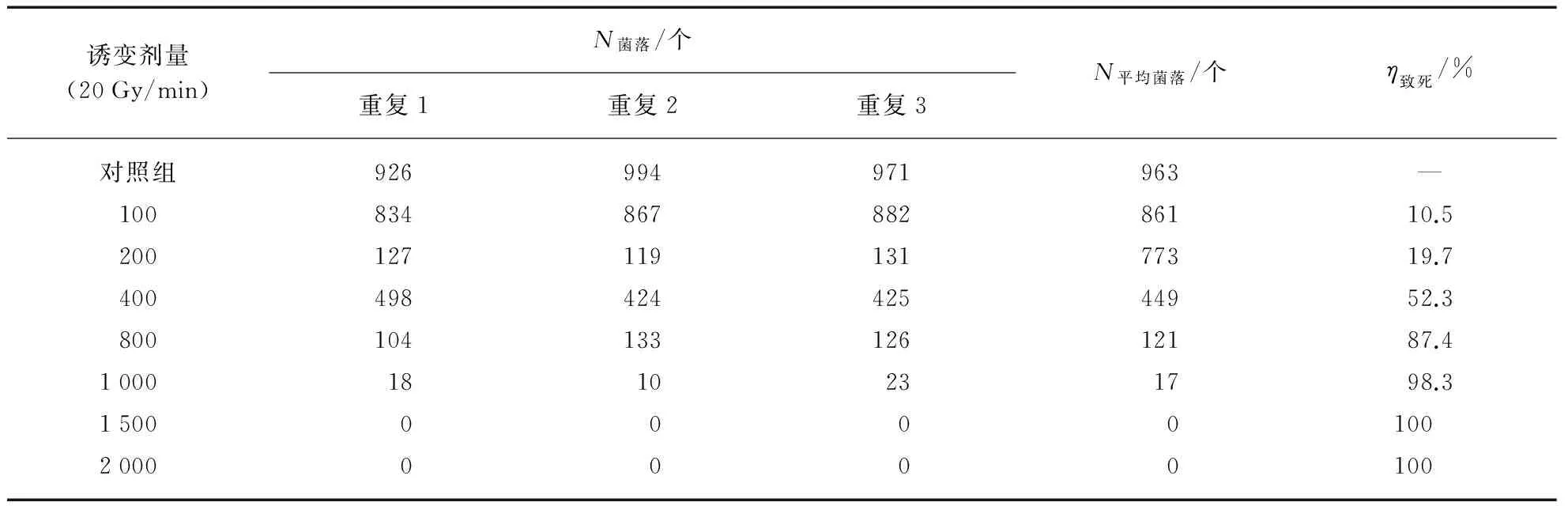
表4 不同剂量60Coγ射线辐射诱变后枯草芽孢杆菌黑色变种的死亡率
2.5.260Coγ射线辐射诱变后细菌产DNJ能力鉴定
我们从诱变剂量为20Gy/min,致死率为87.4%的平板上各挑选24个单菌落分别置于有3mL LB液体12孔细胞培养板内培养60h.按照1.2的方法,对60Coγ射线辐射诱变后菌株生产DNJ的能力进行了鉴定.其中有2个菌株的α-葡萄糖苷酶抑制率分别为39.4%、40.0%,其余菌株抑制α糖苷酶效果没有明显增加(数据未附上).细菌上清液中的DNJ含量分别为20.5mg/L、20.7mg/L.如图3所示,检测出的DNJ含量为20.7mg/mL,在第8.063min和第16.893min出的峰分别为FMOC-DNJ和FMOC-OH.
2.6DNJ合成相关基因扩增与结果序列分析
对细菌上清液中DNJ含量为20.7mg/L的菌株中DNJ合成相关基因GabT1(约1270bp)、Yktc1(约950bp)以及GutB1(约1020bp)进行了PCR扩增,其琼脂糖凝胶电泳结果如图4所示.
所测得基因序列在GenBank比对之后发现,枯草芽孢杆菌黑色变种B-231中基因GabT1、Yktc1和GutB1经过Blast比对之后,发现和细菌B.amyloliquefaciensFZB42(NC_009725.1)[10]的基因分别有83%,76%,76%的相似度,图5分别是对枯草芽孢杆菌黑色变种B-231的基因GabT1、Yktc1和GutB1进行推断得出的氨基酸序列和细菌B.amyloliquefaciensFZB42对应基因的氨基酸序列的比对结果.
3 结 论
3.1检测方法的问题
本实验确定了用对硝基苯酚-a-D-吡喃葡萄糖苷(pNPG)为底物、通过测定α-葡萄糖苷酶活力状况,从而间接检测溶液中DNJ含量的半定量方法,在DNJ含量为0.002mg/mL,即可检出.此方法方便操作,准确性高,价格相对低廉,适合实验室大规模诱变筛选时使用.pNPG法初步筛选到表现出较高的抑制α-葡萄糖苷酶活力的菌株,然后用RT-HPLC法进一步对细菌发酵液中的DNJ定量检测.反向高效液相色谱法灵敏度更高,能特异性检测DNJ.
3.2各种诱变技术的优缺点比较
在微生物发酵工业中,菌种通过诱变育种不仅可以提高有效产物的产量,改善生物学特性,而且对于研究有效产物的代谢途径、遗传图谱绘制等方面都有一定的作用.目前工业生产上所使用的菌种,几乎都是经过诱变育种获得的菌株.本室采用了紫外线诱变、亚硝基胍诱变和60Coγ射线诱变的方法.不同诱变剂处理枯草芽孢杆菌黑色变种菌株的结果表明,不同的诱变剂对该菌株有不同的致死效应并且有累积效应.为进一步的优化诱变条件提供了较为详尽的数据.其中60Coγ射线诱变的方法获得一株高产菌株细菌发酵液中DNJ的含量比出发菌株提高了27%,平均产量达到20.6mg/L.
3.3DNJ合成相关基因
1-脱氧野尻霉素是多基因合成的菌体次生代谢产物,在链霉菌属和芽孢杆菌属中均有发现,然而其代谢通路研究的并不十分透彻.本室筛选到的枯草芽孢杆菌黑色变种B-231表现出较强的抑制α-葡萄糖苷酶活力,在分析其DNJ合成相关基因的实验中,从而为该菌株产生DNJ提供了遗传数据基础.本室后续实验将对DNJ合成相关的3个基因进行研究,为进一步提高其产DNJ的能力提供了思路.
[1]ASANO N, TOMIOKA E, KIZU H,etal. Sugar with nitrogen in the ring isolated from the leaves ofMorusbombycis[J].CarbohydrateResearch, 1994,253(3): 235-245.
[2]HARDICK D J, HUTCHINSON D W. The biosynthesis of 1-deoxynojirimycin inBacillussubtilisvar.niger[J].Tetrahedron, 1993,49(30): 6707-6716.
[3]桂仲争,庄大桓,陈杰,等.全蚕粉降血糖的作用效果及其机理的研究[J].蚕业学,2001,27(2): 114-117
[4]田丽丽,李中军,李辉.1-脱氧氮杂-D-葡萄糖(Deoxynojirimycin,DNJ)的合成[J].应用化学,2004,21(1): 12-15.
[5]LI Y G, JI D F, ZHONG S,etal. Hybrid of 1-deoxynojirimycin and polysaccharide from mulberry leaves treat diabetes mellitus by activating PDX-1/insulin-1 signaling pathway and regulating the expression of glucokinase, phosphoenolpyruvate carboxykinase and glucose-6-phosphatase in alloxan—induced diabetic mice[J].JournalofAppliedEntomology, 2011,134(3): 27-31.
[6]KONG W H, OH S H, AHN Y R,etal. Antiobesity effects and improvement of insulin sensitivity by 1-deoxynojirimycin in animal models [J].JournalofAgriculturalandFoodChemistry, 2008,56(8): 2613-2619.
[7]STEINMANN E, WHITFIELD T, KALLIS S,etal. Antiviral effects of amantadine and iminosugar derivatives against hepatitis C virus[J].Hepatology, 2007,46(2): 330-338.
[8]TSURUOKA T, FUKUYASU H, ISHII M,etal. Inhibition of mouse tumor metastasis with nojirimycin-related compounds[J].JournalofAntibiotics, 1996,49(2): 155-161.
[9]KIMURA T, NAKAGAWA K, SAITO Y,etal. Simple and rapid determination of 1-deoxynojirimycin in mulberry leaves[J].Biofactors, 2004,27(1-4): 341-345.
[10]KYUNG K D, CHO Y S, SONG J H,etal. Identification of the genes involved in 1-deoxynojirimycin synthsis inBacillussubtilisMORI 3K-85[J].TheJournalofMicrobiology, 2011,49(3): 431-440.
[11]CHO Y S, PARK Y S, LEE J Y,etal. Hypoglycemic effect of culture broth ofBacillussubtilisS10 producing 1-deoxynojirimycin[J].JKoreanSocFoodSciNutr, 2008,37(11): 1401-1407.
[12]SEO M J, NAM Y D, LEE S Y, Isolation of the putative biosynthetic gene cluster of 1-deoxynojirimycin byBacillusamyloliquefaciens140N, its production and application to the fermentation of soybean paste[J].BiosciBiotechnolBiochem, 2013,77(2): 398-401.
Mutation Breeding of a Isolated Bacillus subtilis var.niger for Producing the 1-Deoxynojirimycin
BAI Dou1,2, LONG Ling1,2, ZHU Naishuo1,2,3
(1. Department of Microbiology and Microbial Engineering, School of Life Sciences, Fudan University,Shanghai200438,China; 2.StateKeyLaboratoryofGeneticEngineering,FudanUniversity,Shanghai200438,China; 3.InstituteofBiomedicalScience,FudanUniversity,Shanghai200438,China)
1-Deoxynojirimycin(DNJ) is a kind of alkaloid, known to improve diabetic conditions by inhibiting the activity ofα-glucosidase. It also plays a role in anti-tumor metastasis and antiviral activity. DNJ has been mainly isolated from the root and leaf of the mulberry tree(Morusalba) at present. However, it leads high cost. To obtain stable and high yield DNJ producing strain, in the current studyBacillussubtilisvar.nigerwhich can produce DNJ was treated with UV mutagenesis, nitrosoguanidine and60Coγ, a strain was isolated and named as B-231 finally. It produced 20.7mg/L DNJ in the fermentation broth, and the content of DNJ increased by 27.7% compared with the initial strain. More research was done on the new strain about its character in molecular biology. The genes associated with anabolism of DNJ were cloned and sequenced.
1-Deoxynojirimycin;Bacillussubtilisvar.niger; mutation breeding
0427-7104(2016)01-0104-08
2015-03-26
白豆(1985—),女,硕士研究生;龙玲(1990—),女,硕士研究生,此作者为共同第一作者;朱乃硕,男,教授,通讯联系人,E-mail: nzhu@fudan.edu.cn.
Q 93-3
A

