异槲皮苷-β-葡萄糖苷酶的分离纯化及其酶性质
徐 丹, 金 凤 燮, 鱼 红 闪
(大连工业大学 生物工程学院, 辽宁 大连 116034 )
异槲皮苷-β-葡萄糖苷酶的分离纯化及其酶性质
徐 丹,金 凤 燮,鱼 红 闪
(大连工业大学 生物工程学院, 辽宁 大连116034 )
采用分子筛及离子交换法对微生物Absidiasp.R42g所产异槲皮苷-β-葡萄糖苷酶进行分离纯化,并研究其酶学性质。结果表明,异槲皮苷-β-葡萄糖苷酶的分子质量为62 ku,最适温度为40 ℃,最适pH为5.0。在50 ℃以下,pH 4.0~6.0,相对酶活力较稳定,Na+、K+、Ca2+3种金属离子对相对酶活力无影响;而在Fe3+、Cu2+两种金属离子存在的情况下,相对酶活力为零;酶反应结果显示该酶的最大反应速度和米氏常数分别为6.711 mmol/(L·h) 和18.89 mmol/L。
异槲皮苷-β-葡萄糖苷酶;分离纯化;酶性质
0 引 言
异槲皮苷(Isoquercitrin)为黄酮类化合物,具有抗炎、抗氧化、降压等生物活性[1]。异槲皮苷的3-C位水解掉葡萄糖基,成为槲皮素(quercetin),该类化合物及其衍生物同属于类黄酮化合物,在果蔬及中草药中大量存在。槲皮素具有广泛的生物活性,不仅对癌症有化学预防作用,还具有抗癌和抗突变等多种生理功能。近期研究还发现它是强有力的肿瘤多药耐药的逆转剂。人体对槲皮素的不良反应表现不明显,所以具有良好的开发前景和药用价值[2]。本实验研究了利用酶水解法由异槲皮苷制备槲皮素所需的酶,并对其酶学性质进行了探讨。
1 材料与方法
1.1材料
液体培养基:12%的槐花浸出液中加入48%的麦芽汁,糖度为5°;菌种:Absidiasp.R42g,实验室保藏。
1.2方法
1.2.1酶蛋白的分离纯化
1.2.1.1粗酶液的分离
将菌种接种于经过高温灭菌的液体培养基中,在最佳发酵条件下发酵3~5 d。
将发酵液离心,取上清,加入硫酸铵至饱和度75%,4 ℃静止过夜。离心去除上清,收集沉淀。用pH 5.0醋酸-醋酸钠缓冲液溶解,并在该缓冲体系中透析2 d,离心收集上清即为所需粗酶液。
1.2.1.2层析分离
葡聚糖凝胶层析法对酶进行初步分离,用缓冲液作洗脱剂,洗脱液体积流量0.5 mL/min,每10 min收集一管。采用TLC法进行酶活检测,确定酶活较高的收集管,合并酶液进行离子交换层析。离子交换层析法对酶进行再次分离,将8 mL 收集的酶液上柱后,先用缓冲液洗脱,再分别以0.02 mol/L pH 5.0醋酸-醋酸钠缓冲液配制的60、120、150、180、210、240、300 mmol/L KCl溶液为流动相进行梯度洗脱,流动相体积流量为1 mL/min,分离提纯蛋白质。洗脱液在280 nm下测定OD,并通过蛋白质色谱仪绘出吸收图谱。
1.2.2酶活力的测定
薄层层析法测定酶活力,展开剂为体积比10∶7∶1∶1的乙酸乙酯-丁酮-甲醇-水混合液,标准品为用0.02 mol/L pH 5.0醋酸-醋酸钠缓冲液配制的2.0 mg/mL异槲皮苷溶液。取0.1 mL标准品底物溶液,加入等体积的酶液,在40 ℃下恒温反应14 h,加入反应液等体积的水饱和正丁醇终止酶反应,取上层液作TLC检测,计算酶活力。
1.2.3酶的纯度及分子质量测定
采用SDS-PAGE测定酶蛋白的分子质量,根据异槲皮苷-β-葡萄糖苷酶的相对迁移率计算分子质量。
1.2.4蛋白含量测定
用Folin-酚法测定溶液中蛋白质含量。
1.2.5酶学性质的测定
采用“1.2.2”中酶活力的测定方法测定提纯酶的最适pH、最适温度、pH稳定性、温度稳定性、金属离子对酶活力的影响[5-7]。
2 结果与讨论
2.1酶的分离纯化
各纯化步骤的结果如表1所示。由表1可知,粗酶液经过分离纯化后比活达到2.8 U/mg,提纯倍数达到12.17,收率为1.15%。分离纯化所得异槲皮苷葡萄糖苷酶经SDS-PAGE鉴定,提纯酶电泳结果为单带,结果如图1所示。
根据图1中的标准蛋白的相对迁移率与分子量的对数关系绘制标准曲线,得到回归方程:y=2.073-1.023x,R2=0.993。将异槲皮苷葡萄糖苷酶的相对迁移率带入方程,得出其分子质量约为62 ku。

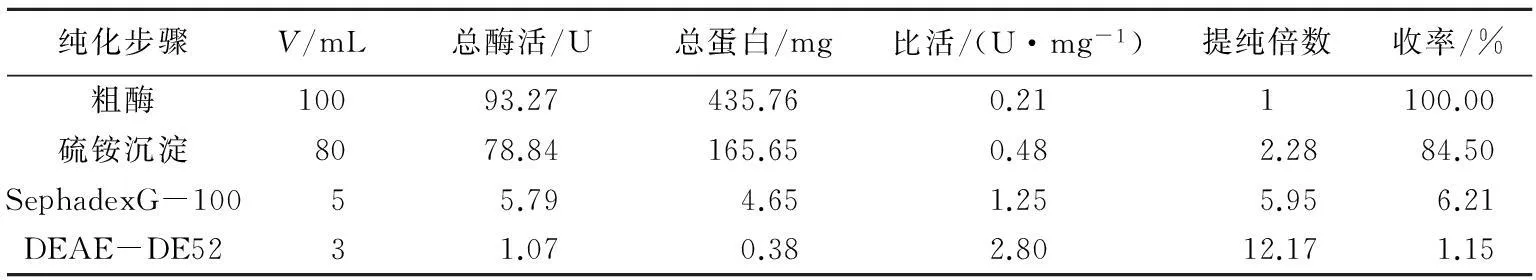
表1 异槲皮苷-β-葡萄糖苷酶分离纯化的结果

图1异槲皮苷-β-葡萄糖苷酶SDS-聚丙烯酰胺凝胶电泳图
Fig.1Isoquercitrin-β-glycosidase in SDS-PAGE
2.2酶学性质
2.2.1温度对相对酶活力的影响
将提纯后的酶在20~70 ℃下进行反应,检测最适反应温度,将酶在各温度条件下静置1 h,在最适温度下的进行酶反应检测其温度稳定性。根据TLC结果得出该温度下的相对酶活力,结果见图2。
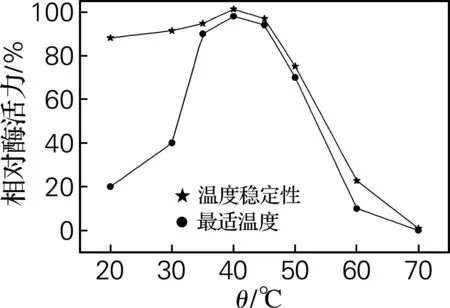
图2 温度对相对酶活力的影响
由图2可知,最适酶反应温度为40 ℃。温度在45 ℃以上时,随着温度的升高,相对酶活力呈下降趋势,在50 ℃以下时,相对酶活力变化较为缓慢,都大于60%。而当温度高于60 ℃时,相对酶活力急剧下降。
2.2.2pH对相对酶活力的影响
将提纯后的酶在pH 2.0~10.0的缓冲体系内进行反应,将酶在各缓冲体系中静置1 h后,在最适pH条件下检测其稳定性。并计算不同pH条件下的相对酶活力,结果见图3。
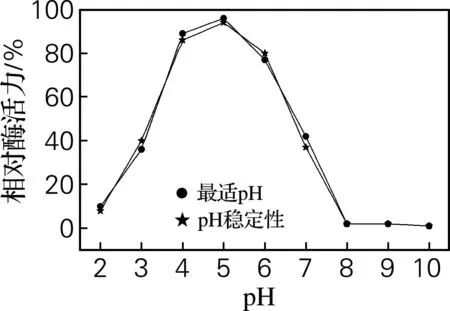
图3 pH对相对酶活力的影响
由图3可看出,该酶在pH 为5.0 时相对酶活力最大;pH在4.0~6.0,相对酶活力变化很小,其相对酶活力可以保持大于80%,超出该范围酶活性急剧下降,因此确定该酶在pH 4.0~6.0 较稳定。
2.2.3金属离子对相对酶活力的影响
由表2可知,Na+、K+、Mg2+、Ca2+的存在不影响酶活力大小,反应液中的Zn2+对异槲皮苷-β-葡萄糖苷酶的相对酶活力的抑制作用随着其浓度的增加而增大,而在Cu2+、Fe3+存在的情况下异槲皮苷-β-葡萄糖苷酶没有相对酶活力,因此Cu2+和 Fe3+可以完全抑制该酶的相对酶活力。
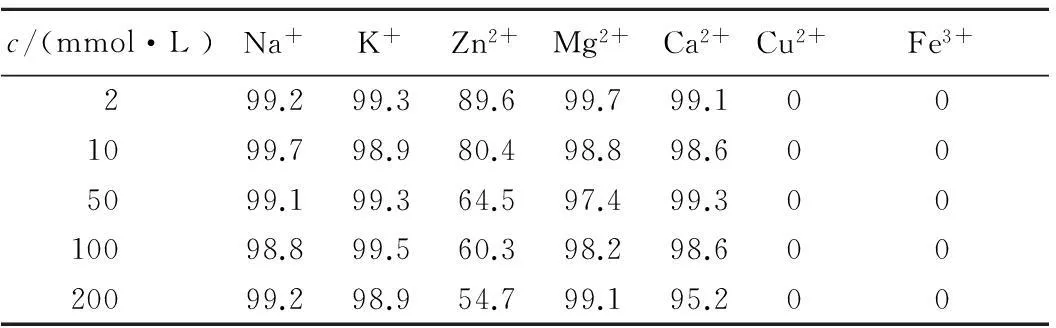
表2 金属离子对相对酶活力的影响
2.2.4酶反应动力学
配制底物质量浓度为1.0、2.0、3.0、4.0、5.0 mg/mL 的异槲皮苷溶液。在pH 5.0、40 ℃条件下进行酶促反应,反应时间3 h,结果见表3。
采用Lineweaver-Burk作图,由图得到米氏方程为1/[V]=2.814/[S]+0.149,R2=0.998 9,从而计算得到最大反应速度和米氏常数分别为6.711 mmol/(L·h) 及18.89 mmol/L。
表3底物浓度对酶反应速度的影响
Tab.3Theeffectsofsubstrateconcentrationonenzymereactionspeed
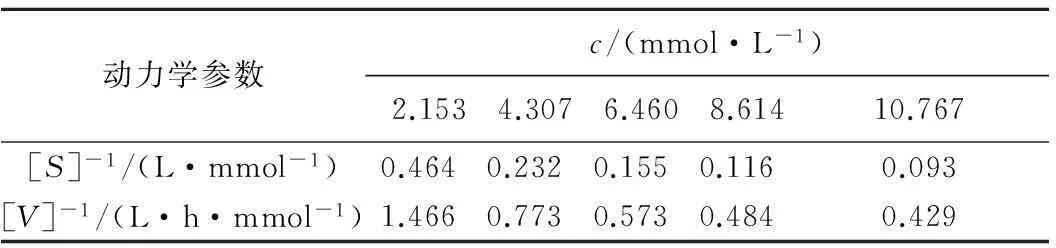
动力学参数c/(mmol·L-1)2.1534.3076.4608.61410.767[S]-1/(L·mmol-1)0.4640.2320.1550.1160.093[V]-1/(L·h·mmol-1)1.4660.7730.5730.4840.429
3 结 论
从Absidiasp. R42g中提取的异槲皮苷葡萄糖苷酶,分子质量大约为62 ku,最适反应温度为40 ℃,pH 5.0,具有较好的 pH耐受性和热稳定性,金属离子 Na+、K+、Mg2+、Ca2+存在时对相对酶活力无影响,Zn2+对该酶的相对酶活力的抑制作用随浓度的增大而增强,Cu2+、Fe3+存在时可以完全抑制该酶的酶活力。由动力学方程可得Vmax=6.711 mmol/(L·h),Km=18.89 mmol/L。
[1] 周浓,杨勤,杨敏.HPLC法同时测定川楝子中芦丁、异槲皮苷和槲皮素的含量[J].药物分析杂志,2013,33(2):225-226.
[2] 朱海扬,曾慧兰.黄酮类化合物药理作用的研究进展[J].山东医药,2009,49(17):114-115.
[3] 陈钧辉,陶力,朱婉华,等.生物化学实验[M].北京:科学出版社,2004.
[4] YU H S, ZHANG C Z, LU M C, et al. Purification and characterization of new special ginsenosidase hydrolyzing multi-glycisides of protopanaxadiol ginsenosides, ginsenosidase type Ⅰ[J]. Chemical and Pharmaceutical Bulletin, 2007, 55(2): 231-235.
[5] 王侃,鱼红闪.芦丁-α-鼠李糖苷酶分离提纯及其酶性质[J].大连工业大学学报,2004,23(1):30-31.
[6] 李文超,王云龙,周叶红,等.异槲皮苷的稳定性及溶解度考察[J].山西大学学报,2009,32(1):102-105.
[7] 邱慧,郭晓璐,易麸波,等.鸭肝过氧化氢酶的分离纯化及部分性质研究[J].西南大学学报(自然科学版),2008,30(4):163-168.
Purification and characterization of isoquercitrin-β-glucosidase
XUDan,JINFengxie,YUHongshan
(School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China )
Isoquercitrin-β-glucosidasewaspurifiedfromAbsidiasp.R42gusingmolecularsieveandtheionexchangeseparationandpurification,anditsenzymaticpropertieswerestudied.Resultsshowedthatitsmolecularmasswasabout62ku,theoptimumtemperaturewas40 ℃,theoptimumpHwas5.0.Enzymewasstablebelow50 ℃atpH4.0-6.0.TheionsofNa+,K+,Ca2+showednoinfluenceonisoquercitrin-β-glucosidaseactivitybutionsFe3+andCu2+inhibitedisoquercitrin-β-glucosidase.Theenzymekineticsofisoquercitrin-β-glucosidasewereVmax=6.711mmol/(L·h)andKm=18.89mmol/L.
isoquercitrin-β-glucosidase; purification; enzymatic characterization
徐丹,金凤燮,鱼红闪.异槲皮苷-β-葡萄糖苷酶的分离纯化及其酶性质[J]. 大连工业大学学报,2016,35(4):243-245.
XU Dan, JIN Fengxie, YU Hongshan. Purification and characterization of isoquercitrin-β-glucosidase[J]. Journal of Dalian Polytechnic University, 2016, 35(4): 243-245.
2015-03-01.
“重大新药创制”科技重大专项(2012ZX09503001-003).
徐 丹(1989-),女,硕士研究生;通信作者:鱼红闪(1968-),男,教授.
TS201.3
A
1674-1404(2016)04-0243-03

