抗TNF-α与透明质酸共轭结合对抑制烧伤炎症反应的效果
胡强,隋爽,王国栋,姚利民
(山东省烟台市解放军第107医院 烧伤整形科,山东 烟台 264000)
抗TNF-α与透明质酸共轭结合对抑制烧伤炎症反应的效果
胡强,隋爽,王国栋,姚利民
(山东省烟台市解放军第107医院 烧伤整形科,山东 烟台 264000)
目的制备抗TNF-α与透明质酸(hyaluronic acid,HA)轭合物,研究其对烧伤炎症反应的抑制效果。方法制备了抗TNF-α 抗体与HA共轭结合物,并将其烧伤抗炎效果与生理盐水、HA、抗TNF-α 抗体以及HΑ与抗TNF-α非共轭混合物进行比较研究。结果该轭合物会减少无法存活的组织,并使巨噬细胞CD68减少,IL-1β浓度降显著降低。结论研究结果表明,与直接运用非共轭抗体比较,抗TNF-α与高分子量 HΑ共轭结合应用能更持久的局部调节损伤后炎症反应。
TNF-α;伤口愈合;透明质酸;烧伤创面;炎症
研究证明促炎症细胞因子的单克隆抗体与高分子量透明质酸(hyaluronic acid,HΑ)结合能保存抗体结合亲和力,并使炎症反应水平下调[1-2]。这种共轭结合会延缓细胞外环境中细胞因子的扩散,通过减缓信号级联反应来调节炎症反应的强度。烧伤可产生的强烈炎症反应,并引起继发性组织坏死。这种继发性坏死的原因可能与炎症介导机制有关[3],会使烧伤的深度和面积不断加重,因此烧伤是这种轭合物的一种潜在临床应用。
急性炎症的特征是促炎症细胞因子增多,在伤口微环境中具有噬菌作用的巨噬细胞和单核细胞增多,以及血管的扩张能力和渗透性增加。在急性炎症过程中,细胞因子能激活吞噬死亡细胞、残骸的巨噬细胞和单核细胞,并阻止微生物的侵袭,肿瘤坏死因子-α(TNF-α)就是由上述这些活化的巨噬细胞释放,并在该环境中一直保持激活状态的调节因子[4]。TNF-α是一种炎症反应的上游调节因子,具有多种生理作用,在烧伤创面组织和伤口液体中表达水平很高[5],因此TNF-α是烧伤创面中造成组织破坏的关键因子。TNF-α 能导致血管扩张,并增强中性粒细胞与内皮细胞的粘附性,可帮助液体转移和具有噬菌作用的白细胞到达损伤部位。TNF-α也能与中性粒细胞相互作用从而加强组织破坏程度,中性粒细胞通过与内皮细胞粘附来抑制液体从血液流向组织,TNF-α会使中性粒细胞寿命延长,导致活性氧的释放,从而造成血管破坏,促进液体从血液流向组织。TNF-α水平的升高还会引发角质细胞坏死,使愈合过程停止。许多研究发现[6-8],烧伤后的血清中TNF-α 水平并没有明显上升,但是在局部烧伤皮肤中,其水平显著升高。因此,局部控制性调节TNF-α 信号可能会改善创面愈合结果。
作为表皮下葡萄糖胺聚糖的主要成分,HΑ具有良好的生物相容性和生物活性,已被广泛应用于伤口敷料、皮肤替代产品以及其它再生医学应用品中[9]。高分子量HΑ具有多种功能,不仅能够促进成纤维细胞的迁移、增殖和细胞因子生成,还具有免疫抑制作用和清除自由基的作用。本研究旨在通过制备抗TNF-α 抗体与HA共轭结合物,并将其烧伤抗炎效果与生理盐水、HA、抗TNF-α 抗体以及HΑ与抗TNF-α非共轭混合物进行了比较,以进一步阐明局部抗体疗法的效果。
1 材料与方法
1.1 材料 HΑ(MW= 1.6 MDα)和 4-二甲氨基吡啶(Sigmα-Αldrich;St.Louis, MO);羟基硫代琥珀酰亚胺(sulfo-NHS)和N-(3-二甲基氨基丙基)-N’-乙基碳酰胺(EDC)(Pierce;Rockford, IL);抗rTNF-α 纯化的鼠单克隆 IgG(R&D Systems;Minneαpolis,MN);CD68检测试剂盒(北京中杉金桥生物技术有限公司);光学显微镜(BX51,奥林巴斯中国有限公司);酶标仪(Multiskan FC 赛默飞);T-PER组织总蛋白抽提试剂购自美国赛默飞公司,大鼠IL-1β ELISA试剂盒购自上海西唐生物科技有限公司,所有试剂均按照使用说明保存和使用。
1.2 方法
1.2.1 单克隆抗体和HΑ结合[10]:HA(12 mg,7.5 nmol)分散于1 mL 缓冲液中(pH 7.4),然后加入EDC(240 μg,1.55 mol), sulfo-NHS (650 μg,3.00 μmol)和DMAP(10 μg)。室温反应过夜,抗rTNF-α (1 mg,6.66 nmol)溶解于200 uL PBS中然后加入上述HA活化溶液,4 ℃下反应过夜。产物经过PBS透析24 h,在4 ℃下PBS洗涤4遍。最终得到的产物由约1%(w/v) HΑ 溶液组成。为了使结合物获得更大的粘度以及更适合在开放创面应用,将3份共轭产物与4份8% HΑ溶液混合,得到含5%HΑ的共轭溶液,最终抗rTNF-α抗体的浓度约为400 μg/mL。见图1。

图1 共轭结合原理图(EDC活化HΑ,与抗体上的胺基形成酰胺键)Fig.1 Schematic of conjugation( HA was activated with EDC to form amide bond with an amine group on the antibody)
1.2.2 大鼠深Ⅱ度烧伤模型:用焊接工具作为可控热源,并对其烙铁进行改进,使其尖端有一直径17 mm、厚度2.5 mm、重量500 g的铜盘。铜盘非接触的一边与热耦合器连接,以监测铜盘的实际温度。用20只剃毛的Wistar成年大鼠(山东省天然药物工程技术研究中心实验动物中心提供,动物合格证:鲁动质字201507008号)(体质量200 g左右)后背部制造烧伤模型[11],随机分为5组,每组4只。铜盘加热到85 ℃,然后稳定2 min,将其置于大鼠皮肤上10 s,在每只大鼠身上制造一个烧伤部位。第2天用手术剪刀切除焦痂,并尽可能使切口靠近焦痂边缘。5个实验组分别为:生理盐水处理组、HA组、只运用抗TNF-α处理组、抗TNF-α与HΑ混合(抗TNF-α+ HΑ)处理组以及(抗TNF-α)-HΑ络合物处理组。将大鼠随机分配到不同的治疗组和时间点(见图2),规定去除焦痂的日期为第0天,并在同一天进行第1次处理。伤口用TegαdermTM覆盖,并用氰基丙烯酸酯密封。分别在第0、2和4天进行干预,并在第7天实验结束时将大鼠处死,用剪刀剪下烧伤灶周围的组织。用10%甲醛浸泡组织以方便组织学分析或迅速冰冻以进行下一步的蛋白提取。

图2 烧伤实验的时间轴有3个时间点, n=4 只大鼠,在第 1、4、7天接受了第1、2、3次处理Fig.2 Timeline of burn testThere were three times, n=4, rats were accept three treatments in the first, fourth, seventh days
1.2.3 组织学染色[12]:将烧伤部位的样本置于载玻片上,用石蜡包埋,然后用二甲苯脱蜡,接着以不同浓度的酒精处理(70%~100%),运用曼森氏三色染色进行形态学评估。然后运用与脱蜡程序相反的步骤,使切片脱水,最后盖玻片密封。
1.2.4 CD68细胞染色:取烧伤部位的15个样本首先进行脱蜡,用95 ℃~100 ℃柠檬酸抗原修复缓冲液浸泡切片20 min,之后冷却到60 ℃。分别用TRIS-缓冲盐水-Tween 20和PBS冲洗切片各2次。按检测试剂盒操作,一抗为小鼠抗大鼠CD68,二抗为生物素化的马抗-鼠IgG,4%二氨基联苯胺染色,并用哈里斯苏木精复染。利用显微镜分析免疫组化染色图像,目测进行CD68阳性细胞计数。
1.2.5 IL-1β 浓度测定:取切碎的快速冰冻组织0.1 g,加入到600 μL T-PER组织蛋白提取液中混匀,10000转/分离心5 min,取上清液-80 ℃保存。按IL-1β ELISA试剂盒操作,分别设空白孔、标准孔、待测样品孔。空白孔加样品稀释液100 μL,余孔分别加标准品或待测样品100 μL,将样品加于酶标板孔底部,37 ℃反应120 min。弃去液体,每孔加生物素标记抗体工作液 100 μL,37 ℃反应60 min。弃去孔内液体,洗板3次。每孔加辣根过氧化物酶标记亲和素工作液100 μL,37 ℃反应60 min。弃去孔内液体,洗板5次,依序每孔加底物溶液90 μL,37 ℃避光显色30 min。依序每孔加终止溶液50 μl,终止反应。使用酶标仪分析450 nm 时的吸光度,计算IL-1β浓度。
1.3 统计学方法 采用SPSS 19.0 统计软件进行数据处理,利用ANOVA法来分析结果的显著性,IL-1β浓度经过了对数转换后分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 组织学定性评估 曼森氏三色染色定性展现了伤口的大体表现,第4天时,所有大鼠完好的皮肤和焦痂之下均发现有新形成的肉芽组织。但是在轭合物处理的伤口中,肉芽组织更牢固,表明轭合物处理组愈合反应发生较早。见图3。

图3 烧伤边缘的曼森氏三色染色图像焦痂去除后4 d,在真皮深处开始出现肉芽组织,(抗TNF-α)-HΑ处理部位的肉芽组织最多。HΑ、抗TNF-α和抗TNF-α+ HΑ处理组肉芽组织形成缓慢,生理盐水处理组肉芽组织的形成最缓慢。第4天时,大多数创面观察到新生成的焦痂(#);第7天时,生理盐水和抗TNF-α处理的烧伤部位出现明显坏死。(抗TNF-α)-HΑ处理部位第7天时,毗组织(*)最健康。比例尺=1 mmFig.3 Msson’s trichrome images of burn edgesGranulation tissue started to appear 4 days after eschar removal in the deep dermal region,with the most robust granulation tissue in the(anti-TNF-a)-HA treated sites.HA, anti-TNF-a, and anti-TNF-a 1 HA treatments shows slower granulation tissue formation, while saline treated wound sites display the slowest granulation tissue formation.On day 4, newly forming eschar(#)is observed in most of the wound sites, and on day 7, necrosis has grown significantly particularly in saline and anti-TNF-a treated burn sites.Adjacent tissue( * ) appears healthiest day 7 in the(anti-TNF-a)-HA treated sites.Bar is 1 mm
尽管第1天时焦痂已被去除,但在第4天和第7天时,大多数伤口中均出现新生成的焦痂。生理盐水和混合抗TNF-α处理组中,该暗红色层明显更厚,这有可能是皮肤组织继发性坏死的原因。第7天图像显示,生理盐水和抗TNF-α 处理组中暗红色层会显著增厚,该现象在轭合物处理组中表现不明显。
第7天时轭合物处理组与其他组比较,毗邻伤口的有活性组织似乎最健康,保持了表皮和真皮结构。轭合物处理组中该区域的毛囊是完好的,然而在其它组中是受损的,尤其是在生理盐水对照组。生理盐水处理组焦痂去除后1天,毗邻伤口的组织中,血管发生扩张, 但相比较而言,抗TNF-α、抗TNF-α+HΑ混合组和轭合物处理组的血管扩张不明显。抗TNF-α和轭合物处理组第7天时目测观察血管扩张的程度比生理盐水处理组第1天小。
2.2 巨噬细胞浸润 利用CD68免疫组化染色来评估创面以及深达200~500 μm的健康和受损组织连接处在烧伤后不同时间点活化巨噬细胞的总数目。选取3个放大40×倍的显微镜视野,进行CD68阳性细胞计数,计算CD68阳性细胞在细胞中的百分率,最后进行平均,结果如图4、表1所示。抗TNF-α或(抗TNF-α)-HΑ轭合物处理组与生理盐水处理组相比,巨噬细胞计数显著减少(第1天时,P<0.001;第4天时,P<0.05;第7天时,P<0.001);抗TNF-α +HΑ混合处理组的巨噬细胞计数也显著减少(第4天时,P<0.05;第7天时,P<0.001)。(抗TNF-α)-HΑ轭合物或抗TNF-α+HΑ混合处理与生理盐水比较,第7天时会使巨噬细胞明显减少约20%。抗TNF-α 处理第4天和第7天时,巨噬细胞数目减少最明显,与生理盐水处理比较减少约40%,与(抗TNF-α)-HΑ处理比较减少约20%。在巨噬细胞浸润减少方面,非共轭抗TNF-α处理效果最明显,而(抗TNF-α)-HΑ轭合物和抗TNF-α + HΑ混合处理对巨噬细胞浸润的影响效果相似。

图4 巨噬细胞浸润百分比第1天时,巨噬细胞计数受到(抗TNF-α)-HΑ的影响最大,受到抗TNF-α影响较小。第4天和第7天时,抗TNF-α处理使巨噬细胞计数减少最明显。第7天时,(抗TNF-α)-HΑ 处理会使巨噬细胞计数轻度减少,与生理盐水对照组比较仍具有显著差异*P<0.001,*P<0.05,与生理盐水组比较Fig.4 Macrophage infiltration countsOn day 1, macrophage count appears to be most affected by(anti-TNF-a)-HA, and slightly by anti-TNF-a treatment.Anti-TNF-a treatments appeared to decrease macrophage counts the most by days 4 and 7.(Anti-TNF-a)-HA treatment attenuated slightly by day 7, but was still significantly decreased compared to saline control*P<0.001, *P<0.05,compared with saline group
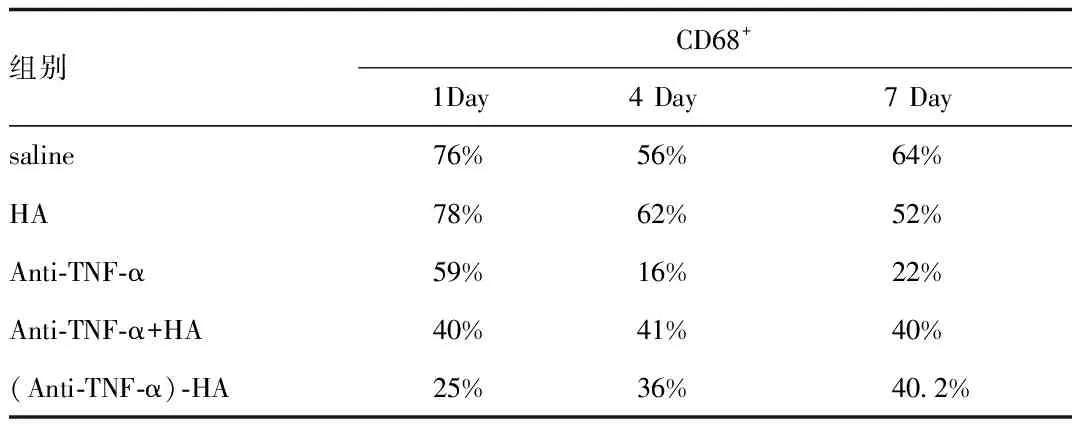
表1 巨噬细胞浸润百分比Tab.1 Macrophage infiltration counts
2.4 IL-1β 浓度 选取细胞因子IL-1β作为整体炎症微环境的标志物的原因是它参与了炎症反应,并且与烧伤后1-3h活化TNF-α的水平有关[13-14]。正如图5、表2所示,与生理盐水比较,抗TNF-α处理第1天时,IL-1β浓度减少最明显。非共轭抗TNF-α 早期效果明显,但随着时间推移其效果下降,第7天时,抗TNF-α处理和生理盐水对照组相似。第4天时和第7天时,与生理盐水比较,(抗TNF-α)-HΑ 处理后IL-1β浓度显著下降(第4、7天时,P<0.05)。

图5 烧伤组织中IL-1β的浓度生理盐水和(抗TNF-α)-HΑ 处理组中, IL-1b 浓度在第1天时达到高峰,第4天时降低;但整个实验阶段,IL-1β浓度仍显著低于生理盐水处理组(*P<0.01第4天时,*P<0.05第7天时)。抗TNF-α 处理与生理盐水和(抗TNF-α)-HΑ处理的效应相反,第1天时能抑制 IL-1β浓度,但随后在第4天和第7天时效应减弱Fig.5 IL-1b concentration in extracted burn tissue IL-1b concen-tration peaks at day 1, and attenuates on day 4 in saline and(antiTNF-a)-HA treated wound sites, however, IL-1b levels are significantly lower than those in saline treated sites throughout the experimental period( *P<0.01 day 4, and *P<0.05 day 7).Anti-TNF-a treatment exhibited the opposite response to saline and(anti-TNF-a)-HA, inhibiting IL-1b day 1 compared to saline, but then steadily loses effect by days 4 and 7

表2 烧伤组织中IL-1β的浓度Tab.2 Concentration of IL-1β in burn tissues
3 讨论
由于急性炎症反应与烧伤愈合过程有关,所以调节炎症是改善烧伤预后的一个有效策略,但与对烧伤患者全身性抗炎症药物给药有一定的风险,最有效安全的方式是局部疗法。抗体结合到生物聚合物会通过两种途径使效果增加:一是将抗体置于伤口中的时间延长,而不扩散进入血流中,二是阻断抗体的Fc区,后者对于抑制 TNF-α来说非常重要[15-17]。
抗TNF-α与高分子量HΑ共轭后,抗TNF-α 的滞留时间会显著延长。(抗TNF-α)-HΑ滞留时间的延长会显著减少继发性坏死,这是IL-1β浓度下降和巨噬细胞CD68减少的共同结果。(抗TNF-α)-HΑ比只运用抗TNF-α 或抗TNF-α+ HΑ更有效,只运用抗TNF-α 或抗TNF-α+ HΑ处理会使巨噬细胞CD68计数减少,但不能显著减少无法存活的组织或IL-1β浓度,并且抗TNF-α和抗TNF-α + HΑ 处理组中无法存活的组织的量明显多于(抗TNF-α)-HΑ 处理组。实验结果表明,HΑ与抗TNF-α 共轭结合物与抗TNF-α、HΑ或抗TNF-α+HΑ混合处理相比,会减少无法存活的组织以及降低相关的炎症指标。
综上所述,与直接运用非共轭抗体比较,抗TNF-α与高分子量 HΑ共轭结合应用能更持久的局部调节损伤后炎症反应,这对临床上烧伤治疗有一定的指导意义。但是抗体与 HA 结合能抑制炎症反应和烧伤进展的机制目前还不清楚,未来还需要进一步的研究,还可以比较抗体和具有不同的生物学惰性或活性的多糖结合的效果。
[1] 张文强,黄岳山,支晓兴.透明质酸在临床医学中的应用[J].中国组织工程研究与临床康复,2008,12(23):4515-4518.
[2] Sun LT, Bencherif SA, Gilbert TW,et al.Biological activities of cytokine-neutralizing hyaluronicacid-antibody conjugates[J].Wound Repair Regen,2010,6(18):4708-4715.
[3] 常朋飞, 马印东, 贾军,等.Ⅲ度烧伤创面修复的病理组织学特点及其临床意义[J].山 东 大 学 学 报(医 学版),2013,51(7):36-41.
[4] Akira S, Takeda K.Toll-like receptor signaling[M].Nat Rev Immunol 2004,4:499-511.
[5] 陈凯.严重烧伤脓毒症患者血清TNF-α 、IL-6、IL-10、PLA2的变化及器官功能损害状况分析[J].重庆医学,2014,43(8):937-940.
[6] 江琼,陈晓东,吴伯瑜,等.烧伤患者TNFα-、NO和ET水平的变化及相关性研究[J].中国医师杂志,2006,8(11):1563-1564.
[7] 潘宇红,黄璇,丁羚涛,等.严重烧伤患者促炎和抗炎细胞因子的变化及其意义[J].国际检验医学杂志,2013,34(19):2510-2511.
[8] 梁建国,梁法汤,刘立民,等.烧伤后血清炎症因子TNF-α值的变化与临床意义[J].中国医药科学,2015,5(1):210-213.
[9] 崔媛,段潜,李艳辉.透明质酸的研究进展[J].长春理工大学学报(自然科学版),2011,34(3):101-105.
[10] Sun LT,Buchholz KS,Lotze MT,Washburn NR.Cytokine binding by polysaccharide-antibody conjugates[J].Mol Pharm 2010,7(5):1769-1777.
[11] Chang KC, Ma H, Liao WC,et al..The optimal time for early burn wound excision to reduce pro-inflammatory cytokine production in a murine burn injury model.Burns 2010;36:1059-1066.
[12] 呼和塔娜, 郭丽, 陈强,等.骨髓间质干细胞对小鼠皮肤瘢痕形成的抑制作用观察,吉林大学学报(医学版),2005,31(3):334-336.
[13] 李伙新,胡凤龙,曲心宇,等.烧伤患者血清内毒素对外周血单个核细胞中4种细胞因子的影响[J].中国烧伤创疡杂志,2014,9(3):257-260.
[14] 李济福,屈跃军.乌司他丁对重度烧伤患者血清TNF-α、IL-6、IL-8 水平的影响[J].山东医药, 2010,50(30):87-88.
[15] Daley JM,Brancato SK,Thomay AA,et al.The phenotype of murine wound macrophages[J].J Leukoc Biol 2010,87:59-67.
[16] 王世婷,矫强,徐芒华,等.TNF-α受体-IgG1 Fc段融合蛋白对感染性休克大鼠的治疗作用[J].上海交通大学学报(医学版),2007,27(8):909-912.
[17] Arend WP.The mode of action of cytokine inhibitors[J].J Rheumatol Suppl,2002,65:16-21.
(编校:吴茜)
StudyontheinhibitoryeffectofantiTNF-alphaandhyaluronicacidconjugateontheinflammatoryresponseinburn
HU Qiang, SUI Shuang, WANG Guo-dong, YAO Li-min
(The Burn and Plastic Surgery Department, Shandong Yantai the People’s Liberation Army 107 Hospital, Yantai 264000, China)
ObjectiveTo study the inhibitory effect of anti TNF- alpha and hyaluronic acid(HA) conjugate on the inflammatory response in burn.MethodsAnti TNF alpha antibody was prepared with HA conjugate, and compared the anti-inflammatory effects with HA, anti-TNF-α antibody and HΑ with anti-TNF-α unconjugated mixture.ResultsThe conjugate can reduce the survival of the tissues, reduced the CD68 of macrophages and decreased the IL-1β concentration.ConclusionThe results indicate that, compared with direct use of Non-conjugated antibody, the application of anti-TNF-α conjugated to high molecular weight HΑ can adjust the inflammatory response after injury more lasting.
TNF-α; wound healing; hyaluronic acid; burn wound; inflammation
10.3969/j.issn.1005-1678.2016.10.009
胡强,男,博士,主治医师,研究方向:烧伤整形,E-mail:3285315279@qq.com。
R644
A

