深黄被孢霉Δ6-脂肪酸脱氢酶基因在毕赤氏酵母SMD1168中表达的研究
王长远,全 越,沈冰蕾,姚 笛,于长青
(黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
试验研究
深黄被孢霉Δ6-脂肪酸脱氢酶基因在毕赤氏酵母SMD1168中表达的研究
王长远,全越,沈冰蕾,姚笛,于长青
(黑龙江八一农垦大学食品学院,黑龙江大庆163319)
引物根据Δ6-脂肪酸脱氢酶(D6D)基因以及酵母蛋白表达载体pGAPZαA的多克隆位点进行引物设计,并在上游插入ECoRⅠ位点、下游插入XhoⅠ位点,从深黄被孢霉中克隆D6D基因,构建pMD18-T-D6D载体与pGAPZαA-D6D载体。将重组质粒线性化,并将其电转导入到毕赤氏酵母(Pichia pastoris SMD1168)中,Zeocin抗生素筛选高拷贝转化子,对重组菌进行诱导表达。经过Tricine-SDS-PAGE分析和蛋白质免疫印迹(Western bloting)试验,证明Δ6-脂肪酸脱氢酶融合蛋白具有免疫学活性。结果成功构建了重组酵母pGAPZαA-SMD1168,为利用基因工程菌生产γ-亚麻酸(GLA)奠定理论基础。
深黄被孢霉;Δ6-脂肪酸脱氢酶;毕赤氏酵母SMD1168;pGAPZαA表达载体
0 引言
γ-亚麻酸(GLA)作为人体必需不饱和脂肪酸之一,具有降血脂、抗血栓等多种生物性功能[1-4],在临床上常被用于防治心梗、冠心病等多种疾病[5]。另有大量研究表明,GLA对多种藻类、G-菌以及一些G+菌生长有一定程度的抑制作用[6-9]。由于GLA在人类健康中的具有重要作用,而成为被人们关注的非常有价值产品,但是由于其产量、生产成本、安全性等问题,使现有来源不能满足日益增长的市场需求。在脂肪酸代谢途径中,Δ6-脂肪酸脱氢酶是合成PUFAs途径过程当中的主要枢纽酶[10-11],对人体具有非常重要的生理意义。近些年,随着分子生物学与基因工程技术的飞速发展,利用此方法构建生产γ-亚麻酸的基因工程菌成为人们研究热点[12]。因此,本试验室选用适合外源蛋白表达的毕赤氏酵母SMD1168作为受体系统,采用pGAPZαA为表达载体,来探索生产γ-亚麻酸的新途径。
1 材料
1.1菌株及质粒
试验所用的毕赤氏酵母(Pichia pastoris SMD1168)菌株、深黄被孢霉(Mortieralla isabellina As3.3410)菌株以及E.coli DH5α'由黑龙江八一农垦大学食品学院微生物实验室提供;兔抗D6D多克隆血清为实验室自行制备;酵母蛋白表达载体pGAPZαA,质粒pMD18-T均购自宝生物工程(大连)有限公司。
1.2工具酶、试剂与培养基
T4DNA连接酶、XhoⅠ酶、ECoRⅠ酶、DNA Marke购自宝生物工程(大连)有限公司;设计的引物由上海生工合成;常规生化试剂均为国产分析纯。PDA培养基、LB培养基、含抗生素Zeocin酵母膏胨葡萄糖培养基YPDS参照文献方法[13-15]。
2 方法
2.1D6D基因的克隆与鉴定
按照深黄被孢霉D6D基因的序列,并根据酵母蛋白表达载体pGAPZαA的多克隆位点进行引物设计,并在上游插入ECoRⅠ酶切位点、下游插入XhoⅠ酶切位点。最终设计的上下游引物如下:
引物P1:5'-GAA TTC GCC GCC ACC ATG GGT ACG GAC C-3'
引物P2:5'-CTC GAG CTC TTC CTT GGG ACG GAG-3'
以深黄被孢霉Δ6-脂肪酸脱氢酶(D6D)基因的cDNA为模板,进行扩增目的基因片段。试验方法:在95℃条件下,预变性5 min;在94℃条件下,继续变性1 min;然后在55℃条件下,退火30 s;最后在72℃条件下延伸1.5 min,共计30个循环。用PCR纯化试剂盒对D6D基因进行纯化,取纯化后的D6D基因与PMD18-T载体进行连接,从而构建克隆载体pMD18-T-D6D。
2.2大肠杆菌感受态细胞、酵母感受态细胞的制备与转化
按常规方法[13]进行。
2.3酵母蛋白表达载体pGAPZαA-D6D的构建
用ECoRⅠ和XhoⅠ双酶切pMD18-T-D6D质粒,回收酶切片段,克隆到相同内切酶处理过的酵母蛋白表达载体pGAPZαA上,并转化至制备好的感受态细胞,产物涂布在低盐LB平板上,平板含25 μg/mL的抗生素Zeocin,在37℃条件下,培养16 h,直至呈现转化菌落。取新鲜培养的转化菌株,提取重组质粒,进行PCR,ECoRⅠ和XhoⅠ酶切鉴定重组质粒,阳性重组质粒命名为pGAPZαA-D6D。
2.4酵母细胞的转化筛选与阳性克隆的PCR鉴定
取重组表达质粒pGAPZαA-D6D进行AvrⅡ酶切线性化,通过电转化法(1 500 V,25 μF,200 Ω),将重组质粒 pGAPZαA-D6D电转到毕赤氏酵母SMD1168中,取200 μL转化产物涂在含Zeocin的YPDS平板上,在30℃下,培养2~10 d。筛选阳性酵母的单个菌落进行培养,收集液体培养基中的目标细胞,同时采用酸化玻璃珠的方法提取DNA基因组,利用PCR方法鉴定阳性重组克隆。
2.5重组蛋白的SDS-PAGE分析及Western bloting鉴定
将PCR检测阳性单菌落接种于YPDS培养基中,15%Tricine-SDS-PAGE分析检测上清液中蛋白的表达。通过转印装置将目的蛋白转移到硝酸纤维素膜上,膜经10%脱脂乳室温封闭1 h后,经1∶100倍稀释的兔抗D6D多克隆血清于4℃下孵育过夜,经PBST缓冲液充分漂洗3次,每次5 min;再经1∶2 000稀释的辣根过氧化物酶标记的羊抗兔IgG抗体室温下孵育1 h,PBST缓冲液充分漂洗3次,每次5 min。将制备好的膜置入二氨基联苯胺DAB-H2O2显色液中,在避光的条件下显色,直至出现条带,随后立刻将膜转移到去离子水中终止显色反应。
3 结果与分析
3.1深黄被孢霉D6D基因的PCR扩增结果
以深黄被孢霉D6D基因的cDNA为模板,利用设计的引物进行PCR。
PCR结果见图1。

图1 PCR结果
由图1可知,目的基因在1 300 bp左右处出现一条明亮的条带,其大小与目的片段大小基本一致。
3.2D6D基因重组质粒pGAPZαA-D6D的PCR与双酶切鉴定
重组质粒pGAPZαA-D6D的PCR结果见图2,重组质粒pGAPZαA-D6D的双酶切结果见图3。

图2 重组质粒pGAPZαA-D6D的PCR结果

图3 重组质粒pGAPZαA-D6D的双酶切结果
结果分析表明,在1 300 bp处有一亮带,与预期目的片段的大小相似。重组质粒经ECoRⅠ和XhoⅠ限制性酶双酶切,酶切产物经1%琼脂糖凝胶电泳。结果分析表明,在1 300 bp和3 000 bp处各有一条明亮的条带,与预期目的片段的大小一致,证明已成功构建重组质粒pGAPZαA-D6D。
3.3重组毕赤氏酵母SMD1168基因组的PCR鉴定
筛选阳性重组克隆,提取重组酵母SMD1168的基因组DNA,利用PCR方法鉴定。
重组毕赤氏酵母SMD1168基因组的PCR结果见图4。
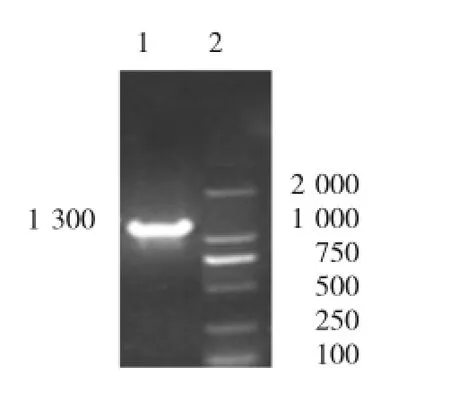
图4 重组毕赤氏酵母SMD1168基因组的PCR结果
由图4可知,在1 300 bp左右处出现一条亮带,与预期片段大小相符,可以证明重组深黄被孢霉D6D基因已整合到酵母SMD1168的染色体上。
3.4表达产物的SDS-PAGE分析及Western bloting鉴定
经PCR鉴定后的阳性重组子进行培养,通过Tricine-SDS-PAGE分析检测上清液中蛋白的表达。
重组毕赤氏酵母SMD1168表达产物的SDSPAGE电泳见图5,重组毕赤氏酵母SMD1168表达产物的Western bloting电泳见图6。

图5 重组毕赤氏酵母SMD1168表达产物的SDS-PAGE电泳
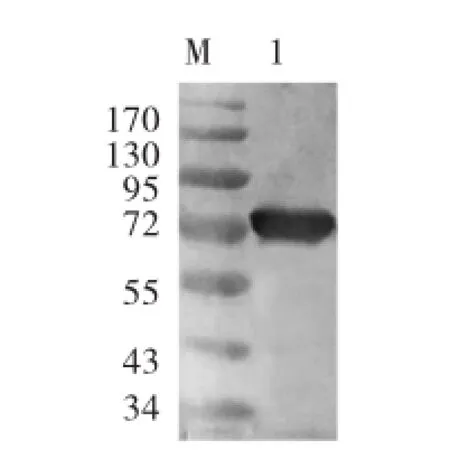
图6 重组毕赤氏酵母SMD1168表达产物的Western bloting电泳
由图5可知,在约70 kDa的位置有一条明显的蛋白条带,其分子量与D6D的理论值相符,而阴性对照菌株在相应处无明显的蛋白条带,说明D6D基因在毕赤氏酵母SMD1168中得到表达。对重组毕赤酵母表达产物进行Western bloting电泳,将其转移到PVDF膜上进行免疫学反应,可以观察到在约70 kDa处呈现了特异的蛋白质印迹带,从而证明表达的重组蛋白具有良好的免疫学活性。
4 讨论
本研究采用pGAPZαA为表达载体,SMD1168毕赤氏酵母为受体系统,来构建高效、分泌型的毕赤酵母表达系统。酵母表达系统相对于原核表达系统具有一定的优势[16-17],并且酵母菌与人类的关系十分密切,一般情况下没有致病性。毕赤氏酵母组成型表达载体pGAPZα能生产比诱导型表达载体pPICZ和pPICZαA更高的外源蛋白,且不需要诱导,无毒性,操作简单。深黄被孢霉Δ6-脂肪酸脱氢酶基因在酵母SMD1168中表达未见报道。本试验构建的重组酵母载体经电转化到毕赤氏酵母SMD1168中,通过鉴定证明Δ6-脂肪酸脱氢酶融合蛋白具有一定的免疫学活性,说明通过酵母表达系统表达重组此蛋白是可行的。但是通过试验发现,其蛋白的表达量不高,达不到工业生产的要求,后期将通过更换表达载体与优化表达条件等方法提高蛋白表达,为利用工程菌生产γ-亚麻酸奠定理论基础。
[1]Begin M,Das U N.A deficiency in dietary gamma-linolenic acid or eicosapentaenoic acids may determine individual susceptivlity to AIDS[J].Med Hypotheses,2006(20):1-8.
[2]石克勋,牛增智.月见草油胶丸治疗高脂血症30例 [J].新药与临床,1990,9(1):8-10.
[3]伶铭,江力,邹竞,等.月见草油胶囊治疗高脂血症 [J].中西医结合杂志,1988(8):469-471.
[4]杜笑逸,王义明.月见草油对实验性高血脂及脂肪肝的影响 [J].中国药学杂志,1991,26(10):597-598.
[5]谷利伟,赵金兰.共轭亚油酸研究进展 [J].粮油食品科技,2001,9(2):28-29.
[6]杭晓敏,唐涌镰,柳向龙.多不饱和脂肪酸的研究进展 [J].生物工程进展,2001,21(4):18-21.
[7]Boudreau M,Chanmugan P S,Hart S B.Lack of dose response by dietary n-3 to n-6 fatty acid in suppressing eicosanoid biosynthesis from arachidonic acid[J].AmJ Clinnurt,2004,54(1):11.
[8]Ohta S,Chang T,Kawashima A,et al.Antibiotic activity of unsaturated fattyacids on methieillin-resistant Staphylococcus aureus[J].Biosci Biotech Bio-chem,2003,57(12):2 194-2 195.
[9]Ratledge C,Katuda Y.Technological advances and alternative sources of LiPids[J].Blackie Aca Demic,2006,33:235-291.
[10]A Macartney,B Maresca,A R Cossins.Acyl-CoA desaturases and the adaptive regulation of membrane lipid composition[J].Temperature Adaptation of Biological Membranes,Portland Press,London,1994,99:129-139.
[11]Sakkutadani E,Kobayashi M,Shimizu S.Δ6-fatty acid desaturase from an arachidonic acid-producing Mortierellafungus gene cloning and its heterologous expression in a fungus:Aspergillus[J].Gene,1999,152:7-12.
[12]张琦,李明春,孙红妍,等.Δ6-脂肪酸脱氢酶的分子生物学研究进展 [J].生物工程学报,2004(3):319-324.
[13]J萨姆布鲁克,E F佛里奇,T曼尼阿蒂斯.分子克隆实验指南 [M].第2版.(金冬雁等译).北京:科学出版社,1993:174-186.
[14]邢来君,钟辉,周辉,等.深黄被孢霉发酵生产γ-亚麻酸的研究 [J].真菌学报,1996,15(4):272-277.
[15]王长远,张丽萍,刘松财,等.甜味蛋白Brazzein在毕赤氏酵母中表达的初步研究 [J].中国食品学报,2009(5):43-47.
[16]Sreekrishna K,Brankamp K E.Strategies for optimal synthesis and secretion and heterologous proteins in the methylotrophic yeast P.pastoris[J].Gene,1997(1):55-67.
[17]张惠展.基因工程 [M].上海:华东理工大学出版社,2005:37-48.◇
Study on the Expression of Mortieralla Isabellina Δ6-fatty Acid Desaturase Gene in the Pichia Pastoris Yeast SMD1168
WANG Changyuan,QUAN Yue,SHEN Binglei,YAO Di,YU Changqing
(College of Food Science,Heilongjiang Bayi Agricultural University,Daqing,Heilongjiang 163319,China)
Primers are designed based on Δ6-fatty acid desaturase(D6D) genes conserved region and pGAPZαA vector cloning sites.For primer design,downstream,respectively,introduced ECoRⅠand XhoⅠrestriction sites.From Mortierallaisabellina cloned Δ6-fatty acid desaturase gene(D6D) .D6D gene is cloned from Mortieralla isabellina,vector pMD18-TD6D with pGAPZαA-D6D.That recombination vector is obtained.After ligation of the plasmids by AvrⅡ,being integratedinto the genome of host yeast P.pastoris SMD1168 by electroporation and sereening the converter by Zeocin.To induce expression recombinant bacteria,and the Immunologic competence is detected with Tricine-SDS-PAGE and Western bloting.The Yeast pGAPZαA-SMD1168 plasmid is construeted suceessfully.For the mass production of GLA has laid a solid foundation.
Mortieralla isabellina;Δ6-fatty acid desaturase;Pichia pastoris SMD1168;expression vector pGAPZαA
TS201.2
A
10.16693/j.cnki.1671-9646(X).2016.07.030
2016-05-31
黑龙江省农垦总局科技攻关项目(HNK125A-04-16)。
王长远(1976— ),男,博士,教授,研究方向为食品科学。

