美沙拉秦、酪酸梭菌、蒙脱石散对UC大鼠血中PG-E2、LT-B4、PAF、VEGF的影响
何 山 刘 凯 黄永坤
(昆明医科大学附属第一医院儿科,昆明650000)
美沙拉秦、酪酸梭菌、蒙脱石散对UC大鼠血中PG-E2、LT-B4、PAF、VEGF的影响
何山①刘凯①黄永坤②
(昆明医科大学附属第一医院儿科,昆明650000)
①现供职于云南省第一人民医院儿科,昆明650000。
目的:探讨模型UC大鼠血中前列腺素-E2(PG-E2)、白三烯B4(LT-B4)、血小板活化因子(PAF)及血管内皮生长因子(VEGF)的水平,及经过美沙拉秦、酪酸梭菌、蒙脱石散治疗干预后上述四个因子的变化情况,以了解这四个炎性因子在模型UC大鼠血中的意义及上述三种药物对这四个炎性因子的干扰效果。方法:将100只大鼠随机分成正常组、模型组、美沙拉秦组、酪酸梭菌组、蒙脱石散组,用酶联免疫吸附试验分别检测各组小鼠血中第12天血中的PG-E2、LT-B4、PAF、VEGF的含量,并进行统计学分析。结果:①模型组、美沙拉秦组、酪酸梭菌组、蒙脱石散组较正常组的DAI及血清PG-E2、LT-B4、PAF、VEGF含量均升高,差异有统计学意义(P<0.05)。②与模型组比较,美沙拉秦组、酪酸梭菌组、蒙脱石散组的DAI及血清PG-E2、LT-B4、PAF、VEGF含量均降低,差异有统计学意义(P<0.05)。③美沙拉秦、酪酸梭菌、蒙脱石散的治疗效果比较,美沙拉秦及蒙脱石散疗效较好,差异有统计学意义(P<0.05),美沙拉秦与蒙脱石散疗效无差异。结论:①在TNBS/乙醇法诱导的UC大鼠血清中PG-E2、LT-B4、PAF、VEGF表达增高,与炎症呈正相关。②美沙拉秦、酪酸梭菌、蒙脱石散可下调模型大鼠促炎因子PG-E2、LT-B4、PAF、VEGF的表达,这可能与UC大鼠肠道炎症的缓解,促进大鼠UC的恢复有关。
美沙拉秦; 酪酸梭菌; 蒙脱石散; 溃疡性结肠炎;大鼠;细胞因子
溃疡性结肠炎的临床表现,主要以慢性、反复性、难以自限性的腹泻、腹痛、呕吐甚至便血,并伴随不同程度的肠外表现及全身症状,人发热,消瘦,营养不良等。从而造成患者生活质量明显下降。UC的发病,可见于任何年龄,但一般好发于20~30岁[1],无性别差异,儿童患者约占1/4[2]。几乎大部分UC患者都存在较为明显的免疫紊乱。目前研究发现多种免疫学因素参与了UC的发病[3],如B淋巴细胞、T淋巴细胞、吞噬细胞和单核细胞等,以及这些细胞所产生的抗体、补体及其免疫复合物。免疫细胞分泌具有活性的细胞因子或多肽类。本研究的目的是通过TNBS/乙醇法建立大鼠UC模型,了解溃疡性结肠炎免疫功能的变化及美沙拉秦、酪酸梭菌、蒙脱石散对免疫功能的影响,研究讨论酪酸梭菌、蒙脱石散治疗UC的机理,为临床治疗UC提供新的依据。
1 资料与方法
1.1实验模型将清洁健康雄性适龄(6~8 w)SD大鼠100只,随机分成5组,每组20只,分别为健康组(A组),模型组(B组),美沙拉秦组(C组),酪酸梭菌组(D组),蒙脱石散组(E组),除A组外,其余四组用TNBS(100 mg/kg)和50%乙醇溶液1∶1混合液从肛门注入造模,造模成功后,除A、B组外,其余三组分别每天灌服美沙拉秦、酪酸梭菌和蒙脱石散,并在第12天时处死大鼠,并采集肠道组织及血标本。
1.2研究方法①观察大鼠存活率:观察不同模型中大鼠死亡情况;②大鼠的一般状况:观察大鼠每天的精神、毛发、大便性状等。便血及腹泻,黏液便的情况。然后对身体质量,大便形状及大便隐血实验这几项指标进行UC评分(DAI评分)。DAI=(体质量下降分数+大便性状分数+便血分数)/3;③用酶联免疫吸附法(ELISA)测定各组大鼠血中PG-E2、LT-B4、PAF、VEGF的含量,并进行统计学分析。

2 结果
2.1各组大鼠情况经过12 d的药物灌胃结束了本实验的大鼠溃疡性结肠炎的治疗,治疗过程中,造模满24 h模型组死亡大鼠1只;造模第2天模型组死亡大鼠2只,美沙拉秦组死亡大鼠3只,蒙脱石散组死亡大鼠1只;造模第3天酪酸梭菌组死亡3只;造模第4天蒙脱石组死亡1只。造模5 d后均无大鼠死亡。死亡原因考虑为严重的腹泻、便血或腹胀导致,尸检可见其结肠肠管充气明显,肠黏膜充血水肿和溃烂等,部分结肠因出血严重而发黑。中途死亡大鼠不计入评分,死亡率为11.9%。
2.2疾病活动指数(Disease activity index,DAI)评分造模满24 h开始每天观察大鼠的精神、毛色情况,记录大鼠的体重、大便情况,且每天通过传统隐血实验方法观察肠道出血情况,从而来DAI评分,各组评分结果见表1。
表1 各组DAI评分表Tab.1
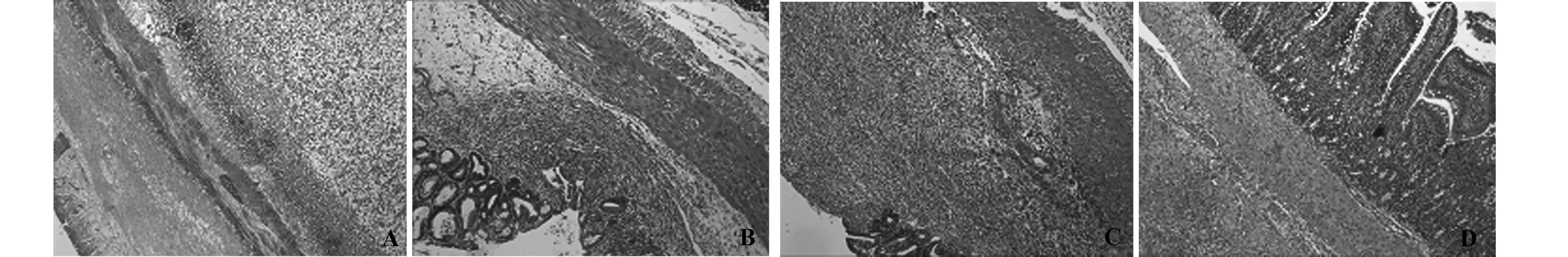
图1 治疗满12 d各组远端结肠病理切片HE染色Fig.1 HE staining result of each group′s distal colon tissue after 12 days treatmentNote: A.Model group,ulcer deep into muscular layer with decreased of inflammatory cell count;B.Mesalazine group,ulcer area was stable and recovered almost normal with fiber tissue hyperplasia;C.Clostridium group,ulcer was repairing with mild inflammatory infiltrate and intestinal mucosal fibrosis;D.Montmorillonite group:significant lymphocyte infiltrate with mucosal partly congestion and edema,ulcer almost repaired.
表2 各组PGE2第12天的水平(pg/ml,n=8)Tab.2 PGE2 level of each group after 12 days treatment(ng/ml,n=8)

图2 各组PGE2第12天含量柱状图,浓度(pg/ml)Fig.2 PGE2 level′s bar chart of each group after 12 days treatment(pg/ml)Note: Compared with the group B,PGE2 level of four intervention groups is decreased and most effective group is group E,followed by group C and group D after 12 days treatment.
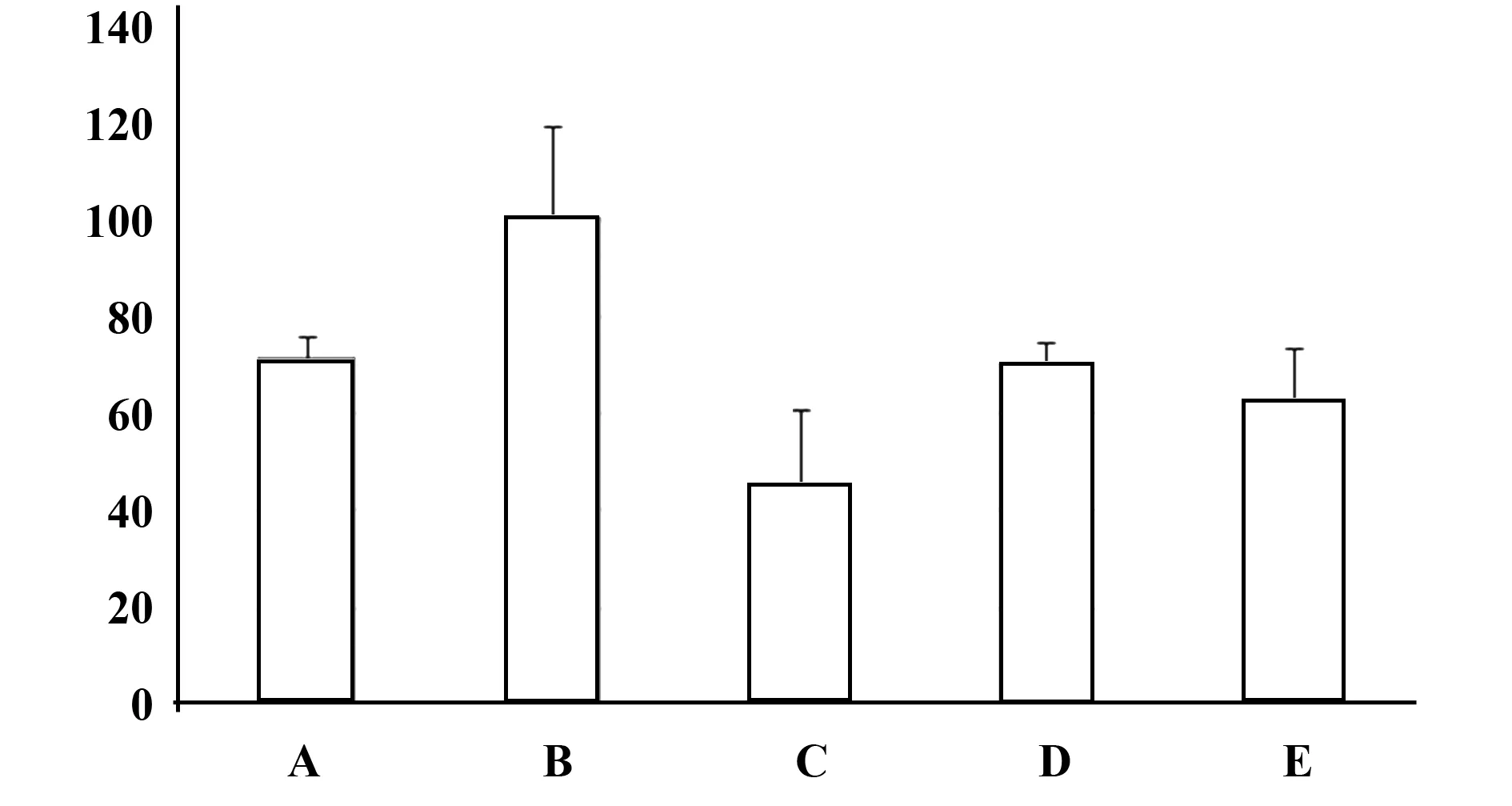
图3 各组LT-B4第12天含量柱状图,浓度(pg/ml)Fig.3 LT-B4 level′s bar chart of each group after 12 days treatment(pg/ml)
2.3结肠组织病理学评价处死大鼠后,解剖取结肠组织HE染色光镜和电镜下观察病理改变, 主要观察大鼠肠黏膜及炎症细胞浸润情况,腺体结构及杯状细胞的变化,有无隐窝脓肿的形成,结肠黏膜上皮脱落及修复的情况,见图1。

表3 各组LB-B4第12天的水平(pg/ml,n=8)Tab.3 LB-B4 level of each group after 12 days treatment
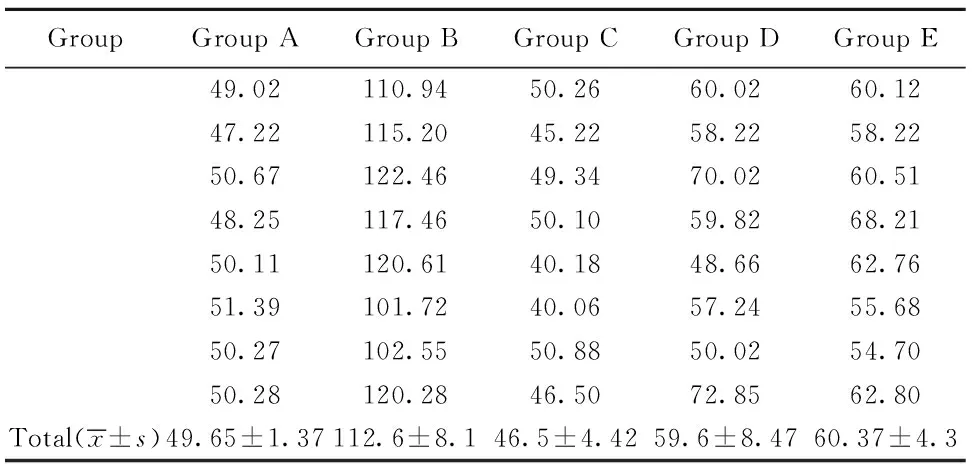
表4 各组PAF第12天的水平(pg/ml,n=8)Tab.4 PAI level of each group after 12 days treatment(pg/ml,n=8)
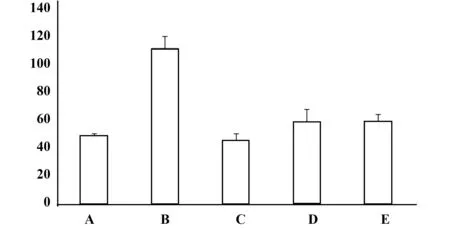
图4 各组PAF第12天含量柱状图,浓度(pg/ml)Fig.4 PAF level′s bar chart of each group after 12 days treatment(pg/ml)Note: Compared with group B,PAF level of four intervention groups is decreased and most effective group is group C,followed by group D and group E after 12 days treatment.
2.4各组大鼠血中PG-E2、LT-B4、PAF和VEGF的水平各细胞因子的实验结果见表2~5及图2~5。
应用SPSS17.0统计软件进行差异性统计,由表6可知,大鼠血清中PGE2,LT-B4,PAF,VEGF的含量,在第12天时,模型组均比正常组升高。差异有统计学意义(P<0.05);美沙拉秦、酪酸梭菌及蒙脱石散干预治疗后,可降低UC大鼠血清中的PGE2,LT-B4,PAF,VEGF的含量,差异有统计学意义(P<0.05)。对于降低PGE2含量的效果顺序为蒙脱石散>美沙拉嗪>酪酸梭菌组;降低LT-B4,PAF的含量的效果顺序为美沙拉嗪美>蒙脱石散>酪酸梭菌组;降低VEGF含量的效果顺序为蒙脱石散组>酪酸梭菌组>美沙拉秦组。各组治疗效果美沙拉秦与蒙脱石散较好,差异有统计学意义(P<0.05),美沙拉嗪与蒙脱石散之间比较,疗效差异不明显。

表5 各组VEGF第12天的水平(pg/ml,n=8)Tab.5 VEGF level of each group after 12 days treatment(pg/ml,n=8)
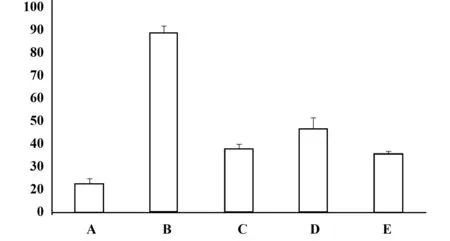
图5 各组VEGF第12天含量柱状图,浓度(pg/ml)Fig.5 VEGF level′s bar chart of each group after 12 days treatment(pg/ml)Note: Compared with group B,VEGF level of four intervention groups is decreased and most effective group is group E,followed by group C and group D after 12 days treatment.

表6 各组细胞因子第12天水平Tab.6 Cytokine level of each group at 12th ±s,pg/ml,n=8)
3 讨论
UC是一组以反复发作性腹痛、腹泻及黏液便和血便为主要特点的,病变范围主要在直肠和结肠的慢性炎症性疾病,迄今为止发病原因及致病机制仍不明确。目前国内外大多数学者认为,UC与某种遗传易感因素有关,并在遗传易感的基础上,在环境及肠道微生物作用下,肠道发生了一系列异常的免疫应答,从而引起的一种以直肠和结肠为主的慢性非特异性的炎症性病变。鉴于免疫因素占主导地位,故目前主要的研究的热点是UC中的各种免疫机制。
PGE2与溃疡性结肠炎前列腺素E2(Prostaglandin E2,PGE2)是花生四烯酸经过环氧酶催化而产生的一种重要的脂质代谢产物,它在许多炎性疾病的病灶中都有很高的表达,包括在溃疡性结肠炎中的表达[4]。近年来发现PGE2可以直接诱导和维持Th17相关的免疫反应,PGE2受体在肠道粘膜固有层单个核细胞上有所表达,而且,PGE2受体EP4在溃疡性结肠炎中,在CD4+的T淋巴细胞中是明显上调的[5]。本实验发现,TNBS/乙醇法诱导的UC大鼠血清PGE2的浓度较正常大鼠明显升高,提示PGE2是UC发病中高度表达的致炎因子。而美沙拉秦、酪酸梭菌、蒙脱石散对PGE2的表达显著下调,治疗后的病变结肠的病理改变也有所减轻。说明PGE2的含量与UC病变的严重程度成正相关。证实了PGE2在UC的发病过程中至关重要的作用。
LT-B4与溃疡性结肠炎白三烯最早在白细胞中发现,故而得名,是花生四烯酸经5-脂氧合酶代谢产物,研究证实,白三烯无论是免疫调节还是炎症趋化,都有很强的作用。白三烯由应答炎症的白细胞所释放,并能趋化白细胞,促进B淋巴细胞分化为浆细胞,从而分泌下一级的细胞因子,如组胺等,从而导致局部血管的通透性增强,水肿,分泌及渗出增多等。同时可以让白细胞活化,并让活化的白细胞黏附于炎症组织上,进一步加重炎症。许多研究都已经证实,很多免疫系统方面的疾病是由于体内T淋巴细胞亚群失衡所导致的,尤其是Th1/Th2淋巴细胞亚群的失衡,而LT-B4恰恰能加重这种失衡。LT-B4主要是通过BLT1受体加速Th2型免疫应答及Th2类细胞因子(IL-5、IL-13)的释放,从而导致体液免疫处在高反应状态,加重了Th1/Th2失衡的[6,7]。国外研究还发现,LT-B4可能参与了小鼠树突细胞的分化、成熟及活化过程,而这一过程,可以提高T淋巴细胞、NK细胞对靶器官的杀伤作用[8]。本实验中,造模后的大鼠血清LT-B4的浓度较正常大鼠明显升高,而经过美沙拉秦、酪酸梭菌、蒙脱石散治疗后,LT-B4均显著下降。说明LT-B4作为促炎因子与UC的发病高度相关,而炎症的修复是通过抑制LT-B4的产生来发挥作用的。
PAF与溃疡性结肠炎血小板活化因子(PAF)是花生四烯酸代谢相关的,内源性的,具有强大生物活性的一类细胞因子,它的化学成分为乙酰甘油醚磷酸胆碱,磷脂酶A2是它的限速酶。体内的PAF主要来自于血小板、嗜酸性粒细胞、嗜碱性粒细胞、巨噬细胞等。PAF的主要作用是活化血小板,促进血小板聚集,中性粒细胞趋化及脱颗粒,中性粒细胞呼吸爆发,从而收缩血管,增加血管的通透性,加剧炎症的发生。PAF是目前发现的最强的血小板聚集诱导剂[9]。PAF主要是通过与相应靶细胞膜上的PAF受体结合从而发挥作用。它可以引起血小板聚集,从而激活炎性细胞释放大量的前列腺素及组胺,白三烯类物质,使血管通透性进一步增强,局部水肿及渗出增加。研究表明,在UC患者身上,PAF可以活化血小板,而活化的血小板又刺激机体产生PAF,形成正反馈效应,导致局部血管通透性增加,血小板聚集,血液动力学改变,从而促进PG-E2,白三烯等致炎因子的释放,同时还可以上调白细胞黏附因子,趋化和锁定白细胞,导致局部的炎症进一步加重[10-11]。本研究中,模型组的血中PAF浓度显著高于生理盐水对照组,美沙拉秦组、酪酸梭菌组、蒙脱石散组血清PAF的表达明显下调而且低于模型组水平。表明PAF在UC炎症中发挥着重要作用。
VEGF与溃疡性结肠炎血管内皮生长因子(VEGF),或称血管通透性因子(VPF),最早在多种肿瘤细胞培养中被发现,它可以促进血管内皮细胞的分化增殖,同时增加血管的通透性[12]。它对血管内皮细胞增殖分化的机理,是由于它可以促进血管内皮细胞的有丝分裂,VEGF最先是从肿瘤细胞的分泌物中分离出来,现已证实它不仅在肿瘤血管生成,在其他的生理和病理以及血管生成中也是必不可少的诱导因子。UC病人肠黏膜组织中VEGF的转录水平和含量,都明显高于正常人。最近几年,国内外的研究,均发现在UC患者中,血清里VEGF的水平显著高于健康人群[13]。本研究发现,模型组VEGF的血清含量较正常组有所升高,治疗组的血清VEGF含量均有所下降,五组相比差异有统计学意义。能推测VEGF作为炎性细胞因子参与了UC的发病,而美沙拉秦、酪酸梭菌、蒙脱石散可能通过下调VEGF的表达来抑制UC的炎性反应。
PGE2、LT-B4、PAF、VEGF之间的相互作用:这四个细胞因子在本实验中,发现在模型组大鼠的血清里,均明显上调,与对照组相比,差异具有统计学意义。本文已对该四个因子导致UC的机理做了一定的阐述。那么,在国内外大量的研究也表明,这四个因子之间,在致炎的过程中,也是相互关联的[14]。
LT-B4作为一种炎性因子,它与支气管哮喘、类风湿性关节炎及炎性肠病等多种炎性疾病密切相关,它与PGE2同为花生四烯酸在两种酶系统催化下所生成的两类衍生物,环氧合酶合成前列腺素、前列环素及血栓烷A-2,这些化合物都具促炎及抗炎特性。脂氧合酶合成花生四烯酸的羟酸衍生物,其中LTB-4是最强有力的趋化因子。一旦炎症发生,前列腺素能够激活T淋巴细胞的介导作用,并能扩张血管,产生疼痛并导致血管通透性增加,而上述反应能正向反馈LT-B4的表达,使LT-B4的水平提高,而当LT-B4水平升高后,产生的下一级炎性因子,如组胺等,导致组织水肿,血管通透性进一步加强,分泌物增多,炎症加剧[15]。一旦LE-B4启动细胞因子风暴之后,同时会激活PAF,因PAF与LT-B4同是花生四烯酸代谢相关的内源性炎性因子,当LT-B4导致血管通透性增加,炎性反应加剧时,可以趋化炎性细胞,如嗜酸性粒细胞,嗜碱性粒细胞,巨噬细胞等,而PAF恰恰来自于这些细胞。随着这些细胞的趋化,聚集,患者炎性部位的PAF也随之升高,从而活化血小板,促进血小板聚集,中性粒细胞呼吸爆发,从而收缩血管,增加血管的通透性[16]。研究表明,PAF还可以通过诱导依赖NF-kB的各种血管新生因子的表达及蛋白质的合成,其中最重要的就是VEGF,而VEGF此刻的产生,加剧了血管通透性,且促进小血管的增生,导致局部的组织结构进一步混乱,微循环恶化,国内外实验表明,VEGF本应具有的保护性作用,在UC患者中并未体现出来[17]。故而,综上所述,上述四个炎性因子之间在UC的发病中,是相互关联,相互促进的,它们本身不但能够导致严重的组织炎症,同样还可以互相反馈促进表达及合成,导致炎症的进一步加剧,病情恶化。
美沙拉秦治疗UC的作用机制:美沙拉嗪较之传统的柳氮磺吡啶类制剂,具有疗效好,副作用小,患者耐受度高的特点,目前在临床中已经广泛的使用,多种研究都已证实,美沙拉嗪在治疗IBD尤其是溃疡性结肠炎方面,有非常明确的疗效[18]。
美沙拉嗪的作用主要在于,可以有效的抑制肠道上皮释放炎性细胞因子,如前列腺素、白三烯等,从而抑制炎症介导的黏膜损伤,对于那些已经被炎性损伤的肠道黏膜,效果更为明显[19]:①通过抑制结肠过氧化物酶以及黏膜释放前列腺素和白三烯;②可以抑制血小板活化因子的活性及巨噬细胞的迁移;③通过一系列抑酶作用,如抑制环氧化酶,脂氧化酶,血栓合成酶等,从而减少花生四烯酸产生;④可以有效的通过清除氧自由基的作用,来抑制肠道上皮脂肪酸的氧化;⑤可增强热休克蛋白表达;⑥可明显降低NOS活性,从而下降NO水平;⑦可通过PPARy通道,负反馈调节NF-κB表达,增加抑炎介质IL-10 的释放并减少促炎介质IL-2 的生成;⑧降低脂肪酸过氧化并组织T淋巴细胞促B细胞向浆细胞分化,从而减少抗体的分泌,局部降低体液免疫的应答,并能诱导肠黏膜组织内淋巴细胞的凋亡及降低肠黏膜组织内TNF-α与其受体的结合能力等[20]。
本研究证实,美沙拉秦对于UC的疗效显著。美沙拉秦明显降低了DAI评分,减轻了UC大鼠结肠的炎症改变,显著下调促炎细胞因子PGE2、LT-B4的表达,一定程度降低了促炎因子PAF及VEGF的血清含量;证实美沙拉嗪在治疗UC中的疗效是确切的。
益生菌治疗UC的作用机制:Fuller在1992年,把益生菌定义为[21]:通过饮食摄取的,能够维持人类正常肠道内微环境的微生物。在健康人类,消化道内大概有约100万亿的微生物,其中细菌的种类就多达500余种,这些有益的菌类包括双歧杆菌,大肠杆菌,粪链球菌,酪酸梭菌等。这些益生菌在人体内起着维持体内菌群平衡,维持正常肠道内微生物屏障,维护消化道免疫的重要作用。
在上述的益生菌中,酪酸梭菌(Clostridium butyricum,C.butyricum)的研究比较丰富,目前已知,酪酸梭菌除了维持正常肠内的菌群之外,还可以刺激Th1细胞亚群,促进和维持Treg/Th17淋巴细胞亚群的分化与增殖,从而起到非常强大的抑炎作用[22]。
有研究表明,在UC患者的肠道内,菌群失衡的情况非常明显。由于菌群失衡,导致局部有害菌的增值,激活了内源性的致炎通道,导致局部的炎症及溃疡经久不愈,且这些有害的病原菌可以产生大量的炎性趋化因子,使得炎症细胞浸润,并分泌大量的如前列腺素,白三烯等细胞因子,激活T淋巴细胞,B淋巴细胞,在细胞免疫和体液免疫的双重作用下,进一步使肠道上皮受损,炎症加重。故如果补充益生菌,对肠道的炎症减轻及修复,有明确的作用。
益生菌治疗UC的可能机制为:①肠道由于菌群的失调,导致炎症的发生,从而暴露了更多的肠道细胞在致病因素之下,而补充益生菌可以重建正常的菌群,维持并修复细胞骨架,加强细胞之间的紧密连接,从而使肠道的屏障功能得以恢复[23];②肠道菌群失调导致了肠道免疫的失衡,而补充益生菌可以下调巨噬细胞的活性,减缓炎性细胞的趋化和浸润,同时调节T淋巴细胞亚群,尤其是促进Th1细胞的活性,并调节Treg/Th17抑炎淋巴细胞亚群,从而起到减轻及改善炎症的作用;③由于益生菌的加入,直接改善了肠道菌群,优势的益生菌阻止其他致病菌的侵入,提高肠道上皮的完整性和黏附性,从而改善了肠道上皮的整体结构,起到了抗炎及促进溃疡面修复的作用[24]。
本研究中,经过酪酸梭菌治疗后,UC大鼠血清中的促炎因子PGE2、LTB4、PAF及VEGF不同程度地下降了,大鼠DAI评分及结肠组织病理改变也有所减轻,证实了酪酸梭菌可以有效的改善及治疗UC大鼠的结肠病损。
蒙脱石散治疗UC的作用机制:蒙脱石散的主要成分为[Si8Al4O20(OH)4],是一种双八面体的蒙脱石结构。这种由双四面体氧化硅与单八面体氧化铝组成的多层结构,具有非均匀性电荷分布,可以覆盖整个肠腔表面,并能维持长达近6 h。蒙脱石散在临床上较常用于腹泻及各种消化道炎症的治疗。在对儿童的急性及慢性腹泻的治疗中,其效果尤为显著。蒙脱石散可以清除病原微生物、保护黏膜屏障,这些作用在以往的研究中也早已被证实[25]。蒙脱石散是一个单纯物理收敛保护作用的制剂,不会被机体所吸收,所以此药即使长期服用,也几乎没有不良反应,患者有较好的耐受性及依从性。
蒙脱石散治疗溃疡性结肠炎的机制或为以下几点:①它均匀覆盖在肠腔表面,形成一层很好的黏膜保护剂,促进局部破溃的病灶愈合,并能形成防御屏障,抵抗病原微生物的侵入,很好的保护肠道上皮细胞[26];②蒙脱石散的双八面体结构,有很强的吸附作用,可以很好的吸附病原微生物,如细菌,病毒及致炎因子等,并将它们固定锁死,随着肠道的蠕动排出体外[27];③对肠细胞顶端和细胞间桥起保护作用,其机制可能为:通过增加黏液凝胶的黏弹性、内聚力及存在时间,使黏液屏障作用增强;可缓解空肠弯曲杆菌引起的黏膜组织病变,从而达到细胞间桥修复的作用,促使细胞连接更加紧密,从而避免了病原微生物入血而达到繁殖抑制的作用。通过减缓肠细胞的转变速度,增强肠细胞吸收功能;④蒙脱石散强有力的吸水性,可以吸附肠腔内大量的水分,锁死水分的流失,从而改善UC患者长期的腹泻症状,改善电解质紊乱[28]。
在本实验中发现,蒙脱石散可以通过下调UC大鼠促炎细胞因子PGE2、LTB4、PAF及VEGF,从而达到修复UC大鼠的结肠炎症的目的。对于PGE2的下调作用较为显著。而且蒙脱石散明显降低了DAI评分、减轻了结肠病理改变,提示蒙脱石散对UC的治疗效果较好。
总体上看,造模后的溃疡性结肠炎大鼠血清中的PGE2、LTB4、PAF、VEGF的含量较正常大鼠升高,而美沙拉秦、酪酸梭菌、蒙脱石散干预后,UC大鼠血清中的PGE2、LTB4、PAF、VEGF的含量与生理盐水组相比,均有不同程度的下降。相应地,三组大鼠的DAI评分及结肠组织病理改变较之生理盐水组也有所减轻。提示美沙拉秦、酪酸梭菌、蒙脱石散可能通过下调促炎细胞因子PGE2、LTB4、PAF、VEGF来减轻UC大鼠结肠的炎症反应。这与大多数相关的研究相吻合。
[1]Chow DK,Leong RW,Tsoi KK,etal.Long-term follow-up of ulcerative colitis in the Chinese population[J].Am J Gastroenterol,2009,104(3):647-654.
[2]Shim JO.Gut microbiota in inflammatory bowel disease[J].Pediatr Gastroenterol Hepatol Nutr,2013,16(1):17-21.
[3]邓长生,张明.炎症性肠炎与免疫[M].北京:人民卫生出版社,2006:51-86.
[4]王秀珍,毛颖,张喆,等.四神丸对溃疡性结肠炎大鼠血清IL-2、IL-4、IL-8影响的实验研究[J].中医药学报,2013,41(3):105-107 .
[5]Lejeune M1,Leung P,Beck PL,etal.Role of EP4 receptor and prostaglandin transporter in prostaglandin E2-induced alteration in colonic epithelial barrier integrity[J].Am J Physiol Gastrointest Liver Physiol,2010,299(5):G1097-G1105.
[6]Barrie A1,Khare A,Henkel M,etal.Prostaglandin E2 and IL-23 plus IL-1β differentially regulate the Th1/Th17 immune response of human CD161(+)CD4(+)memory T cells[J].Clin Transl Sci,2011,4(4):268-273.
[7]Abdel-Aziz H,Wadie W,Abdallah DM,etal.Novel effects of ectoine,a bacteria-derived natural tetrahydropyrimidine,in experimental colitis[J].Phytomedicine,2013,20(7):585-591.
[8]Kanjwal K,Karabin B,Kanjwal Y,etal.Autonomic dysfunction presenting as postural orthostatic tachycardia syndrome in patients with multiple sclerosis[J].Int J Med Sci,2010,7:62-67.
[9]Inada T,Ueshima H,Shingu K.Intravenous anesthetic propofol suppresses leukotriene production in murine dendritic cells[J].Immunotoxicol,2013,10(3):262-269.
[10]陈友岱,周总光.血小板活化因子与局部微循环障碍[J].中国微循环,2001,5(3):241-243.
[11]刘建军,王吉耀.血小板激活因子与炎症性肠病[J].胃肠病学和肝病学杂志,1999,8(2):92-93.
[12]Habibi I,Sfar I,Chebil A,etal.Vascular endothelial growth factor genetic polymorphisms and susceptibility to age-related macular degeneration in Tunisian population[J].Biomark Res,2014,2:15.
[13]Wierr Wiercinska-Drapalo A,Jaroszewicz J,Parfieniuk A,etal.Pigment epithelium-derived factor in ulcerative colitis:possible relationship with disease activity[J].Regul Pept,2007,140(1-2):1-4.
[14]Neurath MF.Cytokines in inflammatory bowel disease[J].Nat Rev Immunol,2014,14(5):329-342.
[15]Francescone R,Hou V,Grivennikov SI,etal.Cytokines,IBD,and colitis-associated cancer[J],Inflamm Bowel Dis,2015,21(2):409-418.
[16]Das UN.Inflammatory bowel disease as a disorder of an imbalance between pro-and anti-inflammatory molecules and deficiency of resolution bioactive lipids[J].Lipids Health Dis,2016,15(11):151-157.
[17]姜东升,张晶,荣珍,等.VEGF在溃疡性结肠炎患者中的表达水平及其临床意义[J].临床消化病杂志,2010,22(1):25-27.
[18]袁晓虹.美沙拉秦和柳氮磺胺吡啶治疗溃疡性结肠炎的疗效对比研究[J].中国医学创新,2012,9(2):25-26.
[19]段文志,黄祖仟,曹秋锐,等.美沙拉嗪肠溶片治疗肠易激综合征 50 例临床效果分析[J].当代医学,2013,19(17):134-135.
[20]莫好红.美沙拉嗪肠溶片与水杨酸柳氮磺胺嘧啶肠溶片治疗溃疡性结肠炎的疗效观察[J].医学理论与实践,2013,26(13):1729-1731.
[21]Quwehand AC,Derrien M,De Vos W,etal.Prebiotics and other microbial substrates for gut functionality[J].Curr Opin Biotechnol,2005,16(2):212-217.
[22]Huamc,Linty,Laimw,etal.Probiotic Bio-three induces Th1 and anti-inflammatory effects in PBMC and dendritic cells[J].Word J Gastroenterol,2010,16(28):3529-3540.
[23]Darfeuille-Michaud A,Boudeau J,Bulois P,etal.High prevalence of adherent-invasive Escherichia coli associated with ileal mucosa in Crohn′s disease[J].Gastroenterology,2004,127(2):412-421.
[24]Kalliomaki M,Sal minen S,Arvilommi H,etal.Probiotics in primary prevention of aropic disease:randomised placebo-controlled trial see comment[J].Lancet,2001,357(9296):1076-1079.
[25]Yao-zong Y,Shi-rong L,Delvaux M.Comparative efficacy of dioctahedral smectite(Smecta)and a probiotic preparation in chronic functional[J].Diq Liver Dis,2004,36(12):824-828.
[26]Chernenko VV,Kharchenko NV.Cytoprotective properties of smecta on the intestinal mucosa of the alimentary canal[J].Lik Sprava,2001(5-6):164-166.
[27]任敏,高剑峰,周好田.关于思密达的药理作用的研究[J].中国中医药咨讯,2009,1(6):85.
[28]Khediri F,Mrad AL,Azzouz M,etal.Efficacy of diosmectite(smecta)in the treatment of acute watery diarrhoea in adults:a multicentre,randomized,double-blind,placebo-controlled,parallel group study[J].Gastroenterol Res Pract,2011,2011:783196.
[收稿2015-12-02修回2016-01-28]
(编辑许四平)
Impacts of mesalazine,clostridium and montmorillonite powder on plasma PG-E2,LT-B4,PAF and VEGF in rats with ulcerative colitis
HE Shan,LIU Kai,HUANG Yong-Kun.Department of Pediatrics,the First Affiliated Hospital of Kunming Medical College,Kunming 650000,China
Objective:To investigate the Prostaglandin E2(PG-E2),Leukotrienes B4(LT-B4)、Platelet activating factor(PAF) and vascular endothelial growth factor(VEGF) levels in the model of UC rats serum,and the changes after the Mesalazine,clostridium,and montmorillonite powder treatment intervention,in order to understand the significance of the four inflammatory factors in UC rats and the interference effect of the above three drugs on the four inflammatory cytokines.Methods: 100 rats were randomly divided into normal group(A),model group(B),Mesalazine group(C),clostridium group(D)and montmorillonite group(E),The levels of the plasma PG-E2,LT-B4,PAF and VEGF were measured by ELISA.The different changes of the four cytokines were compared in the different groups.Results: ①The scores of DAI and the levels of the plasma PGE2,LTB4,PAF and VEGF in the B,C,D and E group were higher than ones in A group(P<0.05).②Compared B group,the scores of DAI and the levels of plasma PGE2,LT-B4,PAF and VEGF in B,C,D and E group were lower(P<0.05).③Compared the efficacy among mesalazine,clostridium and montmorillonite powdergot treating UC,mesalazine and montmorillonite powder got the best results(P<0.05).The efficacy between mesalazine and montmorillonite was similar.Conclusion: ①The PGE2,LT-B4,PAF and VEGF are very active higher in the blood of rats with UC and have a positive correlation with inflammation.②Mesalazine,clostridium and montmorillonite powder may renovate the damage of inflammatory tissues of rats with UC,and relieve the symptoms of inflammation,and also shorten the duration of inflammation by reducing exudation of proinflammatory cytokines PGE2,LTB4,PAF and VEGF.
Mesalazine;Clostridium;Montmorillonite powder;Ulcerative colitis;Rats;Cytokines
10.3969/j.issn.1000-484X.2016.08.029
R547文献标志码A
1000-484X(2016)08-1212-07
何山(1979年-),男,硕士,主治医师,主要从事儿科临床的诊疗、教学及科研研究。
及指导教师:黄永坤(1961年-),男,硕士,教授,博士生导师,主要从事小儿消化系统与营养、感染与免疫疾病的诊治和研究,E-mail:13577097854@163.com。

