夏天无注射液参与脑缺血再灌注大鼠神经保护的NF-κB介导机制①
徐祖才 张莎莎 梁 涛 王 静 彭 燕 张 骏
(遵义医学院附属医院神经内科,遵义563003)
夏天无注射液参与脑缺血再灌注大鼠神经保护的NF-κB介导机制①
徐祖才张莎莎②梁涛王静③彭燕张骏
(遵义医学院附属医院神经内科,遵义563003)
①本文为国家自然科学基金项目(81460191)及贵州省科学技术基金(黔科合J字[2011]2270)。
②共同第一作者,滨州医学院附属医院 健康体检管理部,滨州256603。
③遵义医学院附属医院神经内科 预防保健科,遵义563003。
目的:探讨夏天无注射液参与脑缺血再灌注大鼠神经保护的NF-κB介导机制。方法:随机将雄性SD大鼠分为假手术组、模型组、夏天无注射液1.0 ml/kg的低剂量组、2.5 ml/kg的中剂量组、5 ml/kg的高剂量组及NF-κB抑制剂(BAY11-7082)组。脑缺血再灌注24 h后,2,3,5氯化三苯基四唑(TTC)染色检测各组大鼠脑梗死重量百分比;免疫组织化学技术及Western blot技术检测各组的磷酸化NF-κB表达变化。结果:TTC发现:不同剂量的夏天无注射液及BAY可以减轻脑梗死的总量,其中,高剂量组、中剂量组及抑制剂组之间效果无差异,但三者效果均较低剂量组明显;免疫组化发现:主要在模型组中的海马CA1区细胞核中发现磷酸化NF-κB 表达,而CA3区的表达量较少。Western blot检测发现:不同剂量的夏天无注射液可以模拟BAY11-7082的作用,降低磷酸化NF-κB蛋白的表达量。结论:夏天无注射液可能减轻大鼠脑缺血再灌注后梗死程度,其机制可能是通过抑制NF-κB的过度磷酸化。
夏天无注射液;脑缺血再灌注;NF-κB;神经保护
卒中是全球范围内导致死亡的第二大常见疾病,约占11.9%,平均每年约670万人死于卒中,其中缺血性脑卒中约占80%~90%[1]。与缺血性卒中相关的研究不乏提示炎症相关因子的重要作用[2]。氧糖剥夺所引起的缺血中心区神经细胞死亡,造成神经损伤,而炎症主要导致缺血半暗带神经细胞死亡[3]。炎症细胞的产生及炎症因子的释放进一步加重神经细胞损伤及增加梗死面积[4]。NF-κB(Nuclear factor kappa-light-chain-enhancer of activat-ed B cells)广泛存在于真核细胞内,其在B淋巴细胞中检测到,对多种基因转录进行调控[5,6]。NF-κB是炎症反应中一种重要的蛋白复合物,它可以被许多炎性分子激活,进而启动炎性细胞因子的表达及细胞凋亡,且与脑损伤相关[7],注射用夏天无总碱对大鼠局灶性脑缺血损伤具有治疗作用,其机制可能与保护神经元、抗神经元凋亡以及调控突触可塑性有关[8]。随着对脑缺血再灌注损伤及夏天无研究的研究,抗炎治疗能否成为治疗缺血性脑损伤的靶点,越来越受到关注。本研究拟通过造模后肌肉注射夏天无注射液及尾静脉注射NF-κB抑制剂BAY 11-7082[9],通过对脑梗死的重量的测定,免疫组化及免疫印迹对NF-κB进行检测,揭示夏天无注射液对缺血再灌注脑损伤所起到的神经保护作用及其发生机制。
1 材料与方法
1.1实验相关试剂江西天施康提供夏天无注射液,从碧云天生物技术公司购买BAY 11-7082,自基因科技上海有限公司购买抗鼠/兔通用型免疫组化检测试剂盒,自美国Sigma公司购买抗兔和抗小鼠IgG-HRP以及三羟甲基氨基甲烷(Tris)、牛血清白蛋白(BSA)和G-250考马斯亮蓝等Western blot所需试剂,自美国Santa公司购买兔抗磷酸化NF-κB抗体及小鼠抗β-actin抗体一抗。
1.2方法
1.2.1脑缺血再灌注大鼠模型制备及分组腹腔注射3.5 ml/kg的10%的水合氯醛进行麻醉,将四肢和头部予以固定,对颈部备皮,行2.0 cm左右的正中切口,先后分离出右颈总动脉(Common carotid artery,CCA)、颈外动脉(External carotid artery,ECA)及颈内动脉(Internal carotid artery,ICA),结扎ECA近心端,在颈总动脉分叉处约4 mm 处开小口,把MCAO栓线圆头端经CCA进入ICA,直至遇阻力停止,均入线长约18~20 mm,对颈内动脉结扎,缝合手术处,将栓线留置切口外以便拔除。栓塞2 h后将栓线头端拉至颈内、外动脉分叉处,即可再灌注,进行评分,评分标准如下:0分,无神经损害症状;1分,左侧前爪不能完全伸展;2分,向左侧转圈;3分,行走时向左侧倾倒;4分,不能自发行走。评分>2分,即认为造模成功,纳入正式实验。假手术组处理步骤同上,但MCAO栓线进线深度限于10 mm,不阻塞大脑中动脉血流。随机选择清洁级SD雄性大鼠60只(250~300 g),购于第三军医大学大坪医院实验动物中心[许可证号:SCXK(渝)2007-0005]。随机分为模型组,假手术、夏天无注射液1.0 ml/kg的低剂量组、2.5 ml/kg的中剂量组、5 ml/kg的高剂量组及NF-κB抑制剂BAY 11-7082(10 mg/kg)组,尾静脉注射,各组大鼠均在缺血再灌注前0.5 h用药(各组大鼠n=5)。
1.2.2TTC检测不同组大鼠脑梗死体积变化缺血再灌注后24 h,断头取脑后,迅速将组织放入-20℃冰箱,15 min后取出,用手术刀片沿冠状面自前向后于脑前极与视交叉连线中点处、视交叉处.漏斗柄部、漏斗柄与后叶尾极之间将脑组织均匀切为5等份,将脑片置于1%的TTC(2,3,5-氯化三苯基四氮唑)中,避光孵育 30 min(37℃),10 min后翻面。染色后正常脑组织呈现红色,呈苍白色的为梗死脑组织,其间界限分明。0%甲醛避光固定,24 h后取出,依次排列后拍照,后分离苍白色的梗死区和红色的非梗死区,后再称重[梗死重量百分比计算法如下:梗死重量百分比(%)=苍白区重量/全脑重量×100%]。
1.2.3取材切片及免疫组化脑缺血再灌注24 h后,将大鼠麻醉固定,迅速开胸,将心脏暴露,由左心室插入透灌针至主动脉,剪开右心耳,先用生理盐水灌注冲洗,当流出的液透亮,改用4%多聚甲醛灌流固定,直至大鼠颈部僵硬,断头取脑,并迅速将脑组织在4%多聚甲醛中固定过夜,后进行石蜡包埋,切片。组化前,现对切片常规脱蜡水化,3%H2O2室温避光孵育10 min,滴加磷酸化NF-κB一抗(1:200,阴性对照使用PBS),4℃过夜,滴加二抗(37℃孵育30 min),清洗后滴加DAB显色,苏木素复染,梯度酒精脱水,Leica光学显微镜观察免疫组化结果,拍照记录。
1.2.4Western blot取海马组织匀浆,加入裂解液(含PMSF,pH7.4)后离心。将上清加入RIPA(含蛋白酶抑制剂)稀释蛋白沉淀,分装并冻存于-80℃冰箱。按BCA 法,定量至5 μg/ μl,加入等量×2上样缓冲液,置于沸水中煮沸变性(约5~10 min),于-20℃冰箱冻存备用。磷酸化NF-κB蛋白测定:等量蛋白样品(每个泳道20 μl)经10%SDS-聚丙烯酸胺凝胶电泳(SDS-PAGE)分离后,以湿转法电转移到PVDF 膜上。将已转膜凝胶置于考马斯亮蓝染液(约30 min),脱色液予以洗涤,测凝胶内蛋白是否转移完全,后将PVDF 膜置于封闭液内(37℃,约1.5 h),再加稀释好的一抗磷酸化NF-kB(1∶5 000),4 ℃冰箱中过夜,再用TBST液洗膜,加人二抗(抗兔IgG-HRP,1∶5 000),(37℃,孵育约1 h),后洗膜,再用BeyoECL Plus显色,胶片曝光显影,所得结果使用Quantity one进行分析。
2 结果
2.1不同剂量的ICDP均可减轻脑缺血再灌注大鼠脑梗死程度 TTC结果发现(图1、2及表1):假手术组中未见明显脑梗死灶;模型组中,大鼠脑梗死程度较重(20.34±1.29),然而,高(8.08±1.36)、中(8.57±1.49)和低(13.44±0.99)剂量的ICD及NF-κB 的抑制剂BAY 11-7082(8.64±1.49)均可使得相应组别大鼠脑梗死程度减轻。
2.2免疫组化检测不同剂量ICDP对脑缺血再灌注大鼠脑海马组织磷酸化NF-κB影响如图3所示(×400),磷酸化NF-κB主要表达在细胞胞核中,在胞浆中表达量较少,主要表达部位在大鼠脑海马组织的CA1区,而少量在CA3区,并且,在模型组中表达最为明显,而在假手术组、不同剂量ICDP干预组及BAY 11-7082组中细胞核中表达不明显。

图1 脑缺血后脑组织切片TTC染色Fig.1 TTC staining of brain sections after cerebral infarctionNote: A.Model group;B.Sham surgery group;C.ICDP-H(5 ml/kg) group;D.ICDP-M( 2.5 ml/kg) group;E.ICDP-L(1 ml/kg) group;F.BAY 11-7082(10 mg/kg) group.

图2 不同剂量ICDP对大鼠脑缺血再灌注脑梗死重量的影响±s,n=5)Fig.2 Effect of ICDP on brain infarct weight in ischemia-reperfusion injury of rat ±s,n=5)Note: *.P<0.05.
2.3ICDP对脑缺血再灌注大鼠脑组织 NF-κB蛋白印迹的检测Western blot检测结果表明,假手术组可少量表达NF-κB蛋白(0.30±0.03);与模型组比较(1.05±0.05),夏天无高(0.57±0.02)、中(0.59±0.03)、低(0.62±0.03)剂量组及BAY 11-7082组(0.42±0.01)蛋白表达明显减少(P<0.01)(图4及表2)。
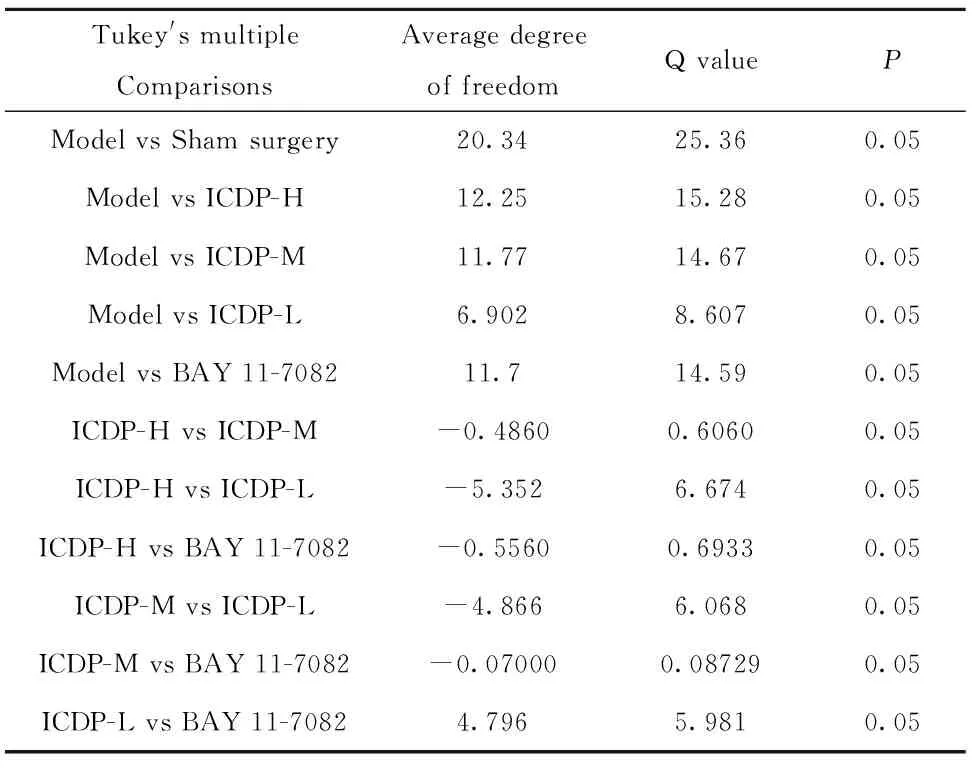
表1 不同组别大鼠脑缺血再灌注脑梗死重量重复测量方差分析结果Tab.1 ANOVA for repeated measurements in brain infarct weight after ischemia-reperfusion in different groups
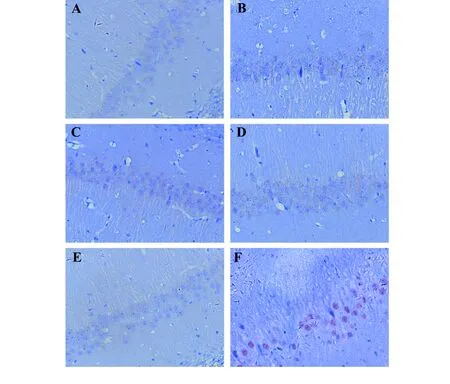
图3 ICDP对大鼠脑缺血再灌注损伤脑组织磷酸化NF-κB p65表达的影响Fig.3 Effect of ICDP on expression of phosphorylated NF-κB p65 in ischemia-reperfusion injury of rat brainNote: A.BAY 11-7082(10 mg/kg) group;B.ICDP-L(1 ml/kg) group;C.ICDP-M( 2.5 ml/kg) group;D.ICDP-H(5 ml/kg) group;E.Sham surgery group;F.Model group.
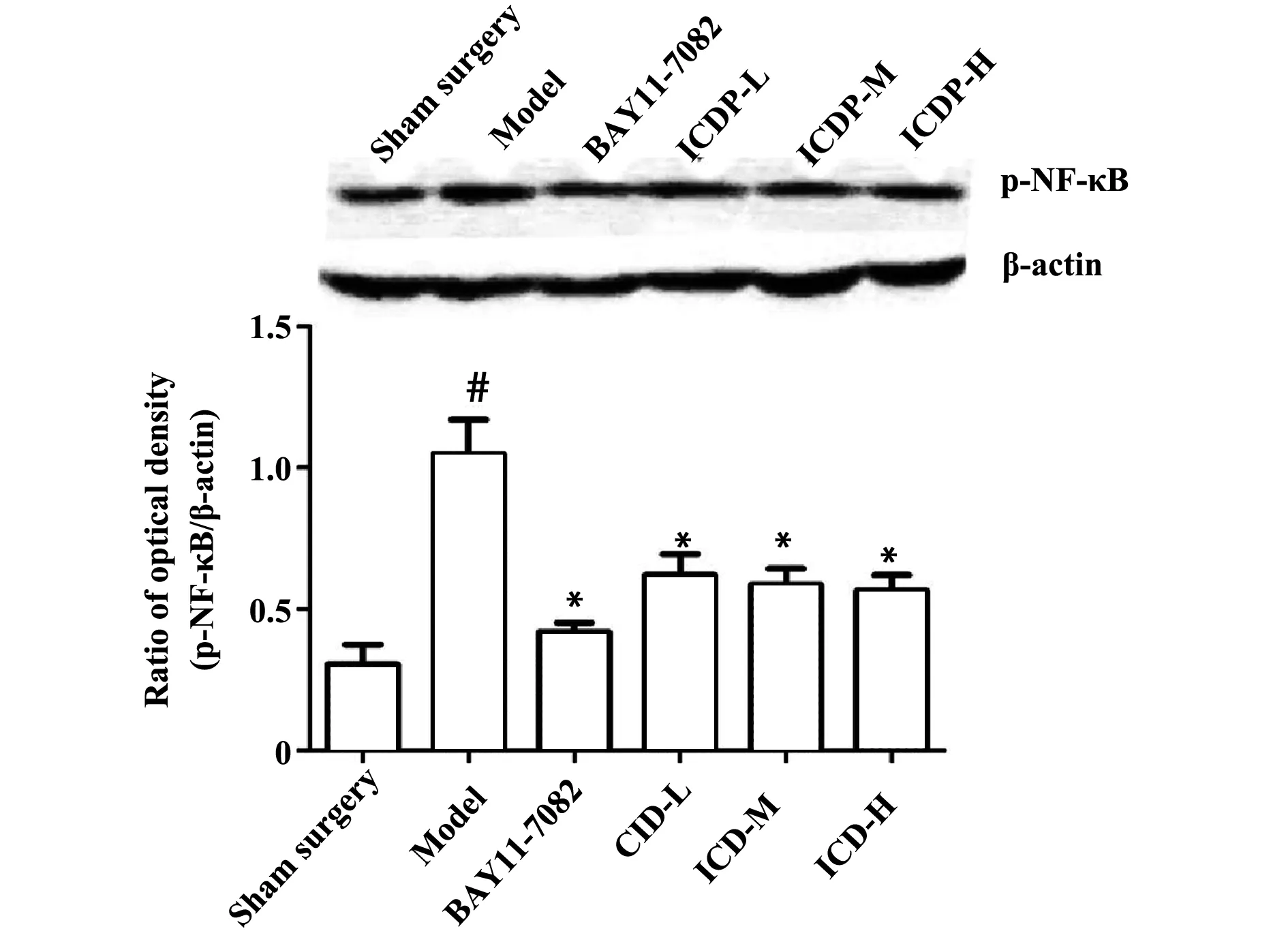
图4 ICDP对缺血再灌注大鼠脑组织p-NF-κB表达的影响Fig.4 Effect of ICDP at expression of p-NF-κB in ischemia-reperfusion injury of rat ±s,n=5 )Note: *.P<0.05;#.P<0.05.

表2 不同组别大鼠脑缺血再灌注后脑组织p-NF-κB重复测量方差分析结果Tab.2 ANOVA for repeated measurements in expression of p-NF-κB in ischemia-reperfusion injury in different groups
3 讨论
本实验所用模型可模拟人脑缺血再灌注损伤过程,选用ICDP进行中药治疗,并以NF-κB信号通路的特异性抑制剂BAY11-7082为对照,从大鼠脑梗死体积及NF-κB磷酸化水平的变化,来检测ICDP的疗效。脑组织缺血后造成损伤的因素较多,可以表现为兴奋性氨基酸毒性作用、钙超载、自由基反应、炎症和细胞凋亡[10,11]。本实验结果对于对夏天无注射液对脑缺血再灌注后神经保护机制的研究具有重大意义。其中TTC染色可清晰、直观的显示脑组织的梗死区域,且发现了ICDP各剂量组同BAY 11-7082组一样,可使得大鼠脑梗死体积缩小。其结果表明ICDP可以显著减轻大鼠缺血再灌注后脑损伤,具有神经保护作用,其机制可能与NF-κB信号通路相关。
已有研究表明NF-κB对参与了缺血性脑卒中损伤[12]。NF-κB包含 IκB 依赖性的经典和非经典途径[13]。当感受到各种细胞内外因素时,IκB激酶活化,继而磷酸化及泛素化,并释放出多个NF-κB二聚体,消除了IκB的抑制作用[14,15]。具核定位功能的p50协助RelA(p65)核转移,继而翻译及修饰,NF-κB二聚体进一步活化,与目的基因及特定DNA序列结合,调控靶基因的转录[16]。Bay11-7082可通过抑制IkB磷酸化,而抑制NF-κB的活化,从而发挥其生物学效能[17]。本实Western blot结果发现Bay11-7082和ICDP各剂量组均可明显抑制NF-κB磷酸化。免疫组化发现磷酸化NF-κB主要在胞核中表达,而ICDP及Bay11-7082均抑制了磷酸化NF-κB 的核转移。
NF-κB信号通路与甲状腺癌及血液系统相关疾病之间具有相关性,并且,其BAY 11-7082能有效抑制碘131诱导的NF-κB相关的细胞凋亡,且能改变血小板的形状及其播散状态,从而起到相应的疗效[18]。通过本实验也发现,抑制过度磷酸化的NF-κB可以较好地保护缺血再灌注后脑组织的损伤,因此,本研究为寻求脑缺血后再灌注损伤的临床治疗新策略提供了实验基础。
[1]Go AS,Mozaffarian D,Roger VL,etal.Executive summary:Heart disease and stroke statistics--2013 update:A report from the american heart association [J].Circulation,2013,127(1):143-152.
[2]Ahmad M,Graham SH.Inflammation after stroke:Mechanisms and therapeutic approaches [J].Translational Stroke Res,2010,1(2):74-84.
[3]Candelario-Jalil E.Injury and repair mechanisms in ischemic stroke:Considerations for the development of novel neuroth-erapeutics [J].Curr Opin Investig Drugs(London,England :2000),2009,10(7):644-654.
[4]Macrez R,Ali C,Toutirais O,etal.Stroke and the immune system:From pathophysiology to new therapeutic strategies [J].Lancet Neurol,2011,10(5):471-480.
[5]van der Kooij MA,Nijboer CH,Ohl F,etal.Nf-kappab inhibition after neonatal cerebral hypoxia-ischemia improves long-term motor and cognitive outcome in rats [J].Neurobiol Disease,2010,38(2):266-272.
[6]Fan H,Li L,Zhang X,etal.Oxymatrine downregulates tlr4,tlr2,myd88,and nf-kappab and protects rat brains against focal ischemia [J].Mediators of inflammation,2009,2009:704-706.
[7]Dabek J,Kulach A,Gasior Z.Nuclear factor kappa-light-chain-enhancer of activated b cells(nf-kappab):A new potential therapeutic target in atherosclerosis? [J].Pharmacological reports,2010,62(5):778-783.
[8]姚丽梅,刘瑶,段启.注射用夏天无总碱对大鼠局灶性脑缺血的影响 [J].中成药,2011,33(5):872-874.
[9]Alvira CM,Abate A,Yang G,etal.Nuclear factor-kappab activation in neonatal mouse lung protects against lipopolysacc-haride-induced inflammation [J].Am J Respiratory Critical Care Med,2007,175(8):805-815.
[10]Zador Z,Benyo Z,Lacza Z,etal.[Neuroprotection in brain ischemia-doubts and hopes][J].Ideggyogyaszati szemle,2004,57(3-4):81-93.
[11]Fagan SC,Hess DC,Machado LS,etal.Tactics for vascular protection after acute ischemic stroke [J].Pharmacotherapy,2005,25(3):387-395.
[12]Harari OA,Liao JK.Nf-kappab and innate immunity in ischemic stroke [J].Annals NY Acad Sci,2010,1207:32-40.
[13]Tamatani M,Che YH,Matsuzaki H,etal.Tumor necrosis factor induces bcl-2 and bcl-x expression through nfkappab activation in primary hippocampal neurons [J].J biological chem,1999,274(13):8531-8538.
[14]Saji C,Higashi C,Niinaka Y,etal.Proteasome inhibitors induce apoptosis and reduce viral replication in primary effusion lymphoma cells [J].Biochemical Biophysical Res Communications,2011,415(4):573-578.
[15]Spinelli SL,Casey AE,Pollock SJ,etal.Platelets and megakaryocytes contain functional nuclear factor-kappab [J].Arterioscle Thromb Vasc Biol,2010,30(3):591-598.
[16]Pfeffer LM.The role of nuclear factor kappab in the interferon response [J].J Interferon Cytokine Res,2011,31(7):553-559.
[17]Ma W,Dumont Y,Vercauteren F,etal.Lipopolysaccharide induces calcitonin gene-related peptide in the raw264.7 macrophage cell line [J].Immunology,2010,130(3):399-409.
[18]Meng Z,Lou S,Tan J,etal.Nuclear factor-kappa b inhibition can enhance apoptosis of differentiated thyroid cancer cells induced by 131Ⅰ[J].PloS One,2012,7(3):e33597.
[收稿2016-01-25修回2016-04-21]
(编辑许四平)
Study of mechanism on NF-κB mediates injection coryadlis decumbens pers participated in neuroprotection after ischemia reperfusion of rats
XU Zu-Cai,ZHANG Sha-Sha,LIANG Tao,WANG Jing,PENG Yan,ZHANG Jun.Department of Neurology,Affiliated Hospital of Zunyi Medical College,Zunyi 563003,China
Objective:To investigate themechanism on NF-κB mediates the injection coryadlis decumbens pers(ICDP) participated in neuroprotection after ischemia reperfusion of rats.Methods: The SD rats were rando mly divided into several groups as follows:Sham operation group,Model group,1.0 ml/kg ICDP group(Low-dose,ICDP-L),2.5 ml/kg ICDP group(Middle-dose,ICDP-M),5 ml/kg ICDP group(High-dose,ICDP-H),and NF-κB inhibitor group(BAY11-7082).24 h after anesthetize,the volume of infarct sections in different groups were detected by TCC staining,and the phosphorylated NF-κB expression in rats brain was observed by immunohistochemistry and Western blot.Results: The TTC staining showed that different concentration of ICDP and BAY11-7082 could reduce the brain infarction volume significantly.There was no significant different effect among the ICDP-H group,ICDP-M group and inhibitor group,however,the effect in these three groups was more effective than that in the ICDP-M group.In addition,the results of immunohistochemistry indicated that phosphorylated NF-κB p65 expressed in brain tissue located mainly at the nucleus neuronal cells in the CA1 region of hippocampusin model rats,and the expression of phosphorylated NF-κB were significantly reduced inICDP groups and BAY11-7082 group.Conclusion: The ICDP can reduce brain infarct volume after ischemia reperfusion of rats.The neuralprotection mechanism of ICDP may relative toinhibits thehyperphosphorylation of NF-κB.
Injection coryadlis decumbens pers;Cerebral ischemia reperfusion;NF-κB;Neuroprotection
10.3969/j.issn.1000-484X.2016.08.023
R743.3文献标志码A
1000-484X(2016)08-1187-05
徐祖才(1981年-),男,博士,副主任医师,主要从事脑血管病及癫痫发病机制研究。
及指导教师:张骏(1964年-),男,主任医师,主要从事脑血管病机制研究,E-mail:zyzj8586@163.com。

