乙型肝炎病毒蛋白诱导白细胞介素32表达情况的研究
张晶晶,谢永富,胡建峰,刘会晶,孙宏勋(河北医科大学第三医院 检验科,河北 石家庄 050051)
乙型肝炎病毒蛋白诱导白细胞介素32表达情况的研究
张晶晶,谢永富,胡建峰,刘会晶,孙宏勋
(河北医科大学第三医院 检验科,河北 石家庄 050051)
目的探讨乙型肝炎病毒蛋白诱导白细胞介素32(IL-32)的表达以及临床意义。方法用Lipofectamine 2000TM介导转染HepG2细胞。转染48 h后,采用聚合酶链反应(RT-PCR),蛋白免疫印迹法(Western blot)分别检测HepG2细胞中IL-32的mRNA及蛋白的表达量。结果RT-PCR结果显示转染HBV的HepG2细胞中IL-32 mRNA的表达量比转染空载体(未转染)的细胞中IL-32 mRNA高2.3倍;Western blot结果显示与空载体转染的HepG2细胞比较,转染pIRES2-HBV-EGFP的HepG2细胞中IL-32蛋白质表达增高,且差异有统计学意义(P<0.05)。结论HBV促进IL-32蛋白的表达,从而证实乙型肝炎的严重程度与IL-32的表达有关。
乙型肝炎病毒蛋白;IL-32;表达;研究
乙型肝炎病毒(hepatitis B virus,HBV)感染是目前严重威胁人类健康的病毒之一。HBV感染肝细胞后不仅极易引起急性肝炎、慢性肝炎和肝硬化等疾病,而且还会提高肝癌的发生率[1]。HBV感染宿主后,正常的免疫应答可以清除乙肝病毒,表现为急性一过性的感染。若是细胞免疫功能低下或紊乱者,则无法清除乙肝病毒,最终将成为慢性感染者[2]。白细胞介素32(Interleukin,IL-32)是一种重要的炎症因子,主要经免疫细胞表达,IL-32为促炎因子。IL-32在丙型肝炎病毒、人乳头状瘤病毒引起的炎症性疾病中发挥重要作用[3-4]。IL-32是否参与乙型病毒性肝炎的发病,国内外研究甚少,本研究在分子生化水平对HBV是否诱导IL-32的表达进行初步探索。
1 材料与方法
1.1实验材料
细胞株:人肝癌细胞株HepG2细胞(购自北京协和技术所细胞库),主要试剂:主要试剂及来源见表1。
1.2实验方法
1.2.1细胞培养HepG2细胞培养在含10%胎牛血清、10%青链双抗的DMEM培养基中,于37℃、5%二氧化碳CO2条件下培养,待贴壁细胞处于生长期时进行传代。
1.2.2质粒转染细胞用脂质体 Lipofectamine 2000TM介导转染,在转染前1 d换用不含双抗的培养液,调整HepG2细胞浓度为1×105个/rat,将其接种于24孔板中,每孔1 ml。用OPTI-MEM稀释质粒和脂质体,当细胞贴壁密度达到90%融合时,把质粒、脂质体混合物加至细胞中。转染6 h后更换培养液为含双抗的培养液,第2天荧光下观察转染率达50%。
1.2.3RT-PCR检测HBV转染IL-32 mRNA的表达量将上述细胞培养48 h后,除去培养液,用PBS(phosphate-buffered saline,PBS)洗2次,然后加入Trizol。按试剂盒说明提取总RNA。采用分光光度法(A260/280 nm值)检测每一个RNA样本的质量。利用反转录试剂盒对总RNA进行逆转录。采用SYBR GreenⅠ染料法对IL-32基因的表达量进行检测,反应体系为25μl:2×Power SYBR Green PCR Master Mix(Applied Bio-system)10μl,10μmol/L的正反向引物各加1μl,模板为总RNA逆转录所得的cDNA,用灭菌双蒸水补足至25μl。各处理组分别做3~4个平行样品,每个样品再分别平行做3个重复。各个样品的反应条件为:95℃、3 min,40个循环:95℃、15 s,60℃、45 s;60℃延伸步骤进行荧光信号的采集。反应结束后,收集本反应体系的融解曲线,以此分析PCR产物的特异性。目的基因相对表达量分析方法采用 2-△△CT法计算。IL-32引物参照KOBAYASHI等[5]:正向引物5'-CGACTTCAAAGAGG GCTACC-3',反向引物5'-GAGTGAGCTCTGGGTGC TG-3';β-actin引物:正向引物5'-TCGTCCACCGCA AATGCTTCTAG-3',反向引物5'-ACTGCTGTCACCT FCACCGTTCC-3',采用双△t法计算结果。
1.2.4蛋白免疫印迹法(Western blot)检测HBV转染IL-32蛋白的表达量影响收集未转染以及转染48 h的细胞,冲洗2次,置放射免疫沉淀分析缓冲液中萃取蛋白,置冰上30 min。采用超声匀浆器处理标本,用未转染细胞做对照,采用Lowry法测定蛋白浓度。采用10%SDS-PAGE(150 V,2 h)分离蛋白,并转到硝酸纤维膜上,用5%的牛血清白蛋白封闭1 h,加1∶2 000的Mouse anti-IL-32单抗孵育过夜,第2天,冲洗掉一抗,在用1∶5 000的辣根过氧化酶结合的Goat anti-mouse IgG孵育1 h。采用增强化学发光法检测蛋白质。Mouse-anti-β-actin单克隆抗体作为内对照。

表1 试剂列表
1.3统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1HBV对IL-32 mRNA的表达量的影响
实时荧光定量PCR结果显示,转染HBV 48 h后的HepG2细胞,比转染空载体(未转染)的细胞中的IL-32 mRNA表达量高2.3倍(见图1,2和表2),并且溶解曲线显示IL-32,以及β-actin的引物特异性良好,进一步显示数据具有可靠性。
结果可见,通过对未转染细胞和转染细胞中βactin统计分析可以看出,β-actin表达在两组比较差异无统计学意义,而对未转染细胞和转染细胞中RNA IL-32 mRNA的含量可以看出未转染细胞RNA IL-32 mRNA表达明显高于转染细胞,差异有统计学意义,见表2。
2.2HBV对IL-32蛋白的表达量的影响

图1 未转染细胞中IL-32及β-actin的扩增曲线
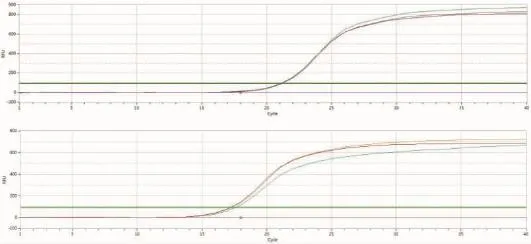
图2 转染细胞中IL-32及β-actin的扩增曲线
Western blot结果显示,转染48h的HepG2细胞,与空载体转染的HepG2细胞比较,转染HBV的HepG2细胞中IL-32蛋白质表达显著增高(P<0.05)。见表3和图3。
表2 HBV对IL-32 mRNA的表达量影响 (dRn±s)
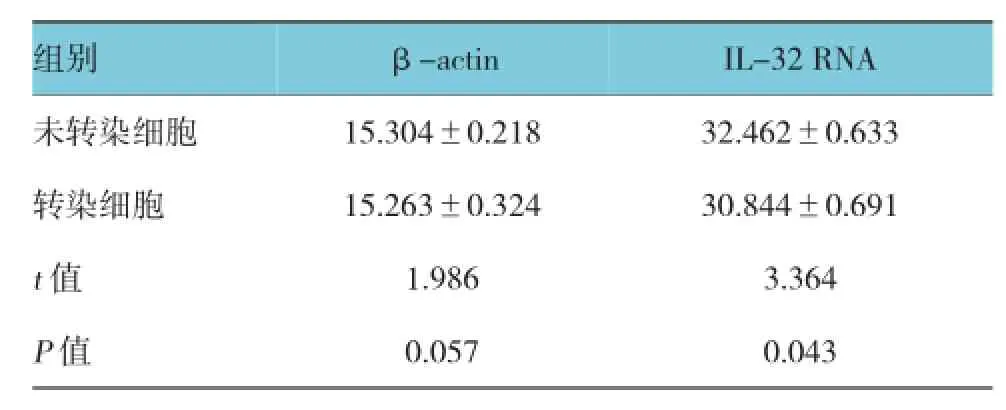
表2 HBV对IL-32 mRNA的表达量影响 (dRn±s)

表3 HBV对IL-32蛋白的表达量的影响

图3 Western blot结果图
3 讨论
近年的研究[6-7]证实,细胞因子在HBV感染所引起的肝损伤中发挥重要作用。许春梅等[8]检测HBV患者血清中IL-32水平,发现IL-32水平与HBV感染者的炎症严重程度相关,并且随炎症程度的加重IL-32呈上升趋势。PAN等[9]证明HBV的X蛋白(HBx)通过IL-32的启动子(从-746到+25)以剂量依赖的方式增强IL-32的表达。IL-32是2005年KIMETAL[10]在用基因芯片方法研究IL-18可诱导基因时发现的一种新型白细胞介素。越来越多的研究表明,IL-32在机体的免疫调节方面发挥着重要作用,它与慢性炎症性疾病、细菌感染性疾病、肿瘤和病毒感染性疾病等密切相关[11]。疾病中所起的作用不同,IL-32可以诱导IL-1β、IL-6、IL-8、TNFα及MIP-2等细胞因子的表达,与HCV[3]、HPV等[12]多种病毒感染引起的疾病的发病密切相关。IL-32基因位于人染色体16p13.3上,有8个外显子,有6种以上剪接变异体,目前比较明确的是 IL-32α、IL-32β、IL-32γ、IL-32δ、IL-32ε和IL-32ζ6种[13]。
IL-32可由多种细胞刺激产生,如T淋巴细胞可在丝裂原等的刺激下、在IL-12和IL-18的共同作用下或在TNF-α的作用下产生,NK细胞可在IL-12和IL-18的共同作用下产生,单核细胞和B细胞均可在活化T细胞的辅助下产生,上皮细胞在IFN-γ的作用下亦可产生等[14]。本研究中显示转染HBV的HepG2细胞比未转染的HepG2细胞中的 IL-32 mRNA的表达量高2.3倍,说明HBV促使IL-32 mRNA的表达,是由于HBV感染引起肝损伤与增加炎症因子的表达有关。同时,本研究结果显示,转染HBV的HepG2细胞中IL-32蛋白比未转染HBV的细胞中IL-32蛋白表达量高,说明HBV促进HepG2细胞中的IL-32蛋白的表达。本研究发现,转染HBV表达载体的HepG2细胞内及培养上清液中均表达IL-32,分泌表达的IL-32可通过诱导其他炎症细胞因子的表达而引起炎症疾病的发生,进一步从蛋白水平说明HBV感染引起肝损伤与增加炎症因子的表达有关。
综上所述,本文通过检测转染及未转染HBV的HepG2细胞中的IL-32 mRNA及蛋白的表达量,探究HBV对IL-32的表达,研究结果证明HBV对IL-32的mRNA及蛋白的表达均有促进作用。
[1]CROWTHER C,MOWA M B,ELY A,ARBUTHNOT P B.Inhibition of hepatitis B virus replication in vivo using helper-dependent adenovirus vectors to deliver antiviral RNAi expression cassettes[J].Antivir Ther,2013,25(1):72-86.
[2]BILITY M T I,CHENG L I,ZHANG Z,et al.Hepatitis B virus infection and immunopathogenesis in a humanized mouse model: inductionofhuman-specificliverfibrosisandM2-like macrophages[J].PLoS Pathog,2014,20(3):29-60.
[3]MOSCHEN A R,FRITZ T,CLOUSTON A D,et al.Interleukin-32:anewproinflammatorycytokineinvolvedinhepatitisC virus-related liver inflammation and fibrosis[J].Hepatology,2011,53(6):1819-1829.
[4]LEE S,KIM J H,KIM H,et al.Activation of the interleukin-32 pro-inflammatory pathway in response To human papilloma virus infection and over-expression of interleukin-32 controls the expression of the human papilloma virus oncogene[J].Immunology,2011,132(3):410-420.
[5]KOBAYASHI H,LIN P C.Molecular characterization of IL-32 in human endothelial cell[J].Cytokine,2011,46(3):351-358.
[6]ZHOU Y,WANG S,MA J W,et al.Hepatitis B virus protein X-induced expression of the CXC chemokine IP-10 is mediated through activation of NF-kappa B and increases migration of leukocytes[J].J Biol Chem,2010,285(16):12159-12168.
[7]ZHANG K,XU Q H,CHEN L B,et al.The measurement and significanceofserumchcmeokineRANTESinpatientswith chronic hepatitis B[J].Chin J Exp Clin Virol,2012,22(12):293-295.
[8]许春梅,左维泽,沈兰超.白介素-32在HBV感染者的变化及其临床意义[J].现代生物医学进展,2010,10(2):298-301.
[9]PAN X,CAO H,LU J,et al.Interleukin-32 expression induced by hepatitis B virus protein X is mediated through activation of NF-κB[J].Mol Immunol,2011,48(12/13):1573-1577.
[10]KIM S H,HAN SY,AZAM T,et al.Interleukin-32:a cytokine and inducer of TNF-alpha[J].Immunity,2005,22(1):131-142.
[11]田兆菊,王英,陈强,等.白细胞介素-32与疾病的关系研究进展[J].免疫学杂志,2012,28(11):994-997.
[12]LEE S,KIM J H,KIM H,et al.Activation of the interleukin-32 proinflammatory pathway in response to human papilloma virus infection and over-expression of interleukin-32 controls the expression of the human papilloma virus oncogene[J].Immunology,2011,132:410-420.
[13]CHOI J D,BAE S Y,HONG J W,et al.Identification of the most active interleukin-32 isoform[J].Immunology,2009,126(4): 535-542.
[14]NETEA M G,AZAM T,FERWERDA G,et al.IL-32 synergizeswithnucleotideoligomerizationdomain(NOD)1and NOD2 ligands for IL-1 beta and IL-6 production through a caspase 1-dependent mechanism[J].USA Proc Natl Acad Sci,2010,102(45):16309-16314.
(张蕾编辑)
Expression of IL-32 induced by hepatitis B virus protein
Jing-jing Zhang,Yong-fu Xie,Jian-feng Hu,Hui-jing Liu,Hong-xun Sun
(Department of clinical laboratory,the Third Hospital of Hebei Medical University,Shijiazhuang,Hebei 050051,China)
Objective To investigate whether protein of hepatitis B virus induced the expression ofIL-32. Methods HepG2 was mediated transfected by Lipofectamine 2000 TM.After 48 hours,the expressions of IL-32 mRNA and protein in HepG2 cells were detected by RT-PCR and western blot respectively.Results RT-PCR result showed expressions of IL-32 mRNA in HepG2 cells transfected with HBV were 2.3 times higher than the cells transfected with empty vector(non-transfected).Western blot result showed that,compared with the IL-32 protein in untransfected HepG2 cells,expression ofIL-32protein in transfected pIRES2-HBV-EGFP HepG2 cells was increased,and the difference was statistically significant(P<0.05).Conclusion The expression ofIL-32mRNA,IL-32protein in HepG2 cells is promoted by HBV.
hepatitis B virus protein;IL-32;expression;study
R575.1
A
10.3969/j.issn.1005-8982.2016.16.007
1005-8982(2016)16-0035-04
2016-04-08
谢永富,E-mail:xieteng811@sohu.com;Tel:13503339862

