RNAi沉默c-Met基因对人脑胶质瘤U251细胞增殖及侵袭能力的影响
段韬,顾应江,张彪
(1.四川省宜宾市第一人民医院 神经外科,四川 宜宾 644000;2.西南医科大学附属中医院 神经外科,四川 泸州646000;3.重庆医科大学附属第一大足医院 神经外科,重庆 402360)
RNAi沉默c-Met基因对人脑胶质瘤U251细胞增殖及侵袭能力的影响
段韬1,顾应江2,张彪3
(1.四川省宜宾市第一人民医院 神经外科,四川 宜宾 644000;2.西南医科大学附属中医院 神经外科,四川 泸州646000;3.重庆医科大学附属第一大足医院 神经外科,重庆 402360)
目的探讨RNAi沉默c-Met基因对人脑胶质瘤U251细胞增殖及侵袭能力的影响。方法分别构建3种靶向c-Met基因的短发卡RNA(shRNA)序列,以脂质体转染的方式导入人脑胶质瘤U251细胞,并筛选出稳定表达的细胞株。采用PCR和Western blot检测c-Met-shRNA转染后U251细胞c-Met的表达情况,以筛选出可有效沉默c-Met基因的shRNA。c-Met基因沉默后,采用MTT法和流式细胞术检测U521细胞增殖情况,采用Transwell法和细胞划痕实验检测U251细胞侵袭和迁移情况,采用裸鼠荷瘤实验研究U251细胞体内成瘤性。结果成功构建可有效沉默c-Met基因的c-Met-shRNA1。沉默c-Met后,c-Met mRNA以及蛋白的表达均显著下降,差异有统计学意义(P<0.05);而且可明显抑制U251细胞的增殖、侵袭、迁移以及体内成瘤能力,差异有统计学意义(P<0.05)。结论RNAi沉默c-Met基因可有效抑制人脑胶质瘤U251细胞的增殖、侵袭、迁移以及体内成瘤能力。
RNAi沉默;c-Met;人脑胶质瘤U251细胞
人脑胶质细胞瘤是中枢神经系统原发性肿瘤,约占全部中枢神经系统原发性肿瘤的32%,约占中枢神经系统高度恶性肿瘤的81%[1-2]。脑胶质细胞瘤的预后极差,患者5年存活率仅为20%~30%,高度恶性胶质瘤患者的存活期仅为9~12个月[3]。高度恶性胶质瘤难以治疗的主要原因是由于其所具有的过度增殖、抗凋亡以及较强的侵袭、迁移能力等恶性生物学行为[4]。研究发现,c-Met基因编码的产物在人脑胶质细胞瘤中高表达,与肿瘤的增殖和侵袭等恶性生物学行为密切相关[5-6]。因此,本研究采用RNAi技术沉默人脑胶质瘤U251细胞c-Met基因的表达,以探讨沉默c-Met基因对人脑胶质瘤U251细胞增殖及侵袭能力的影响,现报道如下。
1 材料与方法
1.1实验材料
人脑胶质瘤U251细胞(中国科学院上海细胞库),RPMI 1640培养基、胎牛血清(Gibco,美国);胰蛋白酶(Invitrogen,美国),EcoRⅠ和XhoⅠ限制性内切酶、T4 DNA连接酶(New England Biolabs公司,英国),Opti-MEM培养基和Lipofectamine 2000(Invitrogen,美国),Trizol(Invitrogen公司,美国),逆转录试剂盒(ABI Applied Biosystems公司,美国),PCR试剂盒(TaKaRa公司,日本);BALB/C-nu/nu裸鼠(上海斯莱克实验动物有限公司)。
1.2实验方法
1.2.1细胞培养传代人脑胶质瘤U251细胞接种于含10%FBS、100 IU/L青霉素和100 mg/L链霉素的RPMI 1640培养基,37℃,5%二氧化碳培养箱中培养。细胞融合到85%左右时,用0.25%胰酶消化、传代。
1.2.2靶向c-MetshRNA构建根据c-Met基因信息,由上海吉玛制药技术有限公司设计并合成3条短发夹RNA(small hairpin RNA,shRNA),分别为c-Met-shRNA1、c-Met-shRNA2和 c-Met-shRNA3(内含限制性内切酶EcoRⅠ和XhoⅠ的酶切位点),Blast比对与人类其他基因编码序列无同源性。退火形成双链DNA,经T4 DNA连接酶与经过EcoRⅠ和XhoⅠ酶切后的pGPU6/GFP/Neo载体连接,以构建干扰c-Met表达的重组质粒。c-Met-shRNA重组质粒转化感受态DH5α大肠杆菌,并转移至含氨苄霉素抗性的琼脂培养基上培养,采用蓝白斑法筛选阳性克隆并送呈上海吉玛制药技术有限公司测序。见表1。
1.2.3靶向c-Met-shRNA细胞转染人脑胶质瘤U251细胞接种于6孔板,每孔细胞1×105,融合达到70%时,随机分为5组开始转染实验。A液:1μg c-Met-shRNA用50μl OPTI-MEM稀释,静置10 min。B液:2μl Lipofectamine 2000用50μl OPTIMEM稀释,静置10 min。混合A、B液,静置20 min。取出培养的U251细胞,弃去原培养液并用无血清培养液漂洗,再加入1 ml无血清培养液和A/B混合液,孵育6 h。6 h后弃去转染液,更换为完全培养基。培养72 h后,观察细胞转染情况。
1.2.4PCR检测c-Met表达转染72 h后,Trizol法提取细胞总RNA,逆转录成cDNA。采用Primer 5.0软件,参照文献[7],设计c-Met和G3PDH引物,由上海吉玛制药技术有限公司提供。c-Met正向:5'-ACAGTGGCATGTCAACATCGCT-3',c-Met反向:5'-GCTCGGTAGTCTACAGATTC-3',656 bp。G3PDH正向:5'-ACCACAGTCCATGCCATCAC-3',反向:5'-TCCACCACCCTGTTGCTG-3',1 000 bp。PCR反应条件:首先,95℃预变性10 min;紧接着,95℃变性30 s,55℃退火1 min,68℃延伸1 min,共24个循环;最后,68℃延伸10 min。产品经1.5%琼脂糖凝胶电泳,Gene Tools软件分析。
1.2.5Western blot检测c-Met蛋白表达转染72h后,收集细胞,PBS淋洗,置于冰浴,加入RIPA裂解液裂解30 min,刮离细胞转移至离心管,4℃,12 000 r/min离心5 min,取上清置入-20℃冰箱保存备用。样品蛋白经二喹啉甲酸蛋白分析试剂盒定量,置入-20℃冰箱冷冻保存备用。50μg总蛋白上样,经10%SDS-PAGE电泳分离,转至硝酸纤维膜;TBST淋洗3×10 min,5%脱脂奶粉室温封闭1 h;加入c-Met一抗,4℃孵育过夜;TBST淋洗3×10 min,加入HRP标记的兔抗鼠二抗,37℃孵育1 h;TBST淋洗3×10 min,DAB显色。
1.2.6MTT检测U251细胞增殖能力人脑胶质瘤U251细胞,以1×104孔的密度接种于24孔板培养。24 h后,每孔加入200μl的5 mg/μl的MTT的PBS溶液,37℃,5%二氧化碳孵育。4 h后,每孔加入100μl的二甲基亚砜,室温慢速振摇15 min,以充分溶解结晶。酶标仪560 nm测定各组的光密度值(optical density,OD)并绘制曲线。

表1 c-Met-shRNA序列
1.2.7Transwell检测U251细胞侵袭能力以1× 109/L的密度将细胞接种于自带基质胶的Transwell小室上室,每室200μl;Transwell小室下室加入600μl含10%FBS、100 IU/L青霉素和100 mg/L链霉素的RPMI 1640培养基;37℃,5%二氧化碳孵育12 h,棉签擦去靠近基底膜内室的细胞,另一面的细胞经10%甲醇固定30 min,PBS洗涤1次,结晶紫染色20 min,PBS洗涤1次,显微镜下观察细胞并记数。
1.2.8细胞划痕实验检测U251细胞迁移能力采用单层细胞划痕实验检测U251细胞迁移能力。以2×105的密度将细胞接种于6孔板,融合达90%时,在培养板内侧底部沿直线划痕,继续孵育24 h。24 h后观察细胞划痕愈合情况。迁移能力=0 h划痕距离-24 h划痕距离。
1.2.9裸鼠体内荷瘤实验收集培养的U251细胞,经生理盐水重悬;裸鼠腹部常规消毒后,皮下注射0.5ml重悬的U251细胞;每5 d观察移植瘤的生长情况,并测量瘤体大小。
1.3统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较用t检验,多组间比较先用One-Way ANOVO方差分析,再用SNK检验进行组内两两比较;计数资料用率(%)表示,采用χ2检验。取双侧a=0.05为检测水准,P<0.05为差异有统计学意义。
2 结果
2.1靶向c-Met-shRNA构建
构建的重组质粒c-Met-shRNA1,c-Met-shRNA 2和c-Met-shRNA3经上海吉玛制药技术有限公司测试证实构建成功。
2.2靶向c-Met-shRNA转染筛选
各组转染效率分别为:未转染组0.0%,空质粒组75.3%,c-Met-shRNA1组85.8%;c-Met-shRNA2组71.2%,c-Met-shRNA3组67.4%,提示c-MetshRNA3的转染效率最高,可用于后续实验。PCR检测显示,各转染组细胞c-MetmRNA表达均显著低于未转染组和空质粒组,c-Met-shRNA1组(0.11± 0.02)较c-Met-shRNA2组(0.26±0.05)和c-MetshRNA3组(0.20±0.03)明显降低,差异有统计学意义(F=13.500,P<0.05;q=7.300,P<0.05;q=4.380,P<0.05)。Western blot检测显示,各转染组细胞c-Met蛋白表达均显著低于未转染组和空质粒组,且c-Met-shRNA1组(0.21±0.05)较c-Met-shRNA2组(0.44±0.07)和c-Met-shRNA3组(0.34±0.06)明显降低,差异有统计学意义(F=10.882,P<0.05;q= 6.579,P<0.05;q=3.719,P<0.05)。提示c-Met-shRNA可沉默人脑胶质瘤U251细胞c-Met基因和蛋白的表达,且以c-Met-shRNA1的沉默效果最好。见图1。

图1 PCR和Western blot检测C-Met基因mRNA和蛋白质的相对表达
2.3U251细胞增殖能力的影响
MTT检测结果显示,从第24 h开始,c-MetshRNA1组OD值(0.21±0.02)明显低于未转染组(0.33±0.03)和空质粒组(0.32±0.03),差异有统计学意义(F=18.136,P<0.05;q=7.675,P<0.05;q=7.036,P<0.05)。c-Met-shRNA1组第36 h(F=46.610,P<0.05;q=10.776,P<0.05;q=12.650,P<0.05),48 h(F= 169.463,P<0.05;q=23.426,P<0.05;q=21.552,P<0.05)和72 h(F=229.188,P<0.05;q=25.548,P<0.05;q=26.847,P<0.05)的OD值均显著低于未转染组和空质粒组。见图2和表2。
流式细胞术测定细胞周期显示,c-Met-shRNA1组G1期细胞比例(68.33%)显著高于未转染组(55.15%)和空质粒组(56.71%),差异有统计学意义(χ2=40.833,P<0.05);而c-Met-shRNA1组S期细胞比例(10.85%)显著高于未转染组(30.62%)和空质粒组(31.53%),差异有统计学意义(χ2=16.764,P<0.05),见图3。提示RNAi沉默c-Met基因可显著抑制人脑胶质瘤U251细胞的增殖。
2.4U251细胞侵袭迁移能力的影响
Transwell检测显示,c-Met-shRNA1组穿膜细胞数目(10.98±3.21)显著低于未转染组(34.53± 4.31)和空质粒组(33.79±4.27),差异有统计学意义(F=34.240,P<0.05;q=10.293,P<0.05;q=9.970,P< 0.05),见图4。提示RNAi沉默c-Met基因导致人脑胶质瘤U251细胞的侵袭能力下降
细胞划痕实验显示,c-Met-shRNA1组细胞迁移距离显著低于未转染组和空白质粒组,差异有统计学意义(F=27.131,P<0.05;q=9.312,P<0.05;q=8.903,P<0.05),见图5。提示RNAi沉默c-Met基因导致人脑胶质瘤U251细胞的迁移能力下降。
2.5对裸鼠体内成瘤的影响
裸鼠体内荷瘤实验显示,接种转染组和空质粒组细胞的裸鼠,10 d左右即形成明显可见的肿瘤结节;而接种c-Met-shRNA1转染细胞的裸鼠在15 d左右才形成肿瘤结节。肿瘤生长曲线显示,c-MetshRNA1组裸鼠肿瘤体积接种后的10 d(F=7.010,P<0.05;q=4.511,P<0.05;q=4.657,P<0.05)、15 d(F=7.749,P<0.05;q=4.767,P<0.05;q=4.874,P<0.05)、20 d(F=6.343,P<0.05;q=4.361,P<0.05;q=4.364,P<0.05)、25 d(F=6.268,P<0.05;q=4.316,P<0.05;q=4.356,P<0.05)和30 d(F=6.987,P<0.05;q= 4.739,P<0.05;q=4.398,P<0.05),明显小于同一时段的未转染组和空质粒组。见图6。
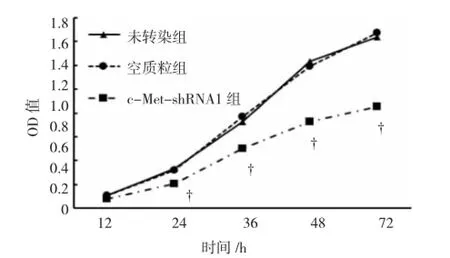
图2 MTT检测c-Met-shRNA1对U251细胞增殖的影响
表2 各组不同时间点OD值 (±s)

表2 各组不同时间点OD值 (±s)
注与同一时期的未转染组和空质粒组比较,P<0.05

图3 流式细胞术检测c-Met-shRNA1对U251细胞周期的影响

图4 Transwell检测c-Met-shRNA1对U251细胞侵袭能力的影响 (×400)

图5 细胞划痕实验检测c-Met-shRNA1对U251细胞迁移能力的影响 (×100)

图6 裸鼠体内成瘤生长情况
3 讨论
由于人脑胶质瘤的恶性度高、预后差和死亡率高,因此,有效的诊断和治疗对于延缓患者生命具有重要意义。大量研究证实,c-Met基因编码的蛋白在人脑胶质细胞瘤中高表达,与脑胶质瘤的恶性生物学行为密切相关,也是影响临床治疗效果的主要因素[8]。c-Met基因位于人类第七号染色体7q31,其编码的产物蛋白是酪氨酸激酶受体(receptor tyrosine kinase,RTKs)家族成员之一,可以特异性识别并结合肝细胞生长因子(hepatocyte growth factor,HGF)[9]。HGF是由间质细胞分泌的,研究发现它有促进多种上皮细胞(包括肾小管细胞、肠道上皮细胞、乳腺上皮细胞和支气管上皮细胞等)以及间质细胞增殖和形态发生的功能,故而在胚胎发育、组织分化和促进伤口愈合方面发挥重要作用[10-11]。然而在恶性肿瘤中,HGF与c-Met基因编码的酪氨酸激酶受体特异性结合后,会引起c-Met酪氨酸自身磷酸化,激活c-Met受体酪氨酸激酶活性,并且为下游信号分子提供磷酸化区域,包括生长因子受体结合蛋白2(growth factor receptor bound protein-2,Grb-2),信号传导和转录激活子3(signal transducer and activator of transcription-3,STAT-3),以及P85-磷脂酰肌醇-3激酶(P85-PI3 kinase,P85-PI3K)等,该信号分子进一步诱发一系列信号传导通路,最终传至细胞核内,介导c-Met基因激活导致的脑胶质瘤细胞的增殖、侵袭和迁移等生物学行为[12-13]。有研究证实,HGF/c-Met信号通路,通过上调肿瘤细胞中的纤溶酶原激活因子抑制因子1和尿激酶型纤溶酶原激活物等促进肿瘤细胞的侵袭和迁移[14]。CHU等[15-16]通过构建shRNA干扰脑胶质瘤U251细胞,下调c-Met蛋白表达,可减慢甚至停止细胞的增殖周期,增加细胞凋亡,抑制机体对HGF刺激的反应,提示或可通过特异性抑制HGF/c-Met信号通路达到治疗脑胶质细胞瘤的目的。为了探讨c-Met基因对脑胶质瘤U251细胞生物学行为的影响,本实验首先构建了靶向c-Met基因的shRNA,并转染U251细胞,继而以PCR和Western blot法筛选出可有效沉默c-Met基因的shRNA进行后续实验。实验中shRNA干扰下调U251细胞中c-Met的表达,进一步研究观察U251细胞增殖、侵袭和迁移能力以及体内成瘤能力的变化。MTT和流式细胞术结果显示,下调c-Met后U251细胞的增殖受到明显抑制;Transwell和细胞划痕实验显示下调c-Met明显抑制U251细胞侵袭和迁移能力;裸鼠体内荷瘤实验显示,下调c-Met后,U251细胞体内成瘤能力受到抑制。综上所述,RNAi沉默c-Met基因可有效抑制人脑胶质瘤U251细胞的增殖、侵袭、迁移以及体内成瘤能力。
[1]OSTROM Q T,GITTLEMAN H,STETSON L,et al.Epidemiology of gliomas[J].Cancer Treat Res,2015,163:1-14.
[2]MOROKOFF A,NG W,GOGOS A,et al.Molecular subtypes,stem cells and heterogeneity:Implications for personalised therapy in glioma[J].J Clin Neurosci,2015,22(8):1219-1226.
[3]BOELE F W,ROONEY A G,GRANT R,et al.Psychiatric symptoms in glioma patients:from diagnosis to management[J]. Neuropsychiatr Dis Treat,2015,11:1413-1420.
[4]PITSKHELAURI DI,BYKANOV AE,ZHUKOV VY,et al.Review of surgical treatment of insular gliomas:challenges and opportunities[J].Zh Vopr Neirokhir Im N N Burdenko,2015,79(2): 111-116.
[5]PETTERSON S A,DAHLROT R H,HERMANSEN S K,et al. Highlevelsofc-M etisassociatedwithpoorprognosisin glioblastoma[J].J Neurooncol,2001,122(3):517-527.
[6]RATH P,LAL B,AJALA O,et al.In vivo c-Met pathway inhibitiondepleteshumangliomaxenograftsoftumor-propagating stem-like cells[J].Transl Oncol,2013,6(2):104-111.
[7]KAORI K,MAKOTO H,FUMIAKI K.Association of c-Met phosphorylation with micropapillary pattern and small cluster invasion in pT1-size lung adenocarcinoma[J].Lung Cancer,2013,82(3):413-419.
[8]MORIYAMA T,KATAOKA H,KOONO M,et al.Expression of hepatocyte growth factor/scatter factor and its receptor c-Met in brain tumors:evidence for a role in progression of astrocytic tumors[J].Int J Mol Med,1999,3(5):531-536.
[9]GOYAL L,MUZUMDAR M D,ZHU A X.Targeting the HGF/c-MET pathway in hepatocellular carcinoma[J].Clin Cancer Res,2013,19(9):2310-2318.
[10]JIANG X,MCCLELLAN S A,BARRETT R,et al.HGF signaling impacts severity of pseudomonas aeruginosa keratitis[J].Invest Ophthalmol Vis Sci,2014,55(4):2180-2290.
[11]CHEN W,WU J,SHI H,et al.Hepatic stellate cell coculture enables sorafenib resistance in Huh7 cells through HGF/c-Met/ Akt and Jak2/Stat3 pathways[J].Biomed Res Int.2014,doi: 10.1155/2014/764981.
[12]CIAMPORCERO E,MILES K M,ADELAIYE R,et al.Combination strategy targeting VEGF and HGF/c-met in human renal cell carcinoma models[J].Mol Cancer Ther,2015,14(1):101-110.
[13]HAO N B,TANG B,WANG G Z,et al.Hepatocyte growth factor(HGF)upregulates heparanase expression via the PI3K/Akt/ NF-κB signaling pathway for gastric cancer metastasis[J].Cancer Lett,2015,361(1):57-66.
[14]ITO Y,CORRELL K,ZEMANS R L,et al.Influenza induces IL-8 and GM-CSF secretion by human alveolar epithelial cells throughHGF/c-MetandTGF-α/EGFRsignaling[J].AmJ Physiol Lung Cell Mol Physiol,2015,308(11):L1178-1188.
[15]CHU S H,MA Y B,ZHU Z A,et al.Radiation-enhanced hepatocyte growth factor secretion in malignant glioma cell lines[J]. Surg Neurol,68(6):610-613.
[16]CHU S H,FENG D F,ZHANG H,et al.c-Met-targeted RNA interference inhibits growth and metastasis of glioma U251 cells in vitro[J].J Neurooncol,2009,93(2):183-189.
(张蕾编辑)
Effect of RNAi silencingc-Metgene on proliferation and invasion ability of human gliomaU251cell
Tao Duan1,Ying-jiang Gu2,Biao Zhang3
(1.Department of Neurosurgery,the First People's Hospital of Yibin,Yibin,Sichuan 644000,China;2.Department of Neurosurgery,Affiliated Hospital of Traditional Chinese Medicine,Southwest Medical University,Luzhou,Sichuan 646000,China;3.Department of Neurosurgery,the First Affiliated Dazu Hospital,Chongqing Medical University,Chongqing 402360,China)
Objective To investigate the effect of RNAi silencingc-Metgene on the proliferation and invasion ability of human gliomaU251cell.Methods Three kinds of short hairpin RNA(shRNA)targetingc-Metgene were constructed.All of theshRNAswere transfected intoU251cell by liposome transfection,in order to screen out the stable expression cell line.The expression of c-Met inU251cell was detected by PCR and Western Blot,in order to screen out the effective shRNA.The proliferation ofU251cell was detected by MTT assay and flow cytometry.The invasion and migration ofU251cell was detected by transwell assay and cell scratch.Results The shRNA targeting c-Metgene was successful constructed.The expression ofc-Metwas significantly decreased after c-Met gene was silenced,the difference was statistically significant(P<0.05).The proliferation,invasion,migration and tumorigenicity ofU251cell was inhibited after silencingc-Metgene,the difference was statistically significant(P<0.05). Conclusions RNAi silencingc-Metgene can effectively inhibit the proliferation,invasion,migration and tumorigenicity of human glioma U251 cell.
RNAi silencing;c-Met;human glioma cell U251
R-332;R739.41
A
10.3969/j.issn.1005-8982.2016.16.003
1005-8982(2016)16-0012-06
2015-11-12
顾应江,E-mail:asdd1688@126.com;Tel:15883048550

