产碱假单胞菌碱性脂肪酶的克隆表达及酶学性质*
刘滔滔,刘明瑞,刘恒嘉,杜丽琴,梁智群,韦宇拓**
(1.广西大学生命科学与技术学院,广西南宁 530005;2.亚热带农业资源保护与利用国家重点实验室,广西南宁 530005)
产碱假单胞菌碱性脂肪酶的克隆表达及酶学性质*
刘滔滔1,2,刘明瑞1,2,刘恒嘉1,2,杜丽琴1,2,梁智群1,2,韦宇拓1,2**
(1.广西大学生命科学与技术学院,广西南宁530005;2.亚热带农业资源保护与利用国家重点实验室,广西南宁530005)
【目的】为获得可应用于酯类水解及合成的脂肪酶资源,本研究通过筛选分离得到能够水解长链脂肪酸酯的脂肪酶产生菌,克隆表达其脂肪酶基因并研究脂肪酶的酶学性质。【方法】从环境中筛选分离出可水解三硬脂酸甘油酯的菌株,利用16S rDNA对其进行分子鉴定,并扩增其脂肪酶基因和脂肪酶分子伴侣基因。以pET-22b(+)为表达载体,构建共表达重组质粒,转化Escherichia coli BL21(DE3)进行异源表达,并对重组酶进行酶学性质研究。【结果】经16S rDNA鉴定该菌株为产碱假单胞菌Pseudomonasalcaligenes。通过PCR成功克隆到该菌的脂肪酶基因(lipPA-9A)和脂肪酶分子伴侣基因(lipPA-9B),并构建共表达重组质粒pET22b-lipPA-9A-9B,实现脂肪酶LIP-9A的活性表达。酶学性质研究表明LIP-9A的最适反应温度为35℃,最适反应pH值为10.5,最适反应底物为对硝基苯酚辛酸酯(pNPO);同时,LIP-9A还可以催化醇和羧酸发生酯化反应产生酯类物质。【结论】LIP-9A在碱性条件下具有较高活力,且可以催化酯化反应,在洗涤行业和酯合成领域具有一定的应用价值。
产碱假单胞菌碱性脂肪酶共表达酯化
0 引言
【研究意义】脂肪酶(EC.3.1.1.3)又称为三酰基甘油酰基水解酶,是催化甘油三酯分解成甘油和脂肪酸的酯键水解酶[1]。脂肪酶除了能在油水界面催化酯键的水解,还能催化酸解、醇解、氨解、转酯化以及酯合成等反应[2],从而被广泛应用于食品加工、手性拆分、洗涤和生物能源等领域。【前人研究进展】多数从环境中获得的脂肪酶需要通过DNA重组技术实现过表达,然而脂肪酶的过表达容易形成包涵体,如Aamand等[3]对来自Pseudomonas cepacia的胞外脂肪酶LipA进行研究,发现LipA在缺乏脂肪酶分子伴侣蛋白LimA的情况下只能产生无活性脂肪酶。Jorgensen等[4]研究发现在洋葱伯克霍尔德菌lipB基因对脂肪酶基因lipA的活性表达是必需的。【本研究切入点】从环境中筛选出可水解长链脂肪酸酯的脂肪酶资源,研究酶的基本性质,降低酶的生产成本,提高酶的转化效率。【拟解决的关键问题】以三硬脂酸甘油酯为底物,从土壤中筛选出对长链脂肪酸酯具有较高水解能力的野生菌,克隆其脂肪酶基因并实现异源表达,再深入研究其酶学性质。
1 材料与方法
1.1材料
样品:广西南宁市周边采集的富油土样。
菌株和载体:Escherichia coli BL21(DE3)、Escherichia coli Rosetta(DE3)、E.coli Trans10、pMD19-T、pET-22b(+)、pET-30a(+)。
酶和试剂:限制性内切酶和PCR扩增聚合酶购自大连TaKaRa公司,T4 DNA连接酶购自Toyobo公司。质粒提取试剂盒、DNA胶回收纯化试剂盒以及PCR产物纯化试剂盒购自BioFlux公司。IPTG和X-gal购自Gibco公司,三硬脂酸甘油酯购自TCI公司,对硝基苯酚及对硝基苯酚酯底物购自sigma公司,其他试剂均为国产分析纯。
筛选平板培养基(W/V):蛋白胨1%,酵母提取物0.5%,NaCl 1%,琼脂粉1.5%,底物乳化液1%,维多利亚蓝B 0.02%,参考文献[5]并作一定修改。
橄榄油乳化液:3%(V/V)的聚乙烯醇与橄榄油以体积比3∶1混合均匀。
三硬脂酸甘油酯乳化液:取1 g三硬脂酸甘油酯溶于10 mL 3%(V/V)聚乙烯醇溶液中,溶解后再于超声波破胞仪中乳化20 min。
1.2方法
1.2.1高产脂肪酶野生菌的筛选
取5 g土样加入50 mL无菌水,摇床震荡20 min,制成菌悬液,过滤后梯度稀释上清液,并涂布橄榄油平板于37℃培养48 h进行初筛,再经三硬脂酸甘油酯平板进行复筛,最后通过摇瓶发酵测定酶活力,选择较高活力的菌株进行研究。
1.2.2野生菌株16S rDNA鉴定及进化树构建
以筛选出的野生菌总DNA(DNA提取方法参考文献[6])为模板,利用16S rDNA为通用引物,进行PCR扩增反应,扩增产物连接pMD19-T载体后送测序,将测序获得的16S rDNA序列进行Blast N分析,并用MEGA 6.0软件构建系统发育树。
1.2.3脂肪酶基因保守区序列的克隆
检索Genbank数据库中已公布的产碱假单胞菌脂肪酶基因序列,比对分析寻找序列保守区。设计简并引物进行PCR扩增反应,扩增产物与pMD19-T载体连接后送测序。
1.2.4脂肪酶基因lipPA-9A的克隆与表达
比对分析保守区序列,设计扩增lipPA-9A的引物。上游引物:5′-CCGGAATTCATGGGCCTGTTCGGCTCCACCGGCTACACCAA-3′(下划线处为 EcoR Ⅰ限制性酶切位点);下游引物:5′-CCCAAGCTTTCAGAGGCCGGCCAGCTTCA-3′(下划线处为 Hind Ⅲ限制性酶切位点)。PCR产物经EcoR Ⅰ和Hind Ⅲ双酶切后,与表达载体pSE380连接构建成pSE-lipPA-9A重组质粒并转入E.coli BL21(DE3)中,挑选阳性克隆子接种于含有0.1 mg/mL Amp的LB培养基,37℃培养至菌液OD600达0.6左右,加入终浓度为0.3 mmol/L的IPTG进行诱导,在20℃条件下诱导培养20 h,SDS-PAGE分析其表达产物并检测粗酶活。
脂肪酶酶活力测定方法[7-8]:以异丙醇为溶剂,配制终浓度为20 mmol/L的底物溶液作为母液;取10 μL底物母液与180 μL反应缓冲液混匀加入1.5 mL 离心管,预热5 min;加入10 μL酶液,空白对照用相应的缓冲液代替,在实验所需条件下反应10 min后,加入200 μL 10%(V/V)三氯乙酸溶液终止反应,静置5 min;加入200 μL 10%(W/V)的Na2CO3溶液显色,混匀。用酶标仪于405 nm处测吸光值,参照标准曲线计算酶活力。
脂肪酶酶活力单位(U)定义:每分钟分解底物释放出1 μmol 对硝基苯酚(pNP)所需的酶量。
1.2.5脂肪酶分子伴侣基因lipPA-9B的克隆表达
以筛选菌PA-9的总DNA为模板,设计引物扩增lipPA-9B,上游引物:5′-CGCCATATGGTGAACAAGCCGCTGCTATT-3′(下划线处为 Nde Ⅰ限制性酶切位点);下游引物:5′-GGAAGATCTTCAGAGTTTCTTTTCCCGGC-3′(下划线处为Bgl Ⅱ限制性酶切位点)。扩增产物经Nde Ⅰ和Bgl Ⅱ双酶切后,与pET-30a(+)连接构建重组质粒pET-lipPA-9B并转入E.coli Rosetta (DE3)中诱导表达,表达产物命名为LIP-9B并进行SDS-PAGE分析。
1.2.6脂肪酶包涵体变复性验证
包涵体的变复性采用一次稀释法[9]。将包涵体溶解于变性液,离心后取上清液进行稀释复性。用含分子伴侣LIP-9B的复性缓冲液分别以25,50,75,100,150和300倍稀释样品,同时以不含LIP-9B的复性缓冲液稀释到相同倍数作为空白对照,4℃保存1 h。按1.2.4节下脂肪酶酶活力测定方法,以pNPP为底物检测酶活力。
1.2.7lipPA-9A与lipPA-9B共表达重组质粒的构建及诱导表达
lipPA-9B和lipPA-9A分别用限制性内切酶BamH Ⅰ和EcoR Ⅰ、EcoR Ⅰ和Hind Ⅲ双酶切过夜,胶回收目的片段连接pET-22b(+)载体,先后串联基因lipPA-9A和lipPA-9B构建共表达重组质粒pET22b-lipPA-9A-9B,其中两个基因5′端均具有rbs和信号肽序列,如图1所示。
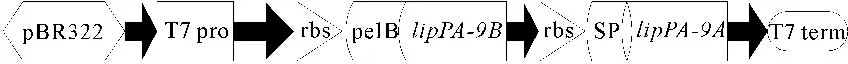
图1重组质粒pET22b-lipPA-9A-9B的构建
Fig.1The schematic of pET22b-lipPA-9A-9Bconstruction pattern
将共表达质粒pET22b-lipPA-9A-9B转入E.coli BL21(DE3),挑选阳性克隆子接种于含有0.1 mg/mL Amp的LB培养基,37℃培养至菌液OD600达0.6左右,加入终浓度为0.3 mmol/L的IPTG进行诱导,20℃、200 r/min摇床培养20 h。胞内外重组蛋白表达情况用SDS-PAGE检测,并以对硝基苯酚棕榈酸酯(pNPP)为底物检测脂肪酶活力。
1.2.8重组酶LIP-9A酶学性质鉴定
(1)温度和pH值对LIP-9A酶活力的影响
以对硝基苯酚辛酸酯(pNPO)为底物,在pH值为7.0的反应缓冲液中,分别在20~65℃(间隔5℃)下测定温度对酶活力的影响。在最适反应温度下,用pH值6.0~12.0(间隔0.5)的缓冲液(氢氧化钠-柠檬酸-磷酸-硼酸缓冲液,参考文献[10])稀释LIP-9A适当倍数,测定pH值对酶活力的影响。
(2)温度和pH值对LIP-9A稳定性的影响
热稳定性:以pNPO为反应底物,将LIP-9A分别在25~55℃(间隔5℃)保温1 h,在最适反应条件下测定残余酶活力。
pH值稳定性:以pNPO为反应底物,用pH值5.0~11.0(间隔0.5)的缓冲液稀释LIP-9A相同倍数后,置于4℃保存24 h,在最适反应条件下测定其残余酶活力。
(3)LIP-9A底物特异性测定
分别以不同链长的对硝基苯酚酯(C2~C16)为底物在最适反应条件下测定重组酶酶活力,测定重组酶的最适反应底物。
(4)金属离子对重组酶LIP-9A活力的影响
用终浓度为5 mmol/L的金属离子缓冲液稀释重组酶LIP-9A(总反应体系为200 μL),以不添加金属离子的酶反应液为对照组,在最适反应条件下研究金属离子对酶活力的影响。
(5)化学试剂对LIP-9A活力的影响
按1%、5%和10%(W/V)的添加比例将非离子型表面活性剂和离子型表面活性剂加到酶反应体系中(总反应体系为200 μL,对照组不加表面活性剂),在最适反应条件下测定相对残余酶活力。
取适量的EDTA、DTT和β-巯基乙醇按终浓度1 mmol/L、5 mmol/L和10 mmol/L加到酶反应体系中(总反应体系为200 μL)。以未加化学试剂的为对照组,在最适反应条件下测定相对残余酶活力。
将有机试剂(甲醇、乙醇、正丁醇、正己醇、1,2-丙二醇、丙三醇、甲苯、乙腈、丙酮、DMSO、DMF、三氯甲烷、四氢呋喃、吡啶)以10%(V/V)的比例加到200 μL的反应体系中,混匀。以不加有机试剂的酶反应液为对照组,在最适反应条件下检测相对残余酶活力。
(6)重组酶LIP-9A酯化反应的检测
酯化反应:100 mmol/L醇、100 mmol/L酸、5 mL正己烷、10 mg酶粉(反应体系5 mL),35℃反应10 h,取1 mL反应液8 000 r/min离心5 min,取上清液进行气相色谱分析,对照组不添加冻干酶粉。其中,醇包括乙醇、丁醇、己醇和辛醇,酸包括乙酸和丁酸。酯化率通过GC测定醇的消耗量间接计算得出,即酯化率Y=消耗醇的量/加入总醇的量×100%。
气相色谱检测条件:气相色谱柱为HP-5,进样口温度为240℃,压力为10.896 psi,进样分流比为20∶1,流速为1.2 mL/min,检测温度从60℃开始,保留2 min,以每分钟20℃的速度升至240℃,检测器温度为300℃。
2 结果和分析
2.1高产脂肪酶产生菌的筛选
本实验利用三硬脂酸甘油酯为底物最终筛选到6株可水解该底物的脂肪酶产生菌(图2)。通过摇瓶发酵检测粗酶活力,最终筛选得到一株脂肪酶酶活力最高的菌株,命名为PA-9。
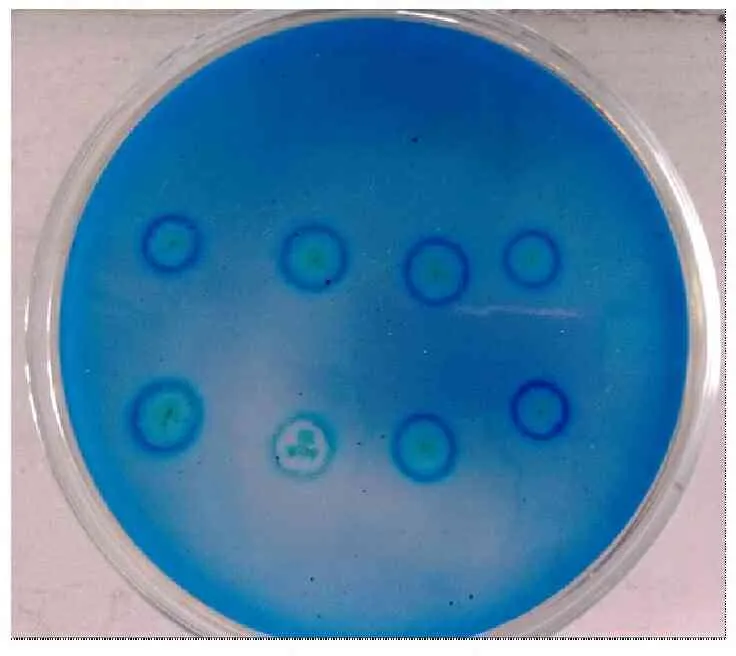
图2产脂肪酶菌株的筛选结果
Fig.2Result of screening lipase-producing microorganisms
2.2PA-9的分子鉴定和进化树的构建
将所得的产脂肪酶菌株PA-9 16S rDNA序列在NCBI中进行比对分析,结果表明该序列与Pseudomonas alcaligenes strain NBRC 14159的16S rDNA一致性为99%,并构建系统发育树(图3),初步鉴定PA-9为Pseudomonas alcaligenes菌株。
2.3脂肪酶基因的克隆表达
2.3.1PA-9脂肪酶基因保守区序列的克隆
利用简并引物成功克隆出一条约500 bp的目的片段,Blast N分析表明保守区序列与来自Pseudomonas alcaligenes NBRC 14159的假定脂肪酶基因(putative lipase)一致性最高,同源性为99%,可初步判断该片段属于脂肪酶。

图3菌株PA-9 16S rDNA基因序列系统发育树
Fig.3Phylogenetic tree derived from 16S rDNA gene sequences of strain PA-9
2.3.2PA-9脂肪酶基因lipPA-9A克隆表达
根据保守区序列的比对分析,以PA-9总DNA为模板,扩增出约900 bp的DNA片段,重组质粒pSE-lipPA-9A转入大肠杆菌诱导表达(图4),SDS-PAGE结果显示在菌体中重组蛋白条带明显,破胞上清液没有重组蛋白表达条带,也检测不到脂肪酶活力,因此推断lipPA-9A在大肠杆菌中表达为包涵体。
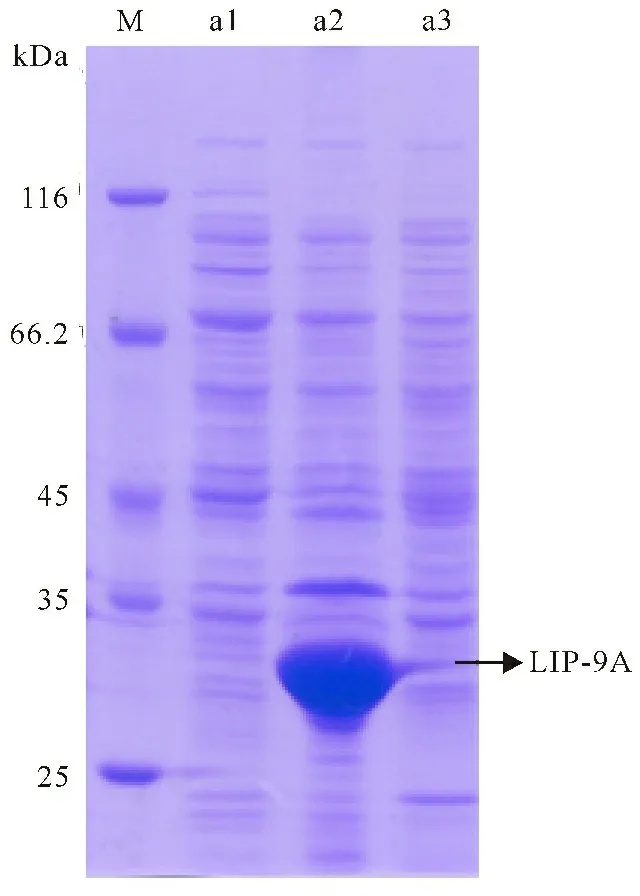
M:Protein marker;a1:pET-22b whole cell lysate;a2:pSE-lipPA-9Awhole cell lysate;a3:pSE-lipPA-9Acell lysate’s supernatant
图4LIP-9A的SDS-PAGE分析
Fig.4SDS-PAGE analysis of LIP-9A
2.4脂肪酶分子伴侣基因lipPA-9B的克隆表达
以PA-9总DNA为模板,扩增lipPA-9B并构建重组质粒pET-lipPA-9B,再转入E.coli Rosetta(DE3)进行诱导表达,并进行SDS-PAGE分析(图5)。结果表明lipPA-9B得到大量可溶性表达,大小为38 kDa左右。
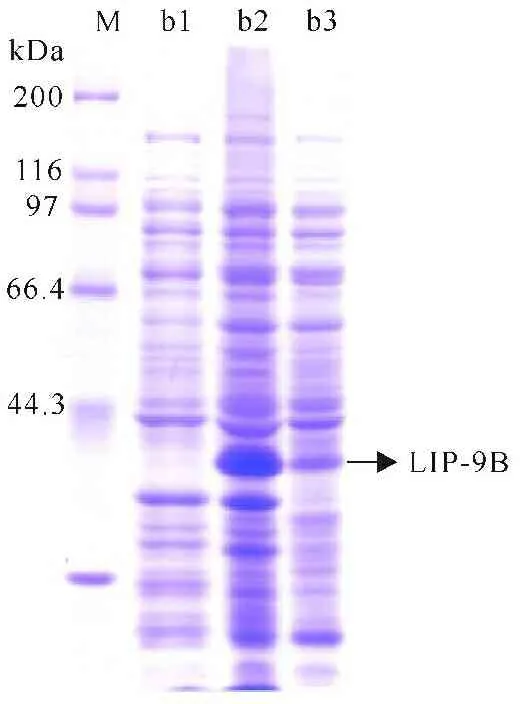
M: Protein marker;b1:pET-22b whole cell lysate;b2:pET-lipPA-9Bwhole cell lysate;b3:pET-lipPA-9Bcell lysate’s supernatant
图5LIP-9B的SDS-PAGE分析
Fig.5SDS-PAGE analysis of LIP-9B
2.5脂肪酶包涵体变性及复性研究
含有分子伴侣LIP-9B的复性液对LIP-9A包涵体蛋白的复性效果较好,不同稀释倍数均能检测到酶活力且以50倍稀释倍数最佳,空白对照组均检测不到脂肪酶活力。因此推断本实验所表达的LIP-9A需要其特异的分子伴侣蛋白LIP-9B的帮助折叠才能形成有活力的脂肪酶。
2.6共表达重组质粒pET22b-lipPA-9A-9B的构建及诱导表达
从图6中可以看出,lipPA-9A和lipPA-9B均获得表达,大小分别为38 kDa和32 kDa,与预期大小相符合。在破胞上清液中,有一条很明显的LIP-9B蛋白条带,而LIP-9A的可溶性表达量少,蛋白条带不明显。通过检测其脂肪酶活力,胞外发酵液对pNPP的水解活力为997 U/L。因为可溶性表达量很少,因此本实验以胞外重组酶LIP-9A为研究对象,将发酵液通过超滤浓缩并脱盐得到LIP-9A粗酶液进行酶学性质研究。
2.7重组酶LIP-9A的酶学性质
(1)最适反应温度和热稳定性
以pNPO为反应底物时,LIP-9A最适反应温度是35℃(图7a)。LIP-9A在4~35℃条件下酶活力较稳定,相对残余酶活力能保持在80%以上;而在35℃以上酶的残余活力迅速降低,热稳定性较差(图7b)。
(2)最适反应pH值和pH稳定性
由图8a可知,以pNPO为反应底物时,LIP-9A的最适反应pH值是10.5。LIP-9A在pH值为6.5~8.0缓冲液中稳定性较好,保存24 h后的残余酶活力仍保持在80%以上(图8b),LIP-9A最适反应pH值以及pH稳定性表明该脂肪酶在洗涤工业具有一定的应用价值。

M:Protein marker;c1:pET-22b whole cell lysate;c2:pET22b-lipPA-9A-9Bwhole cell lysate;c3:pET22b-lipPA-9A-9Bcell lysate’s supernatant

图6 LIP-9A和 LIP-9B的SDS-PAGE分析
图7温度对重组酶LIP-9A活性的影响
Fig.7Effect of temperature on recombinant enzyme
(3)重组酶LIP-9A的底物特异性
由图9可知,重组酶LIP-9A对对硝基苯酚乙酸酯pNPA(2C)、对硝基苯酚丁酸酯pNPB(4C)、对硝基苯酚己酸酯pNPH(6C)、pNPO(8C)和pNPP(16C)都有一定的水解作用,且偏好水解长链脂肪酸酯类底物,特别是对pNPO(8C)具有最高水解活力,说明LIP-9A在酯类水解反应中具有一定应用价值。
(4)金属离子对LIP-9A活性的影响
由图10可知,Mn2+对酶活力的抑制作用比较强烈,K+、Ba2+、Fe3+、Mg2+和Ca2+对酶活力有轻微的抑制作用,而Zn2+、Pb2+、Cu2+和Co2+对LIP-9A的活力影响不大。
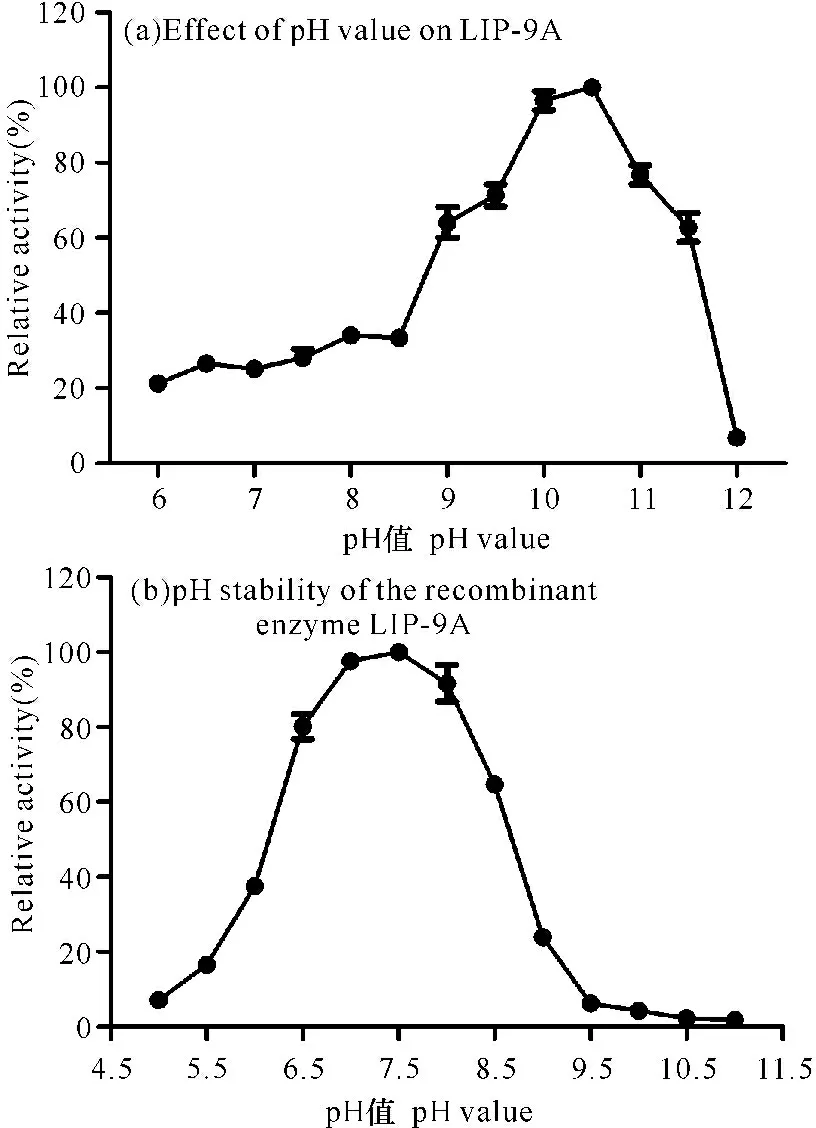
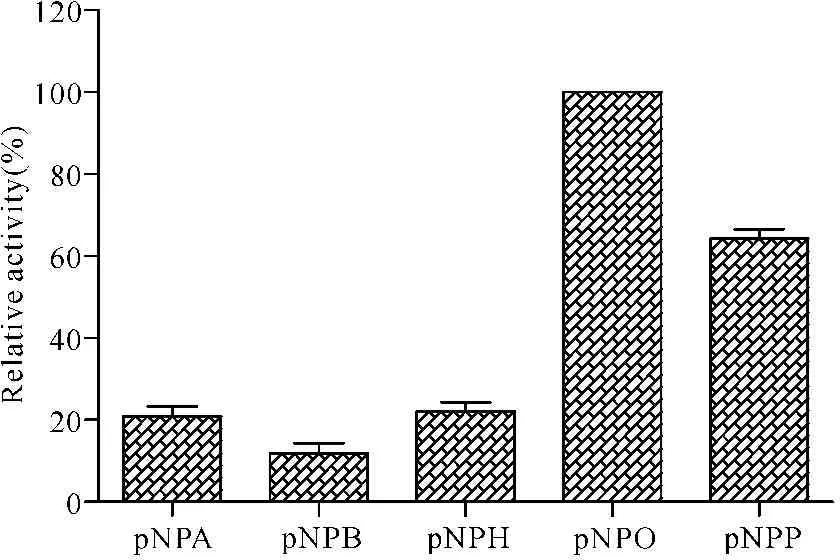
图8 pH值对重组酶LIP-9A活性的影响
图9重组酶LIP-9A的底物特异性测定
Fig.9Substrate specificity of the recombinant enzyme LIP-9A

图10金属离子对重组酶LIP-9A活性的影响
Fig.10Effect of metal ions on recombinant enzyme LIP-9A
(5)化学试剂对LIP-9A活性的影响
由表1中可以看出,1%、5%和10%(W/V)的非离子型表面活性剂和离子型表面活性剂均对重组酶LIP-9A的具有强烈的抑制作用。
表1表面活性剂对重组酶LIP-9A活性的影响
Table 1Effect of detergents on recombinant enzyme LIP-9A
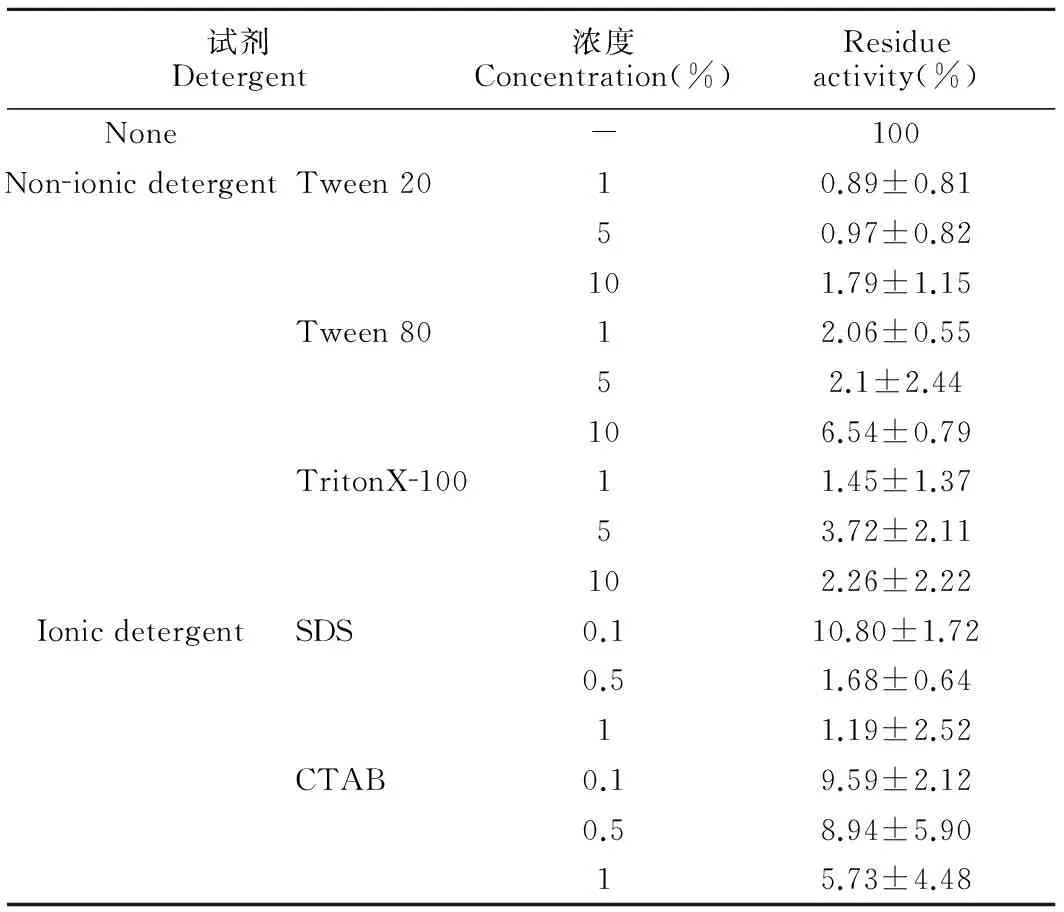
试剂Detergent浓度Concentration(%)Residueactivity(%)None-100NonionicdetergentTween2010.89±0.8150.97±0.82101.79±1.15Tween8012.06±0.5552.1±2.44106.54±0.79TritonX10011.45±1.3753.72±2.11102.26±2.22IonicdetergentSDS0.110.80±1.720.51.68±0.6411.19±2.52CTAB0.19.59±2.120.58.94±5.9015.73±4.48
由图11可知,1~10 mmol/L的EDTA对重组酶LIP-9A均有轻微的抑制作用,高浓度的DTT和β-巯基乙醇强烈抑制LIP-9A的活性。10%(W/V)的丙酮和DMSO对LIP-9A的活性没有明显影响,其他有机试剂对重组酶LIP-9A活性均有不同程度的抑制作用。
(6)LIP-9A的酯化反应
LIP-9A能够催化醇和酸发生酯化反应,其中对乙酸和己醇、辛醇的酯化率分别为5.1%和4.2%,对丁酸和乙醇、丁醇以及己醇的酯化率分别为59.2%、4.0%和5.3%。说明 LIP-9A所具有酯化性质,在生物催化领域具有一定的应用价值。
3 结论
大多数细菌脂肪酶都是采用GSP分泌途径进行,通过N端信号肽引导到达周质空间,然后在分子伴侣蛋白的帮助折叠下形成活性蛋白[11]。本研究所筛选到产碱假单胞菌就是以该方式分泌胞外脂肪酶,这与之前已报道的通过构建基因文库所获得的PAL分泌途径不同[12]。酶学性质研究表明,LIP-9A的最适反应温度是35℃,在0~35℃稳定性较好;在弱碱性条件下较稳定且具有较高的最适pH值10.5;偏好水解长链脂肪酸酯类底物,最适底物是pNPO(8C);LIP-9A可催化酸和醇的酯化反应。这些性质表明该碱性脂肪酶LIP-9A在生物催化领域中具有潜在的应用价值,今后的工作主要是实现该酶大量活性表达并通过分子改造技术或者固定化技术提高酶的稳定性和有机溶剂耐受性,为在洗涤剂和催化合成领域中的应用奠定基础。
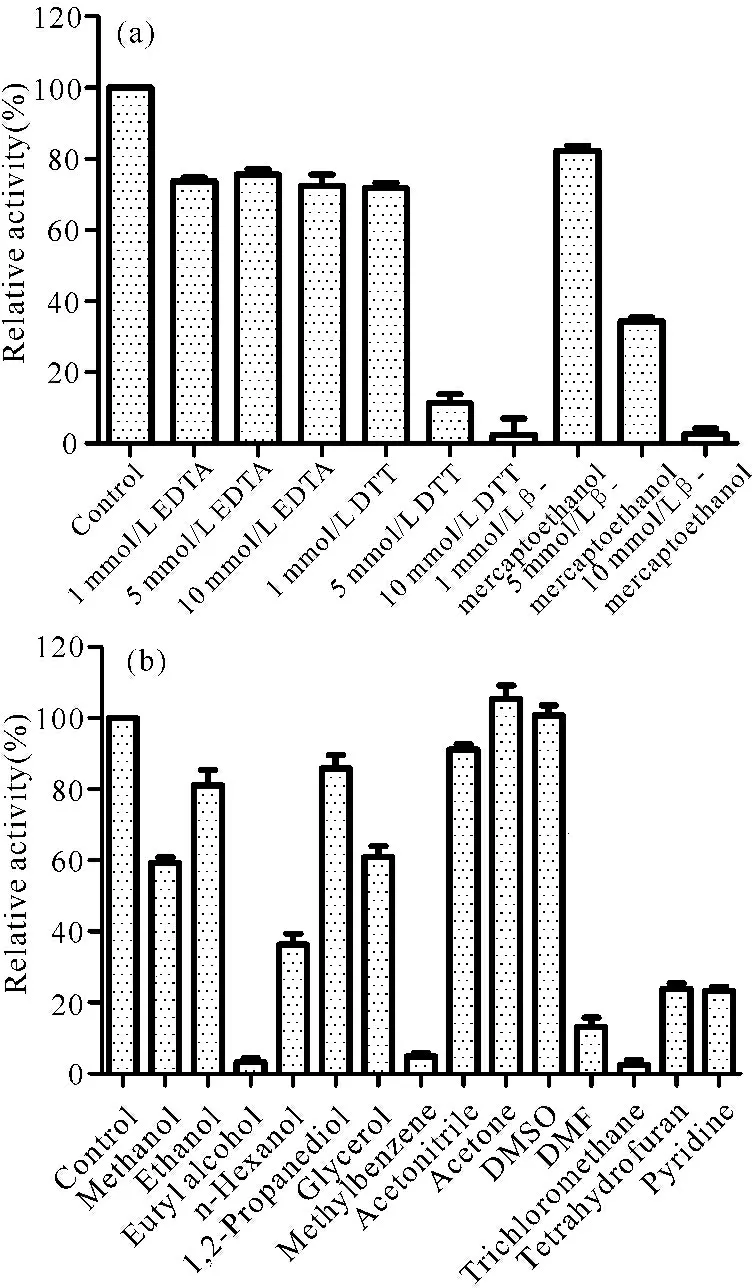
图11化学试剂对重组酶LIP-9A活性的影响
Fig.11Effect of chemicals on recombinant enzyme LIP-9A
[1]VERMA N,THAKUR S,BHATT A.Microbial lipases:Industrial applications and properties (a review) [J].Int Res J Biol Sci,2012,1(8):88-92.
[2]KAPOOR M,GUPTA M N.Lipase promiscuity and its biochemical applications [J].Process Biochemistry,2012,47(4):555-569.
[3]AAMAND J L,HOBSON A H,BUCKLEY C M,et al.Chaperone-mediated activation in vivo of a Pseudomonas cepacia lipase[J].Molecular & General Genetics MGG,1994,245(5):556-564.
[4]JORGENSEN S,SKOV K W,DIDERICHSEN B.Cloning,sequence,and expression of a lipase gene from Pseudomonas cepacia:Lipase production in heterologous hosts requires two Pseudomonas genes [J].Journal of Bacteriology,1991,173(2):559-567.
[5]唐雪娇,苗时雨,吴丰鹏,等.产脂肪酶菌落的生物特性研究[J].南开大学学报:自然科学版,2011,44(5):23-26.
TANG X J,MIAO S Y,WU F P,et al.Study on biological characteristics of lipase-producing strains[J].Acta Scientiarum Naturalium Universitatis Nankaiensis,2011,44(5):23-26.
[6]姜淑梅,张龙,戴世鲲,等.一种简单、有效的适于PCR操作的放线菌DNA提取方法[J].生物技术,2007,17(1):39-41.
JIANG S M,ZHANG L,DAI S K,et al.A quick and efficient method for genomic DNA extraction from Actionbacteria[J].Biotechnology,2007,17(1):39-41.
[7]ZHENG X,CHU X,ZHANG W,et al.A novel cold-adapted lipase from Acinetobacter sp. XMZ-26:Gene cloning and characterisation[J].Applied Microbiology & Biotechnology,2011,90(3):971-980.
[8]滕昆,张吉福,牛福星,等.脂肪酶活力测定中终止反应方法的比较分析[J].广西科学,2014,21(2):115-118.
TENG K,ZHANG J F,NIU F X,et al.Comparative analysis of termination reaction methods in lipase activity assay[J].Gunagxi Sciences,2014,21(2):115-118.
[9]郑小梅.不动杆菌脂肪酶与其特异折叠酶的相互作用与功能研究[D].北京:中国农业科学院,2012.
ZHENG X M.The Interaction and Functional Analysis of the Bacterial Lipase and Its Specific Foldase from Acinatobacter sp.[D].Beijing:Chinese Academy of Agricultural Sciences,2012.
[10]ÖSTLING S,VIRTAMA P.A modified preparation of the universal buffer described by teorell and stenhagen[J].Acta Physiologica Scandinavica,1946,11(4):289-293.
[11]ROSENAU F,JAEGER K E.Bacterial lipases from Pseudomonas:Regulation of gene expression and mechanisms of secretion[J].Biochimie,2000,82(11):1023-1032.
[12]孙苗苗,陈辉,吴坚平,等.产碱假单胞菌脂肪酶的克隆表达及酶学性质研究 [J].微生物学通报,2012,39(11):1580-1588.
SUN M M,CHEN H,WU J P,et al.Clonging,expression and characterization of lipase from Pseudomonas alcaligenes[J].Microbiology China,2012,39(11):1580-1588.
(责任编辑:米慧芝)
Gene Cloning,Expression and Characterization of An Alkaline Lipase from Pseudomonas alcaligenes PA-9
LIU Taotao1,2,LIU Mingrui1,2,LIU Hengjia1,2,DU Liqin1,2,LIANG Zhiqun1,2,WEI Yutuo1,2
(1.College of Life Science & Technology of Guangxi University,Nanning,Guangxi,530005,China;2.State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources,Nanning,Guangxi,530005,China)
【Objective】In order to obtain the lipase that can be applied to the hydrolysis and synthesis of esters,the alkaline lipase-producing strains that hydrolyze long chain fatty acid ester were screened and isolated.The related genes were cloned and expressed, and enzyme characterization was studied.【Methods】A strain,which degraded glycerol tristearate,was isolated from the environment,and identified based on 16S rDNA sequence analyses.Then the lipase gene and the lipase chaperone gene were amplified by PCR.The target geneslipPA-9AandlipPA-9Bwere introduced into expression vector pET-22b(+) and induced for expression in Escherichia coli BL21(DE3).Finally,the characteristics of the recombinant enzyme were studied in detail.【Results】The strain was identified as the genus of Pseudomonas alcaligenes by analyzing of 16S rDNA sequence.And the lipase gene (lipPA-9A) and lipase chaperone gene (lipPA-9B) were cloned.The co-expression recombinant plasmid of pET22b-lipPA-9A-9Bwas successfully constructed and expressed in E.coli BL21(DE3).The maximum activity of LIP-9A was obtained at 35℃,pH 10.5,and pNPO was the most suitable substrate.Meanwhile,the active LIP-9A could catalyze fatty alcohols and fatty acids to generate esters.【Conclusion】LIP-9A is a lipase with relatively high activity in alkaline conditions and can catalyze esterification reaction.Its characteristics are of high value in the detergent industry and biocatalytic applications.
Pseudomonas alcaligenes,alkaline lipase,co-expression,esterification
2016-05-08
2016-06-19
刘滔滔(1991-),男,硕士研究生,主要从事酶工程研究。
Q78,TQ925+.6
A
1005-9164(2016)03-0248-07
*国家自然科学基金项目(31460437)资助。
**通讯作者:韦宇拓(1971-),男,教授,主要从事发酵与酶工程研究,E-mail:weiyutuo@gxu.edu.cn。
广西科学Guangxi Sciences 2016,23(3):248~254
网络优先数字出版时间:2016-07-13【DOI】10.13656/j.cnki.gxkx.20160713.008
网络优先数字出版地址:http://www.cnki.net/kcms/detail/45.1206.G3.20160713.0857.016.html

