超声聚焦刀联合化疗治疗宫颈癌同步放化疗后宫颈肿瘤残留的临床观察
张红丽陈燕萍吴莉杨飞月张汉群
超声聚焦刀联合化疗治疗宫颈癌同步放化疗后宫颈肿瘤残留的临床观察
张红丽①陈燕萍①吴莉①杨飞月①张汉群①
目的:探讨超声聚焦刀联合化疗治疗宫颈癌同步放化疗后肿瘤残留的近期疗效和安全性。方法:收集本科2013年1月-2016年3月收治的ⅡB~ⅣA期宫颈癌经同期放化疗后宫颈肿瘤残留患者97例,随机法分为试验组47例和对照组50例。试验组采用TP方案(紫杉醇+顺铂)+超声聚焦刀,对照组仅采用TP方案(紫杉醇+顺铂),两组均给予化疗2个周期,比较两组的治疗效果及毒副反应。结果:两组患者均完成全部治疗及随访,试验组有效率为95.7%,对照组为82.0%,两组比较差异有统计学意义(P<0.001)。在疼痛及皮肤灼伤方面,试验组高于对照组,但患者均能耐受。在毒副反应方面,两组比较差异无统计学意义(P>0.05)。结论:超声聚焦刀联合化疗治疗宫颈癌同步放化疗后宫颈肿瘤残留,能提高患者的近期疗效,不增加全身毒副反应,安全性好,是值得临床进一步研究推广的安全有效方法。
超声聚焦刀; 宫颈癌; 肿瘤残留; 辅助化疗; 紫杉醇顺铂
First-author’s address:The People’s Hospital of Guizhou Provincial,Guiyang 550002,China
doi:10.3969/j.issn.1674-4985.2016.22.003
宫颈癌是全球妇女中第三大最常见的恶性肿瘤,据WHO报道世界每年大约有50万宫颈癌新发病例,其中85%宫颈癌发生于发展中国家,2012年全球全年发生宫颈癌528 000例,年死亡数为266 000例,我国每年新发病例13.15万,约占世界宫颈癌新发病例的28.8%,为我国妇女恶性肿瘤第一位[1]。最新美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN),已将顺铂为基础的同期放化疗列为局部晚期宫颈癌(采用FIGO 2009临床分期)的标准治疗[2],其5年生存率为22.0%~75.7%[3]。治疗结束后宫颈肿瘤残留是影响预后的主要因素之一。目前,同期放化疗后宫颈肿瘤残留的治疗方法没有达成共识,宫颈癌足量放疗后宫颈肿瘤残留,再加量放疗会造成放射性肠炎和/或膀胱炎的发生率增高,甚至有阴道直肠瘘、阴道膀胱瘘等风险。手术切除,由于足量的放疗盆腔粘连严重,解剖层次不清,手术困难。化疗成为常规治疗手段,但疗效欠佳。高强度聚焦超声(High intensity focused ultrasound,HIFU)是近年来以超声波为治疗源并广泛应用于临床治疗的微创性技术,HIFU通过高强度超声聚焦,瞬间产生65~100 ℃的高温,可在0.10~0.25 s内瞬间高温、空化和机械效应杀死肿瘤细胞,而对焦域以外的正常组织没有影响或影响很小,已广泛应用于腹腔和盆腔的实体肿瘤的辅助治疗,如前列腺癌、胰腺癌、肝癌、肾癌等肿瘤,并取得较好的疗效。本研究的目的在于研究超声聚焦刀联合化疗治疗宫颈癌同步放化疗后肿瘤残留的近期疗效和安全性,现报道如下。
1 资料与方法
1.1一般资料 选择本科2013年1月-2016年3月收治的ⅡB~ⅣA期宫颈癌经同期放化疗后宫颈肿瘤残留患者97例,KPS评分≥70分,按FIGO 2009年分期标准进行分期,患者的年龄为24~70岁,中位年龄为51岁。该研究已经通过伦理委员会的批准,入组患者均签署知情同意书。入组标准:(1)18岁≤年龄≤70岁;(2)病理组织学证实为宫颈癌;(3)经同步放化疗4周后复查影像学证实有肿瘤残留;(4)有可测量病灶;(5)体力状况尚好:ECOG评分0~1分(或KPS评分70~100分);(6)预计生存期≥6个月;(7)基线血常规和生化指标符合下列标准:血红蛋白≥90 g/L,中性粒细胞绝对计数(ANC)≥1.5×109/L,血小板≥100×109/L,ALT、AST≤2.5倍正常上限值,血清白蛋白≥30 g/L;(8)有术前3项,若患者合并梅毒,治疗前需行驱梅治疗;(9)患者对橡胶制品无过敏史;(10)心肺功能基本正常。排除标准:(1)对橡胶制品过敏者;(2)患有严重急性感染,且未被控制或有化脓性和慢性感染伤口迁延不愈者慢性乙型肝炎活动期、梅毒爆发期;(3)原有严重心脏病者,包括:充血性心力衰竭,不能控制的高危心律失常,不稳定性心绞痛,心肌梗塞,重度心瓣膜疾病以及顽固性高血压;(4)患有不易控制的神经,精神疾病或精神障碍,依从性差,不能配合和叙述治疗反应者,原发性脑瘤或中枢神经转移瘤病情未控制,具有明显颅高压征或神经精神症状者;(5)伴恶性浆膜腔积液;(6)严重的放射性肠炎和放射性膀胱炎、肠梗阻、肠穿孔、造瘘、直肠阴道瘘、直肠膀胱瘘等;(7)同时参加其他临床实验的患者;(8)研究者认为患者不宜参加本实验的其他情况。入组患者中鳞癌82例,腺癌10例,腺鳞癌5例,随机分为试验组47例行单纯化疗,对照组50例行超声聚焦刀联合化疗,所有患者经同步放化疗4周后复查影像学(盆腔MRI、腔内彩超或妇科检查明确肿瘤是否有残留,两种以上影像学检查或宫颈刮片阳性,有条件者可行全身PET-CT检查)证实有肿瘤残留。两组均无化疗及应用超声聚焦刀禁忌证,两组的一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 两组患者的一般资料比较 例(%)
1.2方法 两组患者均采用同期放化疗治疗,使用直线加速器6MV-X线行外照射和Ir192高剂量率后装治疗机行腔内放疗。外照射采用调强技术:第一阶段宫旁及淋巴引流区3000 cGy以上,第二阶段针对宫旁、阳性肿大淋巴结缩野加量(根据正常组织的耐受剂量推量),外照射剂量总量4500~5000 cGy,腔内放疗于外照射开始2~3周后进行,后装治疗5次,600cGy/次(换算后低剂量率等效生物学剂量为800 cGy),使A点剂量达到8500 cGy以上。两组患者临床靶区、肿瘤靶区接受的平均放射剂量相似,比较差异无统计学意义(P>0.05)。使用顺铂30~40 mg/m2,1次/周,共4~6周,同期放疗。两组明确肿瘤残留后均给予TP方案巩固化疗2周期:紫杉醇135~175 mg/m2d1+顺铂50~70 mg/m2d1~3,紫杉醇前12、6 h予地塞米松预处理,苯海拉明、西咪替叮化疗前抗过敏处理,化疗过程中均给于止吐、护胃、水化对症处理。(1)对照组患者在TP方案巩固化疗结束及结束后4周进行盆腔MRI和腔内彩超评价疗效。(2)试验组化疗结束后给予超声聚焦刀治疗10次,超声聚焦刀治疗前留取三维资料,以利于今后复查对比。发射时间范围50~100 ms,间歇时间范围100~200 ms,发射次数在50~100 ms,步距为2~5 ms,行距为2~5 ms,层距为6~9 ms,输出功率为600~1000 W,在5×5×10 mm2范围内均匀,焦距在3×3×8 mm2范围内。
1.3疗效评价
1.3.1 疗效评定标准 采用实体瘤RECIST标准(1.1版):完全缓解(CR):所有病灶消失维持4周;部分缓解(PR):病灶缩小30%,维持4周;疾病稳定(SD):非PR/PD;疾病进展(PD):病灶增加20%,增加前非CR/PR/SD。有效率=(CR例数+PR例数)/总例数×100%,疾病控制率= (CR例数+PR例数+SD例数)/总例数×100%。
1.3.2 疼痛评分 数字评估法(numerical rating scales,NRS):为1条10 cm长的水平线段,用0-10的数字代表不同程度的疼痛,让患者选择其最能代表疼痛的数字。一般将NRS中的0、1-3、4-6、7-10级分别对应无痛、轻、中、重度疼痛。轻度疼痛:有痛感但可忍受,能正常生活,睡眠不受干扰;中度疼痛:不能忍受疼痛,要求止痛剂,睡眠受干扰;重度疼痛:疼痛剧烈,可伴有自主神经功能紊乱(出汗、烦躁、休克)或被动休息,睡眠严重受干扰,须用镇痛剂。
1.4统计学处理 使用SPSS 19.0统计软件进行分析,计数资料采用 χ2检验以P<0.05为差异有统计学意义。
2 结果
2.1两组患者的疗效比较 97例患者均完成治疗,总体有效率为88.7%(86/97),总体疾病控制率为99.0%(96/97),其中试验组有效率为95.7%,对照组为82.0%,两组比较差异有统计学意义(P<0.05),见表2。
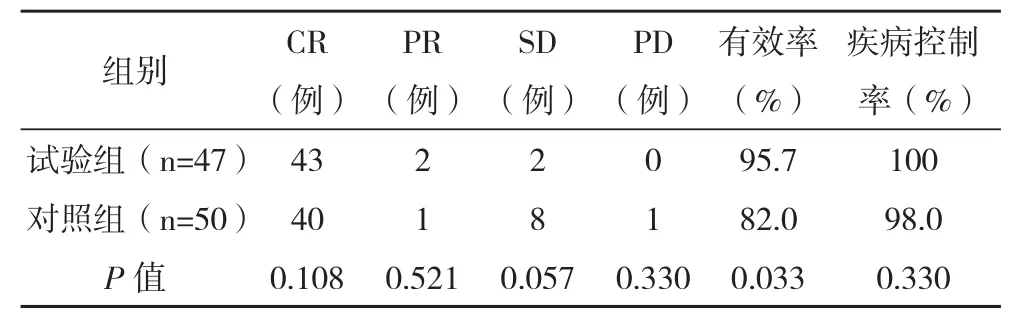
表2 两组患者的疗效比较
2.2两组患者的毒副反应比较 试验组的毒副反应中,粒细胞减少占29.8%,血红蛋白减少占40.5%,血小板减少占55.3%,肾功能损害占6.4%,肝功能损害占8.5%,恶心呕吐占31.9%,放射性皮炎占29.8%,口腔黏膜炎占42.5%。对照组的毒副反应中,粒细胞减少占44.0%,血红蛋白减少占40.0%,血小板减少占44.0%,肾功能损害占12.0%,肝功能损害占14.0%,恶心呕吐占44.0%,放射性皮炎占30.0%,口腔黏膜炎占54.0%。两组治疗后共同毒副反应主要表现为血液学毒性、胃肠道反应、放射性皮炎、口腔黏膜炎等,多为Ⅰ~Ⅱ级,Ⅲ~Ⅳ级的发生率低,见表3。试验组患者出现下腹疼痛者5例,无痛42例;皮肤灼伤反应2例,无灼伤45例。对照组无下腹疼痛、皮肤灼伤反应。

表3 两组患者的毒副反应情况比较 例
3 讨论
宫颈癌是危害全球妇女健康的第三大恶性肿瘤,几乎90%的宫颈癌死亡发生于经济不发达地区[4]。据WHO统计,全球每年宫颈癌新发病例可达50万例,其中我国就有14万例[5]。亚洲宫颈癌发病率和死亡率均占全世界的50%以上,而中国占全世界宫颈癌的29%[6]。宫颈癌在亚洲女性恶性肿瘤发生率中居第2位,仅次于乳腺癌,而死亡率位于第4位[7]。1999年,SWOG-8797(INT-0107)、GOG123、GOG120、RTOG-9001、GOG85以上5个大型Ⅲ期临床究试验结果证实,同步放化疗可以降低宫颈癌局部复发及远处转移率,改善患者生存率,使死亡危险下降,国内外宫颈癌防治指南将同步放化疗作为中晚期治疗的标准治疗模式[8]。中晚期宫颈癌ⅡB~ⅣA期患者选择同步放化疗,其被美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)推荐为宫颈癌治疗标准。同步放化疗指的是放疗的同时采用小剂量化疗,以巩固放疗的效果,化疗药物可提高放射敏感性,进而对局部病灶控制,使远处转移率降低,生存率提高。同步放化疗相互作用的生物学机制是:(1)放疗、化疗分别作用于肿瘤细胞周期的不同时相,两者同时进行具有时间和空间上的协同作用;(2)化疗缩小肿瘤体积增加肿瘤细胞再氧合,提高放疗敏感性;(3)放疗能增加肿瘤细胞膜的通透性,增加铂类等化疗药物的摄入;(4)化疗药物抑制放射所致的亚致死损伤和潜在致死损伤的修复。Duen as-Gonzalez等[9]研究发现顺铂同步放疗的生存期为56%,毒副反应为46.3%。王忠明等[10]研究同步放化疗治疗局部晚期宫颈癌总有效率高于单纯放疗95.2% vs 82.8%。本研究97例患者均完成同步放化疗治疗,近期有效率为88.7%,疾病控制率为99.0%,与上述报道相近。
局部晚期、中晚期宫颈癌经过同步放化疗治疗,仍有相当一部分患者出现宫颈肿瘤的残留,对于同步放化疗后宫颈肿瘤残留的治疗尚无统一标准,NCCN并没有对经同步放化疗后宫颈肿瘤残留的治疗达成共识。宫颈癌首次同步放化疗不能达到完全消退,患者的总生存率和无病生存率均会明显下降,放疗后宫颈肿瘤局部残留一直是困扰临床的一大难题,过去多采用手术或局部加量。手术切除,由于放疗后盆腔粘连严重,组织恢复差,解剖层次不清,局部血供丰富,手术困难,医疗风险大,外科医生多不考虑。局部加大放疗剂量,且当放射剂量达到一定程度时,肿瘤控制率将不再提高[11]。考虑正常组织量耐受剂量、放射性肠炎、肠溃疡、肠穿孔、直肠阴道瘘、阴道膀胱瘘的风险增大,且一旦发生会持续数年,无有效的治疗手段及措施,严重影响患者的生活质量。NCCN已将以顺铂为基础的同步放化疗作为局部晚期宫颈癌的标准治疗[8],紫杉醇是新型抗微管药物,通过促进微管蛋白聚合,抑制解聚,保持微管蛋白稳定,抑制细胞有丝分裂,能使细胞聚集在对放疗敏感的G2/M期而具有放射增敏作用,顺铂与紫杉醇联合化疗在宫颈癌中的应用日益广泛。另有研究报道采用紫杉醇联合顺铂巩固化疗对老年宫颈癌患者进行治疗,取得了良好的疗效并有良好的耐受性[12]。林贵山等[13]研究宫颈癌同步放化疗后2周期TP方案巩固化疗治疗结束后1个月肿瘤完全消除率分别为92.5%(37/40),Ⅲ~Ⅳ度骨髓抑制发生率为17.5%。本研究对于ⅡB~ⅣA期宫颈癌经同期放化疗后有肿瘤残留的病例47例,2周期TP方案化疗主要的毒副反应为骨髓抑制Ⅰ~Ⅱ级的发生率为27.7%(13/47)、Ⅲ~Ⅳ级的发生率为2.1%(1/47),消化道反应主要表现为Ⅰ~Ⅱ级的发生率为29.8%(14/47)、Ⅲ~Ⅳ级的发生率为2.1%(1/47),转氨酶升高多表现为Ⅰ~Ⅱ级其发生率为8.5%(4/47),47例患者的有效率为95.7%,疾病控制率为100%,与上述相关研究相近。
临床发现对于直径大于4 cm的巨块型肿瘤,很难通过放疗达到治愈的目的,分析原因认为与局部肿瘤大小、肿瘤细胞乏氧程度、个体放射敏感性的差异以及正常组织的限制不能给予肿瘤组织高剂量等诸多因素有关[14],直接影响治疗效果。宫颈癌治疗后仍有较高的复发率,疗效进入一个平台期[2-3],介入治疗、基因治疗、生物靶向治疗、热疗等新的治疗手段的不断涌现,为中晚期宫颈癌治疗模式和理念提供一些新的思路和方法。高强度聚焦超声(HIFU)是一种局部无创伤治疗肿瘤的新手段,是当前治疗肿瘤方法的新选择[15-18],治疗系统主要有功率源、治疗控制、定位及实时评估、运动等控制系统组成。其治疗原理主要是利用聚焦于生物组织中的高强度超声产生的热效应,使焦域处的组织瞬间凝固性坏死,焦域以外组织无显著损伤,凝固坏死组织可逐渐被吸收或瘢痕化。HIFU的作用机制包括:(1)热固化效应:超声聚焦时,利用焦点上超声产生的高温(聚焦温度达70~100 ℃),使靶区内肿瘤产生凝固性坏死,基本不损害周围正常组织,局部微血管和毛细血管的破坏妨碍了热量的扩散,增强了疗效;(2)强大的机械力:超声波是一种正弦机械波,聚焦后的声波机械力也随之大幅度提高,可在瞬间对靶细胞施加挤压,膨胀交替的变化压力使细胞破坏;(3)空化效应:是指液体中存在的微小气泡,在超声波作用下被激活所表现出的震荡、生长、收缩、崩溃等一系列动力学过程;(4)能提高机体对肿瘤的特异性及非特异性免疫能力,对于肿瘤免疫逃逸和打破肿瘤免疫封闭具有一定意义[19-20]。肿瘤组织由于其解剖组织学上的缺陷致使其供血不足、缺氧、偏暖、不耐热,癌瘤组织的血供仅为正常组织的2%~15%,这种在血液循环方面的显著差别是HIFU治疗及其他加热方法治疗肿瘤的基础[21]。HIFU技术应用于临床十余年,适应于实质性脏器的多种肿瘤的治疗[22]。袁选举等[23]报道超声聚焦刀联合介入治疗中晚期肝癌35例临床观察中15例患者随访超过6个月,半年生存率为86.7%(13/15),近期有效率(CR+PR)为84.6%(11/13)。文献[24]报道HIFU在胰腺癌中局部控制率为70.97%,有效率为51.61%。HIFU在其他实体瘤的研究中尚缺乏大规模的随机对照研究,在宫颈癌尚未见文献报道,本研究47例患者均完成治疗,主要的副反应为皮肤灼伤、疼痛患者经对症处理后均可耐受,试验组肿瘤消退达CR者43例,PR者2例,近期有效率(CR+PR)为95.7%。
本研究中HIFU联合化疗较单纯化疗的疾病控制率、有效率均有提高,差异均有统计学意义(P<0.05)。本研究认为,HIFU联合化疗使宫颈癌同步放化疗后宫颈肿瘤残留的治疗,能提高患者的近期疗效,不增加全身毒副反应,改善癌症患者的生活质量,是值得临床研究推广的安全有效方法,需进一步扩大临床样本,观察总生存期和无疾病生存期。
[1] Parkin D M,Bray F,Ferlay J,et al.Estimating the world cancer burden:Globocan 2000[J].Int J Cancer,2001,94(2):153-156.
[2] Green J A,Kirwan J M,Tierney J F,et al.Survival and recurrence after concomitant chemotherapy and radiotherapy for cancer of the uterine cervix: a systematic review and metaanalysis[J].Lancet,2001,358(9284):781-786.
[3]石远凯,孙燕.临床肿瘤内科手册[M].北京:人民卫生出版社,2015:526.
[4]林仲秋.《FIGO2015妇癌报告》解读连载一-宫颈癌诊治指南解读[J].中国实用妇科与产科杂志,2015,31(11):981-985.
[5] Anorlu R I.Cervical cancer:the sub-Saharan Afican perspective[J].Report Health Matters,2008,16(32):41-49.
[6] Kim K,Zang R,Choi S C,et al.Current status of gynecological cancer in Chian[J].J Gynecol Oncol,2009,20(2):72-76.
[7] Garland S M,Bhatla N,Nqan H Y.Cervical cancer burden and prevention strategies Asia oceania perpective[J].Cancer Epidemiol Biomarks Prev,2012,21(9): 1414-1422.
[8] Thomas G M.Improved treatment for cervical cancer-concurrent chemotherapy and radiotherapy[J].N Enql J Med,1999,340(15):1198-1200.
[9] Duen as-Gonza A,Zarba J J,Patel F,ea al.Phase Ⅲ,openlabel,randomized study comparing concurrent gemcitabine plus cisplatin and radiation followed by adjuvant gemcitabine and cisplatin versus concurrent cisplatin and radiationn patients with stage ⅡB to ⅣA carcinoma of the cervix[J].J Clin Oncol,2011,29(13):1678-1685.
[10]王忠明,刘桂荣,黄关宏,等.中晚期宫颈癌同步放化疗近期疗效前瞻性研究[J].南通大学学报(医学版),2010,23 (1):52-54.
[12]胡艳华.同步放化疗后巩固化疗对老年宫颈癌患者预后的影响[J].世界最新医学信息文摘,2015,15(54):45-46.
[13]林贵山,程惠华,傅志超.局部晚期宫颈癌同步放化疗后巩固化疗的疗效分析[J].中国妇产科临床杂志,2011,12(1):26-28.
[14]陈文娟,王捷忠,潘建基,等.中晚期巨块型宫颈癌热疗配合同步放化疗的近期疗效观察[J].中国医药指南,2012,10 (27):54-56.
[15]张卫华.高强度聚焦超声刀治疗晚期肝癌的护理体会[J].护理实践与研究,2012,9(1):61-62.
[16]王琳.高强度聚焦超声治疗肿瘤的临床研究进展[J].临床肿瘤学杂志,2002,7(2):155-157.
[17]李荔霞,黄雪琴,张为民,等.超声造影评价高强度聚焦超声治疗肝转移癌疗效1例[J].癌症进展,2008,6(1):99-100.
[18]佐志刚,邓守恒,李林均,等.高强度超声聚焦刀联合肝动脉化疗栓塞治疗肝癌30例疗效观察[J].山西医药杂志(下半月刊),2011,40(3):265-266.
[19]郑国强,姚丽华,郭峰,等.高强度超声聚焦治疗对肝脏肿瘤术后早期肝功能的影响[J].中国医学影像技术,2004,20 (2):279-281.
[20]潘春华,罗荣城.高强度聚焦超声治疗肿瘤原理及应用原则[J].中国肿瘤,2003,12(9):530-533.
[21]万德森等.临床肿瘤学[M].北京:科学出版社,2015:122.
[22] Wu F,Chen W Z,Bai J,et al.Pathological changes in human malignant carcinoma treated with high-intensity focused ultrasound[J].Ultrasound Med Biol,2001,27(8):1099-1106.
[23]袁选举,陈萍,曹风军,等.高强度超声聚焦刀联合鸦胆子油乳介入治疗中晚期肝癌35例临床观察[J].临床和实验医学杂志,2013,12(21):1765-1767.
[24]李亚岭,罗建平,李秋野,等.高强度聚焦超声热疗治疗31例胰腺癌的临床分析[J].胃肠病学与肝病学杂志,2008,17(9):711-713.
Clinical Observation of HIFU Combined with Chemotherapy in the Treatment of Cervical Cancer with Concurrent Chemoradiotherapy Cervical Residual Tumor
ZHANG Hong-li,CHEN Yan-ping,WU Li,et al.//Medical Innovation of China,2016,13(22):011-015
Objective:To investigate the short-term efficacy and safety of HIFU combined with chemotherapy in the treatment of cervical cancer with concurrent chemoradiotherapy cervical residual tumor. Method: 97 patients with cervical cancer were collected from January 2013 to March 2016 in our department of ⅡB-ⅣA who were treated with concurrent radiotherapy and chemotherapy,they were randomly divided into experimental group of 47 cases and control group of 50 cases.The experimental group was given TP (paclitaxel + cisplatin)+HIFU,control group was given TP (paclitaxel + cisplatin).The effective rate and side effects of two groups were compared.Result:Two groups were completed all treatment and follow-up,the effective rate of experimental group was 95.7%,control group was 82.0%, the difference was statistically significant (P<0.001).In terms of pain and skin burns, the experimental group was higher than the control group, but the patients were able to tolerate. There was no significant difference in toxicity and side effects(P>0.05).Conclusion:HIFU combined with chemotherapy in the treatment of cervical cancer concurrent chemoradiotherapy cervical residual tumor,can improve the patients’ curative effect in the near future, does not increase the systemic toxic and side effects,has good safety,it is worthy of further clinical research and promotion of safe and effective method.
High intensity focused ultrasound; Cervical cancer; Residual tumor; Adjuvant chemotherapy; Paclitaxel cisplatin
①贵州省人民医院 贵州 贵阳 550002通信作者:张汉群
(2016-05-16) (本文编辑:周亚杰)

