一种快捷的单细胞藻类计数方法
——运用Photoshop软件分析细胞显微图像轮廓
李茉莉,乔 琨
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
一种快捷的单细胞藻类计数方法
——运用Photoshop软件分析细胞显微图像轮廓
李茉莉1,乔琨2*
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
细胞计数是藻类培养、赤潮调查和环境监测中的一个重要环节。本文设计并测试了一种单细胞藻类计数方法:利用体视显微镜及配套的CCD数字成像系统,获取固定体积样品的全视野图像,运用Photoshop软件对细胞显微图像轮廓进行分析计数。根据细胞粒径差异,实验选取5种代表性单细胞藻类,分别采用新方法和显微镜计数法对其进行细胞密度测定。研究结果表明,新方法在测定亚心形扁藻(Platymonassubcordiformis)时,结果较显微镜计数明显偏低。而在测定东海原甲藻(Prorocentrumdonghaiense)、米氏凯伦藻(Kareniamikimotoi)、塔玛亚历山大藻(Alexandriumtamarense)和血红哈卡藻(Akashiwosanguinea)时,计数结果与显微镜计数结果非常接近,较可信。其计数结果与显微镜计数结果具有较好的线性相关性(R2≥0.981 1,P<0.01)。新方法能够有效测定粒径15 μm以上纯种或混合培养的单细胞藻类的生物量,简化了测定程序的同时,减少了人为误差,具有一定的应用价值。
单细胞藻类;藻类计数方法;Photoshop软件分析;细胞显微图像轮廓
在微藻培养和赤潮监测中,一般需要定时定点分析生物量来确定细胞生长状态及增殖情况。随着科技的进步,目前生物量测定的方法很多,包括显微镜计数法[1-2]、叶绿色a含量测定法[1-3]、可见分光光度法[4]、荧光分光光度法[5-8]、流式细胞显微计数法[9-11]、库尔特计数法[11]等。胡先文、侯建军等先后探讨过不同计数方法衡量某一种类微藻生物量的可行性[4,11-13]。然而,因微藻种类不同、形态多样、细胞大小、不同生长阶段细胞组分变化(如叶绿素含量)、甚至地域差异[14],很难有一种计数方法适合所有微藻。显微镜计数是较常用、最经典的细胞计数方法,是微藻生物量测定的基本方法,也是确定其他测定方法有效性的依据。但其费时费力,存在一定的人为误差,不适合分析大批量样品[13]。
因此,本实验在显微镜计数基础上,针对细胞的显微图像轮廓,设计并测试了一种单细胞藻类计数的新方法。利用体视显微镜及配套的CCD数字成像系统,获取固定体积样品的全视野图像,运用Photoshop软件,对细胞显微图像轮廓进行分析计数。根据细胞粒径差异,选取5种代表性单细胞藻类,采用新方法和显微镜计数法分别计数,分析两种计数方法之间的差异,并探讨了新方法的可行性及应用前景。
1 材料与方法
1.1藻种
实验用5种藻株由近海海洋环境科学国家重点实验室(厦门大学)海洋微型藻类保种中心(CCMA)提供。包括:亚心形扁藻(Platymonassubcordiformis)、东海原甲藻(Prorocentrumdonghaiense)、米氏凯伦藻(Kareniamikimotoi)、塔玛亚历山大藻(Alexandriumtamarense)和血红哈卡藻(Akashiwosanguinea)。
1.2方法
5种藻株皆用K培养基[15]培养,培养条件:温度23℃,盐度30,光照强度60 μE/(m2·s)和光暗周期14 h∶10 h。当细胞生长至指数期时,将藻液放在振荡器上摇匀后开始取样,测试浓度梯度分别为:20%、40%、60%、80%、100%,分别用新方法和显微镜计数法进行细胞测定。其中,新方法和显微镜计数的样品用2%的Lugol's固定剂固定。样品稀释采用灭菌海水。
1.2.1新方法
1)制备样品全视野图像
样品分析前先在振荡器上充分摇匀,取0.1 mL滴在1 mL无分格浮游植物计数框上,加上盖玻片,细胞在计数框上平铺,近均匀分布,少粘连、重叠。同时因样品体积较小,会在计数框上形成一个近椭圆形区域(图1a)。在体式显微镜(奥林巴斯SZX7,日本)下局部放大观察,发现基本没有细胞处于边界上及边界外。即:所有细胞处于椭圆区域内,区域内细胞数量即是单位体积生物量。打开配套的万能视频成像系统及scopephoto软件(LY-WN-HP CCD 8,成都励扬精密机电有限公司),调整视频流格式及静态图像至最大分辨率,手动调节白平衡(R:137、G:88、B:103),选择自动曝光,颜色设置为黑白模式。微调放大倍数及聚焦(物镜倍数调整为1.25X),使目标区域完全置于CCD相机视野内,当图像达到最清晰状态,抓图,保存图片为tif格式。
2)Photoshop软件分析
操作流程:①首先在具有计数工具功能的Photoshop版本(推荐Photoshop CS5 Extended)中打开图片,利用多边形套索工具选取细胞计数区域,尽量将视野范围内的细胞全部包含在选取范围内,并去除不必要的区域(图1a);②打开主菜单中—选择—反向,然后删除,得到待计数区域(图1b);③打开主菜单中—图像—调整—阴影/高光、曝光度和阈值,根据图片本身适当调节参数(图1c),调节时尽量提高色阶值同时确保没有新的黑色像素点出现(图1c);④再次打开主菜单中—图像—调整—阈值,同样根据图片本身适当调节参数(图中左下),尽量提高色阶值并确保没有新的黑色像素点出现(图1d);⑤使用魔术棒工具(容差值尽量保证能选中所有黑色像素点),点选白色区域后,主菜单—选择—反向来选择细胞点(图1e),打开主菜单—窗口—测量记录,选中后打开测量记录窗口,再打开主菜单—分析—选择数据点—自定,确保选区—计数勾选(图1f);⑥再次打开分析—记录测量,得到计数结果,在结果中右键选择导出保存为txt格式;⑦用Excel打开导出的结果,将面积大小进行排序后,删除面积最大,偏小和值为1的特征行,即得到原图中的细胞数量。
面积偏小和值为1的特征行有可能是图像采集和处理过程中产生的噪声点,通常是根据Excel导出结果的中间值来判断,其面积值远远低于中间值。此外,若出现面积相对较大的像素区域,有可能是两个及以上细胞粘连或叠加的像,为确保原图中细胞对应的像素点不被误删除,需人工校正。如需计数的图片数量较多,可以使用Photoshop脚本进行批量处理。
每个样品设置3个重复,取其平均值。

1.2.2显微镜计数法
取充分摇匀的样品0.1 mL滴在浮游植物计数框上,加盖玻片,在光学显微镜(尼康YS-100,日本)下进行细胞计数。每个样品设置3个重复,取其平均值。
2 结果与分析
2.1运用新方法对5种藻不同浓度梯度计数
实验选取的5种单细胞藻株:亚心形扁藻(长11~14 μm,宽7~9 μm)、东海原甲藻(长15~25 μm,宽8~15 μm)、米氏凯伦藻(长15.6~31.2 μm,宽13.2~24 μm)、塔玛亚历山大藻(长20~52 μm,宽17~44 μm)及血红哈卡藻(长55~77 μm,宽40~50 μm),细胞大小呈递增趋势。从Photoshop处理结果中可以看出:亚心形扁藻细胞个体很小,处理之后的像素点比处理前的细胞轮廓点明显减少。而东海原甲藻及另外的3株藻,处理前后几乎保持一致(图2)。

2.2两种方法测定5种藻液不同浓度梯度的线性相关性分析
根据两种计数方法对5种藻的分析结果(表1),分别以新方法和显微镜计数的结果为自变量,对各浓度梯度进行线性回归分析(表2),其结果分别为:亚心形扁藻y=50 350x+5 258,R2=0.956 8,y=76 970x+1 798,R2=0.980 6;东海原甲藻y=59 480x-2 578,R2=0.984 6;y=58 540x-926,R2=0.995 8;米氏凯伦藻y=1 488x-40,R2=0.994 1;y=7 800x-108,R2=0.990 2;塔玛亚历山大藻y=12 800x+524,R2=0.986 1;y=13 145x+773,R2=0.986 7;血红哈卡藻y=1 875x-151,R2=0.976 2;y=1 635x+15,R2=0.973 7。各组数据的线性相关系数均大于0.900,表明两种测定方法与细胞密度梯度线性关系良好。其中,对亚心形扁藻的密度测定,显微镜计数法测定的结果线性关系最好、最准确。新方法测定结果的线性关系稍差。而对另外4株藻类进行计数,两种测定方法线性关系较接近。
以新方法的计数结果为自变量(x),对显微镜计数的标准结果(y)进行线性回归,结果分别为:亚心形扁藻y=1.494 2x-5 015.6,R2=0.979 0;东海原甲藻y=0.975 7x+1 893.7,R2=0.993 8;米氏凯伦藻y=1.048 2x-65.185,R2=0.995 8;塔玛亚历山大藻y=1.025 8x+204.01,R2=0.998 5;血红哈卡藻y=0.864 8x+153.67,R2=0.981 1。3个相关系数均大于R0.01=0.758(IBM SPSS Statistics 19),说明相关性极显著,两种测定方法结果有可比性。在测定东海原甲藻、米氏凯伦藻、塔玛亚历山大藻和血红哈卡藻时,新方法的测定值与显微镜计数结果线性关系较好。而在测定亚心形扁藻时,新方法的测定值与显微镜计数结果线性关系稍差。
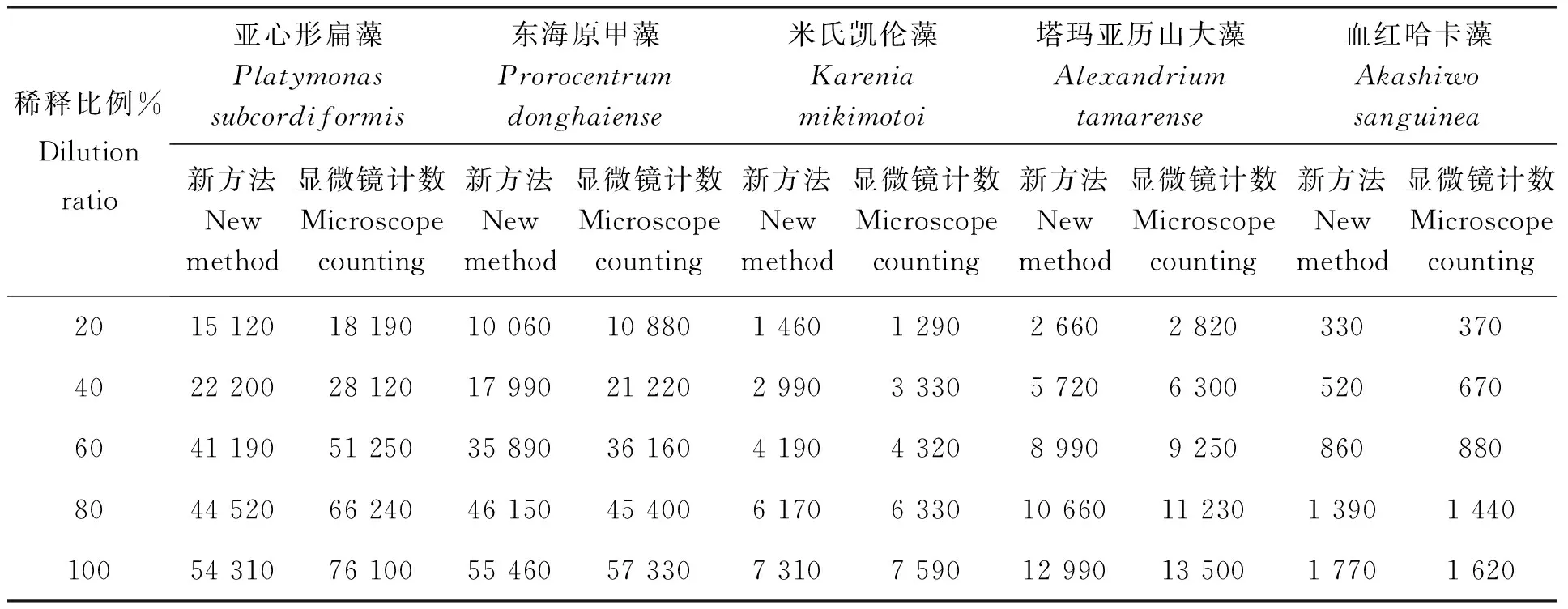
表1 两种计数方法的测定结果

表2 两种计数方法测定结果的线性回归分析
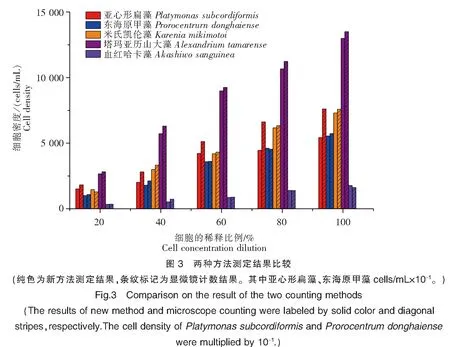
2.3两种方法测定5种藻液不同浓度梯度的结果比较
结合表1数据,从图3柱状图可以看出,对5种藻不同浓度计数时,新方法在测定东海原甲藻、米氏凯伦藻、塔玛亚历山大藻和血红哈卡藻时,计数结果与显微镜计数结果非常接近,但在测定亚心形扁藻时,结果明显偏低。
3 讨论
细胞计数是医学、环境科学和生物学等领域研究中的重要环节[11]。简单、快捷、准确的细胞计数方法会给研究工作带来极大的便利。对于微藻而言,细胞形态多样,细胞大小相差很大(几微米到几百微米不等),又有单细胞、群体之分[14]。因此,很难有一种简易、快捷、高效计数方法能适合所有微藻,对不同种类的微藻,一般选择的计数方法也不尽相同。显微镜计数是微藻生物量测定的基本方法,也是衡量其他测定方法有效性的依据。但其操作费时费力,重现性不好,存在一定的人为误差[11,13]。本文在显微镜成像基础上,直接利用显微镜配套的CCD数字成像系统获取样品全视野图像,运用Photoshop软件把细胞图像轮廓处理成像素点,直接对像素点进行计数。如样品较多,可以使用Photoshop脚本进行批量处理,简化了测定程序的同时,省去了人工观察的步骤,减少了人为误差。同时,新方法是绕开细胞的大部分内在属性,直接计算微藻细胞显微图像转换成的像素点,避免了因微藻种类、细胞形态差异、不同生长阶段叶绿素含量变化甚至样品地域差异对叶绿色a含量测定法[1-3]及光密度法[14]等生物量测定方法的限制。另外,新方法使用成本较低,所需硬件及软件一般实验室都有配备。
从本实验的测定结果可以看出,新方法在测定东海原甲藻、米氏凯伦藻、塔玛亚历山大藻和血红哈卡藻时,结果与显微镜计数数据接近,比较可信(P<0.01)。而在测定亚心形扁藻时,结果明显偏低。主要是因为细胞本身个体较小,样品体积跟硬件限制(体视显微镜成像系统分辨率等),Photoshop处理之后的像素点较分析前细胞轮廓点明显减少,造成新方法在测定亚心形扁藻时与显微镜计数结果明显偏低。因此,在本实验的硬件和软件配置下,新方法的有效计数的细胞大小阈值在15 μm左右。
新方法在实际应用中具有一定的现实意义。除了能够有效测定粒径15 μm以上纯种或混合培养的单细胞藻类的生物量外,粒径15 μm以上的固体颗粒和粉尘等都可以进行准确计数。因此在环境监测、水产养殖、工业制造等领域有一定的应用价值。当然,这种方法的应用也有一些限制因素,如对15 μm以下的藻类细胞计数时,结果偏低;只能对单细胞藻类进行计数,在实际显微图像中,受玻片制样和体视显微系统景深的影响,可能会出现细胞粘连、重叠的现象。对Photoshop计数结果中面积较大的点,需人工对照原图进行修正,或采用距离变换和分水岭算法相结合的分割方法对粘连、重叠颗粒的分割[16]。这已经超出了Photoshop软件的功能,需要进一步研究新的算法。
致谢:香港浸会大学李剑平研究员在论文修改中提出了宝贵意见,在此深表谢忱。
[1]周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1998:170-190.
[2]章宗涉,黄祥飞.淡水浮游生物研究方法[M].北京:科学出版社,1991:333-347.
[3]李淑菁,陈子修,毛显得,等.实验室叶绿素a浓度测定[J].海洋环境科学,1988,7(2):78-82.
[4]胡先文,董元彦,张新萍,等.可见分光光度法测定水华鱼腥藻[J].华中农业大学学报,2002,21(3):295-297.
[5]金海龙,王玉田.基于荧光法的活体海藻识别方法研究光学技术[J].2006,32(4):581-583.
[6]陈丽芬,郑锋.叶绿素荧光技术快速测定水体藻类生物量的应用[J].城镇供水,2007,(6):51-52.
[7]陈纬栋,王崇,胡晓芳,等.应用荧光分析技术检测蓝藻生物量[J].净水技术,2010,29(6):80-84.
[8]杨晓冬.浅析荧光法测定蓝藻生物量的可行性[J].环境科学导刊,2011,30(5):89-91.
[9]陈慧婷,陶益,朱佳.藻细胞计数及死/活分析的流式细胞仪方法[J].深圳职业技术学院学报,2013,12(1)23-27.
[10]李胜男,王秀娟,周建,等.利用流式细胞仪计数微型浮游生物的方法[J].湖泊科学,2015,27(5):757-766.
[11]侯建军,黄邦钦,戴相辉.赤潮藻细胞计数方法比较研究[J].中国公共卫生,2004,20(8):907-908.
[12]董正臻,董振芳,丁德文.快速测定藻生物量的方法探讨[J].实验与技术,2004,28(11):1-5.
[13]曾玲,龙丽娟,梁计林,等.有毒甲藻细胞密度测定方法的比较研究[J].广东农业科学,2012,21:148-150.
[14]沈萍萍,王朝晖,齐雨藻,等.光密度法测定微藻生物量[J].暨南大学学报(自然科学版)2001,22(3):115-119.
[15]Keller M D,Selvin R C,Claus W,et al.Media for the culture of oceanic ultraphytoplankton[J].Phycol,1987,23:633-638.
[16]武宗茜,王鹏,丁天怀.活动轮廓模型在重叠藻细胞计数种的应用[J].计算机工程,2012,38(3):209-211.
A method of quick determination of unicellular algae counting——using Photoshop software to analyze microscopic image contour model
LI Moli1,QIAO Kun2*
(1.College of Biological Sciences and Biotechnology,Hunan Agricultural University,Changsha 410128,China;2.Key Laboratory of Cultivation and High-value Utilization of Marine Organisms in Fujian Province,Fisheries Research Institute of Fujian,Xiamen 361013,China)
Cell counting is an important step in algae culture,red tide investigation and water environment monitoring.A quick counting method of single cell algae was proposed and tested:the image of fixed volume sample was captured by the stereomicroscope and imaging instrument.And then Photoshop software was used to analyze the contour model of microscopic image.In this study,5 representative microalgae species with different cell sizes were selected and the cell densities were measured by our new method and conventional microscope counting method,respectively.The results indicated that the counted numbers of cell density by our new method were apparently lower than those by microscope measurement forPlatymonassubcordiformis.However,for other four algae species(Prorocentrumdonghaiense,Kareniamikimotoi,Alexandriumtamarense,Akashiwosanguinea),the counting results of the two methods were quite close,presenting a significant linear correlation between them(R2≥0.981 1).Thus,for unicellular alga with sizes larger than 15 μm,the new method could determine the biomass of pure and mixed cultivation effectively.Compared with the microscope counting method,the new method simplifies the measure procedures and reduces the artificial errors.Therefore,it has a certain application value in counting of single-cell or particles.
unicellular algae;cell counting method;Photoshop software analysis;microscopic image contour model
2016-03-31
海洋经济创新发展区域示范项目(12PYY001SF08);福建省海洋经济创新发展区域示范项目(2014FJPT01);厦门南方海洋研究中心项目(14PZY017NF17).
李茉莉(1994-),女,本科生,研究方向为藻类生理生态. E-mail:limoli94520@163.com
乔琨(1984-),女,助理研究员,研究方向为海洋生物技术. E-mail:qiaokun@xmu.edu.cn
S917.3
A
1006-5601(2016)03-0236-08
李茉莉,乔琨.一种快捷的单细胞藻类计数方法——运用Photoshop软件分析细胞显微图像轮廓[J].渔业研究,2016,38(3):236-243.

