miR-193b在宫颈癌中的表达与功能及其对化疗敏感性的影响*
杜文霞,姬 霞
(河南省中医院妇产科,河南郑州450002)
miR-193b在宫颈癌中的表达与功能及其对化疗敏感性的影响*
杜文霞△,姬 霞
(河南省中医院妇产科,河南郑州450002)
目的:探讨微小RNA-193b(miR-193b)在不同宫颈组织中的表达以及其对顺铂作用于宫颈癌细胞敏感性的影响,并初步探讨其作用机制。方法:实时荧光定量PCR(qPCR)检测不同宫颈组织中miR-193b的表达水平。采用脂质体将miR-193b-inhibitor转染至HeLa细胞,Transwell法、CCK-8法和免疫蛋白印迹法分别检测细胞迁移数、细胞对顺铂的敏感性以及细胞中PTEN、Akt、p-Akt和P-糖蛋白(P-gp)的蛋白水平。结果:qPCR结果显示miR-193b在正常宫颈组织及宫颈糜烂组织中呈低表达,在宫颈上皮内瘤变和宫颈癌组织中的表达明显上升;转染miR-193b-inhibitor后,HeLa细胞迁移数明显减少(P<0.05),顺铂对HeLa细胞活力的抑制作用进一步增强(P<0.05),细胞中PTEN的蛋白表达明显上调(P<0.05),Akt的蛋白表达无明显变化,p-Akt和P-gp的蛋白水平明显下调(P<0.05)。结论:miR-193b在宫颈癌组织中呈高表达,沉默miR-193b可增加HeLa细胞对顺铂的敏感性,作用机制可能与PTEN-PI3K/Akt通路有关。
微小RNA-193b;宫颈癌;HeLa细胞;顺铂
宫颈癌在全球范围内发病率位于女性恶性肿瘤中第2位,85%以上的患者处于发展中国家[1]。中国每年宫颈癌的发病率占全球四分之一以上,一般为35岁以上妇女,但近年来有逐渐年轻化的趋势[2]。目前公认的发病机理是高危型人乳头瘤病毒(human papillomavirus,HPV)感染,已有2种治疗宫颈癌的预防性疫苗上市,主要针对HPV-16和18亚型,但由于疫苗价格昂贵,针对性强而无法推广[3]。化疗是晚期宫颈癌治疗的主要手段之一,但治疗中产生的耐药性对临床的治疗效果有严重的阻碍。
微小RNA(microRNA,miRNA)是一类非编码、具调控功能的小分子单链RNA,长度为21~22个碱基对,主要参与生长发育、器官形成、细胞增殖与凋亡等许多生物学过程。近年研究发现其与肿瘤发生发展密切相关。随着对miRNA与肿瘤的研究逐渐深入,已有报道指出miRNA可以影响肿瘤细胞对化疗药物的敏感性[4]。miR-193b编码基因位于人16pI3、12,是一种非编码小分子 RNA。研究发现miR-193b通过抑制cyclin D1来抑制癌细胞增殖,且通过下调髄样细胞白血病序列表达来调控黑色素瘤的发生[5]。
本研究通过检测不同宫颈组织中miR-193b的表达,利用miR-193b-inhibitor转染HeLa细胞后,观察细胞对顺铂敏感性的变化,初步探讨其机制。
材料和方法
1 材料
1.1 材料 HeLa细胞株购于上海细胞生物研究所;胎牛血清、DMEM培养基和Opti-MEM培养基购于Gibco;LipofectamineTM2000、TRIzol和qPCR引物购于 Invitrogen;质粒 pcDNA3.1-miR-193b-inhibitor和空载质粒pcDNA3.1购于上海吉玛制药技术有限公司;顺铂(diamminedichloroplatinum,DDP)购于齐鲁制药有限公司;人第10号染色体缺失的磷酸酶(phosphate and tension homology deleted on chromsome ten,PTEN)、蛋白激酶 B(protein kinase B,PKB/ Akt)、p-Akt、P-糖蛋白(P-glycoprotein,P-gp)、β-actin抗体购于Santa Cruz;CCK-8溶液购于Dojindo;其它试剂均为分析纯。
1.2 样本收集 选取2010年1月~2014年12月河南省中医院正常宫颈组织样本30例,经病理鉴定为宫颈糜烂组织样本40例,宫颈上皮内瘤变样本38例,宫颈癌组织样本54例,年龄为30~65岁。取得组织后立即置于-80℃液氮中冷冻保存。所有患者在收集样本前未进行任何放射治疗,化学治疗,且所有样本获取时经过本院伦理委员会的同意。
2 方法
2.1 qPCR测定各宫颈组织中miR-193b的表达
取适量正常宫颈组织、宫颈糜烂组织、宫颈上皮内瘤变和宫颈癌组织,按照TRIzol说明书裂解细胞,使用氯仿提取总RNA,用紫外分光光度法测定RNA样品的A260nm值,并进行定量。建立逆转录反应,miR-193b的上游引物为5’-CTCGCTTCGGCAGCACA-3’,下游引物为5’-AACGCTTCACGAATTTGCGT-3’;内参照U6上游引物为5’-GTCGTATCCAGTGCAGGGTCCGAGGT-3’,下游引物为 5’-ATTCGCACTGGATACGACCAGACTC-3’。扩增条件为95℃5 min;94℃30 s、60℃30 s、72℃1 min,35个循环。采用2-ΔΔCt方法计算相对表达量。
2.2 细胞培养、分组与转染 HeLa细胞株用含10%胎牛血清的DMEM液体培养基培养,置于5%CO2、37℃恒温培养箱中培养。设空白对照(control)组、脂质体组(Lipo组)、转染空载质粒pcDNA3.1组(pcDNA3.1组)和转染 miR-193b-inhibitor质粒组(miR-193b-inhibitor组)。取相应组别处于稳定对数生长期的细胞,消化后置于96孔板中,待细胞密度到达约为60%时,更换新鲜无血清培养基继续培养12 h,将上述各组(空白对照组除外)分别溶解于Opti-MEM培养基中,加入LipofectamineTM2000,按说明书操作,进行转染。
2.3 Transwell小室检测细胞迁移能力 将处于对数生长期的各组细胞,计数后调整细胞浓度为0.5× 109/L,于Transwell小室的上室中加入100 μL细胞悬液,下室中加入含10%胎牛血清的RPMI-1640培养液。在5%CO2、37℃恒温培养箱中培养24 h,PBS洗2次,10%甲醛固定15 min,结晶紫染色30 min,于倒置显微镜下观察、计数。
2.4 CCK-8法检测转染后HeLa细胞对DDP的敏感性 将处于对数生长期的各组细胞接种于96孔板,细胞贴壁后,分别加入DDP(0.01 μmol/L,0.1 μmol/L,1 μmol/L,10 μmol/L),空白对照组不加入DDP,继而培养24 h后,或加入DDP 5 μmol/L,分别培养12 h、24 h、36 h、48 h后,弃去上清液,每孔加入CCK-8溶液10 μL,在5%CO2、37℃恒温培养箱中培养4 h,用酶标仪于450 nm处测量吸光度(A)值。
2.5 Western blot检测相关蛋白表达 离心收集经相应处理的各组细胞,提取总蛋白并测定蛋白浓度,每泳道加入50 μg蛋白进行SDS-PAGE分离,电转至PVDF膜上,用含5%脱脂奶粉的PBS缓冲液封闭1 h,加入相应I抗,4℃过夜,再加入相应II抗,室温1 h化学发光法显色,成像扫描分析系统保存图像并分析。
3 统计学处理
采用SPSS 15.0软件进行分析,计量资料采用均数±标准差(mean±SD)表示,方差齐性检验后做方差分析,用Bonferroni校正的t检验进行各组均数间两两比较,以P<0.05为差异有统计学意义。
结果
1 qPCR检测各宫颈组织中miR-193b的表达水平
采用qPCR测定正常宫颈组织、宫颈糜烂组织、宫颈上皮内瘤变和宫颈癌组织中miR-193b的表达水平。结果表明正常宫颈组织和宫颈糜烂组织中miR-193b的表达水平很低,二者间差异无统计学显著性;宫颈上皮内瘤变和宫颈癌组织中miR-193b的表达水平显著高于正常宫颈组织和宫颈糜烂组织,且二者的表达呈上升趋势,见图1。
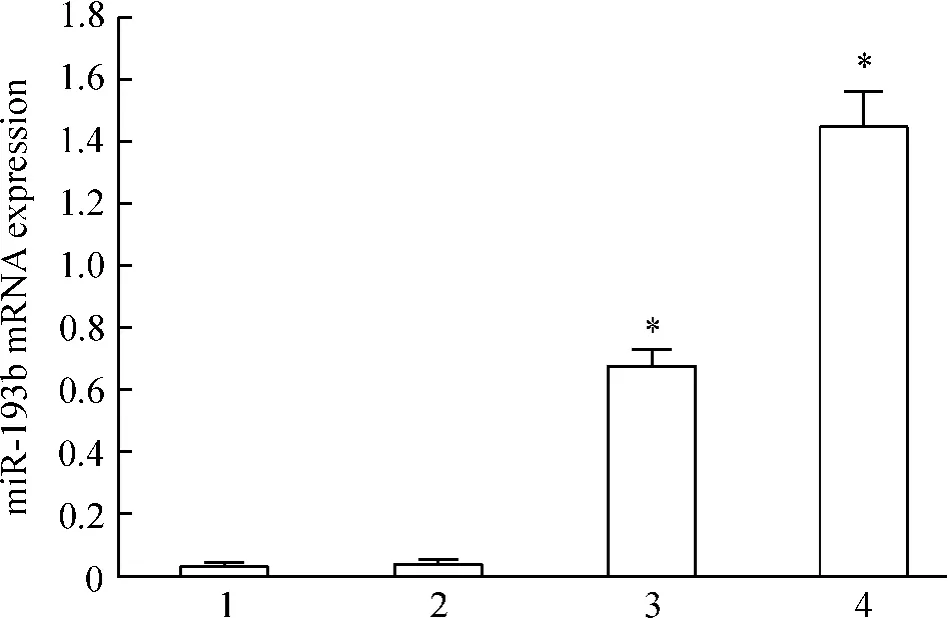
Figure 1.miR-193b expression in various cervical tissues.1: normal cervical tissues(n=30);2:cervical erosion tissues(n=40);3:cervical intraepithelial neoplasia tissues(n=38);4:cervical cancer tissues(n= 54).Mean±SD.*P<0.05 vs normal cervical tissues.图1 各宫颈组织中miR-193b的表达水平
2 miR-193b-inhibitor抑制HeLa细胞的迁移能力
Transwell法检测下调miR-193b对HeLa细胞的迁移能力的影响,结果显示转染miR-193b-inhibitor后,细胞迁移数显著低于control组(P<0.05),pcDNA3.1组、Lipo组和control组之间差异无统计学显著性,见图2。
3 miR-193b-inhibitor增强HeLa细胞对DDP的敏感性
分别给予不同浓度(0.01~10 μmol/L)DDP培养24 h,细胞活力被显著抑制,并随DDP浓度增大而抑制作用增强,与0.01 μmol/L浓度组相比差异有统计学显著性(P<0.05);另外,给予5 μmol/L DDP分别与细胞培养12 h、24 h、36 h、48 h后,细胞活力同样被显著抑制,并随DDP培养时间增加而增强,与12 h组相比差异有统计学显著性(P<0.05)。转染了miR-193b-inhibitor则可进一步增强DDP对HeLa细胞活力的抑制作用,与相应control组相比差异具有统计学显著性。提示沉默miR-193b增强HeLa细胞对DDP的敏感性。见表1、2。
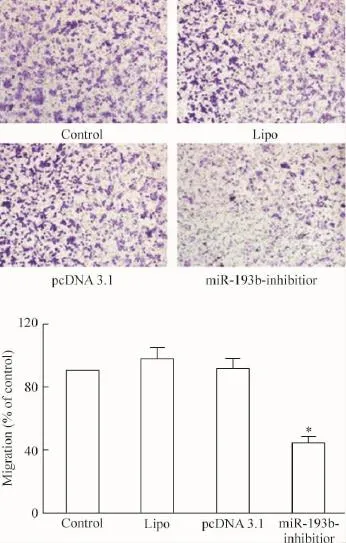
Figure 2.The effect of miR-193b-inhibitor on the migration of HeLa cells(×200).Mean±SD.n=3.*P<0.05 vs control group.图2 下调miR-193b对HeLa细胞迁移率的影响

表1 沉默miR-193b增强HeLa细胞对不同浓度DDP的敏感性Table 1.miR-193b-inhibitor augmented the sensitivity of HeLa cells to DDP at different concentrations(Mean±SD.n=3)
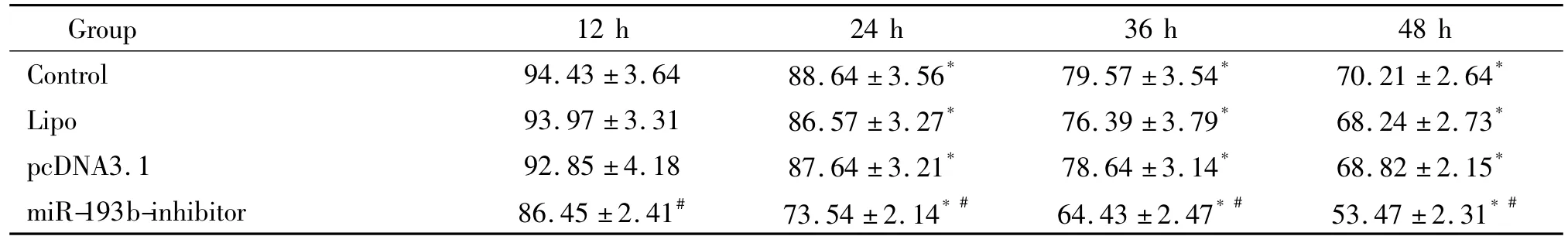
表2 沉默miR-193b DDP处理不同时间的HeLa细胞的敏感性的影响Table 2.Eeffect of miR-193b-inhibitor on the sensitivity of HeLa cells to DDP for different time(Mean±SD.n=3)
4 下调miR-193b对HeLa细胞中PTEN、Akt、p-Akt和P-gp蛋白水平的影响
转染miR-193b-inhibitor后,进一步通过Western blot检测PTEN、Akt、p-Akt和P-gp的蛋白水平,结果显示PTEN的蛋白表达明显上调(P<0.05),Akt的蛋白水平没有变化,p-Akt和P-gp的蛋白水平明显下调(P<0.05),见图3。
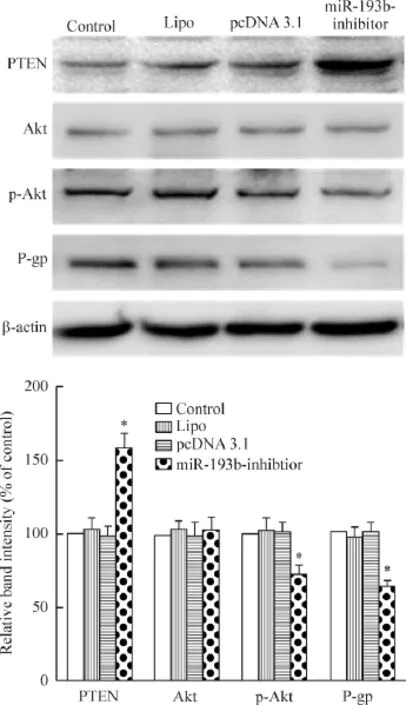
Figure 3.The effects of miR-193b-inhibitor on the protein levels of PTEN,Akt,p-Akt and P-gp of HeLa cells.Mean ±SD.n=6.*P<0.05 vs control group.图3 沉默miR-193b对HeLa细胞PTEN、Akt、p-Akt和P-gp蛋白水平的影响
讨论
多项研究发现,在宫颈癌细胞中,微小RNA的表达异常与癌变的进展及细胞的耐药性有关。刘琳等[6]发现在宫颈癌组织和HeLa细胞中,miR-21呈高表达,促进肿瘤增殖,miR-143和miR-373呈低表达,起抑癌基因的作用。刘颖等[7]研究发现miR-193b在子宫内膜癌HEC-1A细胞中表达明显增高。我们研究发现miR-193b在宫颈癌组织中呈高表达,而在正常组织和宫颈糜烂组织中呈低表达,表明miR-193b在宫颈癌变中具有特异性。下调 miR-193b后子宫内膜癌细胞侵袭能力下降。体外研究发现HNscc的FaDu细胞系敲除miR-193b可以导致癌细胞增殖、迁徙和侵袭能力降低,同样体内实验中敲除miR-193b亦可抑制肿瘤细胞的形成[8]。本实验中Transwell染色法结果表明沉默miR-193b后,HeLa细胞的迁移细胞数明显减少,提示miR-193b与宫颈癌细胞的迁移细胞数呈正相关。
顺铂是目前化疗中最常用的药物之一,化疗药物治疗可为患者最大程度地保留卵巢和子宫阴道,但由于肿瘤细胞存在耐药性,治疗效果欠佳。我们发现,转染miR-193b-inhibitor后可增强顺铂对HeLa细胞的抑制作用。PTEN在多种肿瘤细胞中的常常呈异常表达状态,PTEN蛋白是PI3K/Akt信号途径的负性调节因子,使PI3K的3-磷酸化位点去磷酸化[9]。PI3K/Akt信号途径在细胞的增殖、衰老、凋亡等生命活动中起重要作用[10]。P-gp是由多药耐药基因编码的跨膜蛋白,与肿瘤对化疗的敏感性密切相关。已有研究证明在前列腺癌细胞中,PI3K/Akt信号通路途径激活后,P-gp的蛋白表达增加[11]。Western blot检测结果发现,HeLa细胞中PTEN的蛋白表达明显上调,Akt的蛋白表达没有变化,p-Akt和P-gp的蛋白水平明显下调,提示PTEN激活后,使PI3K/Akt信号通路途径的活性受到抑制,进而抑制了p-Akt和P-gp的蛋白水平,提高了HeLa细胞对顺铂的敏感性。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] 郑荣寿,张思维,吴良有,等.中国肿瘤登记地区2008年恶性肿瘤发病和死亡分析[J].中国肿瘤,2012,21 (1):1-12.
[3] Ciesielska U,Nowinska K,Podhorska-Okolow M,et al.The role of human papillomavirus in the malignant transformation of cervix epithelial cells and the importance of vaccination against this virus[J].Adv Clin Exp Med,2012,21(2):235-244.
[4] Ju J,Jiang J,Fesler A.miRNA:the new frontier in cancer medicine[J].Future Med Chem,2013,5(9):983-985.
[5] Chen J,Feflouer HE,Pare GC,et al.MicroRNA-193b represses cell proliferation and regulates cyclin D1 in melanonla[J].Am J Pathol,2010,176(5):2520-2529.
[6] 刘 琳,王月玲,王江芬.miR-21,miR-126,miR-143和miR-373在正常宫颈组织、宫颈癌组织及HeLa细胞中的表达差异[J].四川大学学报:医学报,2012,43 (4):536-539.
[7] 刘 颖,朱月华,曹 卉.miR-193b对子宫内膜癌侵袭的影响[J].医学研究杂志,2013,43(8):145-148.
[8] Lenarduzzi M,Hui AB,Alajez NM,et al.MicroRNA-193b enhances tumor progression via down regulation of neurofibromin 1[J].PLoS One,2013,8(1):e53765.
[9] Bonnet M,Loosveld M,Montpellier B,et al.Posttranscriptional deregulation of MYC via PTEN constitutes a major alternative pathway of MYC activation in T-cell acute lymphoblastic leukemia[J].Blood,2011,117(24): 6650-6659.
[10]吴共发,黄绮亭,曾宇婷,等.miR-21通过PTEN/AKT通路抑制白血病细胞K562的迁移和增殖[J].医学研究生学报,2013,26(10):1037-1040.
[11]Lee JT,Steelman IS,McCubrey JA.Phosphatidylinositol 3-kinase activation leads to muhidrug resistance protein-1 expression and subsequent chemoresistanee in advanced prostate cancer cells[J].Cancer Res,2004,64(22): 8397-8404.
(责任编辑:陈妙玲,余小慧)
Expression and significance of miR-193b in cervical cancer
DU Wen-xia,JI Xia
(Department of Obstetrics and Gynecology,Henan Province Hospital of TCM,Zhengzhou 450002,China.E-mail:hnduwenxia@163.com)
AIM:To investigate the expression of microRNA-193b(miR-193b)in the cervical tissues,and further to explore the effect of silencing miR-193b on diamminedichloroplatinum(DDP)-treated HeLa cell viability.METHODS:The expression levels of miR-193b in different cervical tissues were examined by qPCR.After transfection of miR-193b-inhibitor,the cell migration was determined by Transwell assay,the sensitivity of HeLa cells to DDP was measured by MTT assay,the protein levels of phosphate and tension homology deleted on chromsome ten(PTEN),protein kinase B (Akt),p-Akt and p-glycoprotein(P-gp)were determined by Western blot.RESULTS:The mRNA level of miR-193b was significantly increased in the cervical cancer tissues compared with normal cervical tissues(P<0.05).Knockdown of miR-193b obviously inhibited migration and enhanced sensitivity to DDP of HeLa cells(P<0.05).Additionally,after transfection of miR-193b-inhibitor,the expression of PTEN was increased,whereas the protein levels of p-Akt and P-gp were decreased(P<0.05).CONCLUSION:miR-193b is highly expressed in the cervical cancer tissues.Inhibition of miR-193b augments the sensitivity to DDP of HeLa cells,at least in part,through PTEN-PI3K/Akt signaling pathway.
MicroRNA-193b;Cervical cancer;HeLa cells;Diamminedichloroplatinum
R730.23
A
10.3969/j.issn.1000-4718.2016.07.014
1000-4718(2016)07-1241-05
2015-11-24
2016-03-01
河南省中医药管理局科研课题(No.2014ZY02013)
△Tel:0371-60908722;E-mail:hnduwenxia@163.com

