蛋白基因产物9.5与宫颈癌临床病理表现的关系及其作用机制的实验研究*
靳 荣, 李红芳, 张立东
(1天津市第五中心医院妇产科,天津300450;2兰州市第一人民医院妇产科,甘肃兰州730050;3天津市第五中心医院病理科,天津300450)
蛋白基因产物9.5与宫颈癌临床病理表现的关系及其作用机制的实验研究*
靳 荣1△, 李红芳2, 张立东3
(1天津市第五中心医院妇产科,天津300450;2兰州市第一人民医院妇产科,甘肃兰州730050;3天津市第五中心医院病理科,天津300450)
目的:研究蛋白基因产物9.5(PGP9.5)在宫颈癌病理标本中的表达与宫颈癌临床病理特征及预后的关系,并初步探讨利用PGP9.5-siRNA靶向治疗宫颈癌的潜在价值。方法:回顾性分析2008年1月~2015年6月在天津市第五中心医院妇科及天津市中心妇产科医院接受手术治疗并经病理确诊的180例宫颈癌患者临床资料。所有患者宫颈癌病理标本制作病理切片并进行SP法免疫组化染色。以PGP9.5染色后评分为依据将患者分为PGP9.5高表达组和PGP9.5低表达组。观察2组患者年龄、HPV感染、病理分级、肿瘤直径、淋巴结转移、浸润深度、累及脉管和临床分期等临床病理学参数的关系。采用Kaplan-Meier法和log-rank检验进行生存分析。采用PGP9.5-siRNA、NC-siRNA、PGP9.5真核表达质粒和对照空质粒按照脂质体载体试剂说明书转染SiHa细胞,设立si-PGP9.5组、NC组、PGP9.5组和vector组。同时设立SiHa细胞空白对照(control)组。分别采用Western blot实验、平板克隆形成实验和Transwell实验分析5组细胞PGP9.5蛋白的表达水平、克隆形成能力和侵袭能力。结果: 2组患者病理分级、肿瘤直径、淋巴结转移、浸润深度、累及脉管和临床分期等临床病理参数与PGP9.5表达水平有关。PGP9.5高表达组患者3、5年总体生存率明显低于PGP9.5低表达组患者。与control组相比,si-PGP9.5组Si-Ha细胞中PGP9.5蛋白的表达量明显降低,克隆形成数量明显减少,过膜细胞数量明显减少;PGP9.5组SiHa细胞中PGP9.5蛋白的表达量明显升高,克隆形成数量明显增多,过膜细胞数量明显增加。结论:PGP9.5蛋白高表达预示宫颈癌患者预后不良,可能成为预测宫颈癌患者预后的良好指标,对其表达进行抑制可能实现对宫颈癌的有效基因治疗。
宫颈癌;克隆形成;细胞侵袭;小干扰RNA;蛋白基因产物9.5
宫颈癌是妇产科最常见恶性肿瘤之一,严重危害患者健康[1]。虽然宫颈细胞学筛查的普遍应用使宫颈癌的发病率和死亡率明显下降,但宫颈癌的死亡率仍占据妇科恶性肿瘤首位[2]。因此,积极探索宫颈癌相关的致病基因,以发现有效的早期诊断和基因治疗指标是目前研究的重要内容[3]。研究发现,泛素水解酶家族成员蛋白基因产物9.5(protein gene product 9.5,PGP9.5)在多种恶性肿瘤中出现异常高表达,抑制其表达水平可能实现对相应肿瘤生长的抑制[4-6]。然而,PGP9.5表达水平与宫颈癌临床病理特征的关系及其意义之间的关系尚未见报道。本研究采用免疫组化法检测PGP9.5在宫颈癌病理标本中的表达情况,研究其与宫颈癌临床病理特征及预后的关系,并初步探讨利用PGP9.5 siRNA靶向治疗宫颈癌的潜在价值。
材料和方法
1 材料来源
1.1 病理标本及临床资料来源 回顾性分析2008 年1月~2015年6月在天津市第五中心医院妇科及天津市中心妇产科医院接受手术治疗并经病理确诊的180例宫颈癌患者临床资料。所有患者均签署由医院伦理委员会批准的患者知情同意书,符合医学伦理学规定。患者平均年龄(49±16)岁,均有3年以上性生活史,其中鳞癌128例,腺癌52例。肿瘤分期FIGO早期(Ⅰ~ⅡA期)115例,FIGO晚期(ⅡB~Ⅳ期)65例[7-8]。对FIGO早期患者采用根治性手术治疗,术式采用次广泛或广泛子宫切除加盆腔淋巴结清扫术;对FIGO晚期患者进行辅助放疗,同步放化疗等治疗[9]。纳入标准:(1)局限于宫颈部位的宫颈癌,未发现转移病灶;(2)标本切取前未接受放疗、化疗等治疗;(3)心肺等重要脏器功能可以耐受手术;(4)术后坚持接受随访。排除标准:(1)术前曾接受放疗、化疗;(2)病历资料不完全,或不能配合随访。所有患者术后均接受2个月1次的电话或门诊随访,随访截止日期为2015年9月30日或失访、死亡。
1.2 细胞及主要试剂 宫颈癌SiHa细胞株购自ATCC,由天津市第五中心医院中心实验室保存。兔抗人PGP9.5抗体和β-actin蛋白抗体购自Novus Biologicals;EnVision免疫组化试剂盒和组织HE染色试剂盒购自Gene Tech。PGP9.5小分子干扰RNA (PGP9.5-siRNA)、阴性对照(negative control,NC) siRNA(NC-siRNA)、PGP9.5真核表达质粒及其对照空质粒由广州爱科生物技术有限公司合成。
2 研究方法
2.1 免疫组化法检测PGP9.5的表达 将所有患者宫颈癌病理标本及癌旁正常宫颈组织制作4 μm厚度病理切片,严格按照Gene Tech的EnVision免疫组化试剂盒和HE染色试剂盒说明书进行SP法免疫组化染色。每张免疫组化切片在光镜下(×400)随机选取3个视野拍照保存后,根据染色强度和阳性细胞百分率对免疫组化结果进行半定量分析。由2位病理学医生独立进行免疫组化染色评分后取均值。以PGP9.5染色后细胞质出现棕黄色颗粒或团块判断为染色阳性[10]。综合染色强度和阳性细胞数进行评分:染色强度未着色者计0分,着色浅者计1分,中度着色者计2分,强染色者计3分;阳性细胞数<25%计0分,25%~50%计1分,51%~75%计2分,>75%为3分。每张切片计分=染色强度+阳性细胞百分率。每张切片3个视野的平均分数作为该切片的最终评分。以评分>3.5的患者作为PGP9.5高表达组,以评分为0或≤3.5的患者作为PGP9.5低表达组。
2.2 观察患者PGP9.5表达与临床病理学参数及预后的关系 观察2组患者年龄、HPV感染、病理分级、肿瘤直径、淋巴结转移、浸润深度、累及脉管和临床分期等临床病理学参数的关系。患者术后接受随访并记录存活情况。随访截止日期为2015年9月30日或失访、死亡。
2.3 SiHa细胞的培养、转染及分组 复苏培养SiHa宫颈癌细胞株,用含10%胎牛血清的DMEM培养基培养。取对数生长期的SiHa细胞,采用PGP9.5-siRNA(si-PGP9.5)、NC-siRNA、PGP9.5真核表达质粒和对照空质粒(vector)按照脂质体载体试剂说明书进行转染,设立si-PGP9.5组、NC组、PGP9.5组和vector组。同时用未转染的SiHa细胞设立空白对照(control)组。
2.4 蛋白印迹法检测5组细胞中功能蛋白的表达
分组转染SiHa细胞48 h后收集细胞提取蛋白,按照常规方法进行Western blot实验,分析PGP9.5和β-actin蛋白的表达。每组细胞实验重复3次。
2.5 平板克隆形成实验检测克隆形成能力 取分组转染48 h后的SiHa细胞。各组SiHa细胞制备单细胞悬液,调整细胞密度,分别取400个细胞接种于6孔板中,并均匀分散细胞。于常规培养条件中培养14 d后固定克隆,结晶紫染色。光镜下计数每孔形成的细胞克隆数。设定细胞数大于60个为1个有效克隆。每组细胞实验重复3次。
2.6 Transwell法检测细胞侵袭能力 Transwell小室每室中加入50 μL预稀释的Matrigel。在温箱中37℃孵育2 h使其凝固。取分组转染48 h后的Si-Ha细胞,接种入Transwell小室上室。下室加入含血清培养基380 μL。常规培养10 h后取出小室,去除未过膜细胞后多聚甲醛固定。使用结晶紫对过膜细胞进行染色,以穿过小孔的细胞数量代表侵袭能力。每组细胞实验重复3次。
3 统计学处理
应用SPSS 13.0软件对实验数据进行分析。实验数据以均数±标准差(mean±SD)表示,多组数据比较采用单因素方差分析,各组均数间的两两比较采用SNK法。2组患者的年龄、HPV感染、病理分级、肿瘤直径、淋巴结转移、浸润深度、累及脉管和临床分期等数据的比较采用2检验;生存分析采用Kaplan-Meier法和log-rank检验。以P<0.05为差异有统计学意义。
结果
1 宫颈癌组织PGP9.5的表达与临床病理学参数的关系
高、低表达 PGP9.5组患者宫颈癌组织的PGP9.5免疫组化染色结果及其对应标本的HE染色结果如图1所示,典型高表达组宫颈癌标本可见肿瘤细胞胞浆内棕色染色,而低表达组标本棕色或黄色染色不明显。本研究同时对正常宫颈癌组织进行PGP9.5免疫组化染色,均为染色阴性或黄色染色不明显。由表1可见2组患者病理分级、肿瘤直径、淋巴结转移、浸润深度、累及脉管和临床分期等临床病理参数与PGP9.5表达水平有关(P<0.05)。
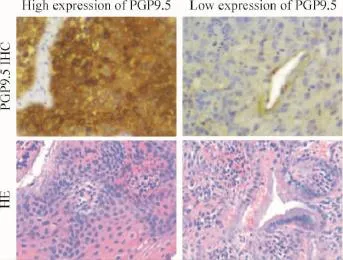
Figure 1.Immunohistochemical(IHC)staining and hematoxylin-eosin(HE)staining in cervical cancer tissues of PGP9.5 high expression group and PGP9.5 low expression group(×400).图1 高表达PGP9.5组和低表达PGP9.5组宫颈癌组织免疫组化染色和HE染色结果
2 宫颈癌组织PGP9.5的表达与患者术后总体生存的关系
所有患者均接受随访,随访时间为1~30个月,中位随访时间27个月。PGP9.5高表达组患者3、5年总体生存率分别为71.91%和66.10%,PGP9.5低表达组患者3、5年总体生存率分别为90.84%和79.93%,PGP9.5高表达组患者的总体生存率明显低于PGP9.5低表达组患者(P<0.05),见图2。
3 SiHa细胞PGP9.5蛋白含量的比较
与control组相比,si-PGP9.5组 SiHa细胞中PGP9.5蛋白的表达量明显降低,PGP9.5组SiHa细胞中PGP9.5蛋白的表达量明显升高,而NC组和vector组的表达量无明显差别。可见si-PGP9.5组细胞的PGP9.5蛋白表达受到抑制,PGP9.5组细胞的PGP9.5蛋白表达受到促进,见图3。
4 PGP9.5对SiHa细胞克隆形成能力的影响
与control组相比,转染48 h后进行实验的si-PGP 组SiHa细胞克隆形成数量明显减少,且形成的克隆细胞数量普遍较少;PGP9.5组SiHa细胞克隆形成数量明显增多,且形成的克隆细胞数量普遍较多。但是NC组和vector组的克隆形成数量与control组相比无明显减少。可见si-PGP9.5组细胞的增殖能力受到抑制,PGP组细胞的增殖能力受到促进,见图4。
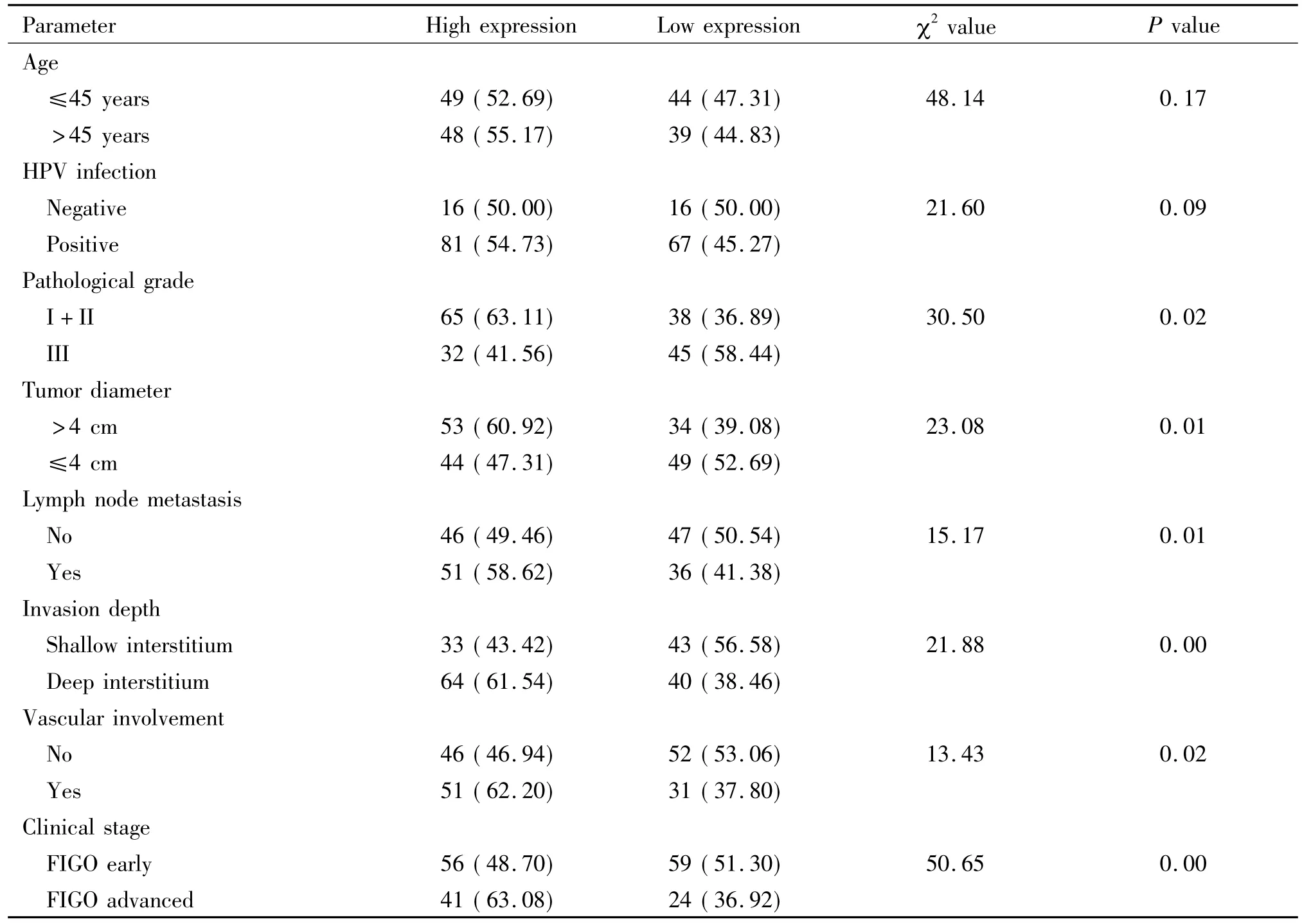
表1 宫颈癌组织PGP9.5的表达与临床病理学参数的关系Table 1.The expression of PGP9.5 in cervical cancer and its relationship with clinicopathological parameters[n(%of total)]
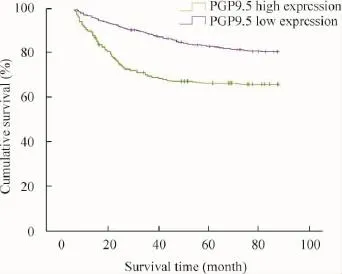
Figure 2.Overall survival of the patients in PGP9.5 high expression group and PGP9.5 low expression group(Kaplan-Meier analysis).图2 高表达PGP9.5组和低表达PGP9.5组的生存曲线比较
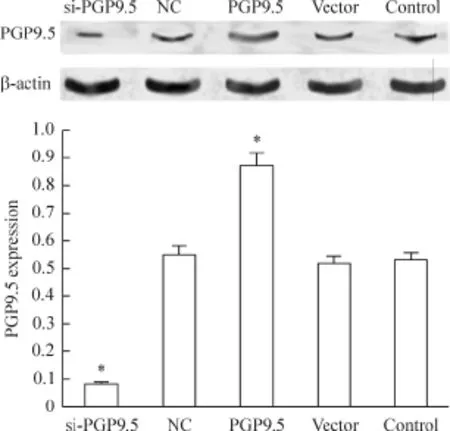
Figure 3.The protein expression of PGP9.5 in the SiHa cells with different treatments.Mean±SD.n=3.*P<0.05 vs control group.图3 不同处理对SiHa细胞PGP9.5蛋白表达的影响
5 PGP9.5对SiHa细胞侵袭能力的影响
如图5所示,与control组相比,siRNA转染48 h 后si-PGP9.5组SiHa细胞过膜细胞数量明显减少,而PGP9.5组SiHa细胞过膜细胞数量明显增多。但是NC组和vector组过膜细胞数量与control组相比无明显差别。可见si-PGP9.5组细胞的侵袭能力受到抑制,PGP组细胞的侵袭能力受到促进。
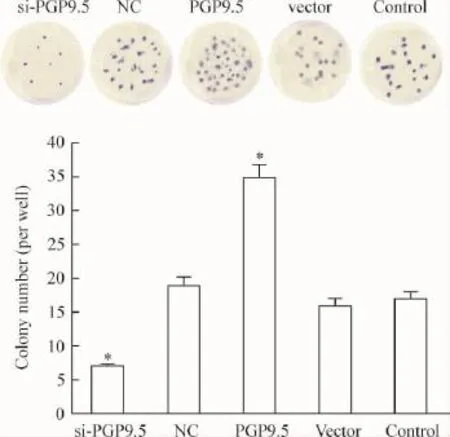
Figure 4.The effect of PGP9.5 on the ability of colony formation in the SiHa cells.Mean±SD.n=3.*P<0.05 vs control group.图4 PGP9.5对SiHa细胞克隆形成能力的影响
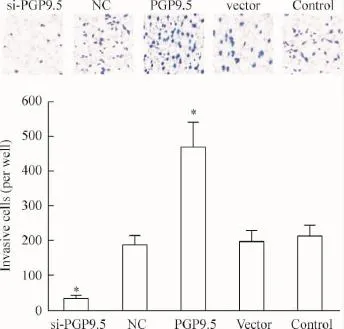
Figure 5.The effect of PGP9.5 on invasion ability of SiHa cells.Mean±SD.n=3.*P<0.05 vs control group.图5 PGP9.5对SiHa细胞侵袭能力的影响
讨论
PGP9.5基因由2 450个碱基组成,其表达产物为含有212个氨基酸的蛋白,在神经元中表达丰富,其作为泛素水解酶系统的重要成员,通过介导泛素-蛋白酶体系统调节细胞周期[11]。在人体其它组织中,PGP9.5的异常表达影响多种恶性肿瘤的发生、发展和侵袭、转移[12-13]。研究发现PGP9.5的表达水平与胃癌和结肠癌的发生、分化程度、侵袭程度、淋巴结转移呈正相关关系[14-17]。在胰腺癌中,PGP9.5表达水平也与胰腺癌的病理分期及进展程度呈正相关,并与术后生存率呈负相关[18]。PGP9.5在肺癌组织中的表达水平显著高于癌旁组织及良性病变组织,其异常表达在肺癌的发生、发展中发挥重要作用[19]。在皮肤鳞状细胞癌的研究同样发现,PGP9.5在皮肤鳞状细胞癌中的表达水平明显高于正常皮肤组,并且其在低分化鳞癌组中的表达水平明显高于在高分化鳞癌组中的表达水平[20-21]。然而,PGP9.5与宫颈癌发生、发展之间的关系却较少研究[22]。
本研究检测分析了180例宫颈癌患者肿瘤组织标本中PGP9.5蛋白的表达水平,以免疫组化评分为依据将患者分为PGP9.5高表达组和PGP9.5低表达组。在对2组患者的临床病理学指标进行比较后发现,PGP9.5高表达组患者病理分级、肿瘤直径、淋巴结转移、浸润深度、累及脉管和临床分期等临床病理参数表现较差,且其术后3年和5年总体生存率较低,预后不良。说明宫颈癌患者肿瘤组织中PGP9.5表达的上调可能促进了肿瘤的发生、发展,并影响了宫颈癌患者的术后生存。国内孔祥菊等[23]在子宫内膜癌患者中的研究也得出相似结论,发现PGP9.5的表达与子宫内膜癌的分期、分化程度和淋巴结转移情况的关系具有统计学意义,与子宫内膜癌的组织学类型无关,认为PGP9.5可作为子宫内膜癌的标记物。刘立伟等[24]对乳腺癌患者所做的研究也发现,PGP9.5的表达与乳腺癌患者的预后密切相关。所以,检测PGP9.5可能是一种有具有辅助监测宫颈癌发生发展,并进行预后评价的有效手段。
在临床研究的基础上,本研究应用RNA干扰技术将合成的PGP9.5-siRNA转染SiHa宫颈癌细胞,通过Western blot实验测定细胞中的PGP9.5蛋白表达水平,发现RNA干扰实现了确切的抑制PGP9.5蛋白表达的效果。本研究进一步利用平板克隆形成实验和Transwell实验检测了沉默PGP9.5表达后对SiHa细胞的生长和侵袭能力影响。结果表明SiHa细胞在PGP9.5-siRNA干扰后,克隆形成数量和过膜细胞数量明显减少,克隆形成能力和侵袭能力明显减弱。相对应地,我们设计了可以增加宫颈癌细胞内PGP9.5蛋白表达水平的过表达质粒,验证PGP9.5在宫颈癌细胞中作用,发现PGP9.5表达水平的增高确实与宫颈癌细胞的生长和侵袭能力呈正相关,验证了临床数据的结果,并作为反向实验验证了PGP9.5-siRNA作为宫颈癌治疗手段的可能性。如上研究结果与临床研究的数据共同说明了PGP9.5的表达水平与宫颈癌的增殖和侵袭相关,对其表达进行下调可能实现对宫颈癌细胞增殖和侵袭的抑制。焉春华等[25]和张弦等[26]的研究也认为,PGP9.5在非小细胞肺癌和胃癌侵袭及转移过程中发挥重要作用,这些在不同类型肿瘤中的研究结果与本研究的发现具有一致性。所以,对PGP9.5的表达进行抑制,有可能实现对宫颈癌发生发展的抑制。
[1] Haar C,Swift S.The prevention of cervical cancer in developing nations[J].J S C Med Assoc,2013,109(4): 132-134.
[2] Wu Y,Li Z,Wu H,et al.Sentinel lymph node biopsy in cervical cancer:a meta-analysis[J].Mol Clin Oncol,2013,1(6):1025-1030.
[3] Kim DH,Lee JH,Ki YK,et al.Short-course palliative radiotherapy for uterine cervical cancer[J].Radiat Oncol J,2013,31(4):216-221.
[4] Heidari B,Rahmati-Ahmadabadi M,Akhondi MM,et al.Isolation,identification,and culture of goat spermatogonial stem cells using c-kit and PGP9.5 markers[J].J Assist Reprod Genet,2012,29(10):1029-1038.
[5] Tokumaru Y,Yamashita K,Kim MS,et al.The role of PGP9.5 as a tumor suppressor gene in human cancer[J].Int J Cancer,2008,123(4):753-759.
[6] Mitsui Y,Shiina H,Hiraki M,et al.Tumor suppressor function of PGP9.5 is associated with epigenetic regulation in prostate cancer:novel predictor of biochemical recurrence after radical surgery[J].Cancer Epidemiol Biomarkers Prev,2012,21(3):487-496.
[7] 杨凌云,王红静,贾西彪,等.35岁以下年轻宫颈癌患者临床病理特征及预后分析[J].广东医学,2012,33 (18):2802-2804.
[8] 林仲秋.FIGO/IGCS妇科恶性肿瘤分期及临床实践指南之三:宫颈癌[J].国际妇产科学杂志,2008,35 (3):226-228.
[9] 周 晖,彭永排,俞 进,等.《2014年NCCN宫颈癌临床实践指南》解读[J].实用妇产科杂志,2014,30 (6):422-425.
[10]Guo Y,Wang J,Zhang L,et al.Theranostical nanosystem-mediated identification of an oncogene and highly effective therapy in hepatocellular carcinoma[J].Hepatology,2016,63(4):1240-1255.
[11]Drobysheva A,Ahmad M,White R,et al.Cardiac sympathetic innervation and PGP9.5 expression by cardiomyocytes after myocardial infarction:Effects of central MR blockade[J].Am J Physiol Heart Circ Physiol,2013,305(12):H1817-H1829.
[12]Zevallos HB,Mckinnon B,Tokushige N,et al.Detection of the pan neuronal marker PGP9.5 by immuno-histochemistry and quantitative PCR in eutopic endometrium from women with and without endometriosis[J].Arch Gynecol Obstet,2015,291(1):85-91.
[13] Yamazaki T,Hibi K,Takase T,et al.PGP9.5 as a marker for invasive colorectal cancer[J].Clin Cancer Res,2002,8(1):192-195.
[14]Truran PP,Johnson SJ,Bliss RD,et al.Parafibromin,galectin-3,PGP9.5,Ki67,and cyclin D1:using an immunohistochemical panel to aid in the diagnosis of parathyroid cancer[J].World J Surg,2014,38(11):2845-2854.
[15]Mizukami H,Shirahata A,Goto T,et al.PGP9.5 methylation as a marker for metastatic colorectal cancer[J].Anticancer Res,2008,28(5A):2697-2700.
[16]Yamashita K,Park HL,Kim MS,et al.PGP9.5 methylation in diffuse-type gastric cancer[J].Cancer Res,2006,66(7):3921-3927.
[17]Akishima-Fukasawa Y,Ino Y,Nakanishi Y,et al.Significance of PGP9.5 expression in cancer-associated fibroblasts for prognosis of colorectal carcinoma[J].Am J Clin Pathol,2010,134(1):71-79.
[18]Tezel E,Hibi K,Nagasaka T,et al.PGP9.5 as a prognostic factor in pancreatic cancer[J].Clin Cancer Res,2000,6(12):4764-4767.
[19]Sasaki H,Yukiue H,Moriyama S,et al.Expression of the protein gene product 9.5,PGP9.5,is correlated with T-status in non-small cell lung cancer[J].JPN J Clin Oncol,2001,31(11):532-535.
[20]Bittencourt RS,Caballero OL,Dong SM,et al.Methylation status in the promoter region of the human PGP9.5 gene in cancer and normal tissues[J].Cancer Lett,2001,170(1):73-79.
[21]Hibi K,Westra WH,Borges M,et al.PGP9.5 as a candidate tumor marker for non-small-cell lung cancer[J].Am J Pathol,1999,155(3):711-715.
[22]Brait M,Maldonado L,Noordhuis MG,et al.Association of promoter methylation of VGF and PGP9.5 with ovarian cancer progression[J].PLoS One,2013,8(9):e70878.
[23]孔祥菊,孔宪超.PGP9.5在子宫内膜癌中的表达及其临床意义[J].国际妇产科学杂志,2012,39(3):300-301,314.
[24]刘立伟,赵倩倩,梁茜子,等.神经标志物蛋白基因产物9.5在乳腺癌组织中的表达及其临床病理意义[J].中华病理学杂志,2014,43(5):318-320.
[25]焉春华,王秋实,王宏伟,等.非小细胞肺癌中PGP9.5的表达与其神经内分泌分化关系的研究[J].哈尔滨医科大学学报,2011,45(4):342-345.
[26]张 弦,陶凯雄,王国斌.MMP-2与PGP9.5在胃癌组织中的表达及其与肿瘤侵袭转移的相关性研究[J].实用癌症杂志,2006,21(4):363-365.
(责任编辑:陈妙玲,罗 森)
Relationship between expression of PGP9.5 and clinicopathological features of cervical carcinoma,and in vitro study of underlying mechanism
JIN Rong1,LI Hong-fang2,ZHANG Li-dong3
(1Department of Obstetrics and Gynecology,Tianjin Fifth Central Hospital,Tianjin 300450,China;2Department of Obstetrics and Gynecology,Lanzhou First People's Hospital,Lanzhou 730050,China;3Department of Pathology,Tianjin Fifth Central Hospital,Tianjin 300450,China.E-mail:jin.rong0815@163.com)
AIM:To detect the protein expression of protein gene product(PGP9.5)in cervical carcinoma samples,and to explore its relationship with clinicopathological features and prognosis of cervical carcinoma patients.The potential value of PGP9.5-siRNA in the treatment of cervical cancer was preliminarily investigated in vitro.METHODS: The clinical data of cervical cancer patients(n=180)who ties of colony formation and cell invasion were determined by Western blot,colony formation assay and Transwell experiment.RESULTS:The relationships between the expression level of PGP9.5 and patients’pathological characteristics including grade,tumor size,lymph node metastasis,depth of invasion,vascular involvement and clinical stage were statistically significant(P<0.05).The overall survival rates of 3 and 5 years in PGP9.5 high expression group were significantly lower than those in PGP9.5 low expression group(P<0.05).Compared with control group,the protein expression of PGP9.5,the number of colony formation and the number of invasive cells in si-PGP9.5 group were significantly decreased.The protein expression of PGP9.5,the number of colony formation and the number of invasive cells in PGP9.5 group were significantly increased.CONCLUSION:Over-expression of PGP9.5 protein indicates poor prognosis of cervical cancer,which may be a good predictor for the prognosis of cervical cancer patients.Inhibition of PGP9.5 expression may be an effective way of gene therapy for cervical cancer.
surgical treatment in Department of Gynecology of Tianjin Fifth Central Hospital and Tianjin Central Hospital of Gynecology and Obstetrics from January 2008 to June 2015 were retrospectively analyzed.Immunohistochemical staining for PGP9.5 in all pathological specimens from cervical cancer biopsy was performed.The patients were divided into high expression of PGP9.5 group and low expression of PGP9.5 group.The relationship between PGP9.5 expression and clinicopathological parameters,such as age,HPV infection,pathological grade,tumor diameter,lymph node metastasis,depth of invasion and clinical stage,were analyzed.The overall survival was analyzed by Kaplan-Meier method and the log-rank test.The PGP9.5-siRNA,NC-siRNA,PGP9.5 eukaryotic expression plasmid and empty vector were transfected into the SiHa cells,and the effects of PGP9.5 expression on the abili-
Cervical cancer;Colony formation;Cell invasion;Small interfering RNA;Protein gene product 9.5
R730.23
A
10.3969/j.issn.1000-4718.2016.07.013
1000-4718(2016)07-1235-06
2016-03-18
2016-05-09
天津市滨海新区卫生局科技项目(No.2014BWKY015)
△Tel:15122136381;E-mail:jin.rong0815@163.com

