pH影响唾液淀粉酶活性下降或丧失的机理初探
陈加敏 朱承慧
(安徽省合肥市第一中学 230601)
绝大多数酶是具有一定空间结构的蛋白质,因蛋白质空间结构易受到pH等环境的影响,因此酶具有易变性的特点。若在不同pH条件下测定酶的反应速度,然后将测得的反应速度相对于pH作图,一般会得到“钟罩形”曲线。在特定pH下,酶促反应速度达到最大值,此值称为酶促反应的最适pH。但对于“钟罩形”的pH范围内,偏离最适pH导致酶活性下降的机理存在争议。因此,实验探究设想如下:根据酶失活后不能恢复活性的特点,偏离最适pH,若导致酶活性下降的原因是反应液中所有酶分子的整体活性下降;那么将不同pH处理的酶溶液,再放入最适pH条件下进行酶促反应,酶的活性将会100%的恢复;若酶的活性不能完全恢复,则应是部分酶失活所致。
1 材料方法
1.1 实验试剂 各种稀释倍数的唾液淀粉酶棉花过滤液、2%淀粉(含0.3% NaCl)溶液、0.2 mol/L Na2HPO4溶液、0.1 mol/L柠檬酸溶液、0.05% HCl溶液和0.05% NaOH溶液、KI-I2溶液(棕黄色)、斐林试剂(蓝色)、蒸馏水等。
不同pH磷酸氢二钠-柠檬酸缓冲液及其回调至pH 6.2的试剂用量见表1,如10mL pH 4的缓冲液配制方法为3.85mL 0.2mol/L Na2HPO4溶液和6.15mL 0.1mol/L柠檬酸溶液混合而成。若将pH 4的缓冲液再调至pH 6.2,可在pH 4的缓冲液中加入9.37mL 0.2mol/L Na2HPO4溶液和0.63mL 0.1mol/L柠檬酸溶液混合液。
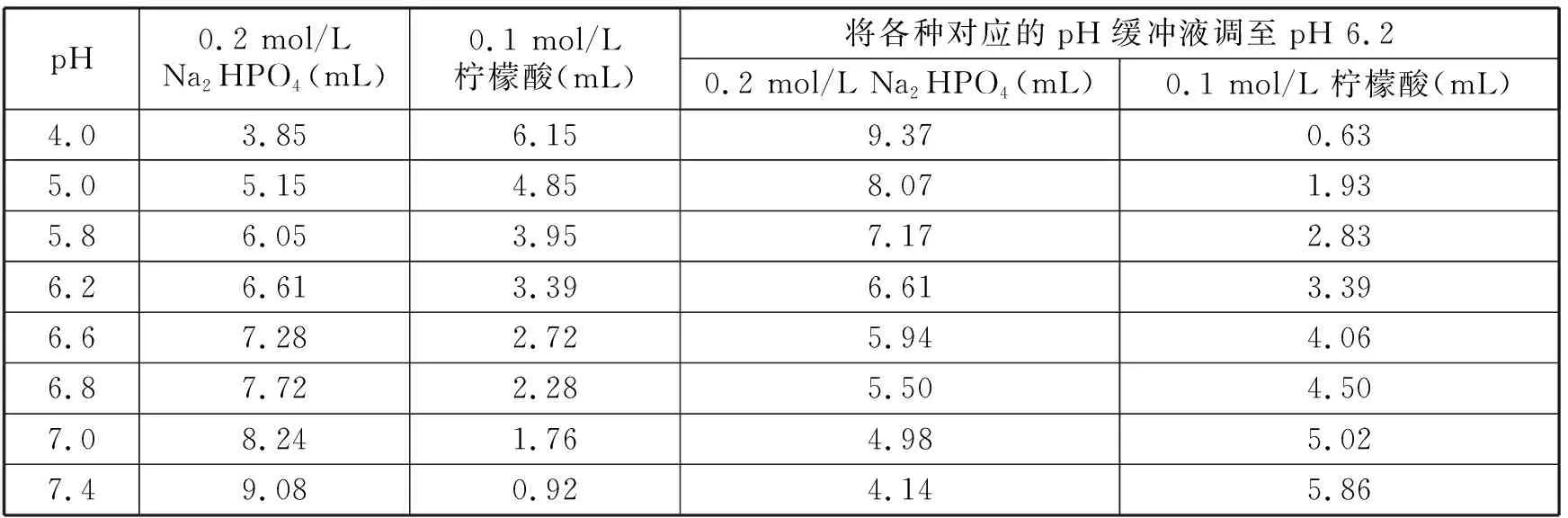
表1 磷酸氢二钠-柠檬酸缓冲液配制及回调
1.2 实验用具 量筒、烧杯、玻璃棒、试管及试管架、移液枪、滴管、水浴锅、点滴板、电磁炉、pH计等。
1.3 检测方法 KI-I2溶液鉴定方法:用滴管吸取反应液和KI-I2溶液各1滴至点滴板上,观察颜色的变化;斐林试剂鉴定方法:取适量斐林试剂1mL加入含有反应液的试管中,60℃水浴5min。
2 实验结果
2.1 唾液淀粉酶最适pH和适宜酶浓度的探究 由于酶含量会影响pH对酶活性影响的判断,如高浓度的酶溶液,即使少量酶失活或活性下降也可能充分将底物反应完毕。因此,若要探究酶活性下降的可逆性机理,适合的酶浓度的探究至关重要。首先,将唾液淀粉酶分别稀释10、25、50、75、100、125、150和200倍,探究不同pH缓冲液(表1)对唾液淀粉酶各种稀释倍数的影响。1mL唾液淀粉酶稀释液+1mL不同pH缓冲液+1mL 2%淀粉溶液混合,37℃水浴反应5min后,斐林试剂鉴定结果表明:pH 6.2为唾液淀粉酶的最适pH(图1曲线Ⅰ)50倍以上的唾液淀粉酶稀释液,根据反应颜色,斐林试剂鉴定可以明显区分不同pH对淀粉酶活性的影响(图1曲线Ⅱ)。
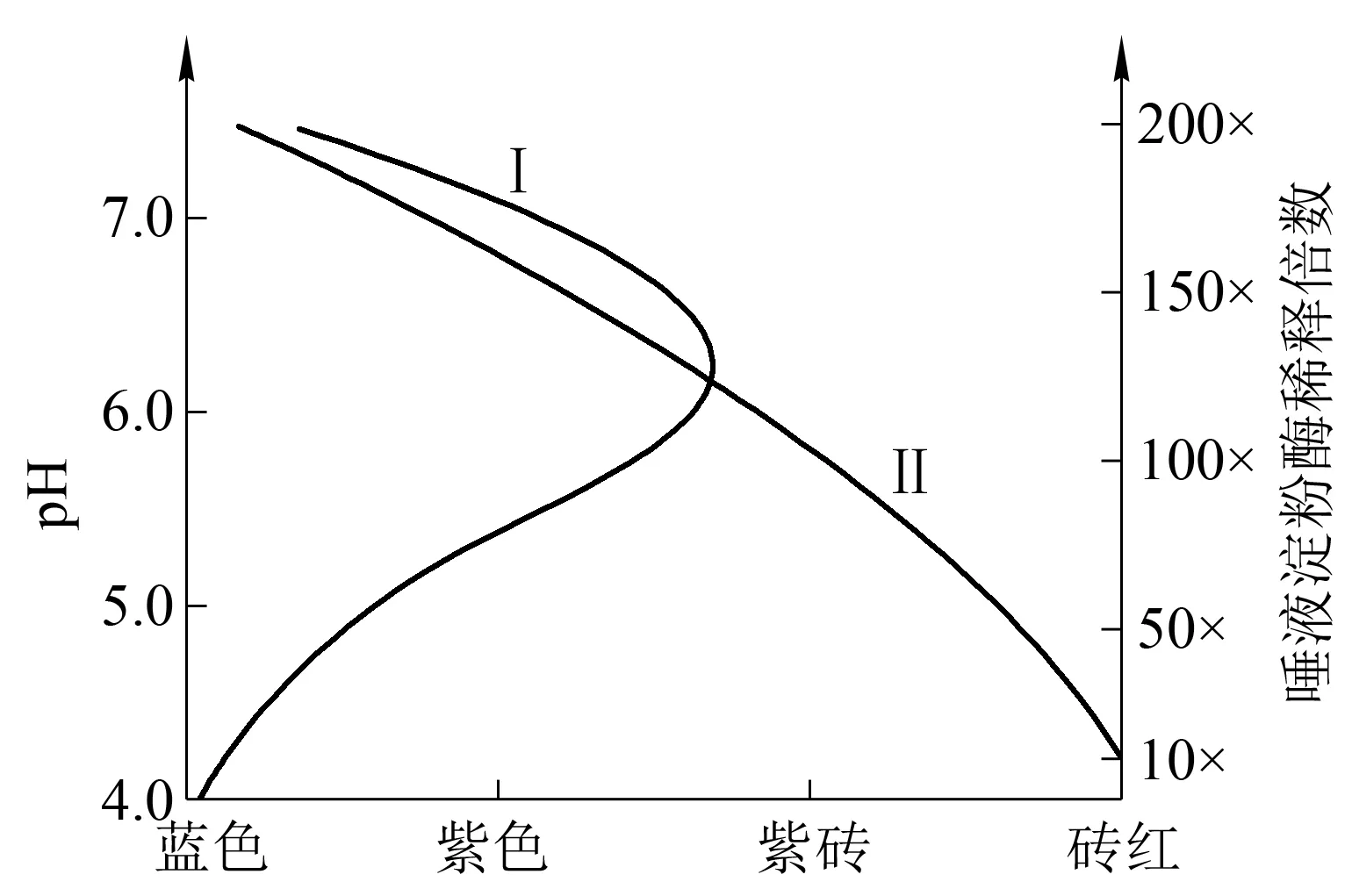
图1 pH对唾液淀粉酶活性的影响及唾液淀粉酶活性鉴定
2.2 pH影响酶活性下降或失活的可逆性探究 唾液淀粉酶不同的稀释倍数实验表明,100倍的唾液淀粉酶稀释液在不同的pH缓冲液中,与2%淀粉溶液反应5min经斐林试剂反应呈不同的颜色。因此,采用100倍的唾液淀粉酶稀释液鉴定pH对酶活性的影响,可以很好地反映出酶活性的变化。另外,将不同pH处理的酶溶液再调至最适pH后,可以很好地反映是酶活性的整体变化还是部分酶失活导致酶活性的下降。
2.2.1 缓冲液调节pH对酶活性的影响 37℃水浴条件下,不同pH缓冲液处理100倍唾液淀粉酶5min后,加入1mL 2%淀粉溶液反应5min后用斐林试剂和KI-I2溶液鉴定结果见表2。鉴定结果表明,斐林试剂可以明显鉴定出各种pH缓冲液对淀粉酶活性的影响,呈现出从紫砖色→灰褐→褐色→灰紫→灰绿→灰蓝→蓝色各种不同的颜色;但KI-I2溶液鉴定淀粉残留量区分度不够明显。
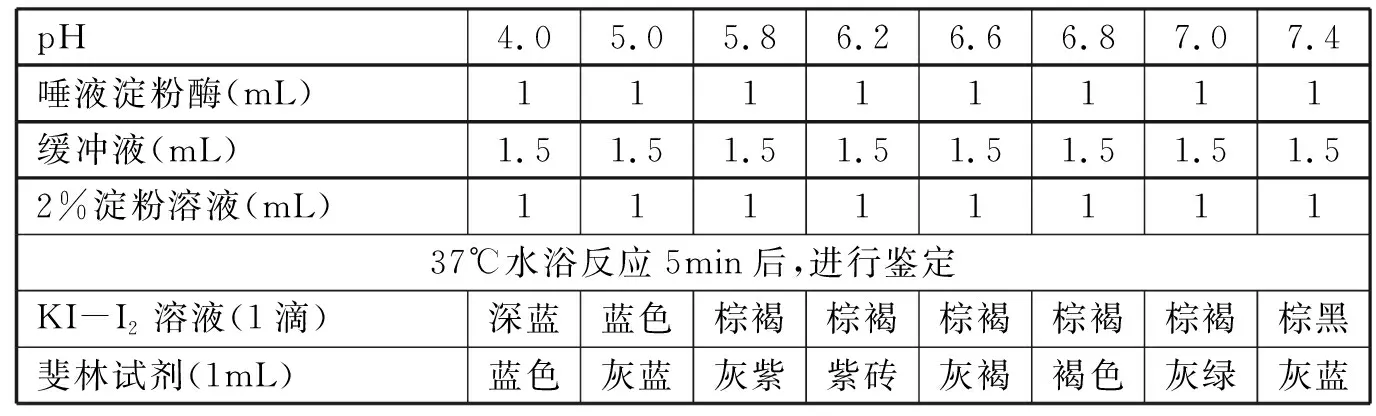
表2 pH 4~7.4磷酸氢二钠-柠檬酸缓冲液对唾液淀粉酶活性的影响
2.2.2 缓冲液调节pH影响酶活性下降的可逆性探究 37℃条件下,100倍唾液淀粉酶用不同pH缓冲液处理5min后,再用相应的磷酸氢二钠和柠檬酸混合液将反应液回调至最适pH 6.2处理5min,加入1mL 2%淀粉溶液,反应5min后,KI-I2溶液和斐林试剂鉴定结果见表3。
鉴定结果表明,在pH 5.0~7.4范围内处理唾液淀粉酶后,再调至最适pH 6.2,KI-I2溶液和斐林试剂鉴定结果呈一致,说明唾液淀粉酶的活性可以100%恢复。
本实验证明,在一定pH范围内,偏离最适pH酶活性的下降,是pH导致反应液中酶整体活性的下降,而并非是导致部分酶的失活。因为若是部分酶的失活导致酶反应能力的下降,那么回调至最适pH后,鉴定结果将不会与始终在最适pH条件下反应结果相同。特别引起注意的鉴定结果是,在pH 4缓冲液条件下,并不能检测到唾液淀粉酶的活性(表2),但将pH 4缓冲液处理的酶液回调至最适pH 6.2后,酶活性也有较大程度的恢复(表3),值得进一步探究。
2.2.3 HCl-NaOH导致酶活性失活的可逆性探究 pH 5.0~7.4的磷酸氢二钠-柠檬酸缓冲液处理酶后再回调至pH 6.2,酶皆可完全恢复,在完全检测不到酶活性的pH 4的缓冲液处理酶后,再回调至pH 6.2,酶也可较大程度的恢复活性。那么过酸或过碱溶液处理酶后,酶是否也可恢复活性,用0.05% HCl和0.05%NaOH溶液处理100倍唾液淀粉酶稀释液的相关实验结果见表4。
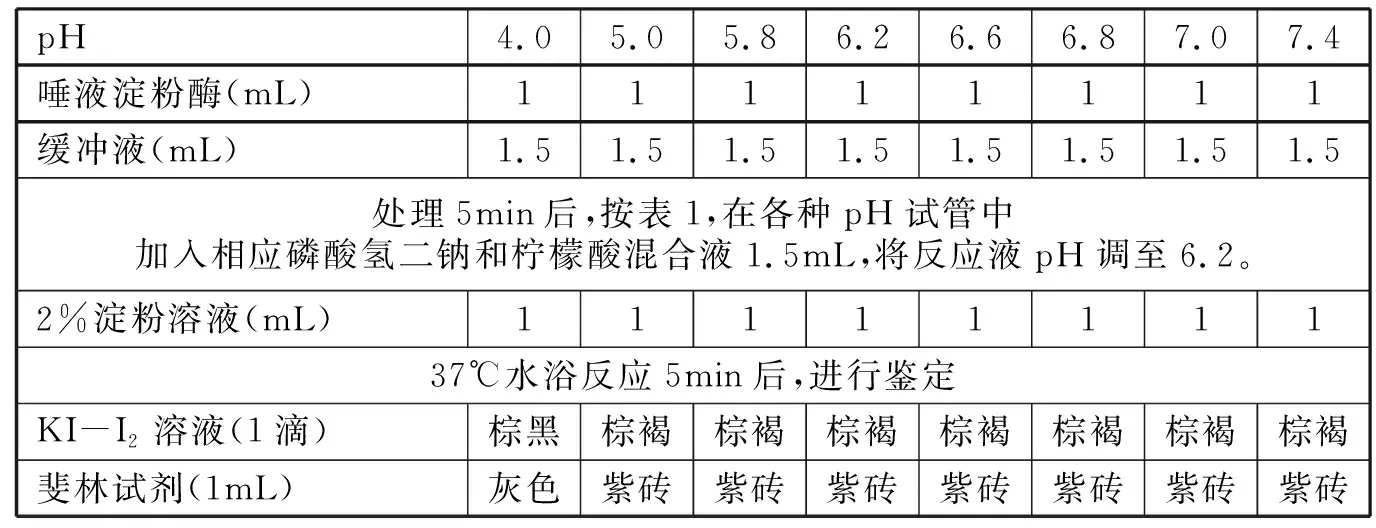
表3 磷酸氢二钠-柠檬酸缓冲液调节pH影响酶活性下降的可逆性探究
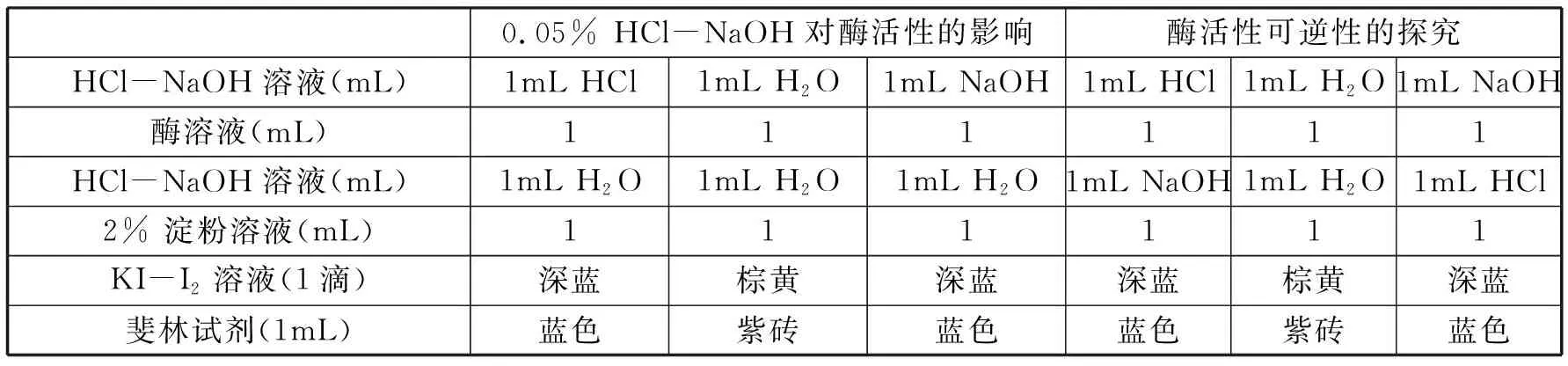
表4 0.05% HCl-NaOH导致酶活性失活及其可逆性探究(HCl和NaOH溶液浓度0.05%,pH分别为2和12)
实验结果表明,经0.05% HCl和0.05% NaOH溶液处理的酶液,再回调至中性pH,酶的活性也不能恢复,说明唾液淀粉酶经过过酸过碱处理,酶发生了不可逆性的失活。由此可以推测,pH 4的缓冲液可能是酶空间结构造成彻底破坏的临界点,此时5min的处理,部分酶可能结构遭到破坏,发生不可逆的失活,但有部分酶空间结构可能并没完全破坏,及时回调至最适pH,酶仍可发挥活性。
3 结论分析
实验结果表明,pH是通过影响所有酶分子的活性而影响酶促反应速度,而不是逐渐使部分酶失活而影响酶促反应速度。因此,有限程度偏离最适pH后,酶活性的下降是可逆的,即“钟罩形”内的pH处理酶后,再将酶促反应条件回调至最适pH,酶的活性可100%的恢复。但过酸或过碱会导致酶发生不可逆的失活。
不同比例的斐林试剂(蓝色)与还原糖反应的砖红色产物混合后呈现不同的颜色:蓝色→灰绿→紫色→紫砖→砖红,且各种颜色的深浅度不同,因此斐林试剂鉴定唾液淀粉酶活性比较理想;而不同程度的淀粉水解产物遇KI-I2溶液呈不同的颜色反应:蓝色(淀粉)→红褐色或红棕色(红色糊精)→棕黄(麦芽糖、葡萄糖),颜色区分并不是很明显,特别是在淀粉过量或酶不足的条件下,淀粉降解不充分,利用KI-I2溶液鉴定pH值对唾液淀粉酶活性的影响并不理想。

