老年慢性阻塞性肺疾病合并2型糖尿病患者检测血清高敏C反应蛋白和D-二聚体的临床意义
王永 魏哲芬 陈如健
老年慢性阻塞性肺疾病合并2型糖尿病患者检测血清高敏C反应蛋白和D-二聚体的临床意义
王永魏哲芬陈如健
目的探讨老年慢性阻塞性肺疾病(COPD)合并2型糖尿病(T2DM)患者检测血清高敏C反应蛋白(hs-CRP)和D-二聚体(D-D)的临床意义。方法92例老年COPD急性加重期(AECOPD)合并T2DM患者为观察一组,92例单纯AECOPD患者为对照一组,84例老年COPD稳定期(SPCOPD)合并T2DM患者为观察二组,84例单纯SPCOPD患者为对照二组。分别检测各组血清hs-CRP、D-D并进行比较分析。结果(1)观察一组血清hs-CRP、D-D浓度分别为(44.5±8.6) mg/L、(482.2±124.6) mg/L,对照一组分别为(34.4±9.4) mg/L、(416.0±93.6) mg/L,2组比较差异均有统计学意义(P<0.01);(2)观察二组血清hs-CRP、D-D浓度分别为(11.9±3.3) mg/L、(378.5±68.3) mg/L,对照二组分别为(7.9±2.7) mg/L、(298.7±58.8) mg/L,2组比较差异均有统计学意义(P<0.01);(3)观察一组治疗后血清hs-CRP、D-D浓度分别为(13.5±3.6) mg/L、(403.7±80.1) mg/L,较治疗前均明显下降,与治疗前比较差异均有统计学意义(P<0.01)。结论在老年COPD合并T2DM 患者中,hs-CRP及D-D均升高,观察血清hs-CRP、D-D 的浓度变化,对判断老年COPD 合并T2DM 患者疾病的严重程度、预后及治疗有较强的指导作用。
慢性阻塞性肺疾病; 2型糖尿病; 高敏C反应蛋白; D-二聚体; 老年人
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)与2型糖尿病(type 2 diabetes mellitus,T2DM)都是老年人常见病和多发病,是威胁老年人群身体健康和生命安全的两大疾病,严重影响老年患者的生活质量,同时加重社会经济负担,已成为全球范围内一个重要的公共卫生问题,引起世界各国的极大关注。COPD与T2DM的发病率均呈逐年上升的趋势,T2DM的发病率为9.7%[1],>40岁的人群中COPD的发病率为8.2%,到2020年将成为世界上第3位死亡原因[2]。老年人中同时罹患这2种疾病的人数也与日俱增[3],2种疾病都极易引发感染,两者并存时常常互相影响,患者往往病情复杂,治疗难度大,治疗时间延长,死亡率高,更易诱发各种并发症,治疗效果及预后都欠佳。血浆D-二聚体(D-dimer,D-D)是纤维蛋白特异性降解产物,是反映体内纤溶功能和高凝状态的标志之一[4],高敏C-反应蛋白(high sensitivity C-reactive protein,hs-CRP) 作为一种急性时相反应蛋白,参与了局部、全身的炎症反应[5],本研究观察COPD急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)和COPD稳定期(stable period of chronic obstructive pulmonary disease,SPCOPD)合并T2DM患者血清hs-CRP、D-D水平并探讨其临床意义。
1 对象与方法
1.1纳入与排除标准入选标准:(1)COPD、AECOPD、SPCOPD诊断均符合中华医学会呼吸病学分会COPD学组颁布的《慢性阻塞性肺疾病诊治指南(2013 年修订版)》[6];(2)T2DM诊断均符合美国糖尿病学会(American Diabetes Association,ADA)制定的《美国糖尿病指南(2014版)》[7];(3)年龄≥60岁。排除标准:(1)合并慢性肝病或肝、肾功能障碍者;(2)合并急性心肌梗死或心力衰竭者;合并活动性肺结核者;(4)合并恶性肿瘤者;(5)合并肺部以外部位细菌性感染,如:泌尿系感染、肠道感染等;(6)合并肺栓塞者;(7)不能或不愿合作者。
1.2一般资料2013年1月至2014年12月我院收治符合入选与排除标准的AECOPD合并T2DM患者92例为观察一组,随机抽取同期符合入选与排除标准的单纯AECOPD患者92例为对照一组;符合入选与排除标准的SPCOPD合并T2DM患者84例为观察二组,随机抽取同期符合入选与排除标准的单纯SPCOPD患者84例为对照二组,均签署知情同意书。观察一组92例,其中男53例,女39例,年龄60~88岁,平均(74.3±8.7)岁。COPD病程11~28年,平均(19.5±6.1)年。T2DM病程8~22年,平均(15.2±5.3)年。吸烟43例,吸烟指数13~37包年,平均(24.3±8.4)包年。对照一组92例,其中男51例,女41例,年龄60~88岁,平均(74.2±8.9)岁。COPD病程11~27年,平均(20.0±5.8)年。吸烟42例,吸烟指数13~36包年,平均(23.4±9.3)包年。观察二组84例,其中男48例,女36例,年龄60~89岁,平均(74.2±8.0)岁。COPD病程10~29年,平均(19.4±5.8)年。T2DM病程7~22年,平均(15.3±4.7)年。吸烟38例,吸烟指数12~38包年,平均(24.5±8.6)包年。对照二组84例,其中男47例,女37例,年龄60~87岁,平均(73.1±9.2)岁。COPD病程12~28年,平均(19.8±5.5)年。吸烟37例,吸烟指数11~36包年,平均(24.3±8.2)包年。观察一组与对照一组、观察二组与对照二组在年龄、性别、病程、吸烟率及吸烟指数等方面比较差异均无统计学意义(P>0.05),具有可比性。
1.3研究方法所有患者均抽取空腹肘静脉血3 ml,观察一组在治疗10 d后再次抽取空腹肘静脉血3 ml,3000 r/min离心10 min,分离血清-20 ℃低温待测。hs-CRP、D-D测定采用免疫散射比浊法,试剂及仪器均由德国西门子公司提供。
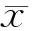
2 结果
2.14组患者血清hs-CRP、D-D比较观察一组血清hs-CRP、D-D浓度均明显高于对照一组,2组比较差异均有统计学意义(P<0.01)。观察二组血清hs-CRP、D-D浓度均明显高于对照二组,2组比较差异均有统计学意义(P<0.01)。见表1。
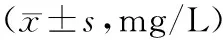
表1 4组患者血清hs-CRP、D-D比较
注:与对照一组比较,**P<0.01,与对照二组比较,△△P<0.01
2.2观察一组患者治疗前后血清hs-CRP、D-D比较观察一组治疗后血清hs-CRP、D-D浓度均明显下降,与治疗前比较差异均有统计学意义(P<0.01)。见表2。
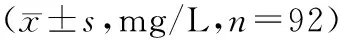
表2 观察一组患者治疗前后血清hs-CRP、D-D水平比较
注:与治疗前比较,**P<0.01
3 讨论
COPD是气道、肺实质、肺血管以及全身的非特异性炎性反应疾病,由于多种炎性反应细胞、细胞因子共同参与发病,是肺对吸入烟草烟雾等有害气体、有害颗粒的异常炎症反应,炎性反应的轻重会对COPD的严重程度产生直接的影响[8]。COPD以气流受限为特征,气流受限不完全可逆,呈进行性加重[9],主要表现为限制性通气功能障碍,小气道功能减退和弥散功能障碍,严重影响患者的劳动能力和生活质量。AECOPD由于长期缺氧、继发感染、二氧化碳潴留、酸中毒、红细胞增多、血管内皮损伤和微循环淤滞,机体处于明显高凝状态,凝血功能发生异常,易导致血栓形成及弥散性血管内凝血。慢性炎症的急性发作、内皮细胞损伤等导致的凝血纤溶系统紊乱、血小板的活化以及氧化应激作用的增强等因素是导致AECOPD的主要原因[10]。T2DM的发病机制同样存在炎症反应,T2DM与COPD的炎症反应因子增加呈高度一致性和相似性[11]。T2DM患者存在血管内皮损伤、血液高凝状态,凝血和纤溶指标出现不同程度的异常改变,处于血栓前状态,并随着病程的进展,最终会使促凝抗凝系统失衡,导致血栓形成,T2DM微血管病变主要累及毛细血管和微动静脉,是造成T2DM肺损害的主要原因,近年来肺脏作为T2DM损害的靶器官日益受到关注。
COPD是T2DM发病的独立危险因素,可以促进T2DM的发生及发展,特别是重度COPD是T2DM的高危因素。T2DM又是AECOPD不良预后的独立危险因素,可以使AECOPD患者动脉血氧分压(PaO2)下降,动脉血二氧化碳分压(PaCO2)升高,病情加重、合并症增多,肺功能进一步恶化,不仅存在限制性为主的肺通气功能障碍,还存在肺弥散功能障碍[12]。高血糖会损害老年COPD患者呼吸纤毛上皮细胞,致使其运动减慢甚至消失,导致消除细菌与异物的能力降低。老年AECOPD合并T2DM患者细胞免疫及体液免疫功能显著下降,糖代谢的紊乱,血管内皮细胞损伤,血小板聚集和活化增强,血液存在更为明显的高凝状态和微小血栓形成[13],许多器官功能处于衰竭的临界状态,机体抗感染能力降低,二者间相互作用和影响引起恶性循环使患者病情逐渐加重,病情较难控制,易诱发各种并发症。
hs-CRP是由肝细胞合成敏感的急性期非特异性的炎症标志物,能反映炎症的严重程度,在正常情况下,其在血中的含量很低,本研究结果显示:血清hs-CRP在老年AECOPD患者中明显高于SPCOPD患者(P<0.01),提示hs-CRP升高可以作为COPD患者急性加重的判断指标,hs-CRP水平可作为判断AECOPD严重程度、预后及疾病的预测较敏感和特异性的指标,hs-CRP在COPD诊治中得到了广泛的应用[14]。hs-CRP与T2DM高度相关,是T2DM 发生的重要预测因子[15],T2DM患者的hs-CRP水平显著增高,控制hs-CRP浓度能减缓T2DM的发生发展[16]。有报道高浓度的hs-CRP患者进展为T2DM的危险度较低浓度患者明显增加[17]。COPD合并T2DM患者血清hs-CRP水平持续升高,说明了患者体内存在持续的炎症。本研究提示,无论AECOPD还是SPCOPD患者只要合并T2DM血清hs-CRP浓度均增高,提示合并T2DM后机体内炎症反应增强,T2DM与SPCOPD均存在慢性炎症过程,两者并发时慢性炎症作用增强,导致血清hs-CRP增高。D-D是纤溶酶水解交联纤维蛋白纤溶降解过程中形成的片段,为一种特异性的降解产物,是特异性反映体内高凝状态继发性纤溶亢进的标志物[18-20],是血管内高凝状态和血栓形成的重要标志物。AECOPD患者感染、低氧血症、高碳酸血症致继发性红细胞增多,组织因子释放,血管内皮受损,使血液黏稠度增高、微血栓形成,D-D明显升高,通过检测COPD 患者D-D水平可以判断病情的严重程度[21],本研究提示,D-D无论在AECOPD还是SPCOPD患者血液中浓度均较高,在AECOPD患者中D-D浓度更高(P<0.01),D-D水平可以为进一步评估、预防和治疗AECOPD患者提供依据。T2DM患者血糖升高,损伤血管内皮细胞,释放组织因子,促使血小板聚集,激活凝血系统,形成高凝状态和纤溶亢进,致人体高凝状态使D-D 明显增高,越严重的T2DM患者其血浆D-D的检测值也越高。T2DM患者血D-D含量随病情加重及血管并发症的出现而升高。本研究结果显示:合并T2DM的AECOPD患者血清D-D浓度显著高于单纯AECOPD患者(P<0.01),合并T2DM的SPCOPD患者血清D-D浓度显著高于单纯SPCOPD患者(P<0.01),提示合并T2DM的AECOPD或SPCOPD患者血液存在更为明显的高凝状态。故在治疗AECOPD合并T2DM患者时,要充分考虑到存在的高凝状态,注意监测患者的凝血功能,根据检查结果使用抗凝剂,避免病情加重。SPCOPD合并T2DM是患者可以使用吸入激素治疗,并长期服用阿司匹林以降低高凝状态,防止血栓形成。
综上所述,hs-CRP是反映老年COPD 合并T2DM 患者炎症的优选指标,D-D是反映老年COPD 合并T2DM 患者体内高凝状态继发性纤溶亢进的标志物,观察老年COPD 合并T2DM 患者血清hs-CRP、D-D 的浓度变化,对判断疾病的严重程度、预后及治疗有较强的指导作用。
[1]Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med,2010,362(12):1090-1101.
[2]吕雯. 中药散剂用于治疗COPD的探讨[J]. 中医临床研究,2014,6(13):147-148.
[3]陈姬,张键. 老年慢性阻塞性肺疾病急性发作期合并2型糖尿病患者血清同型半胱氨酸水平分析[J]. 实用老年医学,2014,28(5):383-385.
[4]周卫华,金东生,朱旖. 急诊80岁以上老年肺炎患者D-二聚体检测的意义[J]. 实用老年医学,2014,28(12):1010-1012.
[5]黄艳芳,胡孝海. 初诊2型糖尿病患者血清超敏C反应蛋白水平及相关因素分析[J]. 河北医学,2014,20(10):1619-1621.
[6]中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013 年修订版)[J]. 中国医学前沿杂志:电子版,2014,6(2): 67-80.
[7]梁峰,胡大一,沈珠军. 2014 美国糖尿病指南:糖尿病诊疗标准[J]. 中华临床医师杂志:电子版,2014,8(6): 1182-1190.
[8]郭宇,张维杰. 2型糖尿病合并慢性阻塞性肺疾病急性加重期血糖的预后对策分析[J]. 吉林医学,2012,33(36):7856-7856.
[9]王永,宋苏娟,朱宝山. 双水平气道正压通气联合雾化吸入治疗AECOPD 临床研究[J]. 临床肺科杂志,2014,19(10):1800-1803.
[10]Roca M, Verduri A, Corbetta L, et al. Mechanisms of acute exacerbation of respiratory symptoms in chronic obstructive pulmonary disease[J]. Eur J Clin Invest, 2013, 43(5): 510-521.
[11]马立萍,赵磊,杨京华,等. 2型糖尿病合并慢性阻塞性肺疾病急性加重期血糖控制与预后的关系[J]. 心肺血管病杂志,2012,31(2):189-191.
[12]赵艳荣,董淑芬,李杰,等. 抗凝治疗慢性阻塞性肺疾病急性加重期合并2 型糖尿病的疗效分析[J]. 重庆医学,2011,40(5):479-481.
[13]苗青,闫子臣,张金凤. 老年慢性阻塞性肺疾病合并糖尿病患者临床资料与分析[J]. 临床和实验医学杂志,2013,12(17):1376-1378.
[14]王永. 慢性阻塞性肺疾病急性加重期与稳定期超敏C反应蛋白测定对比研究[J]. 临床肺科杂志,2014,19(7):1233-1236.
[15]Pfützner A, Schöndorf T, Hanefeld M, et al. High-sensitivity C-reactive protein predicts cardiovascular risk in diabetic and nondiabetic patients: effects of insulin-sensitizing treatment with pioglitazone[J]. J Diabetes Sci Technol, 2010, 4(3): 706-716.
[16]Huffman FG, Whisner S, Zarini GG, et al. Waist circumference and BMI in relation to serum high sensitivity C-reactive protein (hs-CRP) in Cuban Americans with and without type 2 diabetes[J]. Int J Environ Res Public Health, 2010, 7(3): 842-852.
[17]Gada E, Owens AW, Gore MO, et al. Discordant effects of rosiglitazone on novel inflammatory biomarkers[J]. Am Heart J, 2013, 165(4): 609-614.
[18]Abu-Mahfouz M, Cavalcante JL, Arida M, et al. Significance of high sensitivity C-reactive protein and D-dimer in evaluating intracardiac thrombus and spontaneous echo contrast in patients referred for transesophageal echocardiography: a prospective study[J]. Cardiol J, 2012, 19(3): 267-273.
[19]Sadanaga T, Sadanaga M, Ogawa S. Evidence that D-dimer levels predict subsequent thromboembolic and cardiovascular events in patients with atrial fibrillation during oral anticoagulant therapy[J]. J Am Coll Cardiol, 2010, 55(20): 2225-2231.
[20]Hayashi S. Significance of plasma D-dimer in relation to the severity of atherosclerosis among patients evaluated by non-invasive indices of cardio-ankle vascular index and carotid intima-media thickness[J]. Int J Hematol, 2010, 92(1): 76-82.
Clinical significance of serum high sensitivity C reactive protein and D-dimer for the elderly patients with chronic obstructive pulmonary disease complicated with type 2 diabetes
WANGYong,WEIZhe-fen,CHENRu-jian.
XinyiRailroadHospital,Xuzhou221400,China
ObjectiveTo investigate the clinical significance of the serum levels of high sensitivity C reactive protein (hs-CRP) and D-dimer(D-D) in the elderly patients with chronic obstructive pulmonary disease (COPD) complicated with type 2 diabetes mellitus (T2DM).MethodsNinety-two elderly patients with chronic obstructive pulmonary disease with acute exacerbation (AECOPD) complicated with T2DM were enrolled as the first observation group, ninety-two elderly patients with AECOPD enrolled as the first control group, eighty-four elderly patients with stable chronic obstructive pulmonary disease (SPCOPD) complicated with T2DM enrolled as the second observation groups, eighty-four elderly patients with SPCOPD enrolled as the second control group. The serum levels of hs-CRP and D-D were measured and analyzed between the four groups.Results(1)The serum levels of hs-CRP and D-D were (44.5±8.6) mg/L, (482.2±124.6) mg/L in the first observation group, compared with (34.4±9.4) mg/L, (416±93.6) mg/L in the first control group (P<0.01); (2)The serum levels of hs-CRP and D-D were (11.9±3.3) mg/L, (378.5±68.3) mg/L in the second observation group, compared with (7.9±2.7) mg/L, (298.7±58.8) mg/L in the second control group (P<0.01); (3)After treatment, the serum levels of hs-CRP, D-D were significantly decreased in the first observation group (P<0.01).ConclusionsIn the elderly patients with COPD complicated with T2DM, the levels of hs-CRP and D-D increase and can reflect the severity degree, which might guide the prognosis and treatment of COPD complicated with T2DM.
chronic obstructive pulmonary disease; type 2 diabetes mellitus; high sensitivity C reactive protein; D-dimer; aged
221400江苏省徐州市,新沂市铁路医院呼吸科
R 563
A
10.3969/j.issn.1003-9198.2016.02.014
2015-04-02)

