二维阀切换离子色谱法测定海带中游离氨基酸*
刘颖慧,张经华,王明林,法芸(.山东农业大学,食品科学与工程学院,山东泰安 708; .中国科学院青岛生物能源与过程研究所,生物燃料重点实验室,山东青岛 660; .北京市科学技术研究院理化分析测试中心,北京 00094)
二维阀切换离子色谱法测定海带中游离氨基酸*
刘颖慧1,2,张经华3,王明林1,法芸2
(1.山东农业大学,食品科学与工程学院,山东泰安 271018; 2.中国科学院青岛生物能源与过程研究所,生物燃料重点实验室,山东青岛 266101; 3.北京市科学技术研究院理化分析测试中心,北京 100094)
建立一种测定海带中游离氨基酸的阀切换高效阴离子交换色谱耦合脉冲安培检测器法。采用一根阳离子交换柱对氨基酸进行富集,而后经阀切换至氨基酸分析柱AminoPac®PA-10(250 mm×2 mm)上分离并进入安培检测器检测。在最佳分离条件下,20种氨基酸的质量浓度在0.1~20.0 mg/L范围内与其色谱峰面积线性关系良好,线性相关系数r2>0.99,20种氨基酸的检出限为0.01 mg/L,加标回收率为83.12%~117.34%,测定结果的相对标准偏为1.02%~13.05% (n=8)。该方法样品前处理简单,无基底杂质干扰,适用于海带样品中游离氨基酸的测定。
阀切换离子色谱法;脉冲安培检测器;阳离子交换柱;游离氨基酸;海带
海带是一种低温生长的大型海生褐藻类植物,富含丰富的生理活性多糖,包括褐藻胶,岩藻糖胶及褐藻淀粉等[1-2]。因其具有较高的营养价值和药用价值,一直是现代食品药品工业研究的对象[3]。海带中的多种游离氨基酸如天冬氨酸、谷氨酸、甘氨酸、丙氨酸和脯氨酸等是海带浓缩调味汁的主要成分,是重要的海鲜调味料的呈鲜味物质[4];海带渣作为鲍的主要饲料,其氨基酸组成直接影响着鲍的品质和口感[5]。对海带中游离氨基酸的研究,有利于海带产品附加值的开发,更好的发挥海带成本低廉、应用广泛的优点,也为海鲜食品工业的长足发展提供新的可能[6]。
氨基酸的研究方法有高效液相色谱法[7]、气相色谱法[8]、毛细管电泳[9]、氨基酸分析法[10-11]等,但这些方法都各有弊端,高效液相色谱和氨基酸分析仪常常需要柱前柱后衍生化[12-13],过程较为繁琐,误差比较大;而毛细管电泳和气相色谱则对分析条件要求比较高[14-15]。近年来,随着离子色谱的普及,离子交换色谱耦合脉冲安培检测器在检测氨基酸方面应用越来越广泛,具有专门的氨基酸分析柱(AminoPac®PA-10),耐酸碱,检出限为0.01 mg/L,无需衍生化且灵敏度高、选择性好,已被广泛应用于糖和氨基酸的检测[16]。
由于糖在氨基酸的波形下会有电化学响应,因此对混合溶液中氨基酸的检测经常会受到糖的干扰,为了有效降低糖对氨基酸分析的影响,笔者选用一种阳离子交换柱CRC对氨基酸进行捕集,建立了一种简单的阀切换离子色谱方法,通过阀切换对捕集后的氨基酸进行分析,有效避免了糖在氨基酸波形下对氨基酸分析的干扰。
1 实验部分
1.1主要仪器与试剂
离子色谱仪:ICS-3000型,配有AS40自动进样器,两个六通阀,两个四元梯度淋洗泵,电化学检测器ED,Chromeleon 6.80 色谱工作站,美国Thermo Fisher Scientific 公司;
超纯水制备仪:Milli-Q®Advantage A10 型,美国Millipore 公司;
氢氧化钠溶液:质量分数50%,比利时Acros Organics 公司;
乙酸钠溶液:分析纯,美国Sigma-Aldrich 公司;
甲酸溶液:分析纯,天津市科密欧化学试剂开发有限公司;
氨基酸标准品:精氨酸、赖氨酸、谷氨酰胺、天冬酰胺、丙氨酸、苏氨酸、甘氨酸、缬氨酸、丝氨酸、脯氨酸、异亮氨酸、亮氨酸、蛋氨酸、组氨酸、天冬氨酸、谷氨酸、苯丙氨酸、半胱氨酸、酪氨酸、色氨酸:纯度大于99.9%美国AccuStandard 公司;
实验用水为电阻率18 MΩ·cm 的超纯水,进样前经0.22 μm水相滤膜过滤;
海带溶液:自制(干海带购自当地超市)。
1.2样品前处理
取新鲜晒干海带,用超纯水冲洗4~5次,晾干,于50℃烘箱烘24 h,破碎,称取0.1 g(精确至0.1 mg)破碎后的样品,溶解于10 mL容量瓶中,定容,震荡10 min,以12 000 r/min离心5 min,取上清液用0.22 μm水相滤膜过滤,待测。
1.3标准溶液制备
准确称取0.01 g(精确至0.1 mg)经干燥至恒重的精氨酸标准品,用超纯水定容于10 mL容量瓶中,制得1 000 mg/L的精氨酸标准储备溶液。以同样方法配制相同浓度的其它19种氨基酸标准储备液。
用移液枪分别准确称取1,5,10,20,50,100,200,500,1 000 μL上述20种氨基酸标准储备溶液,用超纯水定容于10 mL容量瓶中,质量浓度分别为0.1,0.5,1.0,2.0,5.0,10.0,20.0,50.0 mg/L。
1.4色谱条件
色谱柱:AminoPac®PA-10柱[分析柱(250 mm×2 mm),保护柱(50 mm×2 mm),美国Thermo Scientific公司];淋洗液:800 mmol/L氢氧化钠溶液,1 mol/L乙酸钠溶液,梯度洗脱程序见表1;进样体积:25 μL;柱温:32℃;采用Chromeleon 6.8色谱软件自动控制和数据处理,积分脉冲安培检测器;金工作电极,Ag/AgCl参比电极;检测电位波形数据见表2。
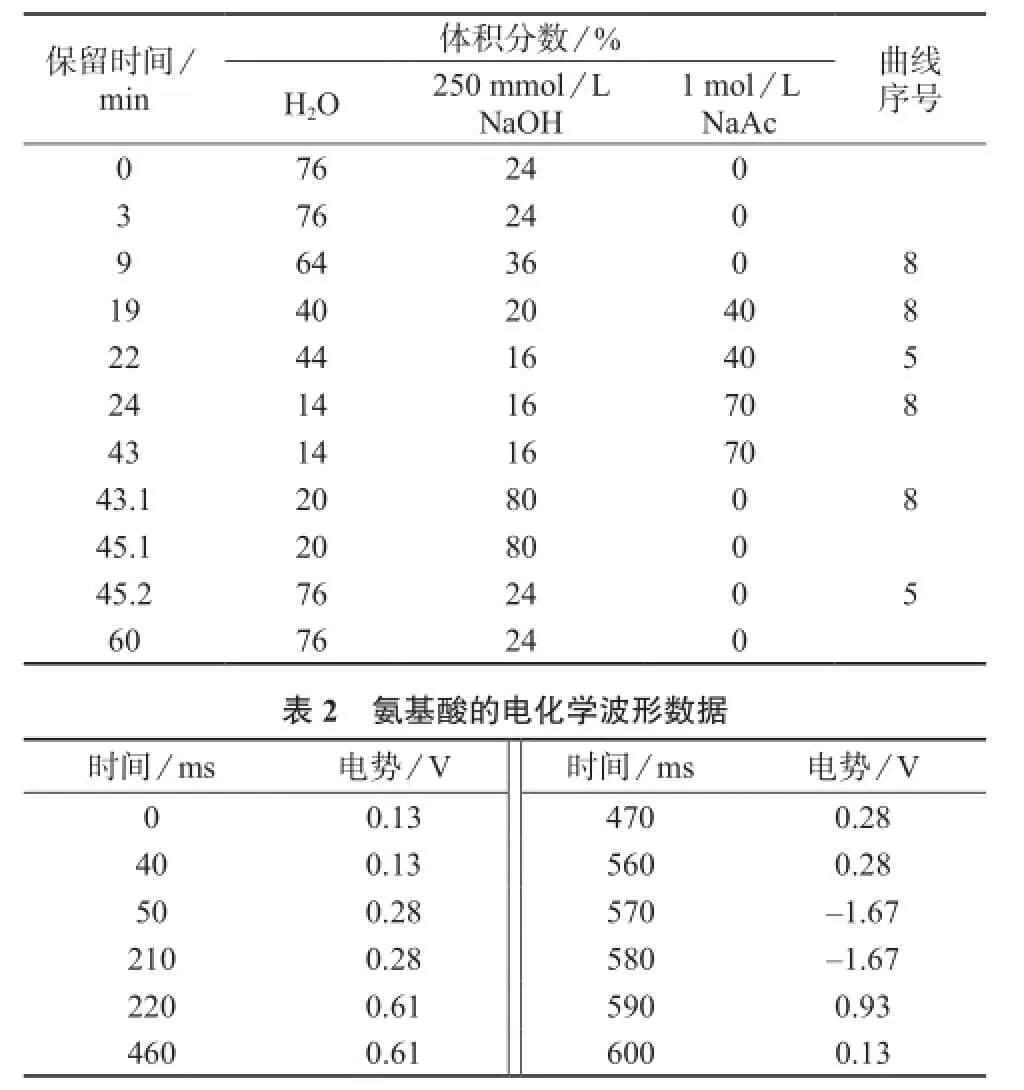
表1 氨基酸梯度淋洗程序
1.5阀切换流程
进样和捕集状态、分离和检测状态的阀切换流程图分别见图1和图2。

图1 阀切换流程图(进样和捕集状态)
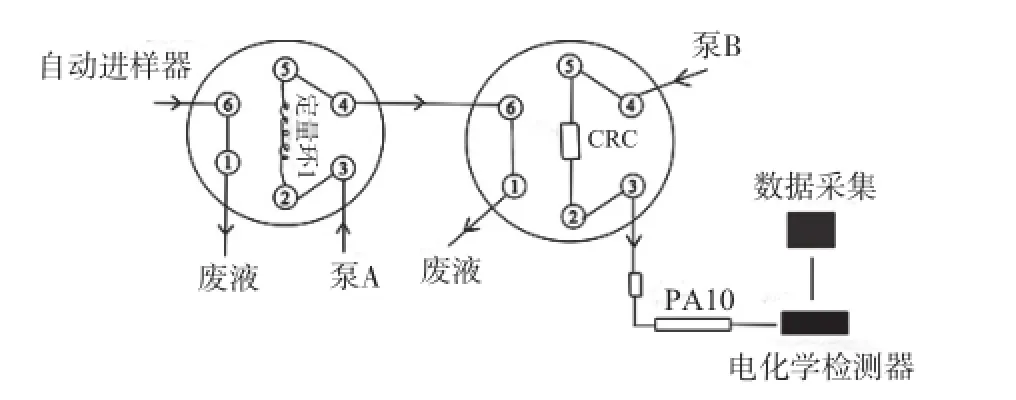
图2 阀切换流程图(分离和检测状态)
阀切换步骤如下:
(1)样品进样。自动进样器将定量环打满,样品被自动进样器带入定量环1中,定量环1被充满,多余的样品流入废液中。
(2)捕集阶段。从0 min开始,定量环1中的样品随着泵A中的甲酸被带到第二个阀中的阳离子交换柱CRC上,在1.2 min时完成氨基酸的捕集,糖不被保留进入废液中,氨基酸和糖实现分离。
(3)洗脱和检测。从第1.2 min开始,CRC中的氨基酸被泵B中的淋洗液带到氨基酸分析柱上分离,随后进入电化学检测器进行检测,采集色谱图。
2 结果与讨论
2.1洗脱液的选择与优化
氨基酸是两性分子,在酸性条件下,氨基酸可以形成阳离子H3+N-CHR-COOH(AA+)。AA+与强酸性阳离子交换树脂作用,可被吸附在树脂上。而糖(碳水化合物)是非常弱的酸,在酸性条件下很稳定,与强酸性阳离子作用很弱。因此本实验选用甲酸作为洗脱液,选用阳离子交换柱(CRC)作为捕集柱,提供酸性条件,使氨基酸在阳离子交换柱上实现吸附保留,糖不被保留,从而实现阀切换对氨基酸和糖的分离。由于天冬氨酸最先从阳离子交换柱上被洗脱,而葡萄糖是糖类物质中最后一个从阳离子交换柱被洗脱的糖,故选用10 mg/L的天冬氨酸与20 mg/L的葡萄糖作为氨基酸和糖的分离代表物质,得出甲酸在浓度3 mmol/L、流量0.1 mL/min时氨基酸被捕集的最佳条件。
2.2阀切换时间优化
以10 mg/L的天冬氨酸与20 mg/L的葡萄糖作为样品进行阀切换时间摸索试验,试验发现,在1.2 min时阀切换天冬氨酸和葡萄糖的捕集和洗脱效果最好,因此实验选择第2个阀的阀切换时间为1.2 min。
2.3线性方程和线性范围
逐级稀释20种氨基酸标准储备液分别得到0.10,0.50,1.00,2.00,5.00,10.00,20.00,50.00 mg/L的混合标准溶液,进样体积为25 μL,以标准品的质量浓度与对应的色谱峰面积进行线性回归。20种氨基酸的线性范围、线性方程、相关系数见表3。
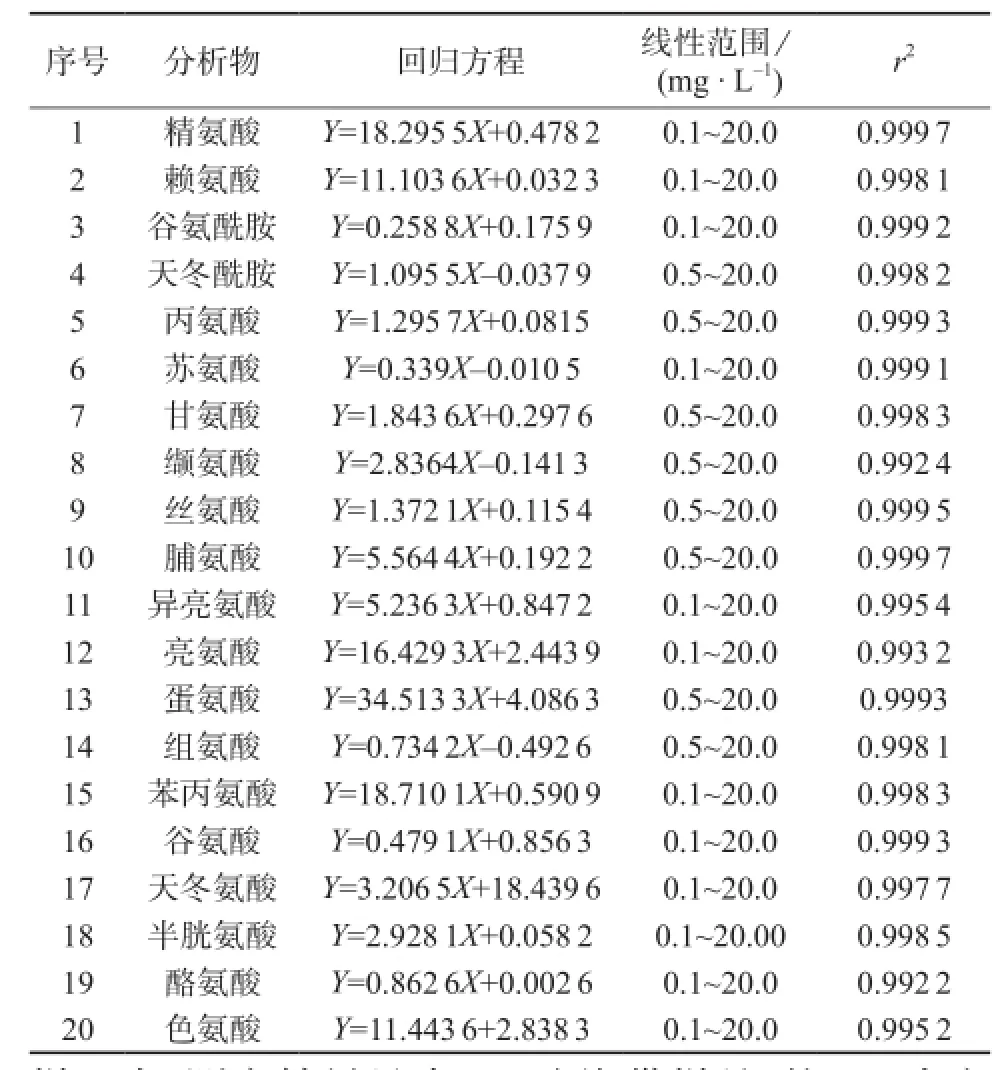
表3 线性相关系数、回归方程、线性范围
2.4精密度和加标回收试验
对2 mg/L的20种氨基酸混合标准品重复进样8次,测定结果见表4。取海带样品,按1.2中方法进行处理,然后进样测定,并分别在样品中加入0.5,1,10 mg/L 3个浓度混合标准品进行回收试验,计算平均加标回收率,结果列于见表4。由表4可知,测定结果的相对标准偏差为1.02%~13.05%,平均加标回收率在83.12%~117.34%之间,可见方法的精密度和准确度较高,满足检测要求。
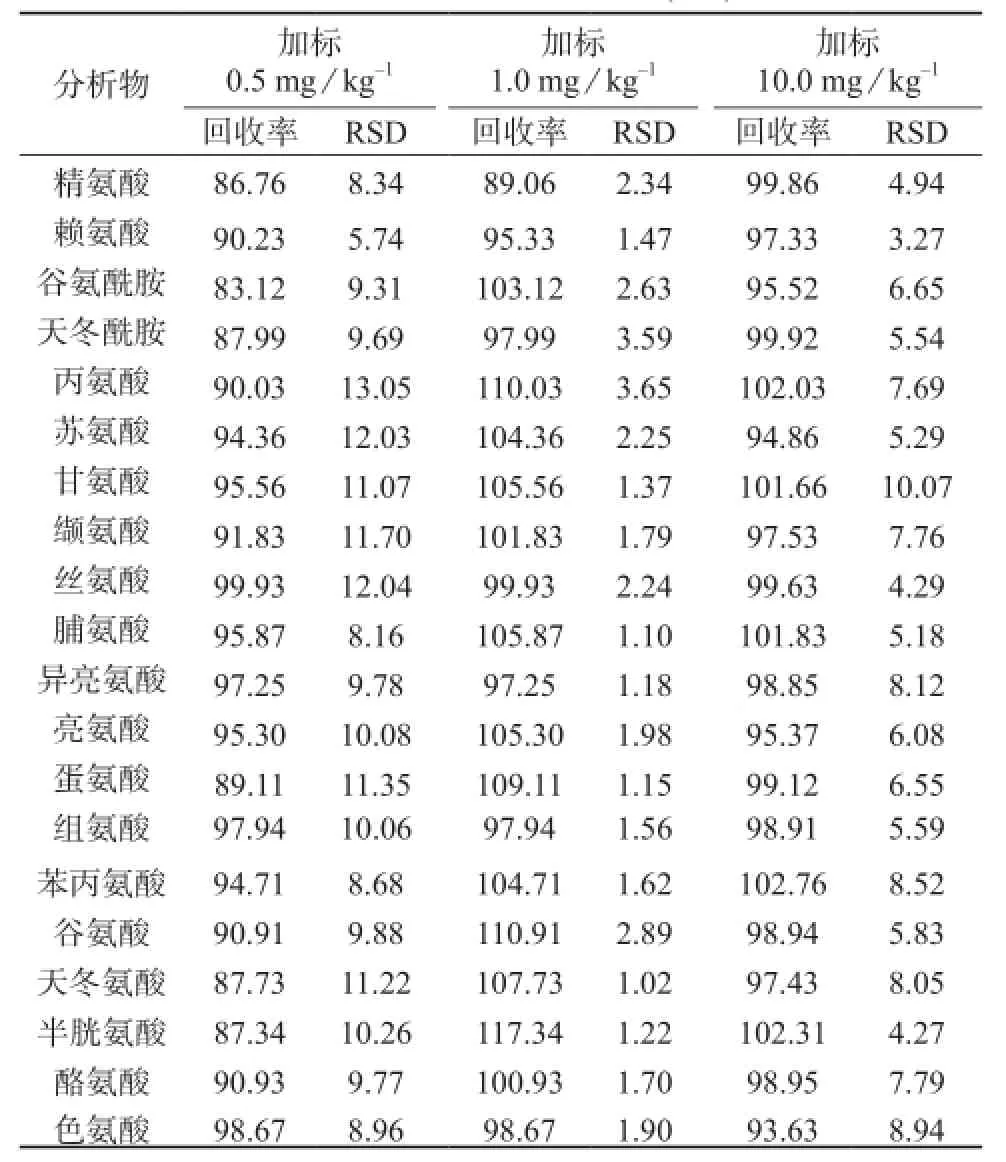
表4 加标回收及精密度结果(n=8) %
2.5样品测定
按1.2方法对海带样品进行处理后进样测定,结果见表5。由表5可知,海带样品中共测出游离氨基酸10种,其中主要成分为赖氨酸和亮氨酸,含量分别为6.427 0 mg/L和13.085 4 mg/L。标准样品及海带样品的离子色谱图见图3。

表5 海带中游离氨基酸测定结果
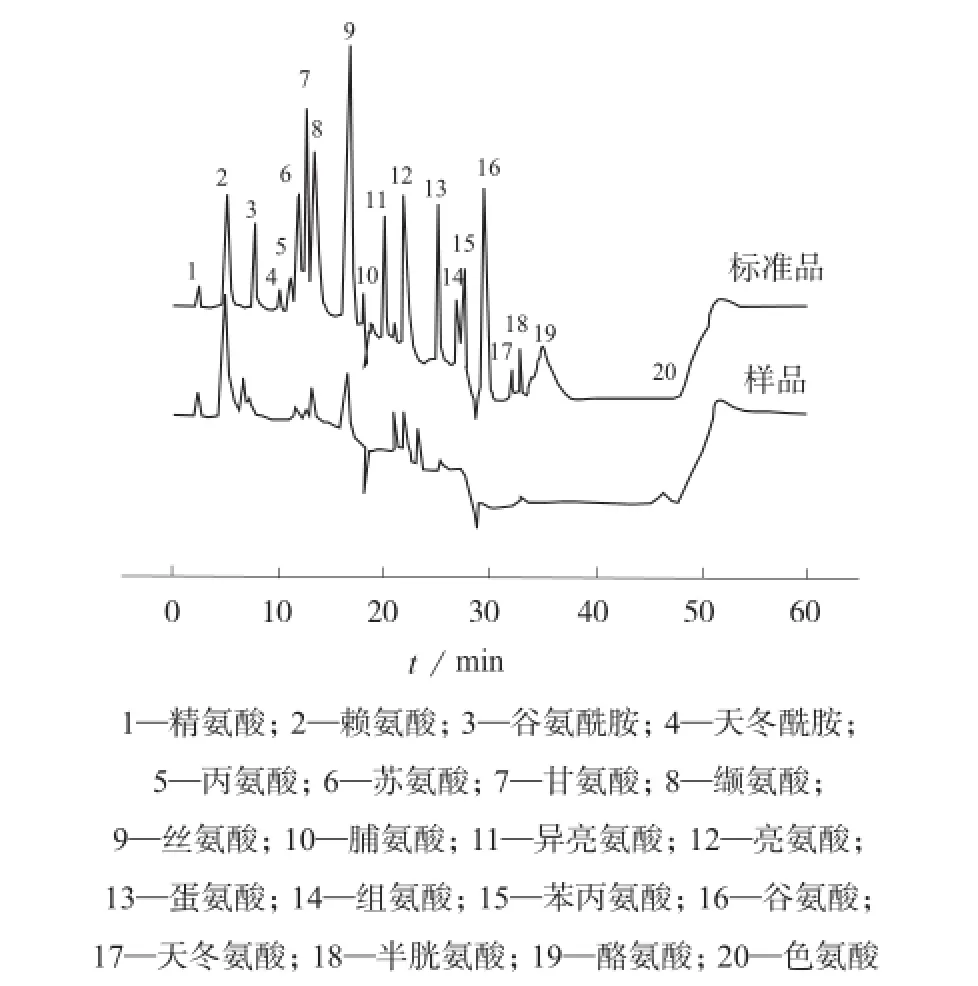
图3 20种氨基酸标准品和海带样品的离子色谱图
3 结语
采用阀切换离子色谱法对混合样品中氨基酸进行测定,在传统离子色谱方法基础上添加一步阀切换程序,有效地去除基底杂质糖类化合物对氨基酸分析的影响,提高了氨基酸检测的准确性。该法较其它检测方法便捷,流动相为氢氧化钠和乙酸钠,没有污染。方法前处理简单,准确度、精密度高,适用于海带样品中游离氨基酸的测定。
[1] 李德远,徐现波,熊亮,等.海带的保健功效及海带生理活性多糖研究现状[J].食品科学,2002(7): 151-154.
[2] 吴永沛,邱晓燕,张东,等.海带提取岩藻聚糖的研究[J].食品科学,2003(10): 78-80.
[3] 郑超,刘剑敏,倪小芬,等.海带多糖的提取工艺研究[J].中国医学工程,2009(4): 241-242.
[4] 余洋定,李冬梅,启航,等.海带浓缩调味汁生产工艺条件的优化[J].大连工业大学学报,2012(5): 313-317.
[5] 甘纯玑.海带渣的氨基酸组成及其用于鲍饵料的可能性[J].饲料研究,1996(9): 11-12.
[6] 谢苗,王斌,邓海燕,等.海带膳食纤维的制备条件与营养评价[J].河南科技大学学报:农学版,2004(4): 56-59.
[7] Herbert P B,Ratola N,Alves A. HPLC Determination of Amino Acids in Musts and Port Wine Using OPA/FMOC Derivatives[J]. Journal of Food Science,2000,65(7): 1 130-1 133.
[8] 周建华.毛细管气相色谱法分析氨基酸[J].山东轻工业学院学报:自然科学版,1998(4): 50-52.
[9] Abd El-Hady D,Albishri H M. Simultaneous determination of acrylamide,asparagine and glucose in food using short chain methyl imidazolium ionic liquid based ultrasonic assisted extraction coupled with analyte focusing by ionic liquid micelle collapse capillary electrophoresis[J]. Food chemistry,2015,188: 551,558.
[10] 李涛,王飞久,孙修涛,等.黄官1号海带在不同海域的营养成分分析与评价[J].食品科技,2012(11): 70-75.
[11] 苗雨田,杨悠悠,王浩,等.全自动氨基酸分析仪法测定不同年份黄酒中游离氨基酸的含量[J].食品安全质量检测学报,2015(4): 1 154-1 161.
[12] Lide C X,Shengyan J,Zhaoan W,et al. Determination of Amino acid in Flower of Lilium brownii var.viridulum by Pre-column Derivation OPA-HPLC[J]. Medicinal Plant,2011(4): 25-27.
[13] 齐建双,铁双贵,韩小花,等.氨基酸分析仪法快速测定玉米籽粒中赖氨酸含量[J].中国农学通报,2014,30: 199-202.
[14] Zhang Y,Chen L,Zhang C,et al. Polydopamine-assisted partial hydrolyzed poly(2-methyl-2-oxazolinze)as coating for determination of melamine in milk by capillary electrophoresis [J].Talanta,2016,150: 375-387.
[15] Myrgorodska I,Meinert C,Martins Z,et al. Quantitative enantioseparation of amino acids by comprehensive twodimensional gas chromatography applied to non-terrestrial samples [J]. Journal of chromatography A,2016,1433: 131-136.
[16] Yu H,Ding Y S,Mou S F. Direct and simultaneous determination of amino acids and sugars in rice wine by high-performance anion-exchange chromatography with integrated pulsed amperometric detection[J]. Chromatographia,2003,57(11/12): 721-728.
Determination of Free Amino Acids of Kelp by 2D Valve-Switching Ion Chromatography
Liu Yinghui1, 2, Zhang Jinghua3, Wang Minglin1, Fa Yun2,
(1. College of Food Science and Engineering, Shandong Agricultural University,Taian 271018,China;2. Bioenergy and Bioprocess Technology, Chinese Academy of Sciences,Qingdao 266101,China;3.Beijing Academy of Science and Technology,Beijing 100094, China)
A valve-switching high performance anion-exchange chromatography with pulsed amperometric detection was developed for the determination of free amino acids in kelp. After being enriched in CRC column, amino acids were cut into amino acid analysis column AminoPac®PA10 (250 mm×2 mm), and then were detected on the ampere detector. Under the optimized conditions,the concentration of 20 amino acids was linear with chromatographic peak area in the range of 0.1-20.0 mg/L (r2>0.99). The detection limit (LOD) of 20 amino acids was 0.01 mg/L. The recoveries were 83.12%-117.34%,the relative standard deviations of the detection results were 1.02%-13.05%(n=8). The method has advantages that sample treatment is simple,no matrix interference,it is suitable for the determination of free amino acids in kelp.
valve-switching ion chromatography;pulsed ampere detector; cation exchange column;free amino acid;kelp
O657.7
A
1008-6145(2016)04-0023-04
10.3969/j.issn.1008-6145.2016.04.006
*国家自然科学基金项目(21405166);科技部重大科学仪器开发专项(2012YQ090229)
联系人:法芸;E-mail: fayun@qibebt.ac.cn
2016-04-05

