α7烟碱型乙酰胆碱受体基因敲除对非酒精性脂肪性肝炎小鼠肝脏炎症的影响研究
李富强,吴小翠,徐丽娜,陈小梅,唐翠兰
·论著·
α7烟碱型乙酰胆碱受体基因敲除对非酒精性脂肪性肝炎小鼠肝脏炎症的影响研究
李富强,吴小翠,徐丽娜,陈小梅,唐翠兰
目的探讨α7烟碱型乙酰胆碱受体(α7nAChR)基因敲除对非酒精性脂肪性肝炎(NASH)小鼠肝脏炎症的影响。方法2014年6月—2015年5月,选取40只SPF级雄性6周龄C57BL/6J小鼠和40只SPF级雄性6周龄α7nAChR基因敲除小鼠,采用随机数字表法分为C57普通饲料组、C57高脂高糖组、基因敲除普通饲料组、基因敲除高脂高糖组,每组20只。C57普通饲料组、基因敲除普通饲料组小鼠给予普通饲料喂养,C57高脂高糖组、基因敲除高脂高糖组小鼠给予高脂饲料喂养同时饮用20%果糖饮用水,喂养24周,建立NASH小鼠模型;小鼠饲养期间定期称量体质量,并且尾静脉取血检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、三酰甘油(TG)、总胆固醇(TC)水平。21周时 C57高脂高糖组、基因敲除高脂高糖组小鼠给予400 μg/kg烟碱腹腔注射;C57普通饲料组、基因敲除普通饲料组小鼠给予等量0.9%氯化钠溶液腹腔注射,均1次/d,共3周。24周后处死小鼠,眼球取血,酶联免疫吸附试验(ELISA)法检测血清炎性细胞因子白介素6(IL-6)、肿瘤坏死因子α(TNF-α)水平,观察小鼠肝脏外观变化及肝脏湿重,肝脏病理切片染色观察炎症程度和脂肪变性情况。结果第12、15、18、21、24周时,C57高脂高糖组、基因敲除高脂高糖组小鼠体质量较C57普通饲料组、基因敲除普通饲料组升高(P<0.05);第12、15、18、21、24周时,基因敲除高脂高糖组小鼠体质量较C57高脂高糖组升高(P<0.05)。C57高脂高糖组、基因敲除高脂高糖组小鼠第8、16、24周时血清ALT、AST、TG、TC水平,第24周时血清IL-6、TNF-α水平、肝脏湿重较C57普通饲料组、基因敲除普通饲料组升高(P<0.05);基因敲除高脂高糖组小鼠第8、16、24周时血清ALT、AST水平,第16、24周时血清TG、TC水平,第24周时血清IL-6、TNF-α水平、肝脏湿重较C57高脂高糖组升高(P<0.05)。病理切片苏木素-伊红(HE)、油红染色结果显示:C57普通饲料组、基因敲除普通饲料组小鼠炎症程度和脂肪变性均不明显,C57高脂高糖组、基因敲除高脂高糖组小鼠在第8周开始出现轻微炎症和脂肪变性,以小脂滴为主,到第16、24周,炎症和脂肪变性逐渐加重,脂肪变性以中、大滴为主,基因敲除高脂高糖组小鼠肝脏组织炎症程度和脂肪变性均明显重于C57高脂高糖组小鼠。结论α7nAChR基因敲除能够明显加重NASH小鼠的肝脏炎症。
非酒精性脂肪性肝炎;基因敲除技术;α7烟碱型乙酰胆碱受体;细胞因子类;炎症
李富强,吴小翠,徐丽娜,等.α7烟碱型乙酰胆碱受体基因敲除对非酒精性脂肪性肝炎小鼠肝脏炎症的影响研究[J].中国全科医学,2016,19(23):2802-2809.[www.chinagp.net]
LI F Q,WU X C,XU L N,et al.Effect of α7nAChR gene knockout on the liver inflammation of non-alcoholic steatohepatitis mice[J].Chinese General Practice,2016,19(23):2802-2809.
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)是非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的一种类型,表现为肝脂肪变性与肝损伤、炎症共存。NASH是NAFLD发展的关键点,因为NASH不但发生肝硬化、甚至肝癌的风险高,而且伴有较高的心血管死亡风险[1]。NASH发病机制尚未完全明确,目前还没有任何一种药物推荐专用于治疗NASH[2],因而NASH的有效治疗显得尤为重要。近年来研究发现,慢性炎性反应在NASH的发生、发展中起重要作用[3]。多种炎性细胞因子参与NASH的炎性反应,如果能找到一种新的治疗靶位可以同时抑制多种炎性细胞因子,将会对NASH的治疗起非常重要的作用。胆碱能抗炎通路是近10年来研究较为热点的神经抗炎通路[4],被认为是体内有效且无不良反应的神经抗炎通路[5],可以抑制多重炎性细胞因子如白介素6(IL-6)、肿瘤坏死因子α(TNF-α)的产生。本课题组前期的研究中已经发现,体内外活化胆碱能抗炎通路可以抑制NASH肝脏的炎症[6],为了进一步明确α7烟碱型乙酰胆碱受体(α7nAChR)基因对NASH的抑制作用,本研究通过模拟NASH患者高脂肪、高果糖饮料的饮食习惯建立C57BL/6J小鼠NASH模型[7]和α7nAChR基因敲除小鼠NASH模型,系统研究α7nAChR介导的胆碱能抗炎通路失活对NASH小鼠肝脏炎症的作用及其分子机制。
1 材料与方法
1.1动物2014年6月—2015年5月,选取SPF级雄性4周龄C57BL/6J小鼠40只(购于南京大学模式动物研究所),SPF级雄性4周龄α7nAChR基因敲除小鼠40只(亲代鼠购于美国Jackson实验室,其余小鼠为亲代小鼠繁育而得),室内饲养,室温22~25 ℃,自由摄水和食物。
1.2材料与试剂普通饲料购于江苏省协同医药生物工程有限责任公司,高脂饲料(普通饲料78.0%,猪油10.0%,奶粉5.0%,蛋黄粉5.0%,胆固醇1.5%,胆酸钠0.5%)购于浙江省医学科学院,果糖购于美国Amerisco公司,烟碱购于美国sigma公司,小鼠IL-6、TNF-α酶联免疫吸附试验(ELISA)试剂盒购于深圳达科为生物技术有限公司,苏木素-伊红(HE)染色、油红染色试剂盒购自武汉百浩天生物科技有限公司。
1.3造模小鼠适应性饲养至6周龄后,C57BL/6J小鼠和α7nAChR基因敲除小鼠分别采用随机数字表法分为C57普通饲料组、C57高脂高糖组、基因敲除普通饲料组、基因敲除高脂高糖组,每组20只。C57普通饲料组、基因敲除普通饲料组小鼠给予普通饲料喂养,C57高脂高糖组、基因敲除高脂高糖组小鼠给予高脂饲料喂养同时饮用20%果糖饮用水(3次/周更换净水)。第6、9、12、15、18、21、24周观察各组小鼠的饮食变化并且称量体质量。21周时C57高脂高糖组、基因敲除高脂高糖组小鼠给予400 μg/kg烟碱腹腔注射,C57普通饲料组、基因敲除普通饲料组小鼠给予等量0.9%氯化钠溶液腹腔注射,1次/d,共3周。
1.4血清学指标检测第8、16、24周,每组采用随机数字表法取5只小鼠,放于固定器中,尾巴向下露出,浸入40~45 ℃水浴锅中30 s,剪掉少许尾巴取静脉血0.5 ml于离心管中,室温静置30 min后,3 000 r/min离心10 min(离心半径6 cm),取上清液,使用日立7180生化分析仪检测小鼠血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、三酰甘油(TG)、总胆固醇(TC)水平。第24周时处死小鼠,眼球取血1 ml,使用ELISA试剂盒检测各组小鼠血清中IL-6、TNF-α水平。
1.5组织学检测第8、16、24周,每组5只小鼠禁食16 h后处死,统一取肝左叶,石蜡切片进行HE染色,冷冻切片进行油红染色,观察各组小鼠肝组织炎症活动度及脂肪变性的程度。24周处死小鼠时观察小鼠肝脏的外观变化及肝脏湿重。

2 结果
2.14组小鼠不同时间体质量比较第6、9周时,4组小鼠体质量比较,差异无统计学意义(P>0.05);第12、15、18、21、24周时,4组小鼠体质量比较,差异均有统计学意义(P<0.05);其中,第12、15、18、21、24周时,C57高脂高糖组、基因敲除高脂高糖组小鼠体质量较C57普通饲料组、基因敲除普通饲料组升高,差异均有统计学意义(P<0.05);第12、15、18、21、24周时,基因敲除高脂高糖组小鼠体质量较C57高脂高糖组升高,差异均有统计学意义(P<0.05);第12、15、18、21、24周时,C57普通饲料组与基因敲除普通饲料组小鼠体质量比较,差异均无统计学意义(P>0.05,见表1)。
2.24组小鼠不同时间血清ALT、AST水平比较第8、16、24周时,4组小鼠血清ALT、AST水平比较,差异均有统计学意义(P<0.05);其中,C57高脂高糖组、基因敲除高脂高糖组小鼠血清ALT、AST水平较C57普通饲料组、基因敲除普通饲料组升高,差异均有统计学意义(P<0.05);基因敲除高脂高糖组小鼠血清ALT、AST水平较C57高脂高糖组升高,差异均有统计学意义(P<0.05);C57普通饲料组与基因敲除普通饲料组小鼠血清ALT、AST水平比较,差异均无统计学意义(P>0.05,见表2)。
2.34组小鼠不同时间血清TG、TC水平比较第8、16、24周时,4组小鼠血清TG、TC水平比较,差异均有统计学意义(P<0.05);其中,第8、16、24周时,C57高脂高糖组、基因敲除高脂高糖组小鼠血清TG、TC水平较C57普通饲料组、基因敲除普通饲料组升高,
本文研究背景:
随着对非酒精性脂肪性肝炎(NASH)的深入研究,发现NASH是非酒精性脂肪性肝病(NAFLD)的一种较严重的病理类型,不同于一般类型的脂肪肝,NASH是一种可以进展为肝纤维化、肝硬化甚至肝癌等终末期肝病的疾病,因而已经引起人们的广泛关注。目前还没有任何一种药物推荐专用于治疗NASH。另外NASH发病机制尚未完全明确,因此深入了解其发病机制,寻找NASH新的治疗靶位具有重要意义。慢性炎性反应在NASH的发生、发展中起重要作用,目前的研究多集中于免疫细胞和细胞因子在免疫反应中的作用,即使有少数抗炎治疗的实验研究,也主要集中于阻断单个细胞因子,比如肿瘤坏死因子α(TNF-α)抗体,但NASH的炎性反应是由多种细胞因子参与的,所以针对单个细胞因子抗体的治疗效果不理想,目前迫切需要找到一个能同时抑制多种炎性细胞因子的治疗靶位。胆碱能抗炎通路是机体神经内分泌免疫调控最重要的抗炎机制之一,α7烟碱型乙酰胆碱受体(α7nAChR)是胆碱能神经与免疫系统之间吻合的分子之一。传出迷走神经释放乙酰胆碱(Ach)与肝、心、脾和胃肠道中巨噬细胞烟碱型乙酰胆碱(nACh)的α7亚基相互作用,抑制TNF-α、白介素1(IL-1)、高迁移率族蛋白1(HMGB1)等炎性细胞因子的大量释放,这一生理学抗炎机制可以作为胆碱能通路拮抗肝脏炎症作用的靶位。胆碱能抗炎通路主要通过活化巨噬细胞表面的α7nAChR发挥作用,其可以同时抑制多种炎性细胞因子的产生,比靶向单一炎性细胞因子的治疗措施更具优势,因其治疗类风湿关节炎的疗效显著,甚至已经提出把α7nAChR作为治疗类风湿关节炎的靶分子。但该通路在慢性炎性疾病NASH中是否发挥抗炎作用及其作用机制,目前国内外尚未见报道。基于上述研究背景,本研究推测活化α7nAChR介导的胆碱能抗炎通路能减轻NASH的炎性反应。
差异均有统计学意义(P<0.05);第16、24周时,基因敲除高脂高糖组小鼠血清TG、TC水平较C57高脂高糖组升高,差异均有统计学意义(P<0.05);第8、16、24周时,C57普通饲料组与基因敲除普通饲料组小鼠血清TG、TC水平比较,差异均无统计学意义(P>0.05);第8周时,C57高脂高糖组与基因敲除高脂高糖组小鼠血清TG、TC水平比较,差异均无统计学意义(P>0.05,见表3)。

表1 4组小鼠不同时间体质量比较±s,g)
注:与C57普通饲料组比较,aP<0.05;与C57高脂高糖组比较,bP<0.05;与基因敲除普通饲料组比较,cP<0.05
表2 4组小鼠不同时间血清ALT、AST水平比较
注:ALT=丙氨酸氨基转移酶,AST=天冬氨酸氨基转移酶;与C57普通饲料组比较,aP<0.05;与C57高脂高糖组比较,bP<0.05;与基因敲除普通饲料组比较,cP<0.05
表3 4组小鼠不同时间血清TG、TC水平比较
注:TG=三酰甘油,TC=总胆固醇;与C57普通饲料组比较,aP<0.05;与C57高脂高糖组比较,bP<0.05;与基因敲除普通饲料组比较,cP<0.05
2.44组小鼠血清IL-6、TNF-α水平比较第24周时,4组小鼠血清IL-6、TNF-α水平比较,差异均有统计学意义(P<0.05);其中C57高脂高糖组、基因敲除高脂高糖组小鼠血清IL-6、TNF-α水平较C57普通饲料组和基因敲除普通饲料组升高,差异均有统计学意义(P<0.05);基因敲除高脂高糖组小鼠血清IL-6、TNF-α水平较C57高脂高糖组升高,差异均有统计学意义(P<0.05);C57普通饲料组与基因敲除普通饲料组小鼠血清IL-6、TNF-α水平比较,差异均无统计学意义(P>0.05,见表4)。
Table 4Comparison of serum IL-6 and TNF-α levels among the four groups in week 24
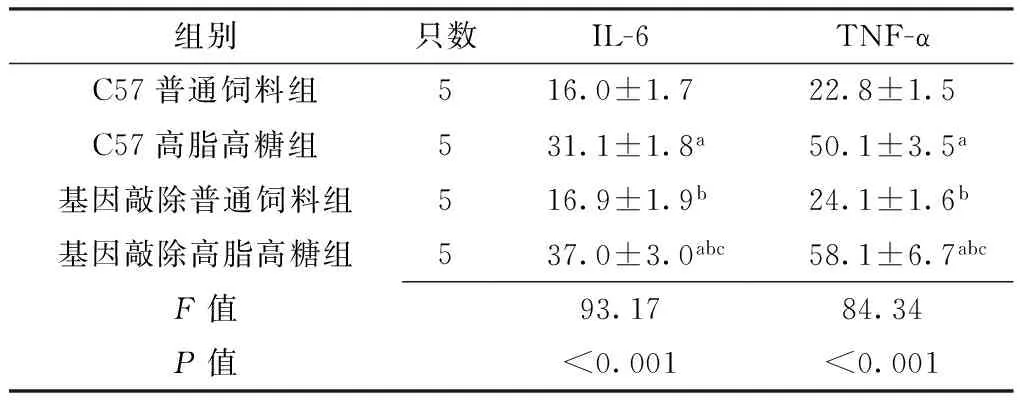
组别只数IL-6TNF-αC57普通饲料组516.0±1.722.8±1.5C57高脂高糖组531.1±1.8a50.1±3.5a基因敲除普通饲料组516.9±1.9b24.1±1.6b基因敲除高脂高糖组537.0±3.0abc58.1±6.7abcF值93.1784.34P值<0.001<0.001
注:IL-6=白介素6,TNF-α=肿瘤坏死因子α;与C57普通饲料组比较,aP<0.05;与C57高脂高糖组比较,bP<0.05;与基因敲除普通饲料组比较,cP<0.05
2.54组小鼠肝脏外观变化和肝脏湿重比较第24周时,C57普通饲料组和基因敲除普通饲料组小鼠肝脏颜色均为暗红色,C57高脂高糖组和基因敲除高脂高糖组小鼠肝脏颜色均变黄,基因敲除高脂高糖组小鼠肝脏颜色变化更明显(见图1,本文图1~3彩图见本刊官网www.chinagp.net电子期刊相应文章附件)。4组小鼠肝脏湿重比较,差异有统计学意义(P<0.05);其中C57高脂高糖组、基因敲除高脂高糖组小鼠肝脏湿重较C57普通饲料组和基因敲除普通饲料组增加,差异均有统计学意义(P<0.05);基因敲除高脂高糖组小鼠肝脏湿重较C57高脂高糖组增加,差异有统计学意义(P<0.05);C57普通饲料组与基因敲除普通饲料组小鼠肝脏湿重比较,差异无统计学意义(P>0.05,见表5)。

表5 4组小鼠24周时肝脏湿重比较±s,g)
注:与C57普通饲料组比较,aP<0.05;与C57高脂高糖组比较,bP<0.05;与基因敲除普通饲料组比较,cP<0.05
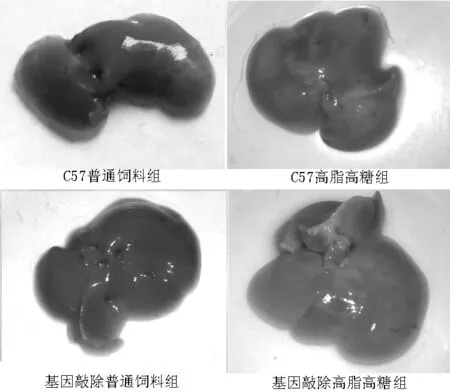
图14组小鼠24周时肝脏颜色
Figure 1Mice liver color of the four groups in week 24
2.64组小鼠肝脏组织病理检查结果病理切片HE、油红染色结果显示:C57普通饲料组、基因敲除普通饲料组小鼠炎症程度和脂肪变性均不明显,C57高脂高糖组、基因敲除高脂高糖组小鼠在第8周开始出现轻微炎症和脂肪变性,以小脂滴为主,到第16、24周,炎症和脂肪变性逐渐加重,脂肪变性以中、大滴为主,基因敲除高脂高糖组小鼠肝脏组织炎症程度和脂肪变性均明显重于C57高脂高糖组小鼠(见图2、3)。
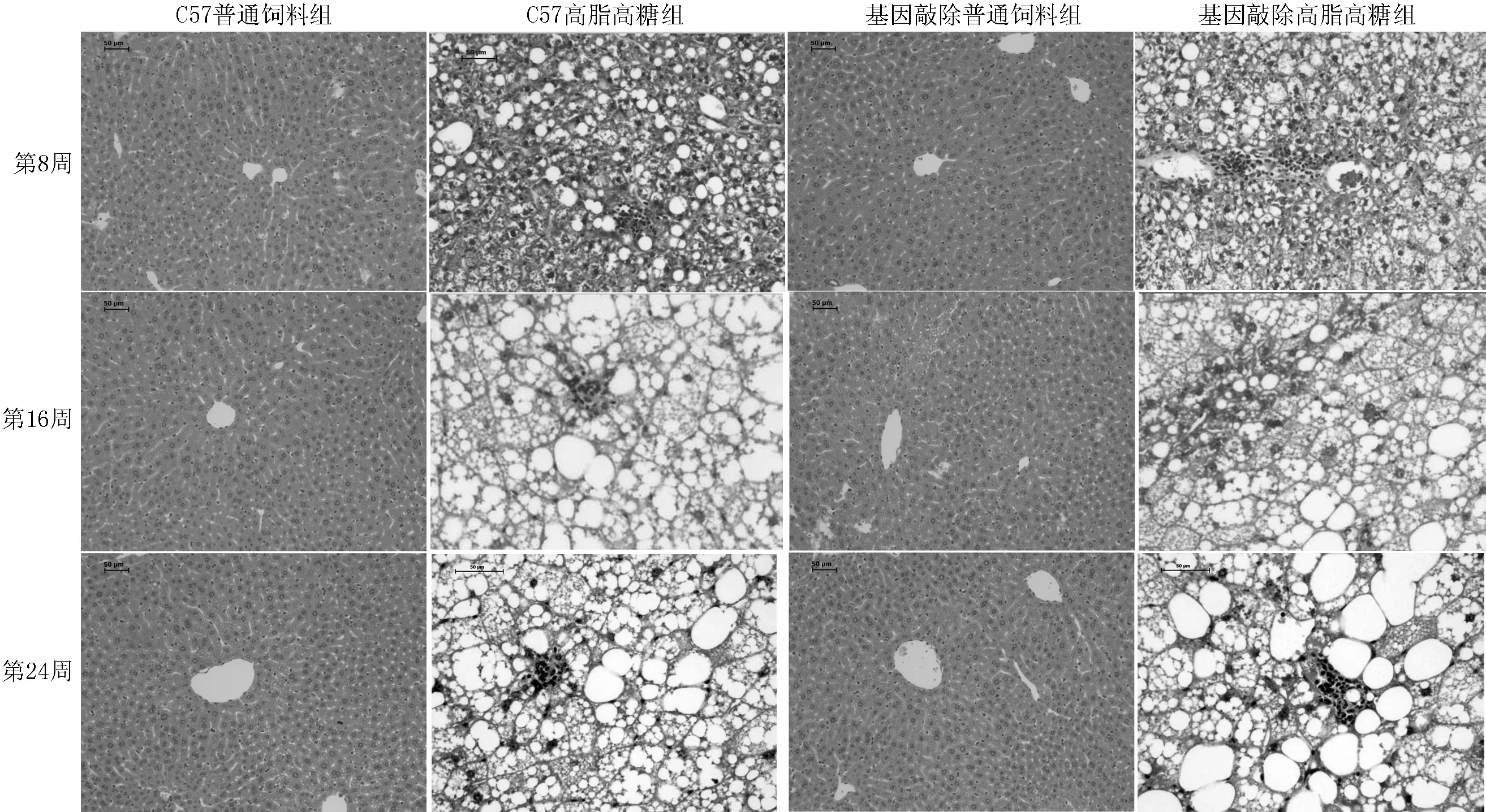
图24组小鼠不同时间肝脏组织病理(HE染色,×20)
Figure 2HE staining of mice liver tissue of the four groups at different time points
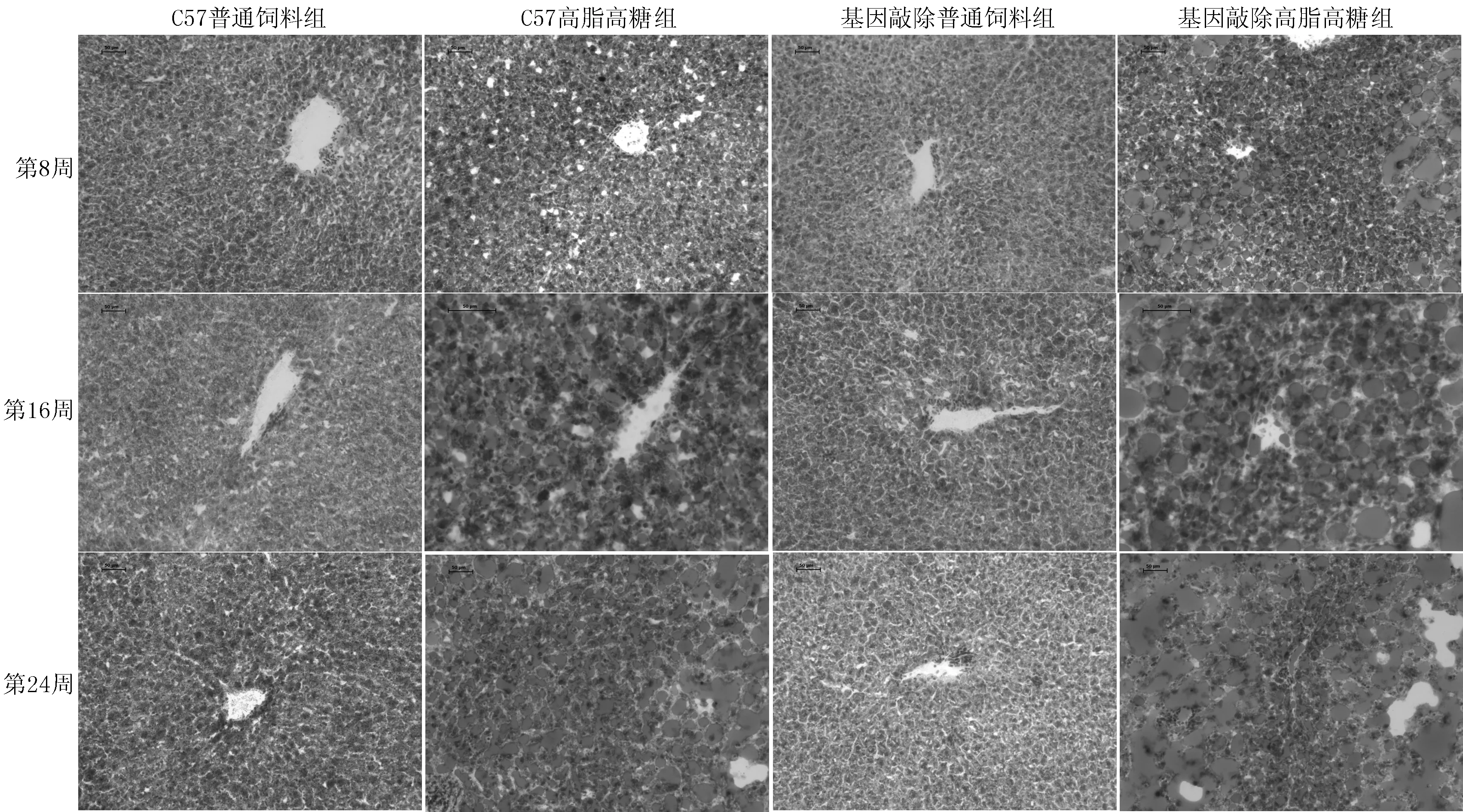
图3 4组小鼠不同时间肝脏组织病理(油红染色,×20)
3 讨论
近年来研究发现,免疫功能紊乱在NASH的发病机制中起重要作用,来源于肝脏巨噬细胞的炎性细胞因子对NASH的发生、发展起重要作用[8]。巨噬细胞是参与胆碱能抗炎通路的主要靶细胞,巨噬细胞表面的α7nAChR是胆碱能抗炎通路发挥抗炎作用的效应器。Kupffer细胞在NASH的慢性炎性反应中起重要作用,巨噬细胞失活后可以阻断NASH大鼠肝脂肪变性和炎症的发展[9]。
目前已有的啮齿类动物模型大致可以分为两类:第一类为饮食或药物控制模型,第二类为转基因模型。常用的是饮食或药物控制模型,主要是增加递送到肝脏的脂肪酸的高脂饮食模型。高脂饮食后,大量乳糜微粒输送入肝,在溶酶体分解产生大量游离脂肪酸,这些饮食来源的大量脂肪酸导致脂肪变性、糖尿病和肥胖[10]。有研究对C57BL/6J小鼠长期给予高脂饮食,这些小鼠出现了肥胖、高胰岛素血症、高血糖、高血压[11],并且出现糖耐量受损和脂肪性肝炎[12]。TETRI等[13]将果糖和高脂饮食结合喂养小鼠,出现了严重肥胖、糖耐量异常、高胰岛素血症以及大量的肝细胞脂肪变性和坏死性炎症。这种模型的优势在于产生类似的NASH特性的过程均为生理过程,但其纤维化少见甚至不出现肝细胞癌。通过总结各种动物模型的优势和不足及本实验的特定需求,本研究选择高脂饲料(普通饲料78.0%,猪油10.0%,奶粉5.0%,蛋黄粉5.0%,胆固醇1.5%,胆酸钠0.5%)加高果糖饮水(20%果糖饮用水)诱导的NASH小鼠模型。实验中定期监测小鼠体质量,观察到随时间的推移,C57高脂高糖组、基因敲除高脂高糖组小鼠体质量增加明显;并对小鼠进行血清生化分析、血脂、肝脏组织病理检查,观察到C57高脂高糖组、基因敲除高脂高糖组小鼠血清AST、ALT、TG、TC水平升高,肝脏组织从单纯脂肪变性逐渐发展到脂肪性肝炎,较为完整的呈现了人类NASH的发生、发展过程,与李阳等[14]研究结果基本符合。因此,通过高脂饲料果糖饮用水诱导的NASH动物模型为进一步研究人类 NASH发生、发展的分子机制有十分重要的价值。
胆碱能抗炎通路是调节免疫系统的一种神经生理机制,主要通过乙酰胆碱与巨噬细胞及其他分泌细胞因子的细胞上的α7nAChR相互作用,抑制促炎细胞因子的合成与释放,防止组织损伤。有实验证明,胆碱能激动剂对α7nAChR基因敲除小鼠来源的巨噬细胞的抗炎作用被取消[15],并且α7nAChR基因敲除小鼠内毒素血症易患性更高[16],相当于外科的迷走神经切断术,也就说明这种由激活迷走神经引起的生理性抗炎机制与α7nAChR密切有关。研究发现,通过基因敲除技术定向敲除α7nAChR基因,可导致小鼠胶原诱导的关节炎病情恶化[17]。给予心肌缺血再灌注模型大鼠α7nAChR短发夹 RNA(shRNA)[18]处理,给予内毒素脂多糖(LPS)败血症模型小鼠α-银环蛇毒素(α7nAChR拮抗剂)处理或行迷走神经切断术[19],均能抑制迷走神经刺激诱发的胆碱能抗炎通路作用。野生型小鼠迷走神经兴奋的抗炎效应正常,而α7nAChR基因缺失小鼠则不能正常工作。体外研究中发现,烟碱受体激动剂抑制野生型小鼠巨噬细胞TNF-α的表达,而不抑制α7nAChR基因敲除小鼠巨噬细胞TNF-α的表达[20-21]。基于临床败血症患者的初步研究结果提示,外周血单核细胞α7nAChR mRNA表达水平是败血症患者胆碱能抗炎通路激活的临床相关性标志,α7nAChR mRNA表达水平越高,患者的炎症控制和预后越好[22]。
上述相关研究提到α7nAChR基因敲除能够加重炎性反应程度,本课题组前期研究证实,小鼠肝脏巨噬细胞上存在α7nAChR,给予烟碱活化α7nAChR介导的胆碱能抗炎通路,小鼠肝组织炎症程度下降,血清中TNF-α水平下降[23]。因此本研究采用C57BL/6J小鼠和α7nAChR基因敲除小鼠构建NASH模型,给予烟碱腹腔注射活化胆碱能抗炎通路,观察α7nAChR基因敲除对NASH小鼠肝脏炎症的影响。
本研究结果显示,基因敲除高脂高糖组小鼠肝脏炎症程度和脂肪变性较C57高脂高糖组严重,基因敲除高脂高糖组小鼠血清肝功能指标ALT、AST水平、血脂TG、TC水平、炎性细胞因子IL-6、TNF-α水平均高于C57高脂高糖组,基因敲除高脂高糖组小鼠体质量以及肝脏湿重也较C57高脂高糖组有所增加,提示α7nAChR基因敲除NASH小鼠肝脏炎症程度加重。给予烟碱腹腔注射后,C57高脂高糖组小鼠肝脏巨噬细胞表面α7nAChR介导的胆碱能抗炎通路被激活,有效地抑制了NASH小鼠的肝脏炎症。然而,基因敲除高脂高糖组小鼠的α7nAChR基因无法被活化,胆碱能抗炎通路无法发挥其抗炎作用,小鼠肝脏的炎症程度加重。这与上述α7nAChRA基因敲除加重炎性反应的研究结果基本一致[10-22],也为进一步在细胞分子水平研究α7nAChR基因对NASH炎性反应的抑制作用及其机制奠定了基础和理论依据,对NASH的发病以及治疗具有重要意义。α7nAChR介导的胆碱能抗炎通路抑制NASH小鼠肝脏炎症,其具体的机制可能为胆碱能抗炎通路被激活后,刺激迷走神经末梢释放乙酰胆碱(ACh),与巨噬细胞和其他细胞上表达的α7nAChR结合,作用于下游JAK2/信号传导与转录激活因子3(STAT3)、丝裂原活化蛋白激酶(MAPK)/核因子(NF)-кB等信号转导通路,抑制TNF-α、白介素1(IL-1)、IL-6等炎性细胞因子,从而发挥抗炎作用[24-25]。α7nAChR与Toll样受体4(TLR-4)均表达于巨噬细胞表面,α7nAChR介导的抗炎信号转导通路与TLR-4 介导的致炎信号转导通路均通过NF-κB和MAPK信号转导通路,TLR-4介导的巨噬细胞活化在NAFLD的炎性反应中起重要作用,而α7nAChR体内外活化胆碱能抗炎通路竞争性抑制TLR-4介导的巨噬细胞活化从而抑制NASH小鼠肝脏炎症。
胆碱能抗炎通路还与改善心肌缺血后血管功能障碍[20]、过敏性哮喘[26]、慢性膀胱炎[27]、类风湿关节炎[28]、脑缺血再灌注损伤[29]、休克[30]、肥胖[31]、败血症[32]等诸多疾病的进展密切相关。目前,关于这方面的研究还在继续,但仍存在一些疑问。本研究中,小鼠造模完成后眼球取血时偶尔会出现溶血,对血清炎性细胞因子水平略有影响,需要采用更为便捷的小鼠眼眶静脉取血。另外小鼠给予烟碱腹腔注射时死亡1只,尸检发现小鼠腹腔被穿破留有血迹,需进一步提高穿刺技术。
本研究结果证实活化α7nAChR介导的胆碱能抗炎通路对NASH动物模型肝脏炎症起抑制作用,基因敲除后能够加重肝脏炎症程度,但是在细胞分子层面没有更深入的研究,下一步计划制备α7nAChR基因沉默细胞或者分离培养α7nAChR基因敲除小鼠原代肝脏巨噬细胞,采用LPS、烟碱处理上述细胞,通过炎症信号转导通路的活化/阻断实验进一步明确α7nAChR抑制NASH炎性反应的分子机制。另外本研究还未证实胆碱能抗炎通路是否对人类革兰阳性菌所致的炎性反应也能发挥抗炎效应,下一步计划进一步阐明胆碱能抗炎机制,为临床患者带来更多的益处。烟碱是α7nAChR激动剂,可以降低炎症,但是对血压、呼吸、心率有一定的抑制作用[33],有待于开发特异性更高的激动剂。
作者贡献:李富强、陈小梅负责实验设计、论文撰写、细胞因子检测;吴小翠、徐丽娜负责小鼠造模、取血、血生化检测、病理切片染色;唐翠兰负责实验设计、质量控制及审校。
本文无利益冲突。
[1]WREE A,BRODERICK L,CANBAY A,et al.From NAFLD to NASH to cirrhosis-new insights into disease mechanisms[J].Nat Rev Gastroenterol Hepatol,2013,10(11):627-636.
[2]CORRADO R L,TORRES D M,HARRISON S A.Review of treatment options for nonalcoholic fatty liver disease[J].Med Clin North Am,2014,98(1):55-72.
[3]LADE A,NOON L A,FRIEDMAN S L.Contributions of metabolic dysregulation and inflammation to nonalcoholic steatohepatitis,hepatic fibrosis,and cancer[J].Curr Opin Oncol,2014,26(1):100-107.
[4]MACDONALD T T,DI SABATION A.The immunologic basis for gastrointestinal food allergy[J].Curt Opin Gastroenterol,2009,25(6):521-526.
[5]TONG W D,RIDOLFI T J,KOSINSKI L,et al.Effects of autonomic nerve stimulation on colorectal motility in rats[J].Neurogastroenterol Motil,2010,22(6):688-693.
[6]ZHOU Z,CHEN X,LI F,et al.Effects and mechanisms of the inflammatory reaction related to NASH and induced by activation of the cholinergic anti-inflammatory pathway [J].Zhonghua Gan Zang Bing Za Zhi,2015,23(1):64-68.
[7]KOHLI R,KIRBY M,XANTHAKOS S A,et al.High-fructose,medium chain trans fat diet induces liver fibrosis and elevates plasma coenzyme Q9 in a novel murine model of obesity and nonalcoholic steatohepatitis[J].Hepatology,2010,52(3):934-944.
[8]ZHAN Y T,AN W.Roles of liver innate immune cells in nonalcoholic fatty liver disease[J].World J Gastroenterol,2010,16(37):4652-4660.
[9]MOURALIDARANE A,SOEDA J,VISCONTI-PUGMIRE C,et al.Maternal obesity programs offspring nonalcoholic fatty liver disease by innate immune dysfunction in mice[J].Hepatology,2013,58(1):128-138.
[10]NEHRA V,ANGULO P,BUCHMAN A L,et al.Nutritional and metabolic considerations in the etiology of nonalcoholic steatohepatitis[J].Dig Dis Sci,2001,46(11):2347-2352.
[11]ITO M,SUZUKI J,SASAKI M,et al.Development of nonalcoholic steatohepatitis model through combination of high-fat diet and tetracycline with morbid obesity in mice[J].Hepatol Res,2006,34(2):92-98.
[12]ITO M,SUZUKI J,TSUJIOKA S,et al.Longitudinal analysis of murine steatohepatitis model induced by chronic exposure to high-fat diet[J].Hepatol Res,2007,37(1):50-57.
[13]TETRI L H,BASARANOGLU M,BRUNT E M,et al.Severe NAFLD with hepatic necroinflammatory changes in mice fed trans fats and a high-fructose corn syrupequivalent[J].Am J Physiol Gastrointest Liver Physiol,2008,295(5):987-995.
[14]李阳,肖丽,耿爱文,等.不同饮食结构构建小鼠非酒精性脂肪性肝炎模型的实验研究[J].上海交通大学学报(医学版),2015,35(11):1682-1686.
LI Y,XIAO L,GENG A W,et al.Experimental study on establishing mouse model of nonalcoholic steatohepatitis by different diet structures [J].Journal of Shanghai Jiaotong University(Medical Science),2015,35(11):1682-1686.
[15]ORR-URTREGER A,GÖLDNER F M,SAEKI M,et al.Mice deficient in the alpha7 neuronal nicotinic acetylcholine receptor lack alpha-bungarotoxin binding sites and hippocampal fast nicotinic currents [J].J Neurosci,1997,17(23):9165-9171.
[16]WANG H,LIAO H,OCHANI M,et al.Cholinergic agonists inhibit HMGB1 release and improve survival in experimental sepsis[J].Nat Med,2004,10(11):1216-1221.
[17]WANG H,YU M,OCHANI M,et al.Nicotinic acetylcholine receptor alpha7 subunit is an essential regulator of inflammation[J].Nature,2003,421(6921):384-388.
[19]VAN MAANEN M A,STOOF S P,LAROSA G J,et al.Role of the cholinergic nervous system in rheumatoid arthritis:aggravation of arthritis in nicotinic acetylcholine receptor α7 subunit gene knockout mice[J].Ann Rheum Dis,2010,69(9):1717-1723.
[20]ZHAO M,HE X,BI X Y,et al.Vagal stimulation triggers peripheral vascular protection through the cholinergic anti-inflammatory pathway in a rat model of myocardial ischemia/reperfusion[J].Basic Res Cardiol,2013,108(3):345.
[21]XIANG H,HU B,LI Z,et al.Dexmedetomidine controls systemic cytokine levels through the cholinergic anti-inflammatory pathway[J].Inflammation,2014,37(5):1763-1770.
[22]CEDILLO J L,ARNALICH F,MARTN-SNCHEZ C,et al.Usefulness of α7 nicotinic receptor messenger RNA levels in peripheral blood mononuclear cells as a marker for cholinergic antiinflammatory pathway activity in septic patients:results of a pilot study[J].J Infect Dis,2015,211(1):146-155.
[23]李富强,吴小翠,陈小梅,等.α7nAChR基因敲除小鼠的饲养繁育及基因型鉴定[J].江西中医药大学学报,2015,27(5):75-77.
LI F Q,WU X C,CHEN X M,et al.Reproduction and genotype identification of α7nAChR knockout mice [J].Journal of Jiangxi University of Traditional Chinese Medicine,2015,27(5):75-77.
[24]CHATTERJEE P K,AL-ABED Y,SHERRY B,et al.Cholinergic agonists regulate JAK2/STAT3 signaling to suppress endothelial cell activation[J].Am J Physiol Cell Physiol,2009,297(5):C1294-1306.
[25]SUN P,ZHOU K,WANG S,et al.Involvement of MAPK/NF-κB signaling in the activation of the cholinergic anti-inflamatory pathway in experimental colitis by chronic vagus nerve stimulation[J].PLoS One,2013,8(8):e69424.
[26]MURAD H A,HASANIN A H.The anti-inflammatory effects of 1,1 dimethyl-4-phenylpiperazinium(DMPP) compared to dexamethasone in a guinea pig model of ovalbumin induced asthma[J].Eur Rev Med Pharmacol Sci,2014,18(15):2228-2236.
[28]Syngle A,Verma I,Krishan P.Interleukin-6 blockade improves autonomic dysfunction in rheumatoid arthritis[J].Acta Reumatol Port,2015,40(1):85-88.
[29]JIANG Y,LI L,LIU B,et al.Vagus nerve stimulation attenuates cerebral ischemia and reperfusion injury via endogenous cholinergic pathway in rat[J].PLoS One,2014,9(7):e102342.
[30]REZENDE-NETO J B,ALVES R L,CARVALHO M Jr,et al.Vagus nerve stimulation improves coagulopathy in hemorrhagic shock:a thromboelastometric animal model study[J].J Trauma Manag Outcomes,2014,8:15.
[31]CANCELLO R,ZULIAN A,MAESTRINI S,et al.The nicotinic acetylcholine receptor α7 in subcutaneous mature adipocytes:downregulation in human obesity and modulation by diet-induced weight loss[J].Int J Obes(Lond),2012,36(12):1552-1557.
[32]VILLEGAS-BASTIDA A,TORRES-ROSAS R,ARRIAGA-PIZANO L A,et al.Electrical stimulation at the ST36 acupoint protects against sepsis lethality and reduces serum TNF levels through vagus nerve- and catecholamine-dependent mechanisms[J].Evid Based Complement Alternat Med,2014,2014:451674.
[33]ALSHARARI S D,AKBARALI H I,ABDULLAH R A,et al.Novel insights on the effect of nicotine in a murine colitis model[J].J Pharmacol Exp Ther,2013,344(1):207-217.
(本文编辑:陈素芳)
Effect of α7nAChR Gene Knockout on the Liver Inflammation of Non-alcoholic Steatohepatitis Mice
LIFu-qiang,WUXiao-cui,XULi-na,CHENXiao-mei,TANGCui-lan.
DepartmentofInfectiousDisease,theSecondHospitalAffiliatedtoZhejiangChineseMedicalUniversity,Hangzhou310005,China
TANGCui-lan,DepartmentofInfectiousDisease,theSecondHospitalAffiliatedtoZhejiangChineseMedicalUniversity,Hangzhou310005,China;E-mail:953806044@qq.com
ObjectiveTo investigate the effect of α7nAChR gene knockout on the liver inflammation of non-alcoholic steatohepatitis(NASH) mice.MethodsFrom June 2014 to May 2015,40 SPF male 6-week-old C57BL/6J mice and 40 SPF male 6-week-old α7nAChR gene knockout mice were selected.The mice were divided into C57 mice normal diet group(group 1),C57 mice high fat and fructose diet group(group 2),gene knockout mice normal diet group(group 3),gene knockout mice high fat and fructose diet group(group 4),with 20 rats in each group.Group 1 and group 3 were fed up with either normal feed,group 2 and group 4 were fed up with high-fat feed plus 20% fructose drinking water,24 weeks to generate an NASH model.The body weight of the mice during the feeding period was measured on a regular basis,and blood was sampled from the caudal vein to detect the levels of ALT,AST,TG and TC.In week 21,group 2 and group 4 were given 400 μg/kg nicotine by intraperitoneal injection,and group 1 and group 3 were given the same volume of 0.9% sodium chloride solution by intraperitoneal injection for one time per day for 3 weeks.24 weeks later,the mice were killed.Blood was sampled from eyeball to detect the levels of IL-6 and TNF-α by ELISA method,the changes of color and liver wet weight were recorded,and liver pathological section staining was conducted to observe inflammation degree and fatty degeneration.ResultsIn week 12,15,18,21 and 24,group 2 and group 4 were higher than group 1 and group 3 in body weight(P<0.05).In week 12,15,18,21 and 24,group 4 was higher than group 2 in body weight(P<0.05).Group 2 and group 4 had higher ALT,AST,TG and TC levels in week 8,16 and 24 and higher IL-6 and TNF-α levels and higher liver wet weight in week 24 than group 1 and group 3(P<0.05);group 4 had higher ALT and AST levels in week 8,16 and 24,higher TG and TC levels in week 16 and 24,higher IL-6 and TNF-α levels and higher liver wet weight in week 24 than group 2(P<0.05).The pathological section of HE and oil red staining showed that group 1 and group 3 had no obvious inflammation degree and fatty degeneration,and group 2 and group 4 showed slight inflammation and fatty degeneration which was mainly manifested as small fat drops in week 8 and showed severer inflammation and fatty degeneration which featured medium or large small fat drops in week 16 and 24,and group 4 had severer inflammation degree and fatty degeneration than group 2.Conclusionα7nAChR gene knockout can significantly aggravate the liver inflammation in NASH mice.
Non-alcoholic steatohepatitis;Gene knockout techniques;α7nAChR;Cytokines;Inflammation
国家自然科学基金资助项目(81100279);浙江省新苗人才计划项目(2015R410013)
310005浙江省杭州市,浙江中医药大学附属第二医院感染科
唐翠兰,310005浙江省杭州市,浙江中医药大学附属第二医院感染科;E-mail:1747603542@qq.com
R 575.1
A
10.3969/j.issn.1007-9572.2016.23.013
2015-11-16;
2016-05-26)

