基于SPR技术高通量呼吸道病毒检测方法研究*
孙秋香,王小华,顾大勇
(1.广东省东莞市凤岗镇社区卫生服务中心 523000;2.重庆市公安局渝中区分局物证鉴定所,重庆 400013;3.广东省深圳市检验检疫科学研究院 518045)
·论著·
基于SPR技术高通量呼吸道病毒检测方法研究*
孙秋香1,王小华2,顾大勇3△
(1.广东省东莞市凤岗镇社区卫生服务中心523000;2.重庆市公安局渝中区分局物证鉴定所,重庆 400013;3.广东省深圳市检验检疫科学研究院518045)
目的结合表面等离子共振(SPR)和基因芯片技术优势,针对9种常见呼吸道病毒[包括A型、B型流感病毒(Influ A,B),甲型H1N1,呼吸道融合病毒(RSV),副流感病毒1~3型(PIV1、2、3),腺病毒(ADV)以及引发严重急性呼吸综合征的冠状病毒(SARS)],构建特异性强、通量高的生物传感器方法。方法首先利用软件premier 5等在保守序列上设计相关病毒的特异性引物及探针;将所设计的9种相应呼吸道病毒的探针固定于化学修饰后的SPR芯片的特定区域,利用SPR技术实时监测探针与PCR产物的杂交过程,最后通过生物素与链霉亲和素系统实现信号的放大。结果设计的基因芯片可以高通量地检测9种呼吸道病毒,具有很好的检测特异性;芯片表面通过一定的再生条件后可以重复利用,避免芯片批间差对结果的影响;检测灵敏度都达到纳摩尔级。结论初步研究结果表明,利用SPR传感技术建立高通量检测呼吸道病毒的检测方法具有一定的实用性和可行性,有望成为快速、大规模、高通量筛查呼吸道病毒感染的手段,具有较好的应用前景。
表面等离子共振;呼吸道病毒;高通量;免标记;基因芯片
呼吸道病毒是导致上、下呼吸道疾病的主要原因[1]。常见的呼吸道病毒主要包括流感病毒A型、B型(Influ A、B),甲型H1N1、呼吸道融合病毒(RSV)、副流感病毒1~3型(PIV1~3)、腺病毒(ADV)以及引发严重急性呼吸综合征的冠状病毒(SARS)[2]。呼吸道病毒感染往往呈现一般的呼吸道症状,临床医生难以作出判断[3]。因此迫切需要一种快速检测呼吸道病毒的方法,以便帮助医生快速确定病毒,并选择合理的治疗方案[4]。目前,呼吸道病毒的常规培养法耗时长,需培养2~10 d,然后通过形态特征进行鉴定,需要在专用的实验室开展。血清学方法包括核酸序列依赖性扩增(NASBAs)[5]、限制性内切酶分析(REA)[6]和直接免疫荧光法[7]或针对病毒表面抗原的酶联免疫吸附试验[8],相对而言具有操作简单、快速、便捷的特点,适用于基层实验室,但存在检测灵敏度低的局限性。随着分子生物诊断技术的发展,聚合酶链反应(PCR)检测RNA病毒培养物也很常见,即从样品中提取病毒的核酸转录成cDNA,然后放大并利用荧光或发光免疫检测[9-10]。虽然这种方法比较简单,但它不能提供基因序列信息并且从非特异性序列的扩增会产生较高的假阳性结果。因此,需要建立一种更高特异性、相互作用的杂交分析方法。表面等离子共振(SPR)技术是一种简便、快速和无标记的生物分子检测方法[11-12]。本文充分利用SPR快速、便捷和基因芯片高通量的技术优势,尝试应用于呼吸道病毒的检测。首先,利用氨基化学将9种呼吸道病毒的探针固定在化学修饰的SPR芯片表面的特定区域,制备成呼吸道病毒诊断基因芯片,然后利用SPR技术平台直接检测PCR产物。本文建立同时检测9种呼吸道病毒的技术方法,为及时应对呼吸道感染疫情提供重要信息。
1 资料与方法
1.1仪器与试剂SPR检测仪器为PlexArrayTMHT生物分子相互作用分析系统(美国Plexera公司);C1000 Thermal cycler PCR(美国伯乐公司);Bio-RAD凝胶成像仪(美国伯乐公司);ND-1000微量紫外可见分光光度计(美国Nanodrop公司)。12-巯基十二酸(12-Mercaptododecanoic)(Sigma-Aldrich,美国);盐酸乙醇胺(TCI,日本);1-乙基-3(3-二甲氨基丙基)碳二亚胺(EDC)(Bio Basic Inc,加拿大);N-羟基丁二酰亚胺(NHS)(上海共价化学科技有限公司);链霉亲和素(北京生物合成技术有限公司)。所有其他试剂均为分析纯。所有生物试剂4 ℃储存。所有溶剂均用超纯水制备(>18.2 MΩ·cm-1)。用0.2 g KCl、8.0 g NaCl、0.24 g KH2PO4和1.44 g Na2HPO4溶解于1 000 mL 水中制备0.01 mol/L的磷酸缓冲盐溶液(PBS,pH7.4)。氨基标记的寡核苷酸探针和生物素标记的引物均由英俊生物技术有限公司合成。
1.2方法
1.2.1SPR-生物芯片构建和表面修饰首先在玻璃基片(ITO光学玻璃)上蒸镀一层2.5 nm厚的铬膜,再在其上蒸镀47 nm的金膜,构成SPR裸金膜芯片。裸金芯片表面由等离子清洗仪清洗1 min后,浸泡在1 mmol/L的12-巯基十二酸(MDA)溶液中进行分子自组装,然后用无水乙醇彻底清洗,氮气吹干。
1.2.2基因芯片设计用0.4 mol/L的EDC和0.1 mol/L NHS混合溶液处理金膜表面10 min,以活化羧基为酯键。将9种呼吸道病毒的探针用PBS缓冲液(10 mmol/L,pH7.4)配置10 μmol/L,实验采用mini Q-array 点样仪将探针固定于芯片的特定位置,室温下孵育2 h,探针上的氨基与活化的酯键反应而固定于芯片表面。然后将芯片直接浸入1 mmol/L的乙醇胺(pH 8.5)中10 min,以封闭剩余的活性酯键。
1.2.3PCR扩增呼吸道病毒RNA从200 μL的咽拭子样品中提取,采用的是北京天恩泽基因科技有限公司的柱式病毒RNA提取试剂盒(产品编号71001-50),按照产品说明书操作。提取的RNA用一步法PCR进行扩增。具体操作步骤如下:0.3 μL的RNA模板,3 μL 的10×PCR缓冲液(TAKARA),9.6 μL的引物混合物,0.5 μL的Taq DNA 聚合酶,0.25 μL的AMV RT,0.6 μL的dNTP混合物,然后加无菌水至30 μL。同时设置一个空白质控管。样品按照以下循环条件进行扩增:42 ℃,40 min;95 ℃,2 min;95 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,5个循环;95 ℃ 30 s,49 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃,2 min;4 ℃,10 min。DNA的浓度采用ND-1000微量紫外可见光分光光度计检测。PCR扩增产物在进样前95 ℃ 5 min热变性,再置入冰中1 min,使双链变为单链以便和固定在芯片上的探针杂交。PCR扩增产物用2%琼脂糖凝胶电泳验证检测。
1.2.4SPR检测所有PCR产物用PBS(10 mmol/L,pH7.4)缓冲液稀释至所需要的浓度。由于PCR扩增产物为双链,在进样前需95 ℃ 5 min的热变性和冰浴1 min的冷却过程,使双链变为单链以便和固定在芯片上的探针杂交。SPR检测实验均采用PlexArrayTMHT 系统(美国Plexera公司)。将基因芯片固定在SPR监测仪上。PBS缓冲液(10 mmol/L,pH7.4)用于杂交反应运行时的缓冲液,流速50 μL/s。待仪器基线稳定后,注入500 μmol/L的PCR产物溶液,设定流速为 5 μL/s,时间为270 s。观察反应5 min,然后用杂交缓冲液自动冲洗传感器芯片以除去未结合的DNA物质。杂交后,再泵入60 μg/mL的链霉亲和素溶液以增强反应信号。反应前后的基线差值为检测信号值。杂交反应结束后,注入100 mmol/L NaOH溶液移除结合到芯片表面的DNA分子,使得芯片的探针阵列恢复单链状态,实现芯片重复使用。检测原理见图1。
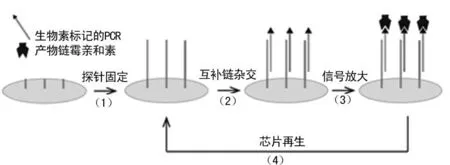
图1 DNA芯片的修饰及探针固定、碱基互补配对结合、链霉亲和素放大信号、NaOH再生芯片过程的原理
2 结 果
2.1PCR产物的凝胶电泳在本次试验中,检测的目标RNA采用RT-PCR扩增。结果如图2所示,琼脂糖凝胶电泳的结果验证了提取的9种呼吸道病毒RNA可以现实特定靶片段扩增。

注:M为DL2000;1~9分别为ADV(297 bp),SARS(68 bp),Influ A(104 bp),PIV2(116 bp),PIV1(129 bp),Influ B(145 bp),RSV(155 bp),PIV3(154 bp),H1N1(202bp)。
图2单一模板扩增电泳图
本研究运用多重PCR扩增靶RNA。多重PCR对4个病毒的靶向基因(ADV,RSV,PIV2,SARS)同时扩增,扩增结果通过琼脂糖凝胶电泳(图3)进行了验证。
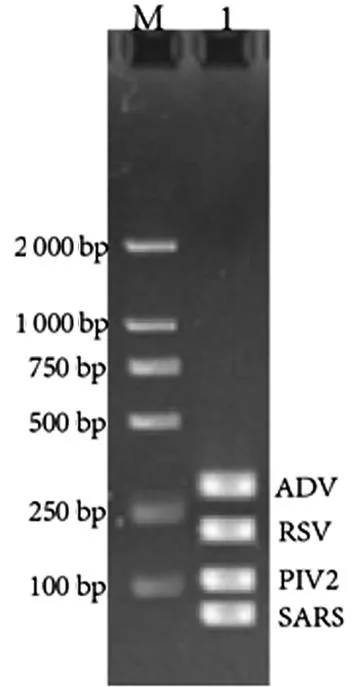
注:M道为DL2000,1道从上至下依次为ADV(297 bp),RSV(155 bp),PIV(116 bp),SARS(68 bp)。
图3多重模板扩增电泳图
2.2检测特异性芯片的检测特异性非常重要,它要求在点置探针阵列时各探针点之间无交叉污染,在检测不同靶目标时无交叉反应。为了验证芯片检测不同呼吸道病原的可行性,本研究首先单重扩增产物分别与芯片杂交,然后通过10 mmol/L NaOH溶液再生芯片,可依次通入9种呼吸道病毒PCR产物。实验结果见图4(以流感A为例)。其中PCR空白包含PCR混合物的所有试剂,除模板DNA,进行测试,以检查任何非特异性反应效应。结果表明,从注入缓冲液到获取无模板DNA的PCR产物,信号的变化接近于仪器噪声信号的变化。
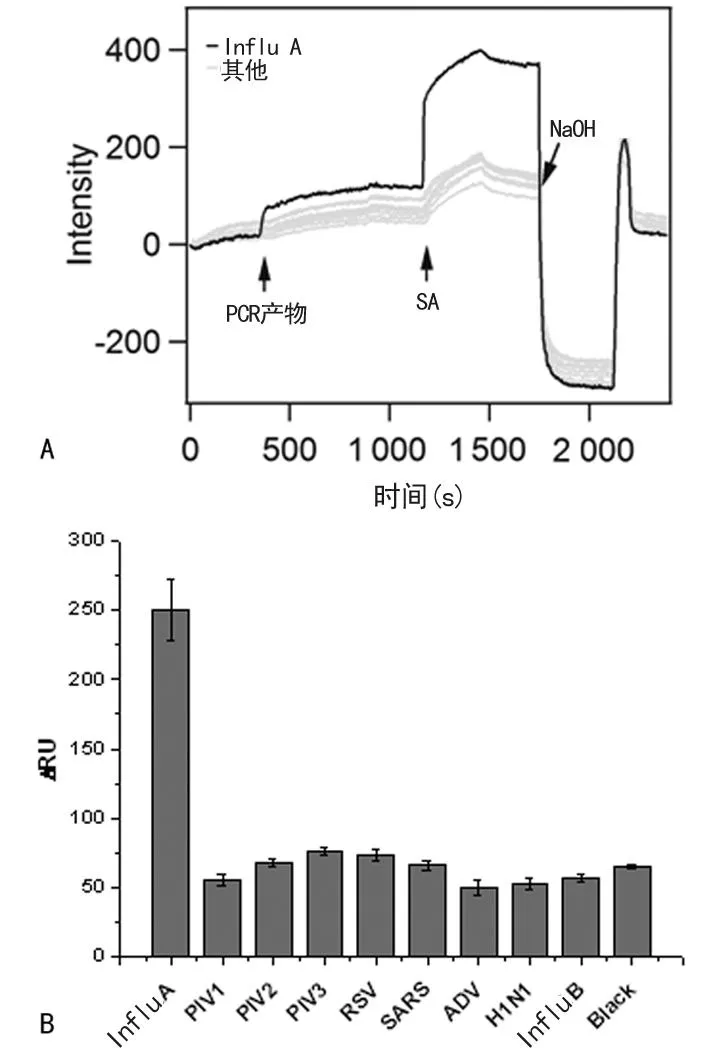
注:A为SPR检测实验结果;B为根据SPR检测信号,结合SA的前后基线差值重建的柱状图。
图4检测流感病毒PCR产物的结果图
本研究应用基因芯片结合SPR技术分析混合PCR产物。在一份PCR产物中同时针对多种呼吸道病毒检测,从而提高临床诊断的敏感性。采用四重PCR对4种呼吸道病毒(ADV、PIV2、RSV、SARS)进行目标片段扩增,然后通过SPR技术直接分析PCR产物,结果表明可以特异性检测其中4种呼吸道病毒,该检测平台可以在十余分钟内对4种呼吸道病毒的特异性检测,这为疾病的病原体快速诊断提供了思路。
2.3检测重复性本文采用A型流感病毒的PCR产物作为模型,系统验证芯片的重复性。图5显示的是在同一张芯片上用A型流感病毒的PCR产物进行4个循环的杂交检测和再生芯片的反应曲线图。芯片再生后响应曲线回到原始基线值,表明靶DNA可以被NaOH完全移除。再生后的结合曲线与典型的SPR反应曲线几乎重合。平均信号值为128 RU,信号值的相对标准偏差值仅为0.3%。表明反应存在良好的重复性。
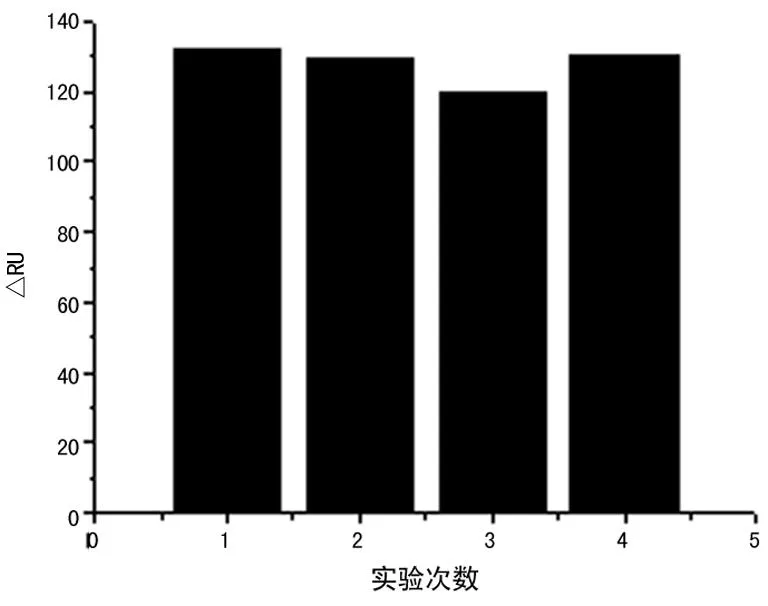
图5 用Influ A产物为模型分析SPR检测的重复性
2.4检测灵敏度采用PBS缓冲溶液稀释目标产物,通过SPR检测这一系列浓度梯度的目标物的情况。当分析物浓度从1~1 000 nmol/L浓度梯度变化,SPR检测信号值与浓度的对数值呈线性相关,见图6。从而得出9种病毒病毒PCR产物的检测灵敏度,数值如表1。
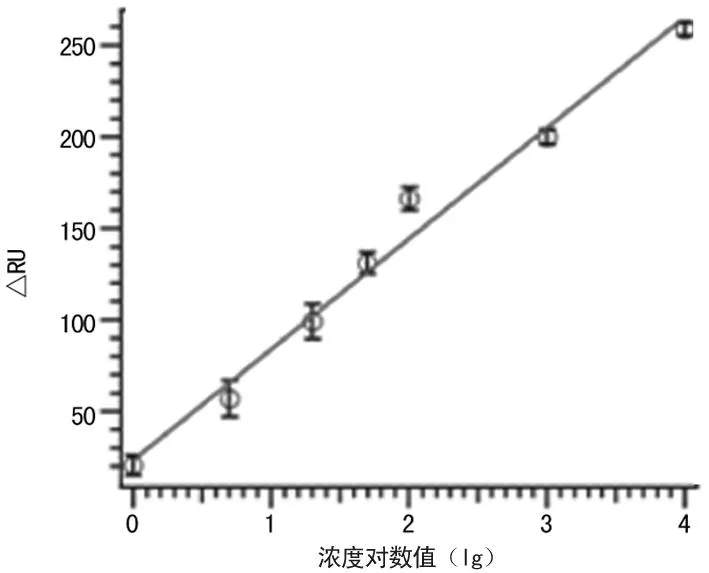
图6 SPR检测Influ A产物的系列浓度

名称InfluAInfluBPIV1PIV2PIV3RSVADVSARAH1N1浓度(nmol/L)5112.53.530.523
3 讨 论
本试验中,利用基于SPR的生物传感器,结合基因芯片技术,可以高通量地检测9种不同的呼吸道病毒PCR产物。从以上实时检测曲线可以看出,当通入其中一种呼吸道病毒的PCR产物时,靶向DNA与相应探针杂交结合,表现出检测曲线的上升。另一方面,其他呼吸道病毒的探针点曲线并无显著的信号变化,这表明研制的SPR可以实现在一张芯片上高特异性检测9种呼吸道病毒。在许多试验中,为减少芯片间的差异和节约检测成本,传感器的芯片需重复利用。芯片要实现重复利用,必须满足两个基本条件:(1)使用再生试剂能将杂交反应的靶DNA必须移除,而探针需要完整的保留;(2)再生后的探针保持原有的生物活性[13]。本文采用InfluA的PCR产物作为模型,系统验证芯片具有较好的重复性。多重PCR技术的发展为疾病的诊断节省了检测成本,缩短了检测时间,增加了临床诊断的敏感性。多重PCR具有通过使用多个引物的反应混合物来扩增多个靶系列而不影响试验效果的潜力。到目前为止,本研究验证了4种从呼吸道病毒中提取的RNA混合物已经成功进行四重PCR扩增,扩增效果通过琼脂糖凝胶电泳验证。最后采用SPR技术平台在半小时内完成了多重PCR产物的检测。该技术方法的主要特点包括:(1)针对现有呼吸道病毒检测方法存在通量低等不足之处,着眼实际运用,构建高通量的检测方法,采用实时、在线监测的SPR技术平台实现了样品的快速检测;(2)SPR技术和基因芯片强强联合,保持了基因芯片的高通量技术特点的同时,无需
引入荧光探针等报告分子,简化检测流程;(3)采用了生物素-链酶亲和素系统提高检测灵敏度。总之,SPR生物传感器结合PCR扩增展现了一个新的分子检测工具,可以高通量特异性检测呼吸道病毒,提高疾病的临床诊断敏感性,从而有效控制呼吸道病毒的感染和治疗的效果。
[1]吴茜,倪林仙,李杨芳,等.急性下呼吸道感染患儿病毒病原学分析[J].中国实用儿科杂志,2007,22(12):938-939.
[2]张雪清,胡骏,宁小晓,等.2425例小儿呼吸道感染7种常见病毒检出情况分析[J].检验医学,2013,28(7):602-605.
[3]张蓉芳.急性呼吸道感染患儿呼吸道病毒分子流行病学和临床特征的研究[D].兰州:兰州大学,2011.
[4]Caygill RL,Blair GE,Millner PA.A review on viral biosensors to detect human pathogens[J].Anal Chim Acta,2010,681(1/2):8-15.
[5]Kievits T,Van Gemen B,Van Strijp D,et al.NASBA isothermal enzymatic in vitro nucleic acid amplification optimized for the diagnosis of HIV-1 infection[J].J Virol Methods,1991,35(3):273-286.
[6]Gouvea V,Hoke CH,Innis BL.Genotyping of hepatitis E virus in clinical specimens by restriction endonuclease analysis[J].J Virol Methods,1998,70(1):71-78.
[7]廖冰洁,周迎春,李翠,等.呼吸道病原体IgM抗体联合检测在呼吸道感染诊断中的应用[J].国际检验医学杂志,2014,35(10):1339-1340.
[8]Boon AC,French AM,Fleming DM,et al.Detection of influenza a subtypes in community-based surveillance[J].J Med Virol,2001,65(1):163-170.
[9]姚亚萍,徐冉行,吕棠山.呼吸道病原体多重实时荧光定量PCR的检测[J].中华医院感染学杂志,2010,20(4):592-594.
[10]方健,王静宇,宋海燕,等.15种呼吸道病原体的实时荧光定量PCR检测方法的建立及应用[J].解放军医学杂志,2010,35(10):1254-1257.
[11]孙秋香,史蕾,顾大勇.SPR传感技术在呼吸道病毒检测中的应用[J].中国卫生检验杂志,2012,22(2):406-408.
[12]Liu X,Song D,Zhang Q,et al.An optical surface plasmon resonance biosensor for determination of tetanus toxin[J].Talanta,2004,62(4):773-779.
[13]Elnifro EM,Ashshi AM,Cooper RJ,et al.Multiplex PCR:optimization and application in diagnostic virology[J].Clin Microbiol Rev,2000,13(4):559-570.
Study on high-throughput respiratory tract virus detection method based SPR*
SUN Qiuxiang1,WANG Xiaohua2,GU Dayong3△
(1.FenggangTownCommunityHealthServiceCenter,Dongguang,Guangdong523000,China;2.InstituteofEvidenceIdentificationofYuzhongDistrictPublicSecurityBranchBureau,Chongqing400013,China;3.ShenzhenAcademyofInspectionandQuarantine,Shenzhen,Guangdong518045,China)
ObjectiveTo develop a biosensor method with strong specificity and high-throughput by combining with the surface plasmon resonance (SPR) and gene chip technique and aiming at 9 kinds of common respiratory tract viruses including influenza A and influenza B,(Influ A,B),H1N1,respiratory syncytial virus (RSV),parainfluenza virus 1-3 (PIV1-3),adenovirus (ADV) and coronavirus (SARS) leading to severe acute respiratory syndrome.MethodsFirstly the software primer 5 was used to design the specific primer and probe of related viruses in the conserved sequence;the designed nine kinds of corresponding respiratory virus probes were immobilized in the specific region of SPR chip after chemical modification.The SPR technique was applied to conduct the real time monitoring the hybridization process of the probe with the PCR products.Finally the signal amplification was realized by the biotin and streptavidin system.ResultsThe designed gene chip could detect 9 kinds of respiratory tract viruses by high-throughput with better detection specificity;the chip surface could be reutilized after certain regeneration condition,which avoided the influence of intra-batch difference on the results;the detection sensitivity reached the nanomole level.ConclusionThe preliminary study results demonstrate that using the SPR biosensor technique to establish a high--throughput detection of respiratory tract viruses has some practicability and feasibility,and is expected to become a rapid,large scale and high- throughput measure for screening respiratory tract viruses with good application prospect.
surface plasmon resonance;respiratory virus;high-throughput;label-free;gene chip
2016-01-20修回日期:2016-05-05)
国家质检总局科技计划项目(2013IK237);广东省深圳市科技研发资金(基础研究)项目(JCYJ20120618172144495)。
孙秋香,女,主管检验技师,主要从事卫生检验与检疫方面的工作。△
,E-mail:wanhood@163.com。
10.3969/j.issn.1673-4130.2016.15.007
A
1673-4130(2016)15-2068-03

