通过CAP能力验证提高妇科细胞学检测质量
岳新爱,胡正强,陈 平,唐袁婷,吴秀丽,彭 英,玉 洁
(四川大学华西第二医院临床检验科, 四川 成都 610041)
通过CAP能力验证提高妇科细胞学检测质量
岳新爱,胡正强,陈平,唐袁婷,吴秀丽,彭英,玉洁
(四川大学华西第二医院临床检验科, 四川 成都610041)
目的:通过参加美国病理学会(CAP)妇科细胞病理学能力验证计划的继续教育项目,评价临床检验室妇科细胞学检查水平,根据对回报结果的分析,来进一步提高妇科细胞学的检测质量。方法:将收到的CAP妇科细胞学传统涂片样本按照常规涂片进行检测,按CAP的要求分别在5个工作日内和10个工作日内将结果上报CAP,并及时对回报结果进行分析。结果:参加CAP能力验证计划13次65张涂片中,我室有6张涂片结果不吻合。其中3张将高度鳞状上皮细胞病变判读为低度鳞状上皮细胞病变,1张低度鳞状上皮细胞病变判读为高度鳞状上皮细胞病变,1张细胞修复性改变判读为低度鳞状上皮细胞病变,1张高度鳞状上皮内病变和(或)癌判读为不满意涂片。结论:通过参加CAP能力验证计划将我室妇科细胞病理学的检测流程标准化,将个人能力评估标准化,从整体上提高了妇科细胞学的检测质量。
美国病理学会(CAP);妇科细胞学能力验证计划;巴氏涂片
优先数字出版地址:http://www.cnki.net/kcms/detail/51.1688.R.20160701.1059.014.html
巴氏涂片是检测妇科宫颈癌及癌前病变最经典的一种检测方法。我室传统妇科细胞病理学检测以其经济、快速而被广大临床医生所接受和认可。但是巴氏涂片是一种筛查试验,具备筛查试验所固有的假阴性的特点,因此,质量控制显得尤为重要。我室于2007年参加美国病理学会(College of American Pathologists,CAP)的妇科细胞病理学的能力验证计划,现总结如下。
1 材料与方法
1.1材料OLYMPUS BX41型光学显微镜(日本OLYMPUS公司生产)。
1.2试验方法CAP每年发放2次妇科细胞学巴氏涂片标本,分别为PAP-A和PAP-B。每次5个标本,每个标本均有简单病史。由科室质量管理员统一接收标本并查验标本是否完整,所附资料是否齐全。我室在接到标本的第5个工作日内由参加妇科细胞学熟练测试程序的个人分别阅片,同时填写个人结果回报表并通过网络回报个人结果,在阅片过程中不得互相交流;在第10个工作日内阅片人员进行讨论得出试验室结果,同时填写试验室结果回报表并传真给CAP。在阅片过程中不得与其试验室交流检测结果。一般结果回报后1~2个工作日内通过网络得到参考结果和回报结果评价。
2 结 果
2.12007—2013年我室参加妇科细胞学熟练测试程序所阅巴氏涂片情况结果详见表1。
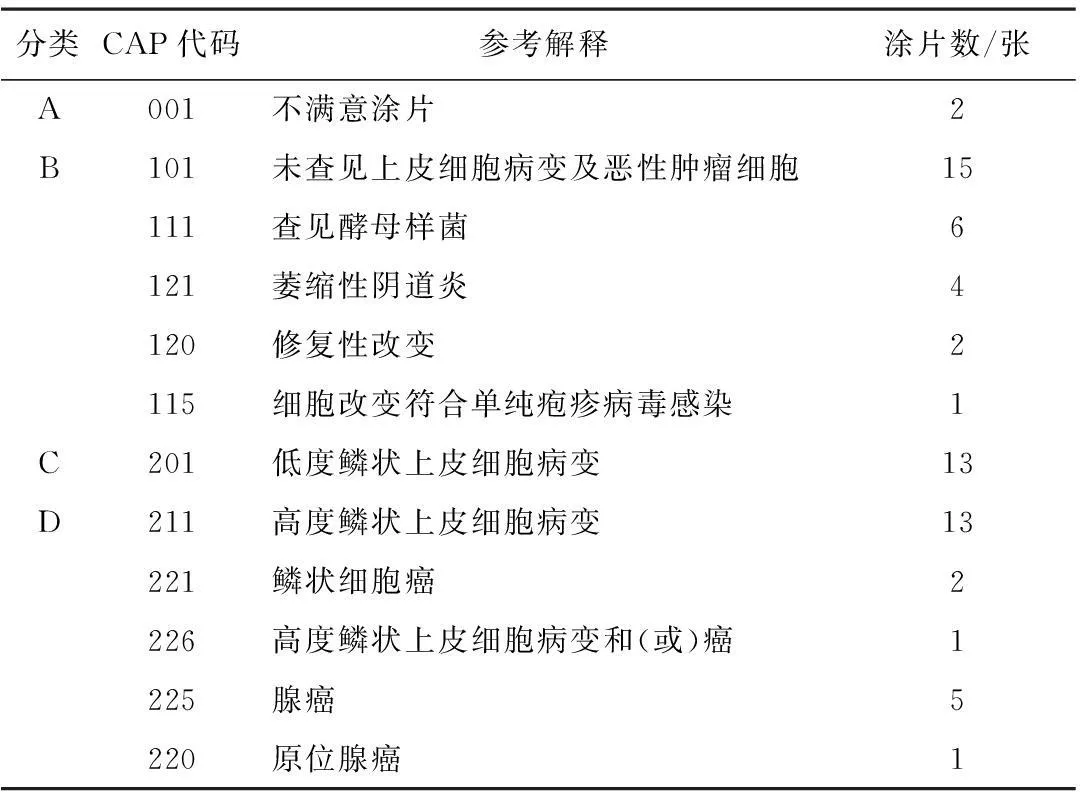
表1 2007—2013年妇科细胞学熟练测试程序巴氏涂片情况
从2007—2013年我室共参加13次妇科细胞学熟练测试程序。每次5张涂片,共计65张。这些涂片基本涵盖2001版子宫颈细胞学Bethesda 系统(The Bethesda System,TBS)判断标准中所有结果分类。按照CAP规定,所有结果总体上分为4类:A代表不满意涂片;B代表涂片内未查见上皮细胞病变及恶性肿瘤细胞,含萎缩性改变、修复性改变和查见微生物;C代表低度鳞状上皮细胞病变;D代表高度鳞状上皮细胞病变,含高度及以上鳞状细胞病变、原位腺癌、腺癌等。每种不同的解释分配唯一代码(表1)。其中,未见上皮细胞病变或恶性肿瘤细胞共15例,占23.1%,其次是低度鳞状上皮细胞病变和高度鳞状上皮细胞病变,均占20.0%。2.22007—2013年参加妇科细胞学熟练测试程序试验室或个人的阅片结果与参考结果吻合率结果详见表2。
按照CAP对参考解释的总分类,若个人或试验室结果与参考结果同属于一个类别,则属于基本吻合,反之,不在同一个类别,则视为结果不吻合。其中,B类别中查见酵母样菌吻合率达100.00%,未见上皮细胞病变或恶性肿瘤细胞基本吻合率达100.00%,吻合率最高。而高度鳞状上皮细胞病变和低度鳞状上皮细胞病变个人结果吻合率分别为75.94%和85.78%,试验室结果吻合率分别为75.16%和87.67%。高度鳞状上皮细胞病变涂片中个人和试验室阅片结果为低度鳞状上皮细胞病变率分别为21.05%和19.87%,修复性改变的细胞涂片中个人和试验室阅片结果为高度鳞状上皮细胞病变分别占12.20%和6.25%。可见,高度鳞状上皮细胞病变在阅片时需与低度鳞状上皮细胞病变相鉴别,修复性改变在阅片时需与高度鳞状上皮细胞病变进行鉴别诊断。
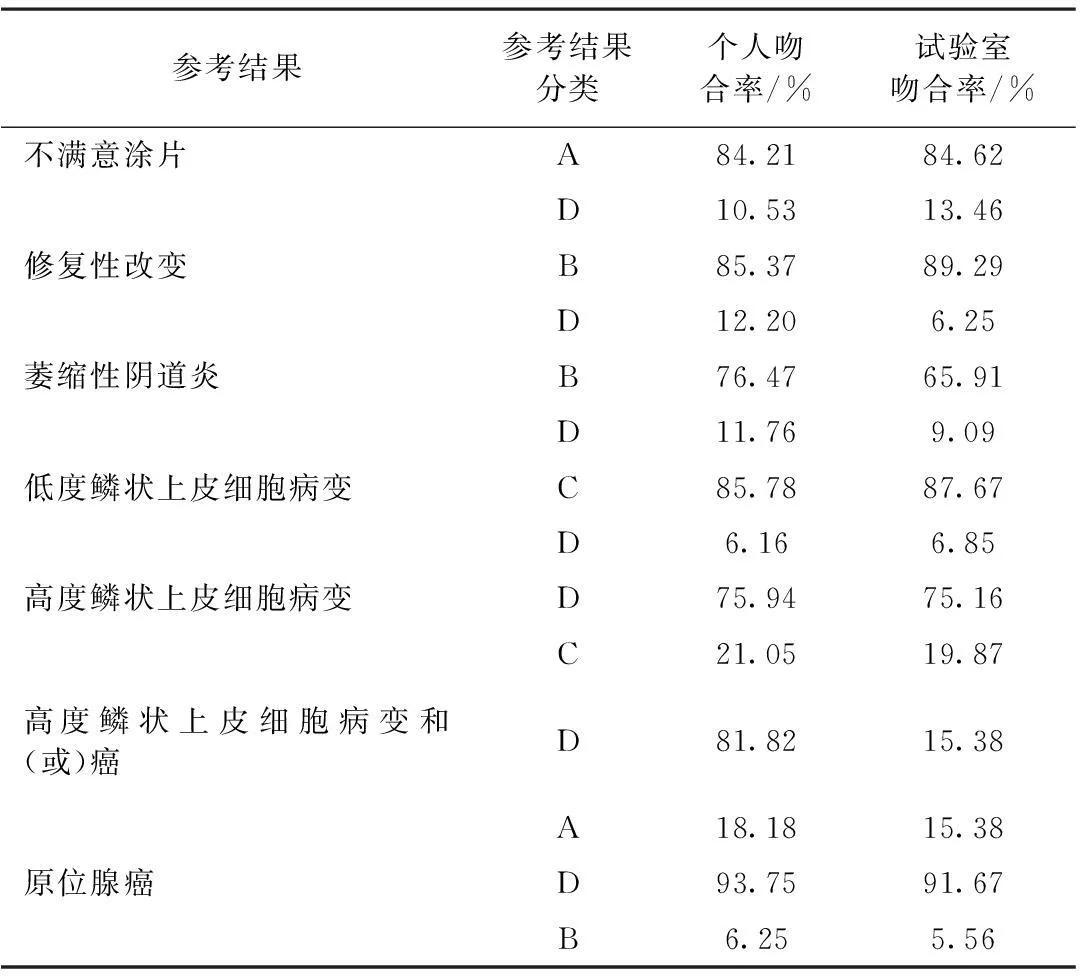
表2 2007—2013年妇科细胞学熟练测试程序参考结果与参加的个人和试验室结果吻合率
2.32007—2013年我室参加妇科细胞学熟练测试程序情况结果详见表3。
3 讨 论
宫颈脱落细胞学巴氏涂片是一项筛查试验,其结果具备一定的假阴性[1],同时,传统巴氏涂片侧重于手工操作,由于显微镜检的特点,对细胞学筛查人员,如细胞学技师和病理学医师的培训是一项艰苦的工作[2]。为了提高我室细胞学筛查人员的阅片水平,更好地为临床服务,我室于2007年开始参加CAP能力验证计划中的继续教育部分。
从2007—2013年我室所阅细胞学涂片可见,涂片范围广泛,基本涵盖2001版TBS所有分类。其中:未见上皮细胞病变或恶性肿瘤细胞涂片最多,其次是低度鳞状上皮细胞病变和高度鳞状上皮细胞病变。由结果可见,后两类病变需要加强鉴别。此外,不满意涂片、修复性改变和萎缩性阴道炎的涂片中均有一定数量被判为高度鳞状上皮细胞病变,因此,对于高度鳞状上皮细胞病变的判别是工作的重点。
我室所阅高度鳞状上皮细胞病变的涂片总数为13张,以表3中试验室吻合率为准,其中结果完全吻合为9张,基本吻合为1张,不吻合为3张。此3张涂片患者均为行常规检查。基本吻合的判断结果为高度鳞状上皮细胞病变和(或)癌,不吻合的判断结果均为低度鳞状上皮细胞病变。从低度鳞状上皮细胞病变到高度鳞状上皮细胞病变是一个连续的过程,对于不典型病例,在形态学上很难鉴别。根据对涂片的复检,此3张涂片在细胞形态学上不典型,涂片中有较多低度鳞状上皮病变的细胞,若细胞学阅片人员不够仔细,或者在认为细胞形态变化不典型的情况下则会被轻判为低度鳞状上皮细胞病变。因此,在以后的工作中,应当加强对高度鳞状上皮细胞病变的识别。同样,参考结果为低度鳞状上皮细胞病变的涂片共13张,其中完全吻合的共12例,有1例不吻合,该例因被判断为高度鳞状上皮细胞病变而不吻合,此例为老年患者,因绝经后出血而进行常规细胞学涂片检查。老年患者涂片一般以中、底层细胞为主,此类细胞发生病变时较难区分病变级别。
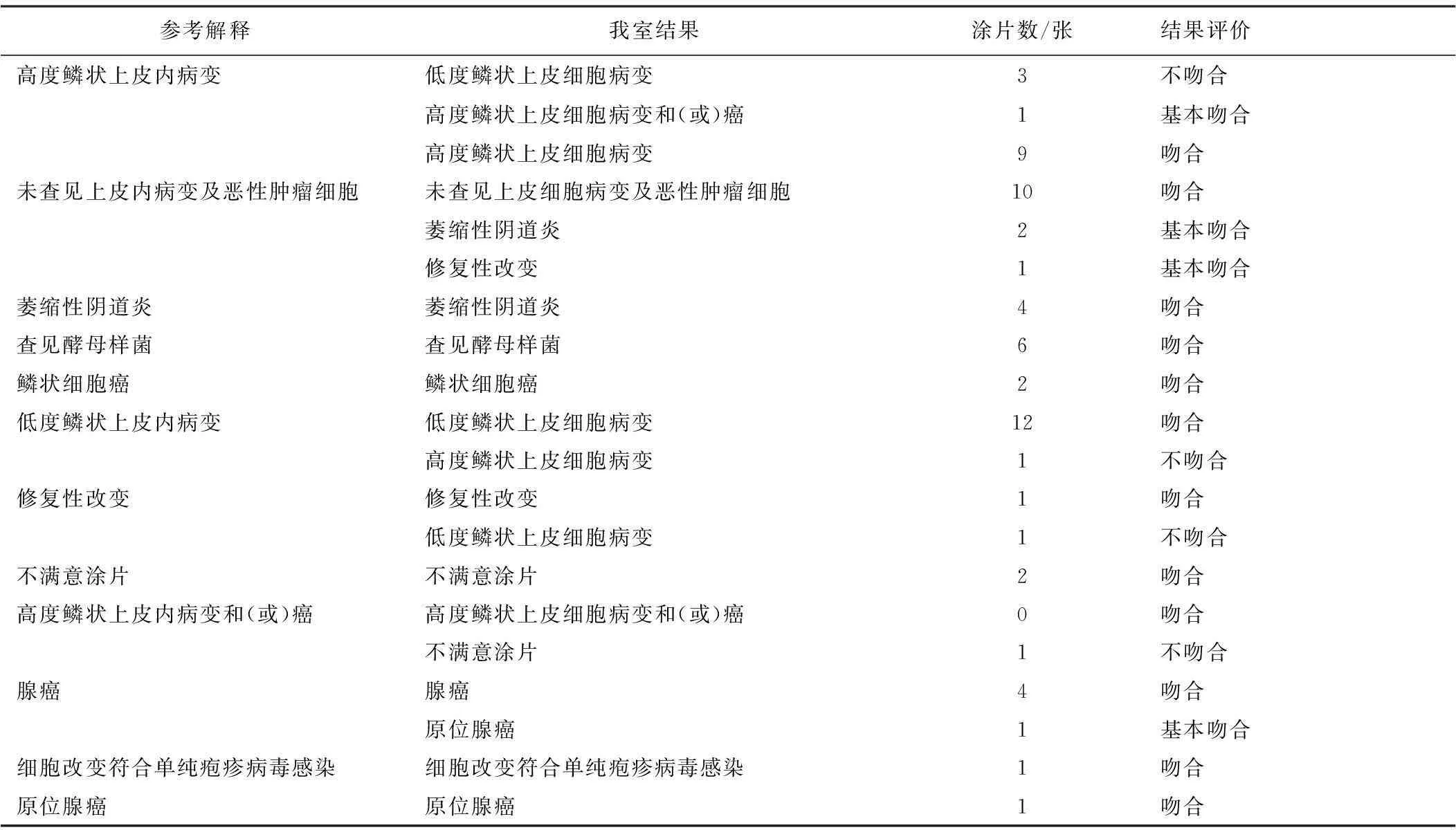
表3 2007—2013年我室参加妇科细胞学熟练测试程序情况
修复性细胞改变是细胞学涂片中较为常见的一种情况,属于未见上皮细胞病变或恶性肿瘤细胞的一种,最常见于重度宫颈炎的患者,也可见于近期行宫颈活检、放疗或子宫全切术后的患者。自2007—2013年,仅有2张修复性改变的涂片,参与阅片的个人数和试验室数均为41个,吻合率分别为85.37%和89.29%,其中判断为高度鳞状上皮细胞病变的个人和试验室分别占12.20%和6.25%。而我室有1张该片判断为低度鳞状上皮细胞病变,此患者有异常的细胞学结果史。完善的临床信息对于细胞学阅片人员必不可少,尤其是患者既往的相关检查史及用药史非常重要,但也不能过度依赖病史,一定以显微镜检为准绳,辅以临床信息而做出最终判断。细胞学筛查试验具备一定的假阴性,可能与细胞学筛查人员在阅片时极易受以往异常细胞学结果的影响而做出倾向于异常的判断有关。针对这种情况,应当完善细胞学室内质控程序,加强对细胞学筛查人员的能力培训。
不满意涂片的判读也是细胞学筛查的重点之一,有文献表明[3],在后来的随访中16%不满意涂片的患者最终诊断为上皮内病变。不满意涂片多为细胞量达不到一定的标准,或者背景物质,如炎细胞、红细胞等覆盖细胞超过75%时,这些背景物质与宫颈病变可能相关[3-4]。2007—2013年,参与妇科细胞学熟练测试程序中个人和试验室对不满意涂片阅片吻合率分别为84.21%和84.62%。将不满意涂片判断为高度鳞状上皮细胞病变及以上的个人和试验室分别占10.53%和13.46%。另对1张高度鳞状上皮细胞病变和(或)癌的涂片的阅片结果显示,个人和试验室结果吻合率分别为81.82%和15.38%,而将该片判断为不满意涂片的个人和试验室分别占18.18%和15.38%,我室对该片的判读结果是不吻合。可见,加强对不满意涂片的筛查和随访也是细胞学检测中一个很重要的环节。
我室通过分析总结每次能力验证计划的结果,针对不吻合的情况加强培训并进行考核,同时将能力验证计划个人结果评价体现在日常个人能力评价中(如
个人工作量评估),切实提高了我室细胞学筛查人员能力,并形成了一套行之有效的细胞学质量控制体系。
[1]ROBB J. The Pap smear is a cancer screening test: why not put the screening error rate in the report?[J]. Diagn Cytopathol, 1993, 9(5): 485-486.
[2]SANKARANARAYANAN R, BUDUKH A M, RAJKUMAR R. Effective screening programmes for cervical cancer in low- and middle-income developing countries[J]. Bull World Health Organ, 2001, 79(10): 954-962.
[3]RANSDELL J S, DAVEY D D, ZALESKI S. Clinicopathologic correlation of the unsatisfactory Papanicolaou smear[J]. Cancer, 1997, 81(3): 139-143.
[4]RENSHAW A A, FRIEDMAN M M, RAHEMTULLA A, et al. Accuracy and reproducibility of estimating the adequacy of the squamous component of cervicovaginal smears[J]. Am J Clin Pathol, 1999, 111(1): 38-42.
Improving Quality of Gynecologic Cytopathology Testing by Participating CAP Proficiency Testing
YUE Xin’ai, HU Zhengqiang, CHEN Ping, TANG Yuanting, WU Xiuli, PENG Ying, YU Jie
(Department of Laboratory Medicine,West China Second University Hospital,Sichuan University,Chengdu, Sichuan 610041,China)
Objective:To evaluate diagnostic ability of gynecologic cytopathology in our laboratory by participating in continuous education project of the College of American Pathologists (CAP) gynecologic cytology proficiency testing program; to improve the detective quality of gynecologic cytopathology according to CAP requirement. Methods: The traditional smear samples of gynecologic cytopathology
from CAP process were examined by routine smear method. The results were respectively reported to CAP within 5 working days and 10 working days according to CAP requirement. The feedback results from CAP were analyzed timely. Results: A total of 65 smears in the 13 CAP proficiency tests were screened. The results of 6 smears did not match with the diagnosis of CAP; HSIL in 3 smears was considered as LSIL; LSIL in a smear was considered as HSIL; cytothesis change in a smear was considered as LSIL; HSIL/cancer in a smear was considered as unsatisfactory smear. Conclusion: Participating in CAP gynecologic cytology proficiency testing program enables a laboratory to standardize detection procedure and improve the evaluation of individual performance. Therefore, it will improve the quality of gynecologic cytology detection.
College of American Pathologists; gynecologic cytology proficiency testing program; Pap smear
2015-10-14)
胡正强,hufly747@163.com
R711;R36
A
10.11851/j.issn.1673-1557.2016.04.006

