当归多糖对环磷酰胺致骨髓抑制小鼠外周血细胞、免疫功能的影响
丁学兰,赵信科,邱勇玉,陈开兵,李应东
(1.甘南州卫生学校,甘肃 合作 747000;2.甘肃中医药大学附属医院,甘肃 兰州 730020;3.甘肃中医药防治慢性疾病重点实验室,甘肃 兰州 730000)
当归多糖对环磷酰胺致骨髓抑制小鼠外周血细胞、免疫功能的影响
丁学兰1,赵信科2,3,邱勇玉2,陈开兵2,李应东2,3
(1.甘南州卫生学校,甘肃 合作 747000;2.甘肃中医药大学附属医院,甘肃 兰州 730020;3.甘肃中医药防治慢性疾病重点实验室,甘肃 兰州 730000)
目的 探讨当归多糖对环磷酰胺致骨髓抑制小鼠外周血细胞、免疫功能的影响,为临床进一步开发应用当归多糖提供理论依据。方法 采用环磷酰胺腹腔给药建立小鼠骨髓抑制模型。将SPF级Wistar雄性小鼠72只按随机对照原则分为6组,即正常组、模型组、当归多糖高剂量组、当归多糖中剂量组、当归多糖低剂量组及对照组。造模成功后各组分别给予蒸馏水、高剂量当归多糖(400 μg/g)、中剂量当归多糖(200 μg/g)、低剂量当归多糖(100 μg/g)及利血生(20 μg/g)干预。应用常规法测外周血细胞计数、流式细胞术检测T细胞亚群、酶联免疫吸附法检测IgM、放射免疫法检测IgG。结果 与B组比较,C组、D组及F组可升高WBC(P〈0.05),C组可升高RBC(P〈0.05),D组、E组可升高PLT(P〈0.05)。与B组比较,C组、D组、E组和F组的IgG、IgM含量出现不同程度的增高(P〈0.01或P〈0.05);C组IgG水平相比F组高(P〈0.05),比A组低(P〈0.01);A组与B组IgG、IgM含量比较,有显著性差异(P〈0.05)。当归多糖高剂量组(C组)T细胞亚群接近正常水平,与B组比较,C组、D组、E组和F组除CD8+显著降低外(P〈0.05),其他亚群水平均升高(P〈0.05)。结论 当归多糖可以改善小鼠不同程度的骨髓抑制,且能增强化疗后小鼠的免疫功能,还可升高骨髓抑制小鼠血清中的IgG、IgM含量,以调节体液免疫,进而调控骨髓造血。
当归多糖;环磷酰胺;骨髓抑制;外周血细胞;免疫功能
恶性肿瘤是一种临床上常见的疾病,在绝大多数国家,癌症的发病率均呈明显上升趋势,已成为严重危害全球人类健康的常见致命性疾病之一[1]。此类患者将不可避免地接触放化疗药物,然而无论放疗或化疗,均存在多种不良反应。骨髓细胞增生及代谢旺盛,对放化疗药物相对敏感,临床最为常见的副作用为骨髓抑制,实验室检查一般体现在白细胞(WBC)和血小板(PLT)不同程度减少,严重患者会出现三系减少的情况。由于危害程度重,化疗无法继续,会严重威胁患者的生存预后。化疗后的耐受程度因人而异,骨髓、免疫抑制程度各异,器官出血、感染等症状给临床工作者带来了很大挑战,因此,加快肿瘤细胞凋亡,减轻对正常骨髓、免疫细胞抑制是改善临床结局的关键措施之一[2]。近年来,西医治疗化疗术后骨髓抑制的药物种类越来越多,但大多数到目前为止无确切的治疗效果,部分药物价格不菲或有多种不良反应[3-4],因此临床不常规使用。越来越多的学者开始研究中医药在肿瘤防治工作中的作用,其中研究相对较多的为当归。作为补血活血药物,当归主要有效成分为当归多糖,部分研究者认为当归具有预防肿瘤、提高免疫力等功效[5-6]。然而,对于当归能否改善化疗后骨髓抑制及免疫抑制程度,目前无大样本基础随机对照实验。因此,本研究采用环磷酰胺腹腔给药模拟小鼠骨髓抑制模型,探讨当归多糖对环磷酰胺致骨髓抑制小鼠外周血细胞、免疫功能的影响,旨在为当归多糖预防和减轻化疗后骨髓抑制及增强免疫功能提供新思路,现介绍如下。
1 材料与方法
1.1实验动物的属性及实验室相关信息(见图1)
图1 实验动物的属性及实验室相关信息
1.2药品与试剂(见图2)
图2 药品与试剂
1.3主要仪器(见图3)

图3 主要仪器
1.4动物分组流程(见图4)
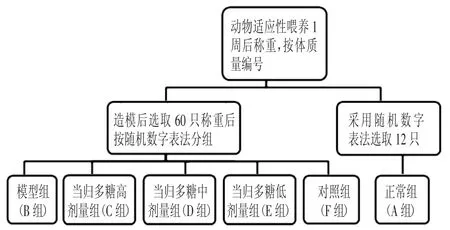
图4 动物分组流程
1.5模型的建立与给药
参照刘海伟等研究者造模研究方法及预实验经验,除正常组外,其余各组腹腔注射150 mg/kg的环磷酰胺(CTX),CTX均采用生理盐水配制,浓度为2 mg/ml,小鼠腹腔注射1.5 ml/20 g,每日1次,持续3天。造模成功后模型组、正常组按用药组的方法,每日灌服蒸馏水;当归多糖高、中、低剂量组分别给予400 μg/g、200 μg/g、100 μg/g的当归多糖;对照组给予20 μg/g的利血生,各组小鼠均连续灌胃14天[7-8]。
1.6检测指标
末次灌胃后24小时,采用尾部静脉采血方式检测WBC、RBC和PLT水平;股动脉取血,按试剂盒说明步骤进行,采用流式细胞术检测T细胞亚群、酶联免疫吸附法检测IgM、放射免疫法检测IgG。
1.7统计学方法
应用统计软件SPSS 17.0进行统计学处理,计量资料经正态性检验后,若为正态分布,采用(x±s)表示;若为非正态分布,则以M(Q1、Q3)表示,指标的参考范围以M(P5、P95)表示。组间两两比较使用Dunnutt检验,P〈0.05为差异有统计学意义。
2 结果
2.1造模后小鼠的一般情况
造模组(除A组外)与正常组(A组)在治疗前对比,表现:外型消瘦,鼻唇苍白,毛发卷缩、稀少无光泽;活动度:蜷缩弓背,懒动,活动量减少;精神状态:精神萎靡,摄食减少。治疗开始后,C、D、E、F各组动物状态逐渐改善,具体表现:体重增加、唇周红润、毛发光泽且增多;活动度:增多;精神状态:精神兴奋,摄食增多。实验期间各组动物均无死亡。
2.2造模后小鼠外周血细胞数
经环磷酰胺腹腔注射后,与A组比较,其他各组WBC、RBC、PLT都有所下降(P〈0.01或P〈0.05),且WBC下降明显。除A组外,其他各组的外周血细胞数采用Dunnutt法两两比较,差异无统计学意义(P>0.05),提示造模成功,见表1。

表1 造模后各组间外周血细胞数比较(x±s)
2.3当归多糖对骨髓抑制小鼠WBC、RBC、PLT的影响
治疗后,C组、D组、F组WBC水平均较B组高(P〈0.05);E 组WBC有上升趋势,但与B组相比,差异无统计学意义(P>0.05)。C组RBC水平较B组、F组高(P〈0.05)。与A组比较,B 组WBC、RBC、PLT显著下降(P〈0.05);D组、E组相比B组,PLT均显著升高(P〈0.05),详见表2。
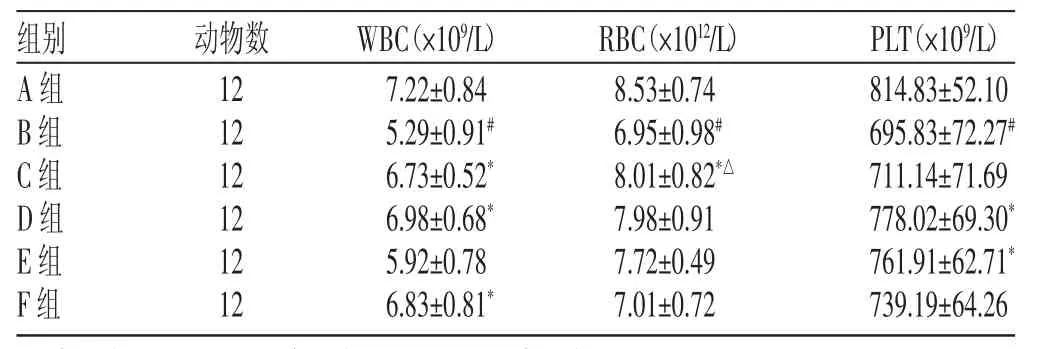
表2 各组治疗后外周血细胞数比较(x±s)
2.4当归多糖对骨髓抑制小鼠体液免疫的影响
A组与B组IgG、IgM比较,有显著性差异(P〈0.05),符合造模标准。与B组比较:C组、D组、E组以及F组均可升高IgG、IgM含量(P〈0.05或P〈0.01),C组IgG相对于A组是下降的(P〈0.01),相对于F组是升高的(P〈0.05),见表3。

表3 各组治疗后IgG、IgM对比结果(x±s,μg/ml)
2.5当归多糖对骨髓抑制小鼠细胞免疫的影响
当归多糖高剂量组(C组)T细胞亚群水平接近正常指标。与B组相比,C组、D组、E组和F组除CD8+显著降低外(P〈0.05),其他亚群水平均升高(P〈0.05)。见表4。
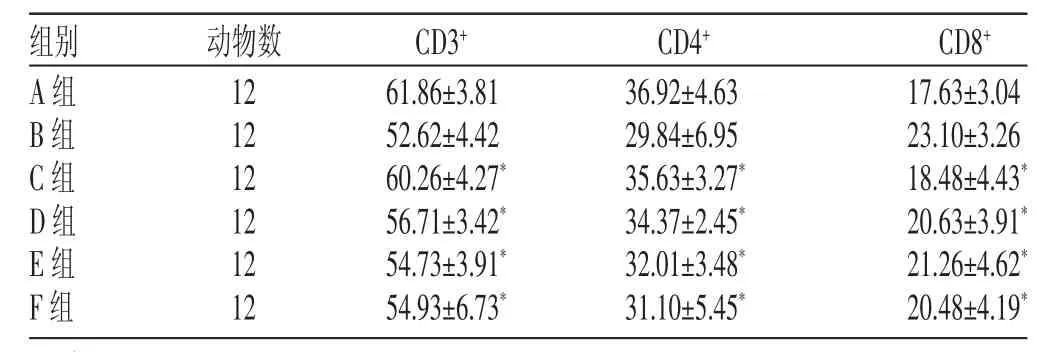
表4 各组治疗后T细胞亚群对比结果(x±s,%)
3 讨论
环磷酰胺是临床上常用的化疗药物,存在各种副反应,其中临床较为常见的为骨髓及免疫抑制。由于化疗后的耐受程度因人而异,因此骨髓、免疫抑制程度各异,器官出血、感染等症状给临床工作者带来了很大挑战。实验室检查一般体现为白细胞(WBC)和血小板(PLT)不同程度减少,严重患者出现三系减少的情况,由于危害程度重,化疗无法继续,从而严重威胁患者的生存预后。因此,加快肿瘤细胞凋亡,减轻对正常骨髓、免疫细胞抑制是改善临床结局的关键环节。目前已批准用于治疗化疗后骨髓抑制的药物种类繁多,大多数药物价格不菲且无确切疗效,因此临床上急需提供有显著抗骨髓抑制的药物,以改善肿瘤患者的治疗结局。
近年来,中医学通常将骨髓抑制、免疫抑制、白细胞减少等归入“虚劳”范畴[8]。虚劳即中医所关注的以各种脏器功能减退为主要表现的多种慢性虚弱症候,包括气虚、血虚、阴虚等,具体症状有面色苍白、腰膝酸软、头晕眼花等。研究认为,虚劳应遵循扶正固本、益气养血的治疗原则。当归自金代开始便应用于中医的益气补血,其主要有效成分为当归多糖。近年来研究逐步发现,当归不仅能够促进骨髓细胞增殖,改善人体外周血液微环境,同时能促进造血干细胞增殖,抑制其凋亡,然而具体基础调控机制目前仍众说纷纭。
本研究根据小鼠的表现、全血细胞减少、体液免疫及细胞免疫受到抑制,说明造模成功。当归多糖可升高WBC、RBC及PLT,可能是当归多糖中的某些成分刺激粒系、红系或造血干/祖细胞的增殖、分化或促进造血细胞生长因子(如EPO)分泌作用增强所致,结果与先前文献报道是一致的。丁妍、张岩岩、张明等[9-11]的相关研究指出,当归多糖能显著升高贫血小鼠的红系、白系及股骨有核细胞,对因化学药物、放射线照射引起的骨髓抑制,促进造血的功能更为显著。中药可作用于免疫器官、细胞因子、T淋巴细胞等,同时促进抗体的产生,改善免疫系统功能,调节免疫机制[12-13]。观察当归多糖对骨髓抑制小鼠的影响发现,当归多糖各组可明显升高IgG、IgM的含量(P〈0.05);A组与B组IgG、IgM比较,有显著性差异(P〈0.05),说明小鼠被化疗药物损伤后,即使不再使用化疗药物,机体IgG、IgM仍恢复较慢,其机制可能是通过对神经—内分泌—免疫调节网络的作用而对小鼠骨髓抑制起到治疗作用。本研究着重从机体外周血象,免疫球蛋白IgG、IgM水平,T细胞亚群水平进行测定,结果显示,当归多糖各组与模型组比较,除CD8+降低外(P〈0.05),其他亚群水平均升高(P〈0.05),当归多糖高剂量组更显著,提示高剂量的当归多糖对T细胞亚群的作用效果更显著,可能与刺激某些细胞因子引起淋巴系祖细胞、T细胞的增殖、分化有关。外周血的稳定是保证肿瘤患者顺利放化疗的根本,而体液免疫、细胞免疫的增强又可使机体对抗化疗药物的毒副作用,还可以协同细胞因子作用于各系造血祖细胞或造血干细胞及淋巴细胞,促进造血系统恢复及免疫系统增强[14]。当归多糖使机体的体液免疫、细胞免疫及细胞因子之间相互作用,从而保护机体免受化疗药物或放射线的伤害。因此,使用当归可以降低烷化剂CTX化疗所致的骨髓、免疫抑制等毒副作用,恢复外周血细胞水平,调节免疫功能,从而改善临床结局、提高肿瘤患者的生存质量。
[1]陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1-10.
[2]德森.临床肿瘤学[M].北京:科学出版社,2010.
[3]胡星明,肖高明,陈跃军,等.围术期应用参麦注射液对肺癌根治术后患者血浆细胞因子的影响[J].中南药学,2011,32(8):571-573.
[4]Shao M,Sun L,Cui XY,et al.Effect of proteasome inhibitor bortezomib on proliferation,apoptosis and XIAP expression in K562 cells[J].Chinese Journal of Hematology,2011,32(3):182-186.
[5]李成鹏,刘俊,贾道勇,等.当归多糖诱导人白血病干细胞衰老与调控端粒系统机制的研究[J].中草药,2014,45(16):2364-2369.
[6]Martínez Paula,Blasco María A.Telomeric and extra-telomeric roles for telomerase and the telomere-binding proteins[J].Nature reviews Cancer,2011,11(3):161-176.
[7]袁拯忠,叶人,陈增强,等.两种血虚证小鼠模型的比较[J].中华中医药学刊,2009,27(6):1265-1266.
[8]刘海伟,路玫,曹大明,等.针灸对环磷酰胺化疗小鼠血清中IL-7和IL-18含量的影响[J].上海针灸杂志,2016,35(2):223-226.
[9]丁妍,崔莉,花曼曼,等.当归多糖与黄芪多糖配伍对辐射损伤模型小鼠的保护作用[J].东南国防医药,2014,16(6):572-574.
[10]张岩岩,李静,贾道勇,等.当归多糖对衰老模型大鼠骨髓造血功能的影响及其机制[J].解剖学报,2014,45(6):785-792.
[11]张明,邓毅.甘肃当归对失血性血虚小鼠外周血常规及肝、脾、胸腺指数的影响[J].中医研究,2014,27(6):69-71.
[12]陈鑫,冯京京.单味中药对免疫系统的调节作用研究[J].中医研究,2015,28(4):78-80.
[13]张大鹏,赵雅.中药多糖免疫调节作用研究进展[J].临床医学工程,2012,9(8):1423-1424.
[14]马振,李宜真,刘淑军.中医药联合化疗对多发性骨髓瘤肾病患者生存质量的影响[J].中医研究,2013,26(5):11-14.■
G424.31
B
1671-1246(2016)16-0153-03
国家自然科学基金资助项目(81160478);甘肃省2009年科技重大专项(092NKDA017)

