柠檬酸修饰真菌Fusariumsp.#ZZF51生物吸附Th(Ⅳ)
杨司坤,谭 倪,向开祥,陆建生,林永成
1.湖南医药学院 化学系,湖南 怀化 418000;2.南华大学 化学化工学院,湖南 衡阳 421001;3.怀化市环境保护监测站,湖南 怀化 418000;4.中山大学 化学化工学院,广东 广州 510275
柠檬酸修饰真菌Fusariumsp.#ZZF51生物吸附Th(Ⅳ)
杨司坤1,2,谭倪2,向开祥1,陆建生3,林永成4
1.湖南医药学院 化学系,湖南 怀化418000;2.南华大学 化学化工学院,湖南 衡阳421001;3.怀化市环境保护监测站,湖南 怀化418000;4.中山大学 化学化工学院,广东 广州510275
摘要:采用生物吸附法去除废水中Th (Ⅳ),研究了南海红树林内源真菌Fusarium sp.#ZZF51化学改性后吸附Th (Ⅳ)的行为特性、吸附模型及吸附机理。通过柠檬酸对真菌Fusarium sp.#ZZF51进行修饰,将吸附剂表面的羟基与柠檬酸发生酯化,能更有效地吸附钍离子。结果表明:常温常压下,pH=4.5,ρ0(Th(Ⅳ))=50 mg/L,吸附剂0.03 g,反应90 min,最大吸附率为90.87%,吸附量为75.47 mg/g,吸附量比未经处理的真菌(最优吸附条件下,吸附量为11.35 mg/g)吸附要大。通过Langmuir、Freundlich、Temkin三种等温吸附模型对数据进行拟合,Langmuir模型能更好地描述受试菌对Th (Ⅳ)的平衡吸附行为,同时吸附过程能很好的用准二级反应动力学来解释。此外,比较吸附前后红外光谱图,发现细胞壁上羰基、羟基、氨基是主要的作用基团。
关键词:Th(Ⅳ);Fusarium sp.#ZZF51;生物吸附;柠檬酸
电镀、铸件清理、采矿、航空航天、电池及化工产业产生了很多工业废水,通常此类废水中都含有高浓度的金属离子。Th是一种有毒的放射性重金属元素,是一种潜在的核燃料,很容易进入表层水体,通过食物链的富集,会严重威胁人和动物的健康。一旦Th进入机体,常富集于肺、肝、肾及骨髓中,因此对Th的富集处理显得日益重要。处理废水中Th(Ⅳ)的常用方法包括稀释法、化学沉淀法、离子交换法、电渗析和反渗透法等。但是传统方法处理费用高、吸附效果差,并且存在二次污染,使其应用受到一定的限制[1]。因此,探索一种吸附效果好、方法简单可靠、成本低廉的材料具有重大意义。
生物吸附法是一种通过生物细胞壁或生物代谢产物来吸附金属离子的方法,现已被证明对重金属离子和放射性元素的吸附非常有用[2-3]。尽管近年来很多真菌类微生物被普遍用来做吸附剂,不过吸附率和吸附量都不甚理想。与陆地环境不同,高盐、低温、高压、贫营养、少光照的海洋环境,使得海洋微生物有其自身独特的新陈代谢方式,由此并产生了许多结构新颖、接枝有大量羟基、羰基、氨基及含硫、磷基团的代谢产物。有研究表明,用甲醛、戊二醛和柠檬酸等对吸附剂表面进行化学修饰,能大大提高吸附率和吸附量[4]。已有研究[5]表明,真菌Fusariumsp.#ZZF51能较好的吸附金属铀、钍及铜离子,其吸附过程不是简单的被动吸收,而是“泵”式主动吸收。本工作采自南海湛江海域的红树林内源真菌Fusariumsp.#ZZF51做生物吸附剂,通过柠檬酸对其进行化学修饰酯化接枝,提高生物吸附量,从Th (Ⅳ)初始浓度、溶液pH值、吸附剂用量和反应时间来讨论受试菌对Th(Ⅳ)吸附的影响,同时对吸附过程的动力学模型和等温吸附模型进行探讨。
1 实验部分
1.1试剂与仪器
四水硝酸钍,上海晶纯试剂有限公司;偶氮胂Ⅲ,天津市光复精细化工研究所;HCl,分析纯(AR),湖南省邵阳市化学试剂厂;NaOH,AR,天津市大茂化学试剂厂;蛋白胨,生物试剂(BR),北京奥博星生物技术有限责任公司;葡萄糖,化学纯(CR),天津市福晨化学试剂厂;酵母膏,BR,上海展云化工有限公司;粗海盐,工业纯,湖南省轻工盐业集团有限责任公司;柠檬酸,AR,长沙明瑞化工有限公司;KBr粉末,AR,市售。
菌种:受试菌Fusariumsp.#ZZF51,由中山大学林永成教授研究组提供。
721型分光光度计,天津普瑞斯仪器有限公司;Spectrum GX傅里叶-红外光谱仪,美国Perkin Elmer设备有限公司;振荡器,长沙索拓科学仪器设备有限公司;PHS-3C pH计,上海鹏顺科学仪器有限公司;JSM-7610F场发射扫描电镜,日本电子株式会社;离心机,江苏金坛市中大仪器厂。
1.2菌种培养与修饰
以马铃薯葡萄糖琼脂(PDA)为培养基,4 ℃保存。培养液配制:葡萄糖10 g/L,蛋白胨2 g/L,酵母浸膏1 g/L,粗海盐2 g/L,pH=7.0。在500 mL锥形瓶内加入培养液300 mL,经120 ℃(0.1 MPa)高温灭菌60 min后冷却、接菌,常温静置培养22 d。通过过滤,收集菌体,菌体经烘干、研磨,100目过筛并置于干燥器中保存备用。取干菌粉20 g于400 mL 0.1 mol/L的NaOH溶液中,常温下300 r/min搅拌1 h,之后用蒸馏水清洗残留的碱,在50 ℃下恒温24 h。然后取NaOH处理过的吸附剂3 g加入100 mL 0.6 mol/L的柠檬酸中,常温下300 r/min反应30 min,之后在50 ℃下恒温24 h,再升温至120 ℃搅拌90 min,用蒸馏水清洗残留的酸。50 ℃干燥24 h,室温冷却备用,得到处理后的CA-Fusariumsp.#ZZF51[3]。其反应机理示于图1。
1.3吸附过程
设置吸附剂CA-Fusariumsp.#ZZF51用量(0.005~0.04 g)、溶液pH(2~6)、钍初始质量浓度(20~60 mg/L)、反应时间(5~120 min)四个变量,常温常压下试样在150 r/min振荡机中反应后取出3 mL溶液,4 000 r/min离心10 min,取出0.4 mL上清液于10 mL容量瓶中,加入0.5 mLw=0.05%的偶氮胂Ⅲ,再用7 mol/L HCl定容。摇匀、静置10 min,于660 nm处[6],以试剂空白样做参比,平行三组,取平均值,测定吸光度。
1.4计算方法
吸附率R和吸附量Q(mg/g)计算如下:
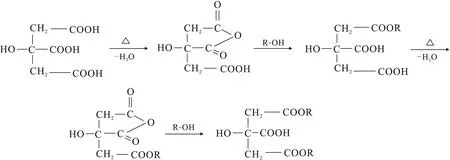
图1 柠檬酸修饰机理Fig.1 Thermochemical reaction of fungus materials and citric acid
其中:ρ0和ρe分别为Th(Ⅳ)初始和平衡质量浓度,mg/L;V为溶液体积,mL;m为吸附剂CA-Fusariumsp.#ZZF51质量,g。
1.5样品表征
为确认吸附过程吸附剂CA-Fusariumsp.#ZZF51上各官能团的变化,在400~4 000 cm-1测定了吸附剂CA-Fusariumsp.#ZZF51吸附前后的红外光谱。称取吸附前与吸附后的吸附剂各2 mg,分别加入200 mg纯KBr粉末置于研钵中研磨均匀,真空状态下压成透明薄片进行测定。
为了观察吸附剂CA-Fusariumsp.#ZZF51在吸附前后表面的变化,用扫描电镜进行了分析。将吸附前后吸附剂置于干净的盖玻片并风干,并用2.5%(体积分数)的戊二醛固定液溶液处理7 h,再通过浓度从稀到浓梯度的乙醇脱水20 min,最后在使用之前,将样品风干并附上一层4 nm的均匀金粒。
2 结果与讨论
2.1真菌化学改性前后红外谱图
通过柠檬酸化学改性,使得真菌Fusariumsp.#ZZF51表面基团发生变化,对比化学改性前后的红外谱图,主要谱峰的变化列入表1。
表1 真菌化学改性前后谱峰变化
Table 1 Infrared (FTIR) spectra peak changes before and after chemical modification

改性处理羟基伸缩振动羰基伸缩振动饱和C—H伸缩振动N—H弯曲振动未处理3452cm-1强峰1639cm-1强峰2924cm-1弱峰1570cm-1弱峰改性后3450cm-1强峰、峰宽1631cm-1强峰2920cm-1中强峰1560cm-1中强峰
2.2pH值对吸附的影响
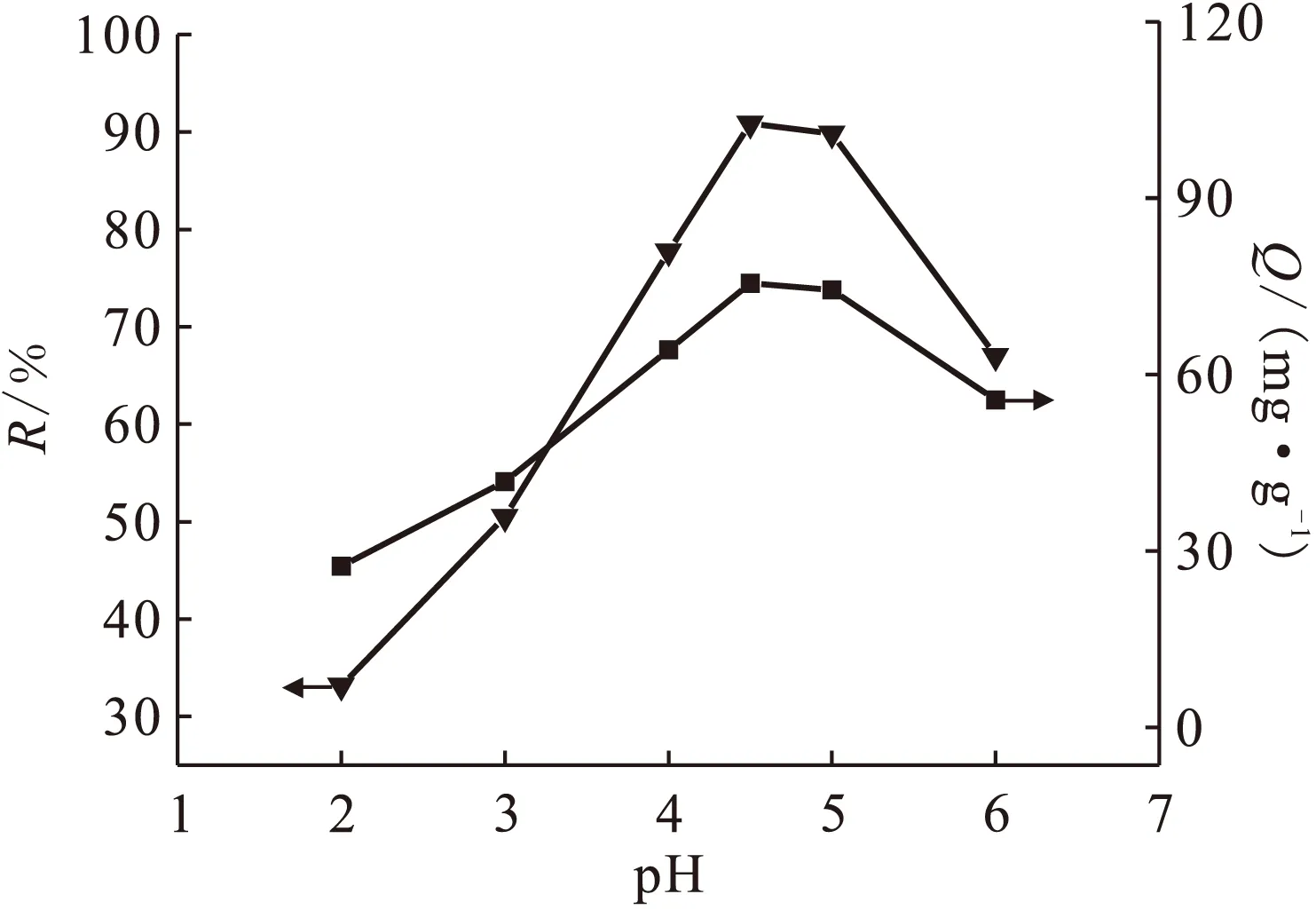
ρ0(Th(Ⅳ))=50 mg/L,m=0.03 g,t=90 min图2 pH对吸附的影响Fig.2 Effect of initial solution pH on thorium sorption
2.3吸附剂用量对吸附的影响
当ρ0(Th(Ⅳ))=50 mg/L、pH=4.5、t=90 min时,吸附剂CA-Fusariumsp.#ZZF51用量对吸附的影响示于图3。由图3可知,当m<0.03 g时,吸附率随吸附剂用量的增加而增加,因为投加量增加时活性位点总数随之增加,溶液中钍离子与活性位点结合的几率增大,最大吸附率可达90.87%,对应吸附量为75.47 mg/g;而m>0.03 g时,吸附率反而有所下降,可能是因为大量的吸附剂聚集成团,使得暴露出来的有效活性位点反而减小,对细胞壁产生一种“空间位阻效应”,导致吸附率有所降低。
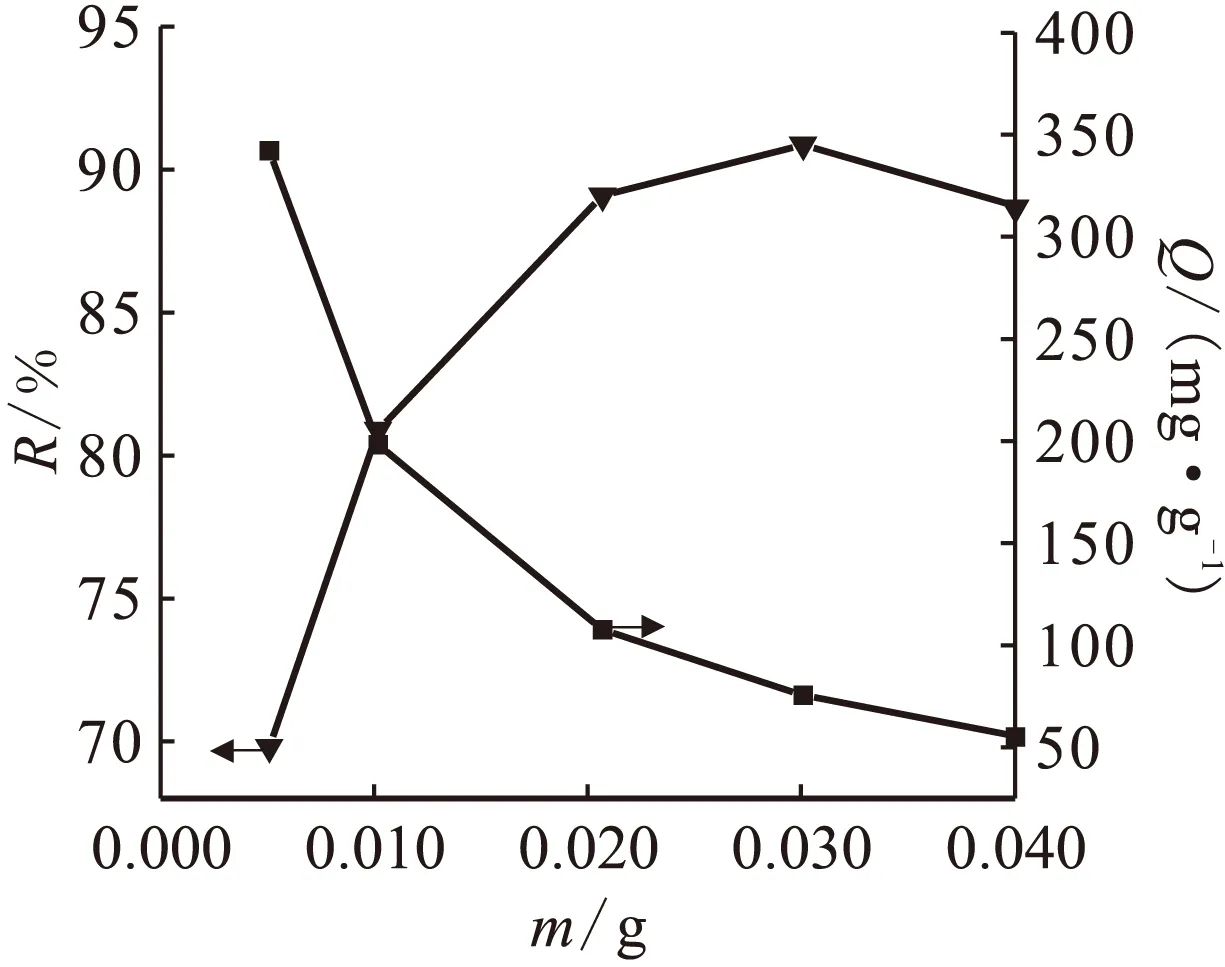
ρ0(Th(Ⅳ))=50 mg/L,pH=4.5,t=90 min图3 吸附剂用量对吸附的影响Fig.3 Effect of biomass dose on thorium sorption

ρ0(Th(Ⅳ))=50 mg/L,pH=4.5,m=0.03 g图4 反应时间对吸附的影响Fig.4 Effect of time on thorium sorption
2.4反应时间对吸附的影响
当ρ0(Th(Ⅳ))=50 mg/L、pH=4.5、m=0.03 g时,不同反应时间对吸附的影响示于图4。由图4可以看出,t<90 min时,吸附率和吸附量随时间的增加而增大,是因为溶液中游离钍离子的浓度高、吸附剂上有效活性位点较多,并且吸附极有可能为单分子层吸附,所以反应速率快,效率高,最大吸附率可达90.87%,对应吸附量为75.47 mg/g;而当t>90 min时,钍离子的吸附率与吸附量保持稳定,略有降低,可能是因为吸附-解吸达到平衡的缘故。
2.5钍初始浓度对吸附的影响
当pH=4.5、m=0.03 g、t=90 min时,不同钍初始浓度对吸附率的影响示于图5。从图5可以看出:在ρ0(Th(Ⅳ))<50 mg/L时,随着浓度的增大,吸附率随之增大,可能是因为钍离子浓度增加,使游离钍离子与有效结合位点能够充分接触,最大吸附率可达90.87%,对应吸附量为75.47 mg/g;当ρ0(Th(Ⅳ))>50 mg/L时,吸附率有所下降,可能是吸附过程接近平衡。

pH=4.5,m=0.03 g,t=90 min图5 钍初始质量浓度对吸附的影响Fig. 5 Effect of initial thorium mass concentration on thorium sorption
2.6吸附动力学
吸附过程可用准一级反应动力学、准二级反应动力学和Elovich动力学模型[7]来解释。方程如式(1—3)。具体拟合方法如下:对于准一级反应动力学模型,以t为横坐标,ln(Q-Qt)为纵坐标得到一条直线(Qt,t时刻吸附量),求出常数k1与吸附量Q。在准二级反应动力学模型中,以t为横坐标,t/Qt为纵坐标得到一条直线,求出常数k2与吸附量Q。对于Elovich动力学模型,α与β是相关的常数,以lnt为横坐标,Qt为纵坐标得到一条直线,求出常数α与β。
准一级反应动力学模型:
ln(Q-Qt)=lnQ-k1t
(1)
准二级反应动力学模型:
(2)
Elovich动力学模型:
(3)
吸附过程的各动力学参数列入表2。由表2可知,准二级反应动力学模型(r2=0.999 9)比准一级反应动力学和Elovich模型能更好地解释吸附过程,说明吸附过程是化学吸附,且是速控步过程。此外,准二级反应动力学模型Q值75.75 mg/g
与实验值75.47 mg/g接近。
2.7吸附模型
用Freundlich、Langmuir、Temkin三种等温吸附模型[8]来拟合吸附过程,模型方程如式(4—6)。拟合结果示于图6。从图6可以看出,Freundlich 模型、Langmuir模型比Temkin吸附模型要适合,Langmuir吸附模型又比Freundlich等温模型相关性更好,说明吸附过程主要是单分子层吸附。
表2 吸附过程的各动力学参数
Table 2 Kinetic parameters for the adsorption

模型Q/(mg·g-1)βkαr2准一级反应5.96610.04530.9644准二级反应75.750.02120.9999Elovich模型0.66481.02×10200.9689
(4)
(5)
Temkin模型:Q=blnA+blnρe
(6)
式中:K,吸附能力常数,mg1-1/n·L1/n·g-1;n,吸附强度常数,无量纲;Qmax,理论饱和吸附量,mg/g;B、b、A,分别为各模型的吸附平衡常数,b无量纲,B、A单位分别是L/mg、L/g。

图6 Freundlich(a)、Langmuir(b)、Temkin(c)模型等温线Fig.6 Freundlich(a), Langmuir(b), and Temkin(c) isotherm plot of Th(Ⅳ) adsorption for CA-Fusarium sp.#ZZF51
2.8吸附前后吸附剂的红外表征

2.9扫描电镜表征
吸附剂CA-Fusariumsp.#ZZF51吸附前后的扫描电镜图示于图8。由图8可知,CA-Fusariumsp.#ZZF51在吸附前,表面相对均匀规则,而吸附后,吸附剂表面变得粗糙,被覆盖得很严实。这表明吸附剂CA-Fusariumsp.#ZZF51表面在钍离子的吸附过程中具有重要作用,细胞壁是主要的吸附部位。
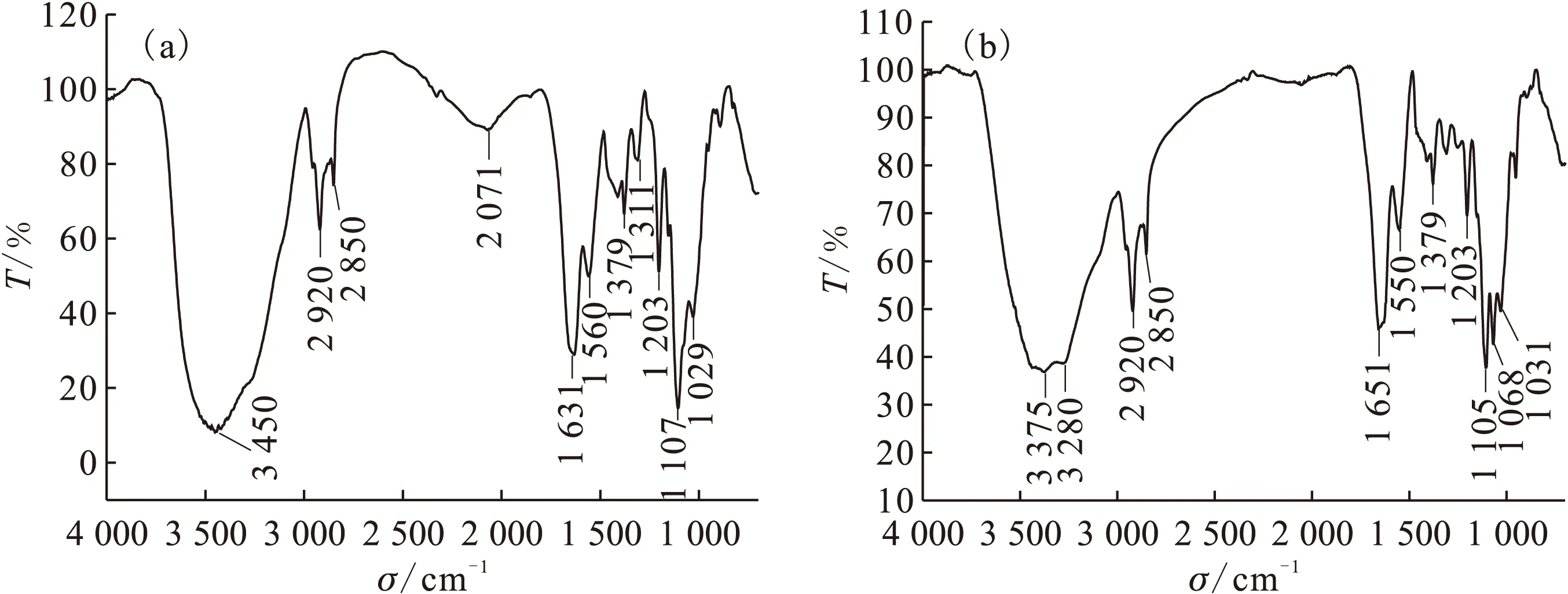
ρ0(Th(Ⅳ))=50 mg/L,pH=4.5,m=0.03 g,t=90 min图7 处理后CA-Fusarium sp.#ZZF51吸附Th(Ⅳ)前(a)、后(b)的红外光谱图Fig.7 Infrared (FTIR) spectra for CA-Fusarium sp.#ZZF51 before(a) and after(b) loaded with Th(Ⅳ)

图8 CA-Fusarium sp.#ZZF51吸附Th(Ⅳ)前(a)、后(b)的扫描电镜图(×5 000)Fig.8 Scanning electron micrographs for CA-Fusarium sp.#ZZF51 before(a) and after(b) loaded with Th(Ⅳ) (×5 000)
3 结 论

参考文献:
[1]陈灿,周芸,王建龙,等.啤酒酵母对废水中Cu2+的生物吸附特性[J].清华大学学报(自然科学版),2008,48(12):2093-2095.
[2]贾娜娜,方为茂,赵红卫,等.谷壳对水中Cr(Ⅵ)离子的生物吸附研究[J].离子交换与吸附,2011,27(2):110-121.
[3]柏云,朱晓红,仲敬荣,等.铀离子的微生物吸附回收技术[J].核化学与放射化学,2011,3(44):236-239.
[4]吴小均.柠檬酸修饰桔皮吸附重金属铅(Ⅱ)的应用研究[J].四川地质学报,2010,30(3):360-363.
[5]Yang S K, Tan N, Yan X M. Adsorption of thorium(Ⅳ) from aqueous solution by non-living biomass of mangrove endophytic fungusFusariumsp.#ZZF51[J]. J Radioanal Nucl Chem, 2013, 298 (2): 827-833.
[6]王晓斌,黄国林,张高飞,等.磁性交联壳聚糖的制备及其对钍(Ⅳ)的吸附研究[J].化工新型材料,2011,39(9):66-69.
[7]李雪,于梅,唐晓平,等.Th(Ⅳ)在氧化石墨烯上的吸附动力学与热力学[J].核化学与放射化学,2014,36(5):300-304.
[8]雷雪飞,祁光霞,孙应龙,等.粉煤灰衍生介孔硅钙材料吸附去除Co(Ⅱ)及放射性过渡金属离子性能研究[J].核化学与放射化学,2014,36(增刊):13-20.
收稿日期:2015-03-04;
修订日期:2015-05-09
基金项目:湖南省科技发展项目(2010FJ3014)
作者简介:杨司坤(1988—),男,湖南怀化人,硕士,讲师,生物吸附与环境工程专业
中图分类号:X703.1
文献标志码:A
文章编号:0253-9950(2016)03-0182-06
doi:10.7538/hhx.2016.38.03.0182
Biosorption of Th(Ⅳ) From Aqueous Solutions by Citric Acid Modified Mangrove Endophytic FungusFusariumsp.#ZZF51
YANG Si-kun1,2, TAN Ni2, XIANG Kai-xiang1, LU Jian-sheng3, LIN Yong-cheng4
1.School of Chemistry, Hunan University of Medicine, Huaihua 418000, China;2.School of Chemistry and Chemical Engineering, University of South China, Hengyang 421001, China;3.Huaihua Municipal Environmental Protection Monitoring Station, Huaihua 418000, China;4.School of Chemistry and Chemical Engineering, Sun Yat-sen University, Guangzhou 510275, China
Abstract:To remove Th(Ⅳ) ions from wastewater, the adsorption behavior was investigated by mangrove endophytic fungus Fussarium sp.#ZZF51 that citric acid treated from South China Sea. The biosorption process was optimized at pH=4.5, equilibrium time 90 min, initial Th(Ⅳ) mass concentration 50 mg/L and adsorbent dose 0.6 g/L with 90.87% of removal efficiency and 75.47 mg/g of adsorption capacity, which is obviously greater than that (11.35 mg/g) of the untreated fungus Fussarium sp.#ZZF51 for Th(Ⅳ) biosorption under the condition of optimization. The experimental data were analyzed by using isotherm and kinetic models. Kinetic data follow the pseudo-second-order model and equilibrium data agree very well with the Langmuir model. In addition, FTIR analysis indicates that hydroxyl, amino, and carbonyl groups act as the important roles in the adsorption process.
Key words:Th(Ⅳ); fungus Fussarium sp.#ZZF51; biosorption; citric acid

