Lipofectamine2000转染pSiRNA-STAT3质粒对脑神经胶质瘤C6细胞的作用
周翔宇 田 琳 周 悦 戴 乐 刘 爽 周庆伟
(吉林大学中日联谊医院,吉林 长春 130033)
Lipofectamine2000转染pSiRNA-STAT3质粒对脑神经胶质瘤C6细胞的作用
周翔宇田琳1周悦2戴乐刘爽1周庆伟1
(吉林大学中日联谊医院,吉林长春130033)
目的研究Lipofectamine2000下转染pSiRNA-STAT3质粒对脑神经细胞C6的作用。方法取对数生长期的C6细胞随机分为Mack组、Scramble组和pSiRNA-STAT3组采用MTT法检测C6细胞在不同时间段(6、8、10 h)细胞增殖活性;荧光显微镜观察吖啶橙/溴乙啶(AO/EB)检测细胞凋亡及线粒体膜电位变化。结果Lipo2000转染pSiRNA-STAT3质粒在8 h时对C6细胞具有明显的抑制作用;镜下观察pSiRNA-STAT3组可见典型的细胞凋亡形态学特征性改变;线粒体膜电位显著降低。Mock组与Scramble组比较无统计学意义(P>0.05);pSiRNA-STAT3组与Scramble组比较差异显著(P<0.05)。结论Lipo2000 转染pSiRNA-STAT3质粒可能通过降低线粒体膜电位,抑制肿瘤细胞增殖并促进细胞凋亡,发挥抗肿瘤生长的作用。
pSiRNA-STAT3质粒;神经胶质瘤C6细胞;细胞凋亡;线粒体膜电位
神经胶质瘤的发病机制尚未十分清楚,研究显示,神经胶质瘤的发生、发展与细胞凋亡密切相关〔1~3〕。传统的治疗原则是术后先放疗后化疗或单独放疗/化疗,但都难以提高其临床疗效〔4〕。研究已证明,利用小干扰 RNA(siRNA)、微RNA(miRNA)或小分子抑制剂调低 STAT3蛋白的表达具有抗肿瘤作用〔5~7〕。因此,STAT3可作为恶性肿瘤的预后指标和治疗靶点。本实验旨在研究Lipofectamine 2000 c Lipo2000,转染pSiRNA-STAT3质粒对脑神经胶质瘤C6细胞作用的影响。
1 材料与方法
1.1材料脑神经胶质C6细胞株:购自中国科学院上海细胞生物学研究所;主要试剂:①Opti-MEM培养基(美国GIBCO公司产品,编号:1267487);②Lipofectamine2000转染试剂(美国,编号:1345247,);③线粒体膜电位检测试剂盒(JC-1,编号:C2006)。主要药品:①溴乙啶(EB,美国Sigma公司,批号:E8751);②吖啶橙(AO,中国北京鼎国昌盛生物技术有限责任公司,批号:1AB10220);③二甲基亚砜 、四甲基偶氮唑蓝(MTT)均为美国Sigma公司产品。主要仪器:① 荧光显微镜 NiKon ECLIPSE 80i(日本尼康公司);②二氧化碳培养箱(日本 三样电机株式会社制造,型号:NCO-15AC);③AN YANG超净台(中国 苏州安洋科技发展有限公司,型号:BSC-BOOⅡB2);④ 酶标仪(中国 上海BIO-RAD公司,型号:MODEL550)。
1.2方法
1.2.1Lipo2000 转染pSiRNA-STAT3质粒浓度的配置设4个EP管,分别标记A、B、C、D,每管加入550 μl Opti培养基。A和B分别加入8.8 μl的pSiRNA-STAT3和Scramle质粒。C和D每管分别加入22 μl Lipo 2000转染试剂,将上述C管与A管混合,D管和B管混合,混均后室温放置20 min,取对数生长期的C6细胞随机分为Mack组、Scramble组和pSiRNA-STAT3组分别向pSiRNA-STAT3和Scramble组加入上述配制的混合物,轻轻摇均,按不同实验方法用药。
1.2.2MTT比色法检测细胞活力①取对数生长期C6细胞用0.25%胰酶消化,调整细胞悬液1×104/ml,每孔加入100 μl细胞悬液接种到96孔板,置于37℃,5%CO2下孵育;②随机分为Mock、Scramble和pSiRNA-STAT3组,各设8个复孔,按分组给药(参照方法1.2.1);③检测6、8、10 h细胞生长情况;④在实验各时间点每孔加入5 mg/ml MTT溶液20 μl,孵育4 h,弃上清;加入DMSO 150 μl,置于震荡仪震荡10 min,使结晶充分溶解;⑤使用酶联免疫仪检测OD值,吸收波长设为490 nm。
1.2.3AO/EB双染①细胞爬片:取对数生长期C6细胞用0.25%胰酶消化。调整细胞悬液3×105ml接种六孔板,37℃,5%CO2下孵育;②每组设2个复孔,按分组给药(参照方法1.2.1),每孔终体积2 ml。37℃,5%CO2下孵育8 h;③取出爬满细胞的盖玻片置于载玻片上,在盖玻片上滴加AO和EB染液各5 μl,立即在荧光显微镜下观察,随机选取5个视野拍照,取其均数计算细胞程序性凋亡率。
1.2.4线粒体膜电位检测(JC-1)① 取对数生长期C6细胞用0.25%胰酶消化,细胞计数为3.0×105/ml,接种在6孔板,实验设阳性空白对照组、Mock组、Scramble组及pSiRNA-STAT3组。每组设2个复孔,细胞贴壁后弃掉培养液;②加入无双抗10%DMEM培养液,按分组给药(方法参照1.2.1),终体积为2 ml,置入37℃,5%CO2下孵育;③转染8 h,阳性空白对照组每孔加入CCCP(CCCP按照1∶1 000的比例加入到细胞培养液中);Scramble与pSiRNA-STAT3组每孔加入0.5 ml JC-1染色工作液。37℃孵育20 min,弃掉上清液,用冰浴JC-1(1×)缓冲液冲洗细胞2次,每孔加入1 ml培养液;④荧光显微镜下观察,激发波长为490 nm,发射波长530 nm。随机选取5个视野拍照,取其均数计算细胞程序性凋亡率。
1.3统计学方法采用SPSS19.0软件进行t检验。
2 结 果
2.1MTT法检测细胞活性在6 h时,各实验组之间抑制作用无统计学意义(P>0.05)。在8 h时,pSiRNA-STAT3组对C6细胞具有明显的抑制作用,与Scramble比较有统计学意义(P<0.05),在10 h时,各实验组之间比较无统计学意义(P>0.05)。提示细胞生长10 h pSiRNA-STAT3对C6细胞生长无抑制作用。见表1及图1。
2.2转染pSiRNA-STAT3质粒对C6细胞双染(AO/EB)荧光染色观察细胞凋亡转染pSiRNA-STAT3质粒作用于C6胶质瘤细胞8 h后用AO/EB染色在荧光显微镜下观察。结果表明,Mock组可见大量被染成绿色的正常细胞,细胞呈梭形,胞核完整,界限清楚。pSiRNA-STAT3组绿色细胞数目逐渐减少,红色凋亡细胞数目显著增多,pSiRNA-STAT3组细胞凋亡率(0.34±0.04)与Mock组(0.12±0.03)及Scramble组(0.17±0.02)比较显著性均具有统计学意义(P<0.05),Mock组与Scramble组比较差异无统计学意义(P>0.05)。见图2。
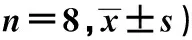
表1 pSiRNA-STAT3质粒对C6胶质瘤细胞增殖活性的影响(OD值,
与Scramble组比较:1)P<0.05
2.3转染 pSiRNA-STAT3质粒对C6细胞线粒体膜电位变化的影响 荧光显微镜下可见:阳性空白对照组在CCCP处理20 min后呈绿色荧光,Mock组细胞状态良好,呈红色荧光,胞质着色深,可见少量凋亡细胞;Scramble组细胞状态良好,可见许多分布均匀的红色荧光,少许绿色荧光;pSiRNA-STAT3组可见许多绿色荧光,少许红色荧光。 结果表明,pSiRNA-STAT3组(0.33±0.10)与Mock组(0.06±0.03)及Scramble组(0.13±0.03)比较差异均具有统计学意义(P<0.05);Scramble组与Mock组比较差异无统计学意义(P>0.05)。见图3。

图1 pSiRNA-STAT3质粒对C6胶质瘤细胞增殖活性的影响(OD)值(×20)

图2 转染PsiRNA-STAT3质粒对C6细胞凋亡的影响(AO/EB)(×20)
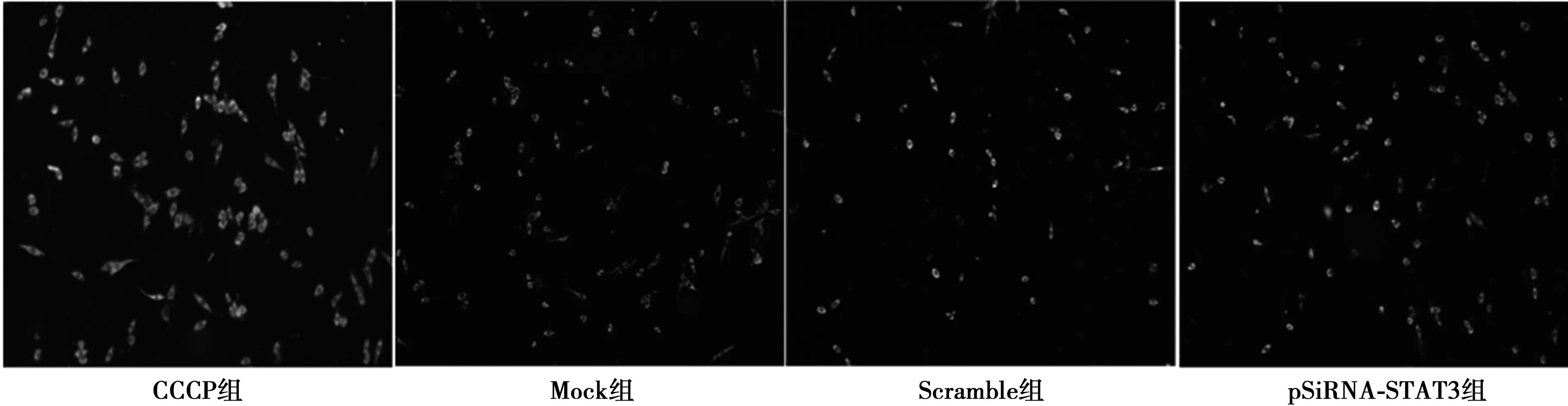
图3 转染pSiRNA-STAT3质粒对C6细胞线粒体膜电位变化的影响(×20)
3 讨 论
脑神经胶质瘤是中枢神经系统中最为常见的原发性恶性肿瘤,目前颅内肿瘤发生的病因尚未完全清楚,近些年来一些转录因子逐渐被发现,它们在调节肿瘤的相关基因方面起着重要作用。研究显示,STAT3与肿瘤的发生、发展密切相关,STAT3 在恶性胶质瘤细胞中存在异常活化〔8〕。而且多数恶性肿瘤,如前列腺癌、宫颈癌、卵巢癌、乳腺癌、肺癌、胰腺癌及骨髓瘤中均发现了STAT3 的异常活化,上述结果证实了肿瘤的发生与 STAT3 蛋白的异常活化可能存在一定的相关性。因此,致癌基因STAT3与肿瘤的研究成为热点,其抑制剂被认为是一种潜在的抗肿瘤药物〔9〕。已有研究证实,通过RNA干扰技术抑制STAT3后能够减弱细胞的增殖〔10〕。这些发现使STAT3 成为肿瘤治疗中的重要靶点。本实验提示,pSiRNA-STAT3对C6细胞具有明显的抑制作用,而且证实了Lipo2000转染pSiRNA-STAT3质粒后在8 h时能够明显抑制C6肿瘤细胞的增殖并诱导凋亡的作用。据文献报道,正常情况下,JC-1是维持线粒体进行正常氧化磷酸化并产生三磷酸腺苷的必要条件可是保持线粒体正常功能。线粒体跨膜电位的消失是一个不可逆转的细胞凋亡过程的标志。因此,可以认定线粒体跨膜电位的消失能够较早的,并不可逆转地决定了细胞凋亡的命运〔11〕。本研究显示转染pSiRNA-STAT3质粒可能直接作用于C6细胞线粒体,使线粒体膜通透性增加,跨膜电位下降,诱导细胞凋亡的发生,其诱导凋亡的分子机制可能与线粒体膜电位下降有关。
1Sancho-Martinez I,Martin-Villalba A.Tyrosine phosphorylation and CD95:a FAScinating switch〔J〕.Cell Cycle,2009;8(6):838-42.
2Eisele G,Roth P,Hasenbach K,etal.APO010,a synthetic hexameric CD95 ligand,induces human glioma cell death in vitro and in vivo〔J〕.Neurol Oncol,2011;13(2):155-64.
3Konkankit VV,Kim W,Koya RC,etal.Decitabine immunosensitizes human gliomas to NY-ESO-1 specific T lymphocyte targeting through the Fas/Fas ligand pathway〔J〕.J Transl Med,2011;9:192.
4Zhao JX,Liu XQ,Dong BJ.Primary study of bevacizumab combined with temozolomide for recurrent glioma〔J〕.Chin Clin Oncol,2011;16(10):920-2.
5Fuh B,Sobo M,Cen L,etal.LLL3 inhibits STAT3 activity,suppresses glioblastoma cell growth and prolongs survival in a mouse glioblastoma model〔J〕.Br J Cancer,2009;100(1):106-12.
6Li GH,Wei H,Lv SQ,etal.Knockdown of STAT3 expression by RNAi suppresses growth and induces apoptosis and differentiation in glioblastoma stem cells〔J〕.Int J Oncol,2010;37(1):103-10.
7Gao L,Li F,Dong B,etal.Inhibition of STAT3 and ErbB2 suppresses tumor growth,enhances radiosensitivity,and induces mitochondria-dependent apoptosis in glioma cells〔J〕.Int J Radiat Oncol Biol Phys,2010;77(4):1223-31.
8Chan K S,Cabajal S,Kiguchi K,etal.Epidermal growth factor receptor mediated activation of STAT3 during mutistage skin carcinogenesis〔J〕.Caner Res,2004;64(7):2382-9.
9Shi ZB,Zhao D,Huang YY,etal.Discovery,synthesis,and evaluation of small-molecule signal transducer and activator of transcription 3 inhibitors 〔J〕.J Chem Pharm Bull(Tokyo),2012;60(12):1574-80.
10Madoux F,Koenig M,Nelson Eetal.Modulators of STAT transcription factors for the targeted therapy of cancer(STAT3 activators)〔J〕.J Bethesda(MD):Nat Center Biotechnol Inform,2010;16:2.
11陈慧莉,李建华,王树庆.线粒体跨膜电位和细胞凋亡相关性的研究〔J〕.医学综述,2007;13(14):1041-3.
〔2016-02-19修回〕
(编辑郭菁)
10.3969/j.issn.1005-9202.2016.14.023
刘爽(1991-),女,在读硕士,主要从事肿瘤研究。
周翔宇(1992-),男,在读硕士,主要从事普外疾病研究。
R74
A
1005-9202(2016)14-3404-03;
1吉林大学药学院2南京中医药大学药学院

