电针对阿尔茨海默病小鼠海马晚期糖基化终末产物受体和低密度脂蛋白受体相关蛋白1的影响及机制
姜国华 费洪新 周忠光
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
·基础研究·
电针对阿尔茨海默病小鼠海马晚期糖基化终末产物受体和低密度脂蛋白受体相关蛋白1的影响及机制
姜国华费洪新1周忠光
(黑龙江中医药大学,黑龙江哈尔滨150040)
目的探讨电针(EA)对阿尔茨海默病(AD)小鼠海马晚期糖基化终末产物受体(RAGE)和低密度脂蛋白受体相关蛋白(LRP)1的影响及机制。方法复制AD小鼠模型,小鼠随机分为对照组,模型组,治疗组(多奈哌齐0.001 g/kg),EA(针刺肾俞、百会、大椎),8只/组。采用小鼠双侧海马微量注射(10 μg)β-淀粉样蛋白1~42(Aβ1~42,2 g/L)诱导AD小鼠,1次/d,持续30 d。采用Morris水迷宫测试小鼠学习记忆能力,电镜观察海马结构,检测小鼠脏器指数。采用双抗体夹心法测定海马APP、Aβ1~40和血清Aβ1~40,海马组织RAGE和LRP1。采用RT-PCR检测海马RAGE和LRP1 mRNA表达。结果与模型组比较,EA组小鼠海马学习记忆能力明显改善(P<0.05),海马神经元结构明显改善,脾和胸腺脏器指数明显增加(P<0.05),海马APP、Aβ1~40和RAGE水平明显降低(P<0.05),血清Aβ1~40和海马LRP1明显增加(P<0.05)。结论EA通过下调海马RAGE和上调海马LRP1表达改善AD小鼠学习记忆能力、海马电镜结构、脾指数、胸腺指数和海马Aβ1~40水平。
电针;阿尔茨海默病;低密度脂蛋白受体相关蛋白1;晚期糖基化终末产物受体
阿尔茨海默病(AD)是一种β-淀粉样蛋白(Aβ)积累引起的老年人常见疾病〔1,2〕。Aβ主要分为Aβ1~42和Aβ1~40,脑Aβ1~40可跨越血脑屏障(BBB)进行清除〔3〕,BBB基本结构中脑微血管内皮细胞(BMEC)参与了Aβ清除〔4,5〕。BMEC上存在晚期糖基化终末产物受体(RAGE),RAGE与Aβ结合可介导神经毒性〔6〕;RAGE参与Aβ运输并引起Aβ在脑内积聚〔7〕,使用RAGE抑制剂可改善AD脑功能〔8〕。BBB上低密度脂蛋白受体相关蛋白(LRP)1也可介导Aβ转运〔9〕,而AD患者LRP1表达下调〔10〕。电针(EA)可调节AD海马长时程增强电位〔11〕,治疗抑郁症〔12〕,减少麻醉剂使用量〔13〕,调节机体血压〔14〕等,但是EA对AD小鼠海马RAGE和LRP1的影响和机制,国内外未见报道。基于此,本研究探讨EA对AD小鼠海马RAGE和LRP1的影响及机制。
1 材料和方法
1.1实验动物清洁级雄性8周龄C57BL/6小鼠,体重(23±2)g,购于北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2012-0001。动物常规饲养于黑龙江中医药大学实验动物中心。
1.2主要药物及其仪器药物多奈哌齐(重庆植恩药业有限公司,批号20141201);APP、Aβ1~40、RAGE和LRP1酶联免疫试剂盒(南京建成生物工程研究所,批号20140401);Aβ1~42(Sigma公司);其他试剂均为国产分析纯。仪器:6100型RT-雷杜酶标仪(美国RT公司);TCNAI-G2型透射电镜(荷兰公司);STW-1型脑立体定位仪(成都仪器厂);Morris水迷宫(安徽淮北正华生物仪器设备有限公司);Applied Biosystems step one plus定量PCR仪(美国应用生物系统公司);PLZOZ-S型电子天平(梅特勒-托利多仪器有限公司)等。
1.3方法
1.3.1AD模型复制参考文献〔15〕制备AD小鼠模型。小鼠麻醉后,固定小鼠头部和四肢,剪去头顶部毛发,定位小鼠海马区,用微量加样器于双侧脑室海马区连续注入10 μg的Aβ1~42(2 g/L),针头置留10 min后包扎小鼠。对照组小鼠双侧脑室注射等量生理盐水。
1.3.2分组和给药C57BL/6小鼠随机分为对照组、模型组、治疗组和EA组,每组8只。对照组和模型组灌胃给予生理盐水,治疗组灌胃给予多奈哌齐0.001 g/kg,EA组使用0.25 mm×0.25 mm无菌针针刺肾俞、百会和大椎穴位,双侧肾俞直刺4 mm,百会平刺2.5 mm,大椎直刺3 mm,肾俞、百会和大椎连接电针治疗仪器(30 Hz,2 V),1次/d,连续治疗30 d。
1.3.3测定逃避潜伏期采用Morris水迷宫检测逃避潜伏期,评价小鼠的学习能力。水池内放置清洁自来水及奶粉,水深20 cm,水温(23±2)℃,平台放于第Ⅳ象限,训练时间为4 d,1次/d,60 s/次。第5天测试,观察小鼠到达平台位置的逃避潜伏期。
1.3.4测定游泳距离过程同1.3.3,在Morris水迷宫测试第5天时撤去第Ⅳ象限的移动平台,测定小鼠在60 s内的游泳距离,评价小鼠的记忆能力。
1.3.5测定目标象限停留时间和跨平台次数过程同1.3.3,测试第5天的时候撤去平台,测定小鼠在60 s内在第Ⅳ象限的游泳时间(目标象限停留时间)和跨越平台的次数(跨平台次数),综合评价小鼠学习记忆保持能力。
1.3.6观察海马CA1区电镜结构Morris水迷宫测试结束后,小鼠左心室灌注70 ml生理盐水,冲刷小鼠的循环系统,2.5%戊二醛灌注70 ml,取小鼠海马CA1区后2.5%戊二醛固定、四氧化锇固定、脱水、包埋、切片等,透射电镜观察小鼠海马CA1区的电镜结构。
1.3.7测定脏器指数Morris水迷宫测试结束后,电子天平称取小鼠的体重。迅速断头处死小鼠,取材小鼠脾和胸腺,计算脏器指数。脏器指数(mg/g)=脏器质量(mg)/体重(g)。
1.3.8测定海马RAGE、LRP1和其他因子Morris水迷宫测试结束后,摘除眼球后取血,取小鼠海马,匀浆,静置海马匀浆液和血液,4 000 r/min离心10 min,取上清液,分装,-80℃冰箱内保存。在酶标仪上450 nm波长处测定吸光度(A),绘制标准曲线,计算小鼠海马RAGE、LRP1、淀粉样蛋白前体蛋白(APP)、Aβ1~40和血清Aβ1~40水平。
1.3.9测定海马RAGE 和LRP1 mRNA表达实验结束后,取材海马,按照试剂盒说明书,应用Trizol试剂盒提取海马总RNA,合成cDNA,PCR扩增。RAGE引物(上游:5′-AAA ACG ACA ACC CAG GCG T-3′,下游:5′-ATT CTC TGG CAT CTC CGC TTC-3′)、LRP1引物(上游:5′-CCG ACT GGC GAA CAA ATA CAC-3′,下游:5′-ATC GGC TTT GTT GCA CGT G-3′)、β-actin引物(上游:5′-CGT GCG TGA CAT CAA AGA GAA-3′,下游:5′-AAC CGC TCG TTG CCA ATA GT-3′)均由中国上海捷瑞生物工程有限公司合成,PCR参数为50℃ 2 min,95℃ 10 min,95℃ 15 s,60℃ 1 min,共40个循环,RAGE 和LRP1 mRNA结果以2-ΔΔCt法表示。
1.4统计学分析采用SPSS19.0统计软件对数据行单因素方差分析。
2 结 果
2.1EA对AD小鼠逃避潜伏期的影响各组逃避潜伏期随着训练次数的增加,而呈现整体缩短的趋势。与对照组比较,模型组小鼠逃避潜伏期明显延长(P<0.05);与模型组比较,治疗组和EA组小鼠逃避潜伏期明显缩短(P<0.05)。见表1。
2.2EA对AD小鼠游泳距离的影响各组游泳距离随着训练次数的增加,而呈现整体下降的趋势。与对照组比较,模型组小鼠游泳距离明显增加(P<0.05);与模型组比较,治疗组和EA组小鼠游泳距离明显降低(P<0.05)。见表2。
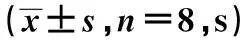
表1 EA对AD小鼠逃避潜伏期的影响
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05;下表同
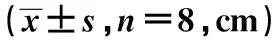
表2 EA对AD小鼠游泳距离的影响
2.3EA对AD小鼠目标象限停留时间和跨平台次数的影响与对照组比较,模型组小鼠目标象限停留时间明显缩短且跨平台次数明显减少(P<0.05);与模型组比较,治疗组和EA组小鼠目标象限停留时间明显延长且跨平台次数明显增加(P<0.05)。见表3。
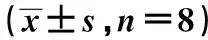
表3 EA对AD小鼠目标象限停留时间和跨平台次数的影响
2.4EA对AD小鼠海马CA1区神经元电镜结构的影响对照组小鼠海马CA1区神经元细胞核大而圆,核仁清晰;模型组小鼠海马CA1区神经元不规则,神经元较小且萎缩;经过治疗后,治疗组和EA组小鼠海马CA1区神经元较大,结构比较清晰。见图1。

图1 小鼠海马CA1区神经元电镜结构(透射电镜,×2 550)
2.5EA对AD小鼠海马CA1区神经元细胞质电镜结构的影响对照组小鼠海马CA1区神经元细胞质粗面内质网较多,线粒体清晰;模型组小鼠海马CA1区神经元细胞器较少;经过治疗后,治疗组和EA组小鼠海马CA1区神经元细胞器较多,核膜清晰。见图2。

图2 小鼠海马CA1区神经元细胞质电镜结构(透射电镜,×16 500)
2.6EA对AD小鼠脏器指数的影响与对照组比较,模型组小鼠脾指数和胸腺指数明显降低(P<0.05);与模型组比较,治疗组和EA组小鼠脾指数和胸腺指数明显升高(P<0.05)。见表4。
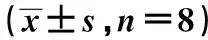
表4 EA对AD小鼠脏器指数的影响
2.7EA对AD小鼠海马APP、Aβ1~40和血清Aβ1~40的影响与对照组比较,模型组小鼠海马APP和Aβ1~40明显增加,血清Aβ1~40明显降低(P<0.05);与模型组比较,治疗组和EA组小鼠海马APP和Aβ1~40明显降低,而血清Aβ1~40明显增加(P<0.05)。见表5。
2.8EA对AD小鼠海马RAGE和LRP1的影响表6可见,与对照组比较,模型组小鼠海马RAGE明显增加,海马LRP1明显降低(P<0.05);与模型组比较,治疗组和EA组小鼠海马RAGE明显降低,海马LRP1明显增加(P<0.05)。
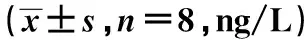
表5 EA对AD小鼠海马APP、Aβ1~40和血清Aβ1~40的影响
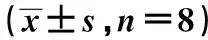
表6 EA对AD小鼠海马RAGE和LRP1的影响
2.9EA对AD小鼠海马RAGE mRNA表达的影响与对照组(1.030 2±0.254 8)比较,模型组小鼠海马RAGE mRNA(1.488 7±0.208 3)明显增加(P<0.05);与模型组比较,治疗组(1.113 1±0.342 8)和EA组(1.071 5±0.373 3)小鼠海马RAGE mRNA明显降低(P<0.05)。
2.10EA对AD小鼠海马LRP1 mRNA表达的影响与对照组(1.030 0±0.265 2)比较,模型组小鼠海马LRP1 mRNA(0.658 8±0.128 6)明显降低(P<0.05);与模型组比较,治疗组(0.934 7±0.151 0)和EA组(0.902 3±0.227 1)小鼠海马LRP1 mRNA明显增加(P<0.05)。
3 讨 论
Morris水迷宫实验结果显示,模型小鼠逃避潜伏期延长和游泳距离增加,同时目标象限停留时间和跨平台次数减少,说明模型建立成功;经过EA治疗后,模型小鼠对移动平台的记忆能力增强,说明EA可改善AD小鼠的学习记忆能力。
研究显示,海马CA1区与学习记忆有一定关联〔16,17〕。本实验中模型组海马CA1区神经元形态不规则,细胞器较少,提示模型组海马CA1区神经元结构异常,适合开展实验研究。经过EA治疗后,海马CA1区神经元的结构得到恢复,说明EA可改善海马CA1区的形态结构。
本实验模型组小鼠脾指数和胸腺指数降低,提示免疫器官相对质量减轻,产生B细胞和T细胞的数量减少,说明模型组小鼠体液免疫和细胞免疫水平较低。经过EA治疗后,免疫器官的相对质量增加,说明EA可增强AD小鼠免疫功能。
本实验检测了海马APP、Aβ1~40和血清Aβ1~40水平。结果显示,海马APP和Aβ1~40增加,而血清Aβ1~40降低,说明脑Aβ增加加重AD。经过EA治疗后,EA组海马APP和Aβ1~40降低,而血清Aβ1~40增加,提示脑海马经过某种特殊机制将Aβ1~40外排到血清或减少血清Aβ1~40进入脑组织。
RAGE促进Aβ进入脑,LRP1促进Aβ转运出脑。本文结果表明,RAGE与Aβ1~40结合增加,促进Aβ1~40进入脑;同时,由于海马LRP1水平降低,减少了Aβ1~40外排出脑,加速了Aβ的沉积。经过EA治疗后,EA组小鼠海马RAGE水平降低,提示RAGE与Aβ1~40结合减少,减少了Aβ1~40进入脑;同时,海马LRP1水平增加,加速了Aβ1~40外排出脑,从而减缓AD的发生发展。本实验显示海马RAGE和LRP1的变化趋势与海马及血清Aβ1~40密切相关。
1Sun X,Chen WD,Wang YD.β-Amyloid:the key peptide in the pathogenesis of Alzheimer′s disease〔J〕.Front Pharmacol,2015;30(6):221.
2Decock M,El Haylani L,Stanga S,etal.Analysis by a highly sensitive split luciferase assay of the regions involved in APP dimerization and its impact on processing〔J〕.FEBS Open Biol,2015;6(5):763-73.
3Ito S,Ohtsuki S,Murata S,etal.Involvement of insulin-degrading enzyme in insulin-and atrial natriuretic peptide-sensitive internalization of amyloid-β peptide in mouse brain capillary endothelial cells〔J〕.J Alzheimers Dis,2014;38(1):185-200.
4Pflanzner T,Kuhlmann CR,Pietrzik CU.Blood-brain-barrier models for the investigation of transporter and receptor-mediated amyloid-β clearance in Alzheimer′s disease〔J〕.Curr Alzheimer Res,2010;7(7):578-90.
5Erickson MA,Banks WA.Blood-brain barrier dysfunction as a cause and consequence of Alzheimer′s disease〔J〕.J Cereb Blood Flow Metab,2013;33(10):1500-13.
6Wan W,Chen H,Li Y.The potential mechanisms of Aβ-receptor for advanced glycation end-products interaction disrupting tight junctions of the blood-brain barrier in Alzheimer′s disease〔J〕.Int J Neurosci,2014;124(2):75-81.
7Choi K,Lim KS,Shin J,etal.6-Phenoxy-2-phenylbenzoxazoles,novel inhibitors of receptor for advanced glycation end products(RAGE)〔J〕.Bioorg Med Chem,2015;23(15):4919-35.
8Deane R,Singh I,Sagare AP,etal.A multimodal RAGE-specific inhibitor reduces amyloid β-mediated brain disorder in a mouse model of Alzheimer disease〔J〕.J Clin Invest,2012;122(4):1377-92.
9Ramanathan A,Nelson AR,Sagare AP,etal.Impaired vascular-mediated clearance of brain amyloid beta in Alzheimer′s disease:the role,regulation and restoration of LRP1〔J〕.Front Aging Neurosci,2015;15(7):136.
10Liu CC,Hu J,Tsai CW,etal.Neuronal LRP1 regulates glucose metabolism and insulin signaling in the brain〔J〕.J Neurosci,2015;35(14):5851-9.
11He X,Yan T,Chen R,etal.Acute effects of Electroacupuncture(EA)on hippocampal long term potentiation(LTP)of perforant path-dentate gyrus granule cells synapse related to memory〔J〕.Acupunct Electrother Res,2012;37(2-3):89-101.
12Mo YP,Yao HJ,Song HT,etal.Progress of animal research on Electroacupuncture treatment for depression〔J〕.Chin Med Sci J,2014;29(1):43-7.
13Silva AH,Prado Neto AX,Guimarães SB.Electroacupuncture reduces the need for additional anesthetics in experimental studies〔J〕.Acta Cir Bras,2010;25(4):381-4.
14Chen MJ,Peng ML,Chen LW,etal.Pressor effects on blood pressure induced by isovolumic bladder distension and Electroacupuncture stimulations in anesthetized rats〔J〕.Chin J Physiol,2009;52(6):426-31.
15Ren SC,Chen PZ,Jiang HH,etal.Persistent sodium currents contribute to Aβ1~42induced hyperexcitation of hippocampal CA1 pyramidal neurons〔J〕.Neurosci Lett,2014;580:62-7.
16Luo P,Lu Y,Li C,etal.Long-lasting spatial learning and memory impairments caused by chronic cerebral hypoperfusion associate with a dynamic change of HCN1/HCN2 expression in hippocampal CA1 region〔J〕.Neurobiol Learn Mem,2015;123:72-83.
〔2015-11-06修回〕
(编辑郭菁)
Effects and related mechanisms of electro acupuncture on RAGE and LRP1 of hippocampus in Alzheimer′s disease mice
JIANG Guo-Hua,FEI Hong-Xin,ZHOU Zhong-Guang.
Heilongjiang University of Chinese Medicine,Harbin 150040,Heilongjiang,China
ObjectiveTo explore the effects and related mechanisms of electro acupuncture(EA)on RAGE and LRP1 of hippocampus in Alzheimer′s disease(AD)mice.MethodsAD model mice were duplicated and randomly divided into control,model,treatment(Donepezil 0.001 g/kg)and electro acupuncture groups(bilateralm Shenshu,Baihui and Dazhui),8 mice in each group.AD model mice were made by using microinjection of 10 μg incubated amyloid beta1~42(Aβ1~422 g/L)into the dorsal blade of the dentale gyrus in the bilateral hippocampus.Treatment was done once each day for 30 days.The Morris water maze was used to observe the learning and memory ability.After the treatment all animals were sacrificed,electron microscopy of hippocampus was observed.After the treatment all animals organ coefficients of AD mice were measured.Biochemical methods were used to determine the content of APP and Aβ1~40in the hippocampus and Aβ1~40in the serum,the content of RAGE and LRP1 in the hippocampus.RT-PCR method was used to determine the expression of RAGE and LRP1 mRNA in the hippocampus.ResultsCompared with the model group,EA could significantly improve the learning and memory ability of AD mice(P<0.05).EA recovered brain maintain normal morphological structure of hippocampus tissue,the organ coefficients of splenic and thymus significantly increased(P<0.05),APP,Aβ1~40and RAGE in the hippocampus tissue were significantly decreased(P<0.05),Aβ1~40in the serum and LRP1 in the hippocampus tissue were significantly increased(P<0.05).ConclusionsEA could significantly improve the learning and memory ability and Aβ1~40in hippocampus and improve normal morphological structure of the hippocampus and the organ coefficients of splenic and thymus in AD mice.EA plays a certain role in the treatment of AD by inhibiting RAGE and increasing LRP1.
Electro acupuncture;Alzheimer′s disease;LRP1;RAGE
10.3969/j.issn.1005-9202.2016.14.001
国家自然科学基金(81173576,81373777);黑龙江省自然基金(H201354);国家高校博士学科点科研基金(博导类,20132327110010)
周忠光(1957-),男,博士,教授,博士生导师,主要从事痴呆、痛风、肿瘤研究。
姜国华(1966-),男,博士,教授,硕士生导师,主要从事痴呆、肿瘤、痛风研究。
R285
A
1005-9202(2016)14-3349-03;
1齐齐哈尔医学院

