3-甲基腺嘌呤对急进高原缺氧大鼠肠上皮细胞损伤的自噬影响研究
郑晓凤,张久聪,邓尚新,王彬彬,周慧茹,杨永林,马 强,张方信*
3-甲基腺嘌呤对急进高原缺氧大鼠肠上皮细胞损伤的自噬影响研究
郑晓凤1,2,张久聪2,邓尚新2,王彬彬2,周慧茹2,杨永林2,马强2,张方信2*
1.兰州大学第二医院消化科,兰州 730030;2.兰州军区兰州总医院消化科,兰州 730050
[摘要]目的探讨自噬抑制剂3-甲基腺嘌呤(3-MA)对急进高原缺氧大鼠肠上皮细胞自噬水平及损伤程度的影响。方法将50只Wistar大鼠随机分成5组(A~E组),在低氧氧舱环境下建立急进高原缺氧大鼠肠上皮细胞损伤模型,用3-MA进行处理,肉眼观察各组大鼠的行为学改变,HE染色分析大鼠肠组织的损伤程度,免疫组织化学检测自噬相关蛋白LC-3、Beclin-1的表达情况,RT-PCR方法检测LC-3、Beclin-1 mRNA的表达情况。结果3-MA作用于缺氧大鼠肠上皮细胞后,肠组织的病理性损伤明显加重,自噬相关蛋白LC-3、Beclin-1及其相关mRNA表达也显著降低,细胞自噬水平下降。结论3-MA可能通过降低细胞自噬水平加重急进高原缺氧肠上皮细胞损伤,细胞自噬可能是急进高原缺氧肠上皮细胞损伤过程中的重要保护因素之一。
[关键词]3-甲基腺嘌呤;肠上皮细胞损伤;自噬;高原;缺氧
0 引言
肠上皮细胞对缺氧反应敏感,易引起一定的损伤。最近的研究发现,急进高原缺氧环境促进肠上皮细胞损伤,且与自噬活性的表达有关[1]。自噬与肿瘤细胞缺氧的关系已得到国内外研究的证实,但具体是一种保护作用还是抑制作用仍存有争议,目前的研究多认为自噬可保护肿瘤细胞增加对缺氧的耐受[2],然而自噬在高原环境引起的缺氧应激肠上皮细胞损伤中是否也是一种保护机制尚不明确。本实验通过建立大鼠急进高原缺氧模型,应用自噬抑制剂3-甲基腺嘌呤(3-MA)干预自噬的表达,初步探讨细胞自噬在急进高原缺氧引起的肠上皮细胞损伤中的作用。
1 材料和方法
1.1实验动物和分组选择50只SPF级雄性Wistar大鼠(兰州军区兰州总医院动物实验中心提供),大鼠体重180~280 g,6~9周龄。将大鼠随机平均分为A、B、C、D、E 5组,A组为平原对照组,B组为急进高原缺氧24 h组,C组为急进高原缺氧24 h(3-MA)干预组,D组为急进高原缺氧48 h组,E组为急进高原缺氧48 h(3-MA)干预组。利用模拟高原低压氧舱建立急进高原缺氧大鼠肠上皮细胞损伤模型,模型建立前0.5 h分别给予A~C组腹腔注射1 mL 0.9%生理盐水,C组和E组腹腔注射3-MA(剂量为20 mg/kg,溶于1 mL生理盐水中)。各组大鼠在模型建立后不同时间点断颈处死后,打开腹腔,暴露十二指肠及空回肠,距十二指肠起始处15 cm处截取两段2~5 cm长的空肠上段组织,用生理盐水冲洗干净,一段立即放入4%甲醛固定液中,一段放入冻存管中-80 ℃冰箱中保存,待检测相关指标。
1.2主要试剂LC3A/B(兔多克隆)抗体,Beclin-1(小鼠单克隆)抗体均购自美国Abcam公司;3-Methyladenine购自Sigma公司,LC3、Beclin-l及β-actin引物序列由Takara公司合成,用于RT-PCR的RNAiso plus、逆转录试剂盒及SYBR荧光定量PCR试剂盒均购自Takara公司,即用型SABC免疫组化染色试剂盒购自北京博奥森生物技术有限公司,DAB显色试剂盒购自北京中杉金桥试剂公司,水合氯醛、4%多聚甲醛、PBS缓冲液均由兰州军区兰州总医院实验科提供。
1.3检测指标和方法
1.3.1大鼠行为学及肠道组织病理学观察肉眼分别观察给予缺氧处理及应用3-MA后大鼠精神、呼吸、动作等的变化,处死大鼠后,在空肠上段取材,制成切片,经过HE染色,在电子显微镜下观察每组大鼠肠道组织的病理损伤情况,按Chiu氏病理评分进行统计学分析,具体评分标准参照表1。

表1 肠黏膜Chiu氏病理评分标准
1.3.2免疫组织化学方法检测自噬相关蛋白LC-3、Beclin-1采用SABC方法进行免疫组织化学反应,小鼠单克隆Beclin-1抗体按1∶50稀释,兔多克隆LC3抗体按1∶100稀释,将浸泡在多聚甲醛中的肠组织取出裁剪,固定,制成厚度为4 μm的切片,然后依次经过烤箱烘烤-脱蜡脱水-柠檬酸高压热修复-双氧水-加入BSA-加稀释后一抗-加入二抗-SABC-DAB显色-苏木素复染-盐酸、氨水酒精分化-脱水-封片等处理。由两位病理医生在光镜高倍镜下(×200)随机选取5个不同视野观察分析并拍照,肠上皮细胞质或细胞核中颗粒颜色为棕黄色为阳性表达,通过Image-Pro-Plus分析软件对图像进行分析,阳性细胞目的蛋白的表达用平均光密度值(MOD值)表示。
1.3.3RT-PCR方法检测自噬相关基因的表达从GenBank中查找LC3、Beclin-1基因序列,基因的设计及合成由Takara试剂公司完成,最后经BLAST检测合成的引物序列证实为特异性引物序列(见表2)。将保存在-80 ℃冰箱中的肠组织取出,称取50~100 g,采用Trizol试剂盒提取肠组织总RNA,用分光光度计对所提取的RNA进行检测,算出OD260/OD280,范围在1.8~2.0之间即可继续进行下面的操作,所提的总RNA可于-70 ℃冰箱中保存;也可直接将RNA反转录为cDNA,反应条件为37 ℃ 15 min-85 ℃ 5 s-4 ℃,合成的cDNA于-20 ℃冰箱内保存;PCR扩增反应,将合成的引物稀释备用,采取SYBRGreen Ⅰ嵌合荧光法,配成20 μL反应体系,进行RT-PCR反应,每个样本每个基因重复3次,在扩增仪上进行扩增反应为:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 31 s,共40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s下溶解;分析整理实验结果,确保扩增曲线标注扩增完成,扩增产物融解曲线为单峰曲线,特异性好,用2-△△Ct法分析待测基因的相对表达量,△Ct=目的基因Ct值-β-actin Ct值。△△Ct=实验组目的基因△Ct-对照组目的基因△Ct。

表2 RT-PCR引物序列及大小
2 结果
2.1行为学及组织病理学观察当开始暴露于缺氧环境时,大鼠起先暴躁不安,接着双眼迷离,呼吸急促,自主活动量减少,逐渐脱离缺氧环境,大鼠开始暴躁活跃、自主活动明显增多,给予3-MA的大鼠反应更加敏感激烈。
肉眼观察大鼠肠道组织,B~E组的小肠组织可见不同程度的节段性充血、坏死,且3-MA组比同一时间段的模型组充血更明显。光镜下观察,与A组正常的肠黏膜组织相比,B~E组大鼠的肠黏膜均有不同程度的损伤,包括绒毛脱落、毛细血管充血、黏膜层跟黏膜下层的局部分离等,Chiu′s评分等级显著升高(P<0.05),各用药组(C组和E组)较模型组(B组和D组)损伤程度加重,局部可见固有层的暴露及炎性细胞的浸润(P<0.01)。见图1、表3。
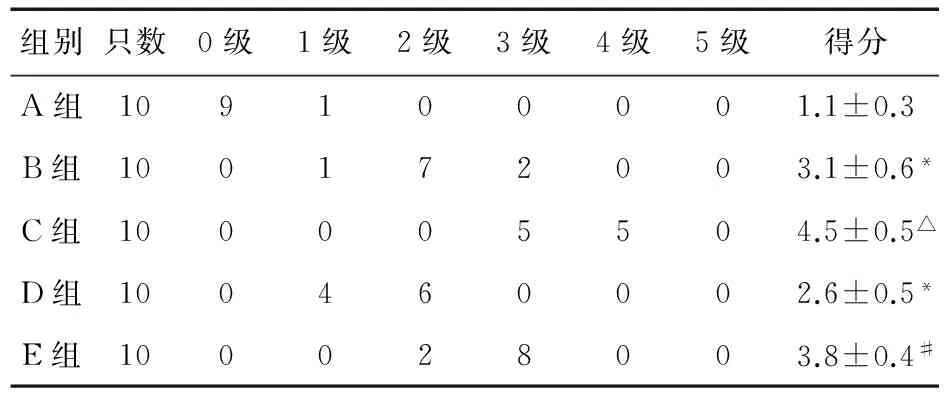
表3 大鼠肠道病理损伤级别得分比较
注:*与A组比较,P<0.05;△与B组比较,P<0.05;#与D组比较,P<0.01
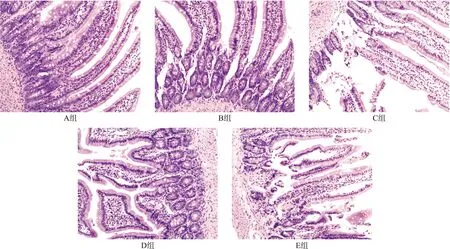
图1 组织病理学观察
2.2免疫组织化学检测每张切片随机选取5个高倍视野(×200)进行图像分析。结果表明,LC3、Beclin-1在正常肠上皮细胞中表达极少(图2A、图3A),而在高原缺氧各个时间点的细胞中有显著阳性表达,胞质成棕黄色或褐黄色,偶有细胞核中表达(图2B、D,图3B、D),两者比较,差异有统计学意义(P<0.05);与不同时间点模型组比较,3-MA组LC3、Beclin-1阳性表达下降(图2C、E,图3C、E),差异有统计学意义(P<0.05,见表4)。
2.3RT-PCR结果相对于A组,B组、D组的Beclin-1 mRNA的相对表达量分别为8.85±0.28、4.29±0.16,表达显著增加,差异有统计学意义(P<0.05),与B组比较,C组Beclin-1 mRNA相对表达量为1.76±0.19,明显降低(P<0.05)。与D组比较,E组Beclin-1 mRNA相对表达量为2.16±0.13,表达显著减少,差异有统计学意义(P<0.05),LC3 mRNA表达同上(见表5)。
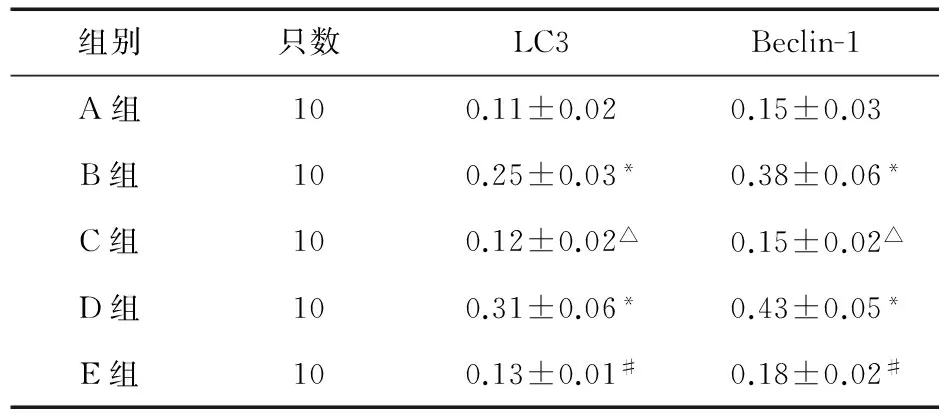
表4 各组LC3及Beclin-1表达情况
注:*与A比较,P<0.05;△与B组比较,P<0.05;#与D组比较,P<0.05
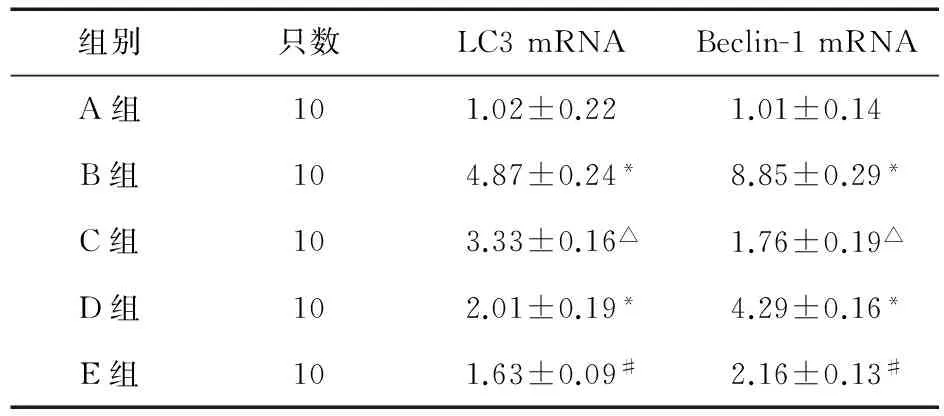
表5 各组LC3 mRNA及Beclin-1 mRNA表达情况(2-△△Ct值)
注:*与A组比较,P<0.05;△与B组比较,P<0.05;#与D组比较,P<0.05

图2 各组LC3表达情况
3 讨论
高原缺氧条件下,机体各器官均表现出不同程度的缺氧应激反应,肠道作为一个对缺氧比较敏感的器官之一,消化道症状亦不少见。李素芝等[3]对我国1 753例急进高原地区的普通人群研究发现,约62.58%的个体出现消化道反应,其症状发生率由高到低依次为腹胀、食欲不振、恶心、呕吐、腹痛等。张久聪等[4]对1 137例驻格尔木高原官兵急进高原胃肠道应激反应进行调查研究发现,进驻不同海拔高度高原3 d内消化系统症状依次表现为纳差(54.7%)、恶心(31.1%)、腹胀(25.1%)、腹泻(23.3%)、便秘(18.3%)。综合分析高原消化道反应发生的原因可能由于:高原缺氧应激引起胃肠道黏膜屏障功能损伤,腔内致病菌及内毒素移位,诱导炎症介质的释放、活化,严重者可诱发全身炎症反应综合征(SIRS);另一方面,缺氧环境引起机体氧供不足,大脑缺氧导致中枢神经系统调节能力减弱,进而影响胃肠道消化液的分泌功能[4-6]。近年研究发现,缺氧应激使胃肠功能下降,且组成肠黏膜屏障的上皮细胞中存在细胞自噬现象[7],我们前期的实验也发现与之相符的结果。
细胞自噬是除凋亡、坏死之外的另一种细胞程序性死亡,在正常情况下,面对各种外界刺激如缺氧、饥饿、紫外线照射时,细胞自噬常作为一种保护机制而存在,通过利用自身的溶酶体清除大分子物质和受损的细胞器,促进机体对外界不良环境的适应[8]。但是在过度应激条件下,细胞自噬的发生则导致细胞的程序性死亡。已经有研究发现,在多种肿瘤细胞中,缺氧可诱导自噬的发生,但是在高原缺氧环境下,肠上皮细胞是否有自噬的发生,且对机体是何种作用,尚是一个新的研究领域,需要进一步研究。
通过我们前期的研究已经发现[1,4,6,9],高原缺氧环境引起肠黏膜屏障的损伤,且自噬体和自噬相关蛋白LC3、Beclin-1表达增加,提示细胞自噬现象的发生明显增强,且随着时间的延长,黏膜屏障损伤加重,肠上皮细胞自噬发生明显增多,鉴于之前的研究结果,推测细胞自噬可能对高原缺氧引起的肠粘膜屏障损伤起保护作用。本研究是在前期研究的基础上,筛选出细胞自噬现象发生较明显的时间点(24、48 h),在高原缺氧肠应激模型中应用自噬抑制剂3-MA干预肠上皮细胞自噬的发生,进一步探讨细胞自噬发生的强弱及肠上皮细胞的损伤程度。自噬抑制剂3-MA是至今应用范围广泛且比较成熟的药物之一,且有关研究表明,面对饥饿等应激,3-MA可通过抑制心肌细胞自噬作用,促进凋亡的发生,引起心肌细胞的死亡[10],另外,3-MA也能通过抑制细胞自噬,增强化疗药物对肿瘤细胞的杀伤作用[11-12]。其发挥作用的机制可能是由于3-MA主要阻滞Ⅲ类磷脂酰肌醇3磷酸激酶(class Ⅲ PI3K),从而影响自噬相关蛋白到自噬小体膜聚集启动自噬的发生来实现的[13]。我们通过有关文献及前期的预实验筛选出3-MA发挥抑制自噬作用的最佳浓度,在不同的海拔条件下证明3-MA对肠黏膜上皮细胞的作用,进而得出结论。通过肉眼观察及肠道HE染色结果表明,应用3-MA后,肠上皮细胞炎性水肿、坏死等损伤加重,初步提示细胞自噬对高原缺氧上皮细胞可能是一种保护作用。
虽然到目前为止,在真核生物体内已经发现了几十种自噬相关蛋白及同源物,但LC3、Beclin-1在自噬发生的不同阶段具有各自的作用,常作为自噬体发生的标志蛋白。其中,LC3微管相关蛋白1-轻链3(Microtubule-associated protein 1-light chain 3,LC-3),包括LC3-Ⅰ和LC3-Ⅱ两种,在自噬发生时,LC3-Ⅱ与自噬膜结合,其含量的高低可反映自噬泡的多少[14]。另外,LC3按亚型可分为3种,即LC3A、LC3B、LC3C,其中LC3B可用于特异性检测自噬活性,因此,本实验采用LC3B-Ⅱ抗体,电子显微镜下观察其在肠上皮细胞中的特异性表达情况。Beclin-1基因由Liang等[15]在研究大鼠抵抗Sindbis病毒感染中枢神经系统的机制时首次发现,是首个也是唯一一个可启动自噬发生的基因,其发挥作用的方式主要通过与Ⅲ型磷酸肌醇-3-激酶(PI3K)结合,启动PI3K/Akt(PKB)通路,聚集其他自噬相关蛋白到自噬前体定位,来促进自噬的发生[16]。本实验通过免疫组织化学法分别于24、48 h时间点检测模型组及3-MA组LC3、Beclin-1等自噬相关蛋白表达,结果显示,模型组大鼠肠上皮细胞质中棕黄色颗粒明显增多,而3-MA组阳性颗粒明显减少,提示LC3、Beclin-1等蛋白表达量下降。另外,RT-PCR检测结果显示,模型组自噬相关基因表达明显上调,3-MA组基因表达则明显下降,与免疫组织化学结果相对应。最近有研究表明,自噬对缺氧环境中肿瘤细胞既有保护作用,也有自噬性死亡的杀伤作用[17-18]。推测在高原缺氧应激条件下,自噬可能起保护作用,与最初的猜想结果是一致的。
综上所述,高原缺氧条件下,应用3-MA后肠上皮细胞损伤明显,自噬活性下调,细胞自噬对肠上皮细胞可能是一种保护作用,但其具体的作用机制有待进一步研究,为高原相关胃肠道不适的预防及治疗提供了一个新思路。
参考文献:
[1]Zhang F,Deng Z,Li W,et al.Activation of autophagy in rats with plateau stress-induced intestinal failure[J].Int J Clin Exp Pathol,2015,8(2):1816-1821.
[2]Burada F,Nicoli ER,Ciurea ME,et al.Autophagy in colorectal cancer:an important switch from physiology to pathology[J].World J Gastrointest Oncol,2015,7(11):271-284.
[3]李素芝,郑必海,闫春城,等.急进高原个体胃肠型高原反应发生情况及其原因[J].职业与健康,2011,27(4):427-429.
[4]张久聪,杨永林,马香芝,等.驻格尔木高原官兵急进高原胃肠道应激反应调查研究[J].西北国防医学杂志,2015,36(8):27-29.
[5]Pastorelli L,De Salvo C,Mercado JR,et al.Central role of the gut epithelial barrier in the pathogenesis of chronic intestinal inflammation:lessons learned from animal models and human genetics[J].Front Immunol,2013,4:280.
[6]张久聪,耿闻男,张方信,等.不同海拔高度官兵519例胃镜临床分析[J].西北国防医学杂志,2016,37(1):38-41.
[7]Henderson PW,Weinstein AL,Sung J,et al.Hydrogen sulfide attenuates ischemia-reperfusion injury in in vitro and in vivo models of intestine free tissue transfer[J].Plast Reconstr Surg,2010,125(6):1670-1678.
[8]Li J,Yang D,Wang W,et al.Inhibition of autophagy by 3-MA enhances IL-24-induced apoptosis in human oral squamous cell carcinoma cells[J].J Exp Clin Cancer Res,2015,34:97.
[9]Zhang F,Wu W,Deng Z,et al.High altitude increases the expression of hypoxia-inducible factor 1α and inducible nitric oxide synthase with intest-inal mucosal barrier failure in rats[J].Int J Clin Exp Pathol,2015,8(5):5189-5195.
[10]杨翼,李章华,贺磊磊,等.自噬抑制剂3-MA对“饥饿状态”下心肌细胞自噬和凋亡的影响[J].武汉体育学院学报,2014,48(11):61-66.
[11]Liu D,Yang Y,Liu Q,et al.Inhibition of autophagy by 3-MA potentiates cisplatin-induced apoptosis in esophageal squamous cell carcinoma cells[J].Med Oncol,2011,28(1):105-111.
[12]Li J,Hou N,Faried A,et al.Inhibition of autophagy by 3-MA enhances the effect of 5-FU-induced apoptosis in colon cancer cells[J].Ann Surg Oncol,2009,16(3):761-771.
[13]Wu YT,Tan HL,Shui G,et al.Dual role of 3-methyladenine in modulation of autophagy via different temporal patterns of inhibition on class I and III phosphoinositide 3-kinase [J].J Biol Chem,2010,285(14):10850-10861.
[14]Hu YF,Lei X,Zhang HY,et al.Expressions and clinical significance of autophagy-related markers Beclin1,LC3,and EGFR in human cervical squamous cell carcinoma[J].Onco Targets Ther,2015,8:2243-2249.
[15]Liang XH,Kleeman LK,Jiang HH,et al.Protection against fatal Sindbis virus encephalitis by beclin,a novel Bcl-2-interacting protein[J].J Virol,1998,72(11):8586-8596.
[16]Zhao R,Chen M,Jiang Z,et al.Platycodin-D induced autophagy in non-small cell lung cancer cells via PI3K/Akt/mTOR and MAPK signaling pathways[J].J Cancer,2015,6(7):623-631.
[17]Sakitani K,Hirata Y,Hikiba Y,et al.Inhibition of autophagy exerts anti-colon cancer effects via apoptosis induced by p53 activation and ER stress[J].BMC Cancer,2015,15:795.
[18]Qin W,Li C,Zheng W,et al.Inhibition of autophagy promotes metastasis and glycolysis by inducing ROS in gastric cancer cells[J].Oncotarget,2015,6(37):39839-39854.
收稿日期:2016-01-29
基金项目:国家自然科学基金(81570481);甘肃省自然科学基金(145RJZA049)
*通信作者
DOI:10.14053/j.cnki.ppcr.201607002
Study on the influence of 3-Methyladenine on autophagy in intestinal epithelial cells of hypoxic rats rapidly ascending to high altitude areas
ZHENG Xiao-feng1,2,ZHANG Jiu-cong2,DENG Shang-xin2,WANG Bin-bin2,ZHOU Hui-ru2,YANG Yong-lin2,MA Qiang2,ZHANG Fang-xin2*
(1.Department of Gastroenterology,the Second Clinical Medical College of Lanzhou University,Lanzhou 730030,China;2.Department of Gastroenterology,Lanzhou General Hospital of Lanzhou Military Command,Lanzhou 730050,China)
[Abstract]ObjectiveTo investigate the influence of autophagy inhibitor 3-Methyladenine (3-MA) on the level of autophagy and the injury extent of intestinal epithelial cells caused by hypobaric hypoxia in rats rapidly ascending to high altitude areas.MethodsFifty healthy male Wistar rats were randomly divided into 5 groups (A to E) and intestinal epithelial cell injury in the models of rats with hypobaric hypoxia were established in decompression chamber.Autophagy inhibitor 3-MA was employed for drug intervention.Behavioral change of rats was observed,the intestinal tissue injury was analyzed by HE staining,and the expressions of autophagy-related protein LC-3 and Beclin-1 were detected by immunohistochemistry,and the mRNA expressions of LC-3 and Beclin-1 were quantified by RT-PCR.ResultsThe injury of intestinal tissue was significantly aggravated in 3-MA group,the expressions of autophagy-related protein LC-3 and Beclin-1 and corresponding mRNAs were also significantly lower in 3-MA group.Conclusion3-MA may aggravate the damage to intestinal epithelial cells by inhibiting the autophagy in hypoxic rats rapidly ascending to high altitude areas.Autophagy may play a pivotal role in the protection of intestinal epithelial cell in high altitude areas.
Key words:3-Methyladenine;Intestinal epithelial cells injury;Autophagy;High altitude;Hypoxia

