HIF-1α和Rac1在宫颈鳞状细胞癌中的表达及意义*
陈 瑛,敖启林,黄 磊,宁 杨,李 莉,王玉兰,李 瑞,田 训,李贺梅,张庆华△
(1.华中科技大学附属武汉中心医院妇产科,武汉 430014;2.华中科技大学附属同济医院病理科,武汉 430000)
HIF-1α和Rac1在宫颈鳞状细胞癌中的表达及意义*
陈瑛1,敖启林2,黄磊1,宁杨1,李莉1,王玉兰1,李瑞1,田训1,李贺梅1,张庆华1△
(1.华中科技大学附属武汉中心医院妇产科,武汉 430014;2.华中科技大学附属同济医院病理科,武汉 430000)
目的探讨缺氧诱导因子-1α(HIF-1α)和Ras相关C3肉毒杆菌毒素底物1(Rac1)在宫颈上皮内瘤变(CIN)和鳞状细胞癌中的表达以及临床意义。方法采用免疫组织化学法检测正常宫颈组织20例、宫颈CIN 42例(CINⅠ级12例,CINⅡ~Ⅲ级30例)、宫颈鳞状细胞癌58例(高分化15例,中分化24例,低分化19例)中HIF-1α和Rac1蛋白的表达情况,以分析其表达与临床病理特征的关系,并结合临床资料进行分析。结果HIF-1α蛋白在正常宫颈黏膜组织中的阳性表达率为0%(0/20),CINⅠ级组织阳性表达率为16.7%(2/12),CINⅡ~Ⅲ级组织阳性表达率为56.7%(17/30),宫颈鳞状细胞癌组织阳性表达率为81.0%(47/58),其中高分化阳性表达率53.3%,中分化阳性表达率83.3%,低分化阳性表达率100%。HIF-1α蛋白在宫颈鳞状细胞癌发生发展中的表达依次升高,差异具有统计学意义(P<0.05)。且宫颈鳞状细胞癌组织中HIF-1α蛋白表达与其组织学分级、TNM分期及淋巴结转移有关(P<0.05)。Rac1蛋白表达在正常宫颈黏膜组织中的阳性表达率为0%(0/20),宫颈CINⅠ级组织阳性表达率为8.3%(1/12),宫颈CINⅡ~Ⅲ级组织阳性表达率为53.3%(16/30),宫颈鳞状细胞癌组织阳性表达率为77.6%(45/58),其中高分化阳性表达率60.0%,中分化阳性表达率73.0%,低分化阳性表达率94.7%。Rac1蛋白在宫颈癌发生发展中的表达依次升高,差异具有统计学意义(P<0.05)。且宫颈鳞状细胞癌组织Rac1蛋白表达与其组织学分级、TNM分期及淋巴结转移有关(P<0.05)。HIF-1α蛋白的阳性表达率与Rac1蛋白的阳性表达率呈正相关(r=0.3,P<0.05)。结论HIF-1α及Rac1联合检测蛋白表达有助于判断宫颈鳞状上皮肿瘤的病变程度及预后。
宫颈鳞状细胞癌;缺氧诱导因子-1α;Ras相关C3肉毒杆菌毒素底物1
宫颈癌是全球女性最常见的妇科恶性实体肿瘤,严重威胁女性健康。我国每年新增宫颈癌病例约13.5万,占全球发病数量的1/3。缺氧是恶性实体瘤的基本特征之一,在缺氧环境中处于核心地位的缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)是一种异源二聚体蛋白复合物,由α和β两个蛋白亚基组成,HIF-1α在动物及人体的多种肿瘤组织中呈过度表达,促进血管形成,维持肿瘤细胞的能量代谢,影响肿瘤的生长、转移和凋亡[1]。Ras 相关 C3 肉毒杆菌毒素底物 1(Ras-related C3 botulinum toxin substrate 1,Rac1)是小G蛋白Rho家族的重要成员,在肿瘤组织中激活状态的Rac1通过参与细胞骨架重组、基因转录调控和细胞信号转导等生理过程[2],影响肿瘤细胞的极性、黏附、生长和运动能力,而且越来越多的证据显示Rac1能被缺氧激活[3],在诱导HIF-1α转录活性增强过程中发挥关键作用[4]。
本研究拟对HIF-1α、Rac1蛋白在各种程度宫颈鳞状细胞病变中的表达及其相关性进行研究,探索其与临床病理参数的关系,为探讨新的宫颈癌诊断和治疗靶点提供理论依据。
1 资料与方法
1.1一般资料收集武汉市中心医院2009年7月至2011年6月手术切除的宫颈组织共120例,其中子宫良性病变患者手术切除后的正常宫颈组织20例、宫颈上皮内瘤变(CIN)42例(CINⅠ级12例、CINⅡ和Ⅲ级30例)、宫颈鳞状细胞癌58例,患者平均年龄49.2岁,58例宫颈鳞状细胞癌患者术前均未接受放疗、化疗。组织学分级根据世界卫生组织2003年肿瘤细胞分化程度分类标准:低分化癌19例,中分化癌24例,高分化癌15例。TNM分期根据FIGO 2000年修订的标准:Ⅰ期22例,Ⅱ期24例,Ⅲ期8例,Ⅳ期4例,无淋巴结转移者37例,有淋巴结转移者21例。上述所有病例的诊断均经1~2位有丰富临床病理诊断经验的高级职称病理医师证实。
1.2试剂鼠抗人HIF-1α单克隆抗体为Neomarker公司产品,鼠抗人Rac1 单克隆抗体为美国Santa Cruz公司产品,SP免疫组织化学试剂盒、DAB显色试剂盒、二甲苯、乙醇、PBS缓冲液pH7.4,乙二胺四乙酸(EDTA)缓冲液pH9.0、过氧化氢、苏木素、1%盐酸酒精等。
1.3免疫组织化学检测上述组织标本均置于10%甲醛溶液固定,经脱水、透明、浸蜡、包埋后4 μm连续切片,进行HE染色和免疫组织化学染色。鼠抗人HIF-1α单克隆抗体工作浓度为1∶50,鼠抗人Rac1单克隆抗体工作浓度为1∶50,梯度乙醇(100%、95%、80%、70%)。
1.4免疫组织化学结果判断HIF-1α和Rac1的结果判定标准:HIF-1α的阳性表达为细胞核或胞质被染成浅黄色、棕黄色或黄褐色颗粒。Rac1蛋白阳性表达主要位于肿瘤细胞的细胞质中,呈浅黄色或深黄色。
按染色强度计分:无染色计0分,轻度染色计1分,中度染色计2分,强染色计3分;按阳性染色细胞百分率计分:阳性细胞数小于或等于10%计0分,阳性细胞数>10%~25%计1分,阳性细胞数>25%~50%计2分,阳性细胞数大于50%计3分。然后将两类计分结果的乘积得分分为以下等级:0分为-,1~2分为+,3~4分为++,5~6分为+++。设定+~+++为阳性表达,-为阴性表达。
1.5统计学处理所有数据用SPSS13.0统计学软件进行处理,应用χ2检验分析HIF-1α和Rac1在各宫颈组织中的表达,应用Spearman等级相关性分析进行HIF-1α和Rac1的相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1HIF-1α及Rac1在正常宫颈组织、宫颈CIN组织和宫颈鳞状细胞癌组织中的表达HIF-1α及Rac1其在各组宫颈病变中表达情况见表1和图1。HIF-1α及Rac1在正常宫颈组织中无表达,HIF-1α在CINⅠ级、CINⅡ~Ⅲ级、宫颈鳞状细胞癌中的阳性表达率(16.7%、56.7%、81.0%),差异有统计学意义(P<0.05)。
2.2HIF-1α及Rac1与宫颈鳞状细胞癌的组织学分级、分期及淋巴转移的关系在不同临床分期的宫颈鳞状细胞癌中,HIF-1α在Ⅰ~Ⅱ期、Ⅲ~Ⅳ期的阳性表达率(78.3%vs. 91.7%)差异有统计学意义(P<0.05);Rac1在Ⅰ~Ⅱ期、Ⅲ~Ⅳ期的阳性表达率(73.9%vs. 91.7%)差异有统计学意义(P<0.05),随期别的进展而升高(表2)。
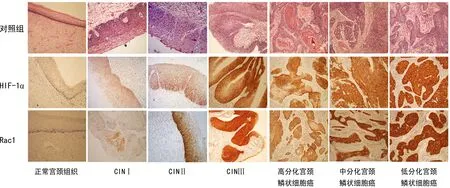
图1 HIF-1α及Rac1在正常宫颈组织、CIN组织和宫颈鳞状细胞癌组织中的表达(SP×100)

组别nHIF-1α阴性阳性阳性率(%)PRac1阴性阳性阳性率(%)P正常宫颈组织202000<0.052000<0.05CINⅠ1210216.71118.3CINⅡ~Ⅲ30131756.7141653.3宫颈鳞状细胞癌组织58114781.0134577.6
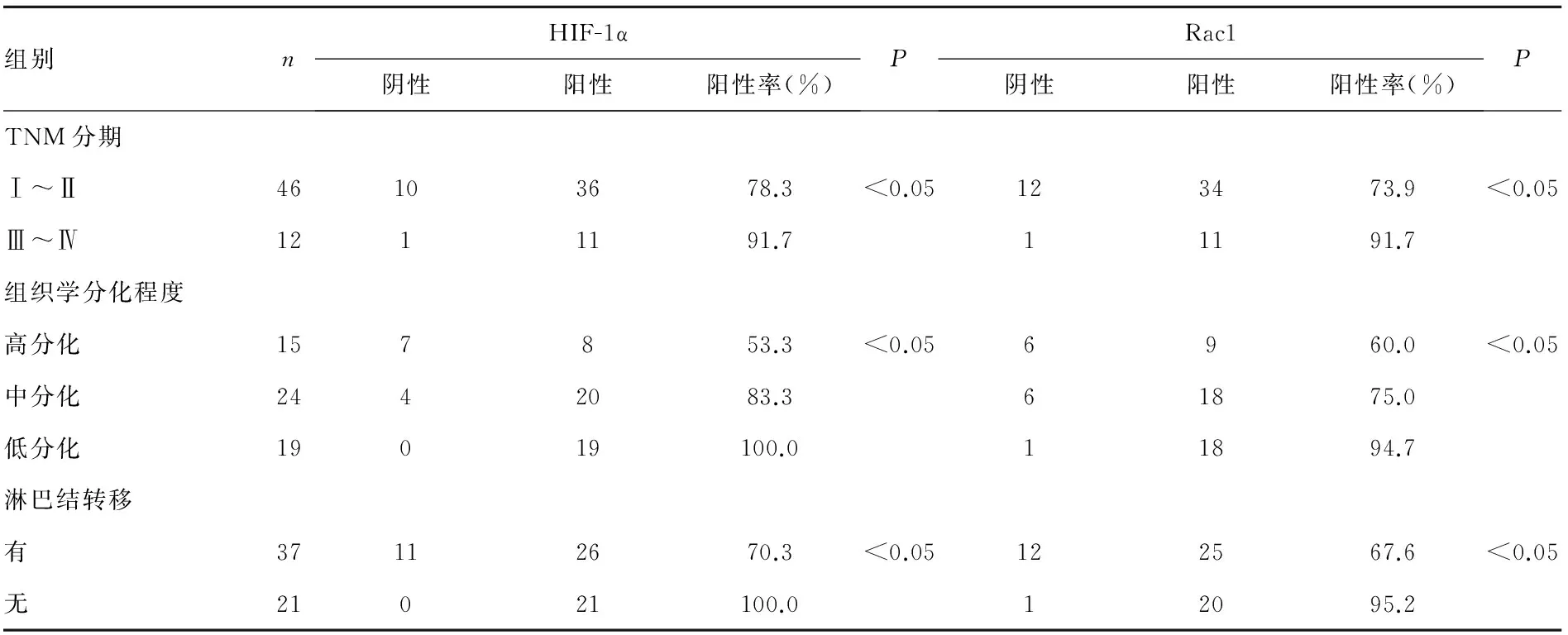
表2 HIF-1α和Rac1蛋白表达与宫颈鳞状细胞癌临床病理特征的关系
Rac1在CINⅠ、CINⅡ~Ⅲ级、宫颈鳞状细胞癌的阳性表达率(8.3%、53.3%、77.6%),差异有统计学意义(P<0.05)。在不同组织学分化程度的宫颈鳞状细胞癌中,HIF-1α在低分化组、中分化组、高分化组的阳性表达率(100.0%、83.3%、53.3%)差异有统计学意义(P<0.05), Rac1在低分化组、中分化组、高分化组的阳性表达率(94.7%、75.0%、60.0%),差异有统计学意义(P<0.05)。58例宫颈鳞状细胞癌患者中,有淋巴结转移者的HIF-1α及Rac1阳性表达率均高于无淋巴结转移者。
2.3在宫颈CIN组织和宫颈鳞状细胞癌组织中HIF-1α和Rac1表达的相关性42例宫颈CIN组织中,Rac1和HIF-1α蛋白共同表达阳性14例,共同表达阴性20例,采用Spearman等级相关性分析,Rac1和HIF-1α蛋白的表达呈正相关(r=0.3,P<0.05)见表3。
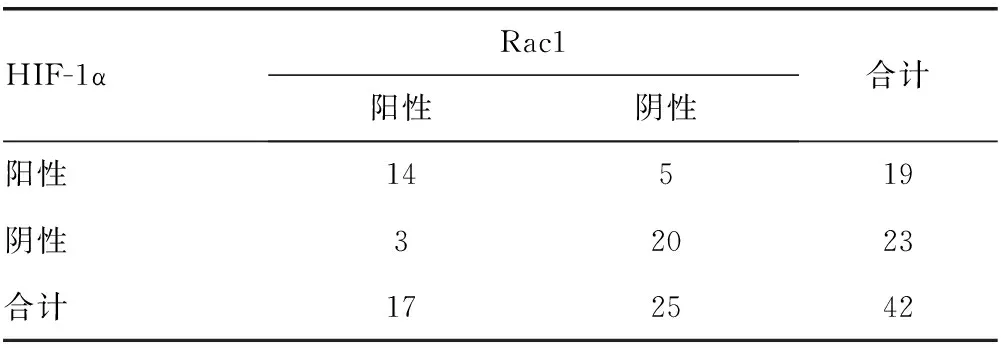
表3 宫颈CIN组织中HIF-1α和Rac1蛋白表达的关系(n)
58例宫颈鳞状细胞癌组织中,Rac1和HIF-1α蛋白共同表达阳性40例,共同表达阴性6例,采用Spearman等级相关性分析,Rac1和HIF-1α蛋白的表达呈正相关(r=0.3,P<0.05),见表4。

表4 宫颈鳞状细胞癌组织中HIF-1α和Rac1蛋白表达的关系(n)
3 讨 论
HIF-1α尽管在正常氧浓度下也表达,但很快可被泛素蛋白酶体系统所降解;而在缺氧状态时其降解过程被阻断,导致HIF-1α在核内蓄积,与β蛋白亚基结合,形成有活性的HIF-1,启动多种下游基因[5],使细胞适应缺氧状态,促进肿瘤细胞的生长和分裂,而且可通过减少有氧代谢中反应性氧类对细胞 DNA 复制的破坏,促进肿瘤的增殖和转移。
大量免疫组织化学实验已证明,HIF-1α 在人类多种肿瘤中表达增加,HIF-1α通过调节不同靶基因的转录活性及其自身的表达,参与肿瘤的增殖凋亡与侵袭转移等过程,其过度表达与恶性肿瘤的不良预后有关[6]。本实验研究结果也显示:HIF-1α蛋白在宫颈鳞状细胞癌组织中的表达远高于宫颈CIN组织及正常子宫颈组织,且宫颈鳞状细胞癌组织HIF-1α表达与浸润深度、淋巴结转移、临床分期相关,说明HIF-1α蛋白高表达的宫颈鳞状细胞癌具有更强的侵袭能力,提示HIF-1α其过度表达可能与宫颈癌不良预后有关,对其表达程度的检测具有重要的生物学和临床价值。
Rac-1 基因位于人染色体7p22,有Rac1、Rac2、Rac3 3个亚型。Rac1蛋白可广泛表达于机体各组织中,通过结合或水解GTP 核苷酸,在GDP 结合形式( 失活状态)与 GTP 结合形式( 激活状态) 之间相互转换[7]。肿瘤组织中活性形式的Rac1蛋白参与调节细胞丝状伪足的生成以及膜皱缩[7-9],调节肿瘤细胞的运动,影响肿瘤的生长。此外,Rac1还通过增加细胞内超氧化物阴离子,抑制肿瘤细胞发生凋亡[10],对肿瘤的发展及侵袭转移起着重要的作用。
目前大多数试验表明Rac1与人类恶性肿瘤的发生发展有着密切的关系,在多种恶性肿瘤中呈过表达,Rac1在肿瘤及其增殖、转移过程中起着重要作用[11]。本试验研究结果表明在宫颈鳞状细胞癌组织中Rac1的表达高于宫颈CIN组织,且与浸润深度、淋巴结转移、临床分期相关。宫颈CIN组织中高级别病变的Rac1表达高于低级别病变,高于正常宫颈组织。
近年来有研究发现在某些恶性肿瘤中存在HIF-1α和Rac1蛋白共同表达的情况, Rac1通过抑制VHL蛋白水平可在低氧环境中增加HIF-1α的稳定性,进一步促进肿瘤血管的生成[12]。此外Rac1是HIF-1α的上游调控基因,Rac1可通过结合蛋白激酶调节缺氧引起的HIF-1及HIF-1 相关蛋白的磷酸化和氧化还原反应,从而参与HIF-1α的活化,促进其表达[13]。Rac1通过激活p38MAPK 活化HIF-1α末端活性区(TAD),从而提高了HIF-1的转录活性。DU等[14]研究发现Rac1在人类乳腺癌中能激活促进HIF-1α的表达。本研究分析显示, HIF-1α与Rac1的表达在宫颈癌前病变及宫颈鳞状细胞癌中呈正相关(r=0.3,P<0.05),且随宫颈病变的进展而变化的趋势也基本一致,提示HIF-1α与Rac1可能有着较密切的联系。
综上所述,HIF-1α和Rac1在宫颈癌前病变及宫颈鳞状细胞癌组织中的表达水平均明显增高,浸润深度越深,分化程度越低,表达水平越高。且在宫颈鳞状细胞癌组织中二者的表达呈正相关,提示在宫颈鳞状细胞癌的病理演变过程中,HIF-1α与Rac1相互间可能存在协同调控作用,促进了宫颈癌的进展及转移。分析二者协同作用的机制可能为肿瘤组织中Rac1通过激活p38MAPK活化HIF-1α末端活性区(TAD),提高了HIF-1α的转录活性[4],且通过抑制VHL蛋白水平在低氧状态下增加了HIF-1α的稳定性[15]。
总之,HIF-1α及Rac1的联合检测有助于判断宫颈上皮内瘤变的病变程度,评价宫颈鳞状细胞癌的生物学行为和预后,为其早期诊断和治疗提供理论依据。
[1]Brown JM.Exploiting the hypoxic cancer cell:mechanisms and therapeutic strategies[J].Mol Med Tod,2000,6(4):157-162.
[2]Gómez Del Pulgar T,Bandrés E,Espina C,et al.Differential expression of Rac1 identifies its target genes and its contribution to progression of colorectal cancer[J].Int J Biochem Cell Biol,2007,39(12):2289-2302.
[3]Turcotte S,Desrosiers RR,Béliveau R.HIF-1alpha mRNA and protein upregulation involves Rho GTPase expression during hypoxia in renal cell carcinoma[J].J Cell Sci,2003,116(Pt 11):2247-2260.
[4]Hirota K,Semenza GL.Rac1 activity is required for the activation of hypoxia-inducible factor 1[J].J Biol Chem,2001,276(24):21166-21172.
[5]Semenza GL.Targeting HIF-1 for cancer therapy[J].Nat Rev Cancer,2003,3(10):721-732.
[6]周明利.HlF-1α与EMT在肿瘤中的作用及意义研究进展[J].中国普通外科杂志,2012,21(9):1132-1136.
[7]Heasman SJ,Ridley AJ.Mammalian Rho GTPases:new insights into their functions from in vivo studies[J].Nat Rev Mol Cell Biol,2008,9(9):690-701.
[8]Ridley AJ,Schwartz MA,Burridge K,et al.Cell migration:Integrating signals from front to back[J].Science,2003,302(5651):1704-1709.
[9]Del Pozo MA,Alderson NB,Kiosses WB,et al.Integrins regulate Rac targeting by internalization of membrane domains[J].Science,2004,303(5659):839-842.
[10]Pervaiz S,Cao J,Chao OS,et al.Activation of the RacGTPase inhibits apoptosis in human tumor cells[J].Oncogene,2001,20(43):6263-6268.
[11]田锐,郭兴军,江建新,等.Rac1对胰腺癌增殖的影响及其机制[J].世界华人消化杂志,2013,21(12):1070-1074.
[12]Terence K,Ronnie T,Anthony P,et al.Rac activation is associated with hepatocellular carcinoma metastasis by up-regulation of vascular endothelial growth factor expression[J].Clin Cancer Res,2006,12(17):5082-5089.
[13]郝晓凤,惠延年,王雨生,等.Rac1和HIF-1在激光诱导小鼠脉络膜新生血管模型组织中的表达[J].眼科新进展,2007,27(6):401-404.
[14]Du J,Xu R,Hu Z,et al.PI3K and ERK-induced Rac1 activation mediates hypoxia-induced HIF-1α expression in MCF-7 breast cancer cells[J].PLoS One,2011,6(9):e25213.
[15]Terence K,Ronnie T,Anthony P,et al.Rac activation is associated with hepatocellular carcinoma metastasis by up-regulation of vascular endothelial growth factor expression[J].Clin Canaer Res,2006,12(17):5082-5089.
武汉市卫生局临床医学科研项目资助(WX11B05)。作者简介:陈瑛(1979-),主治医师,硕士,主要从事妇科肿瘤方面的研究。△
,E-mail:zhangqh66@qq.com。
R711.74
B
1671-8348(2016)20-2828-04
2016-02-11
2016-04-18)
·经验交流·doi:10.3969/j.issn.1671-8348.2016.20.030

