氧气浓度对水稻土N2O排放的影响①
杨艳菊,蔡祖聪,2,3*,张金波,2,3( 虚拟地理环境教育部重点实验室(南京师范大学),南京 20023;2 江苏省地理环境演化国家重点实验室培育建设点,南京 20023;3 江苏省地理信息资源开发与利用协同创新中心,南京 20023)
氧气浓度对水稻土N2O排放的影响①
杨艳菊1,蔡祖聪1,2,3*,张金波1,2,3
(1 虚拟地理环境教育部重点实验室(南京师范大学),南京 210023;2 江苏省地理环境演化国家重点实验室培育建设点,南京 210023;3 江苏省地理信息资源开发与利用协同创新中心,南京 210023)
摘 要:通过室内模拟试验,在25℃,60% 田间持水量条件下,研究了氧气浓度(200、100 和20 ml/L)和铵态氮浓度(10、30和50 mg/kg)对6个水稻土(pH 5.23 ~ 7.83,黏粒含量71.0 ~ 522 g/kg)N2O排放的影响。结果表明:供试水稻土N2O排放通量随铵态氮浓度的增加、氧气浓度的下降而增加。逐步回归分析表明,N2O累积排放量与铵态氮含量、土壤有机碳含量、黏粒含量呈正相关关系,与氧气浓度呈负相关关系(R2=0.845,P<0.01)。氧气浓度下降增加N2O排放可能与硝化产物中N2O比例增加和反硝化作用加强有关,但不同氧气浓度条件下各N2O产生过程的贡献还需进一步研究。
关键词:氧气浓度;N2O;铵态氮;黏粒含量;水稻土
氧化亚氮(N2O)因其具有较强的增温潜势(百年尺度上是CO2的298倍)、大气中滞留时间长(生命周期为 121年)、破坏臭氧层、增加地面紫外辐射等特点而被认为是目前最具有环境破坏性的温室气体[1-2]。农田土壤是N2O排放的主要来源之一[3-4]。
氧气是影响土壤氮转化过程及N2O排放的重要因素。土壤硝态氮的反硝化过程是厌氧过程,仅在低氧或厌氧的条件下发生,氧气主要通过影响反硝化作用相关的酶活性而影响其速率和产物组成比例[5]。研究表明,当土壤中的氧气浓度降低到5 ml/L以下时反硝化微生物的活性增强[6]。最近的研究表明,反硝化微生物可以在较大的氧气范围内发生并产生 N2O[7]。硝化过程与反硝化过程相反,是严格的好氧过程。硝化微生物及其相关的酶类必须在有氧气存在的情况下才能进行硝化作用[8]。随着氧气含量下降,硝化作用产物中N2O的比例升高[9]。
在我国的水稻生产实践中,在水稻生长期,通常采用间歇灌溉方式。这一水分管理特点导致稻田土壤中氧气浓度不仅在空间上有很大的分异,而且在时间上也有很大的变化。氧气浓度通过直接影响硝化、反硝化过程的反应速率和 N2O在产物中的比例而影响N2O排放量。施入稻田的氮肥以铵态氮肥或产生铵态氮的氮肥为主,铵态氮肥在有氧气的微区发生硝化作用,产生的硝态氮通过扩散过程进入周围厌氧区域而发生反硝化作用,释放 N2O、N2等气体。这一过程称为成对硝化和反硝化作用(coupled nitrification and denitrification)[10]。与其他农业土壤相比,成对硝化与反硝化过程是稻田土壤N2O的主要来源,占稻田总排放量的 30% 以上[11]。成对硝化与反硝化作用的强度受硝化速率控制[12],氧气对硝化速率起着决定性的作用,所以氧气也是影响稻田成对硝化和反硝化过程及其气体产物的重要因素。过去一般认为,稻田长期处于淹水状态,氧气浓度低,硝化作用受到限制,加之土壤还原性较强,反硝化作用进行得较为彻底,所以稻田土壤排放的含氮气体以N2为主[13]。但田间观测结果表明,稻田土壤排放的N2O也不可以忽略并且受氧气浓度影响较大[14]。本文研究不同氧气浓度条件下水稻土N2O排放的规律,为采取适当的生产管理措施减少稻田N2O排放提供科学依据。
1 材料与方法
1.1 供试土壤
水稻土作为人为土,在我国分布范围较为广泛,基本理化性质差异较大。为使试验结果更具代表性,本文选择不同质地和pH的水稻土作为研究对象,研究其在不同氧气浓度条件下N2O的排放规律。
供试水稻土于2014年3月水稻种植前,分别采自江苏淮安(33°43′N, 118°86′E),句容(31°56′N, 119°10′E)、宜兴(31°17′N, 119°54′E),四川盐亭(31°16′N,105°27′E),江西鹰潭(28°15′N,116°55′E)和龙虎山(28°15′N,116°55´E)的耕层土壤。江苏淮安、四川盐亭、江苏宜兴、江苏句容、江西鹰潭和江西龙虎山水稻土分别发育于湖泊沉积物、紫砂岩、冲积土、下蜀黄土、第四纪黏土和第三纪红砂岩。土壤样品采集后,风干、过2 mm筛备用。江苏淮安、句容、宜兴水稻土分别记为HA、JR、YX,四川盐亭和江西鹰潭及龙虎山的水稻土分别记为SC、JC、JS。供试土壤的理化性质见表1。

表 1 供试水稻土的理化性状Table 1 Physico-chemical properties of tested paddy soils
1.2 培养试验
本试验采用双因素三水平的完全随机区组实验设计,双因素分别为氧气浓度和铵态氮添加量。氧气浓度设置为200 ml/L(O1)、100 ml/L(O2) 和20 ml/L(O3),铵态氮浓度(以纯 N计)分别为 10 (N1)、30(N2)、50(N3)mg/kg土壤,加入的铵态氮肥为硫酸铵。
称取20 g(干土重)的风干土壤样品于250 ml三角瓶中,调节至50% 田间持水量,用带孔保鲜膜封口,于25℃恒温培养箱内预培养4 天。预培养结束后,每个三角瓶中加入设计的铵态氮浓度,加入蒸馏水调节土壤含水量到60% 最大持水量。迅速用橡胶塞及704硅胶密封三角瓶(试验过程中三角瓶保持密闭,直到试验结束),抽真空后,向瓶内注入试验设计氧气浓度的空气,反复3次。为在培养过程中保持瓶内氧气浓度为试验设计浓度,每天固定时间用含试验设计氧气浓度的气体更换瓶内气体,在 25℃恒温培养箱内培养7 天。
1.3 气体的采集与测定
分别在培养的1、2、3、5和7天采集气体样品。采集气体样品前,用含设计氧气浓度的气体更换瓶内气体,静置6 h后,用气密性注射器采集20 ml气体,每一处理,每次采集3个培养瓶,作为3次重复,气体采集后立即测定N2O浓度(以纯N计),测定方法见文献[15]。
1.4 计算方法及数据处理
N2O排放通量及累积排放量的计算参照文献[16]。
数据分析使用SPSS16.0软件,采用多因素方差分析(Univariate-way ANOVA)和最小显著差异法(LSD)比较不同处理的 N2O排放通量与累积排放量的差异。Pearson 相关系数检验法判断土壤N2O平均排放通量与影响因素的相关性及显著水平。用逐步回归分析建立土壤N2O累积排放量与各影响因素之间的回归方程。使用Origin 9.0软件绘图。
2 结果与分析
2.1 N2O 排放通量
由于供试土壤和处理较多,且添加相同铵态氮浓度时不同氧气浓度处理的 N2O排放通量变化规律相同,为使结果更加清晰,本文仅列出铵态氮添加量为30 mg/kg土壤(N2)时,不同氧气浓度条件下N2O排放通量随培养时间的变化(图1)。
从图1中可以看出,当铵态氮添加量为30 mg/kg时,供试水稻土N2O排放通量在0.247 ~ 2.872 μg/(kg·h)。氧气浓度为20 ml/L (O3) 的处理,N2O排放通量高于氧气浓度为100 ml/L(O2)和200 ml/L(O1)的处理,这种差异在培养的第5天开始逐渐缩小。氧气浓度为100 ml/L(O2) 的处理,除SC水稻土外,N2O排放通量高于氧气浓度为200 ml/L(O1)处理。氧气浓度对HA和SC水稻土N2O排放通量的影响大于pH较低的水稻土。

图1 添加30 mg/kg 铵态氮水稻土在25℃和60%WHC水分下培养,N2O 排放通量随时间的变化Fig.1 Temporal variations of N2O fluxes during incubation of tested paddy soils added with 30 mg/kg as NH4+-N before incubation at 25℃ and 60%WHC
2.2 N2O 累积排放量
供试条件下,水稻土N2O累积排放量在16 ~365 μg/kg,随着添加的铵态氮浓度增加而增加(图2)。除JC和JS水稻土铵态氮添加量为10 mg/kg(N1)处理外,相同铵态氮添加水平下,N2O累积排放量随氧气浓度的下降而增加,差异极显著(P<0.01,表2)。铵态氮添加浓度与氧气浓度对SC水稻土的N2O累积排放量具有显著的交互作用(P<0.05),但在其余水稻土上,交互作用均不显著(P>0.05,表2)。
2.3 影响N2O排放的因素
将同一供试土壤不同处理的 N2O累积排放量进行平均,作为土壤平均 N2O累积排放量。通过分析土壤理化性质与平均 N2O累积排放量之间的关系可知,平均N2O累积排放量与土壤pH、全氮含量、有机碳含量和土壤黏粒含量均呈正相关关系,决定系数分别为0.36、0.59、0.72和0.62(表3),其中土壤有机碳含量与平均N2O累积排放量间的相关系数达到显著水平(P<0.05)。这说明土壤有机碳含量是影响水稻土N2O排放的重要因素。
以各土壤各处理的N2O累积排放量为因变量,添加铵态氮浓度、氧气浓度和土壤性质为自变量进行逐步回归分析,结果表明在显著性为 P=0.05水平上,N2O累积排放量与铵态氮添加量、氧气浓度及土壤性质可建立如下回归方程:Y=35.564 + 5.384X1-4.440X2+ 1.285X3+0.843X4(R2=0.845, P<0.01),式中:Y为N2O累积排放量;X1为添加的初始铵态氮浓度(mg/kg);X2为氧气浓度(ml/L);X3为土壤有机碳含量(g/kg);X4为土壤黏粒含量(g/kg)。结果表明,添加的铵态氮浓度、氧气浓度、土壤有机碳含量和黏粒含量是影响稻田土壤N2O累积排放量的重要因素。
3 讨论
3.1 氧气浓度对水稻土N2O排放的影响
本文的试验结果表明,当氧气浓度从 200 ml/L降低到20 ml/L 时,供试水稻土N2O排放量显著增加,这一规律与前人的研究结果一致[17-19]。氧气浓度降低,N2O排放量增加,是土壤产生 N2O的多个过程及相关微生物酶共同作用的结果[18]。在氧气充足的条件下,土壤氨单加氧酶活性较高,有利于硝化作用的进行,且最终产物为硝态氮,不利于硝化作用产生N2O;当氧气浓度为零,土壤处于完全厌氧的环境,氨单加氧酶活性受到抑制,N2O还原酶活性较高,有利于反硝化作用的彻底进行并释放N2,这种情况也不利于反硝化作用生成N2O。当氧气含量处于中间水平时,硝化作用、反硝化作用同时产生N2O,土壤排放较多的N2O[19]。在200 ml/L氧气浓度下,土壤硝化作用进行彻底,N2O排放较少。100 ml/L 和20 ml/L 浓度与完全厌氧条件相比则处于中间水平,有利于硝化和反硝化过程同时产生N2O,所以,氧气浓度从200 ml/L 降低到20 ml/L,水稻土N2O排放增加。
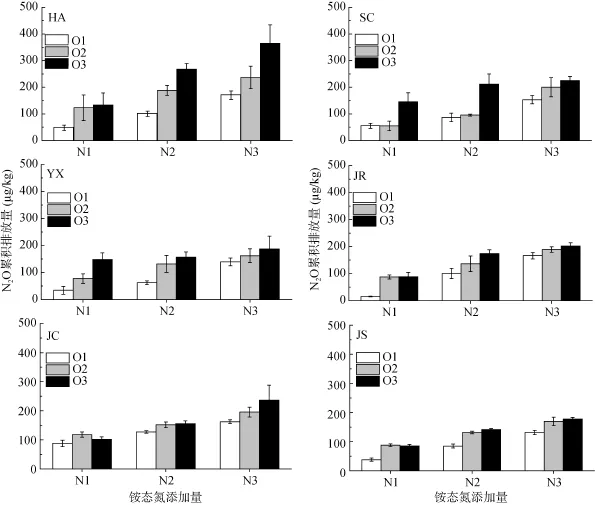
图2 培养过程中土壤N2O 累积排放量Fig.2 N2O cumulative emissions from soils during 7d incubation

表2 氧气浓度(O)和添加铵态氮浓度(N)对N2O累积排放量的统计分析结果Table 2 Significance of effects of oxygen content (O) and NH4+addition rate (N) on N2O accumulative emissions

表3 土壤理化性质与平均N2O累积排放量的关系Table 3 Relationship between soil physico-chemical properties and mean N2O accumulative emission
文献报道,添加硫酸铵50 mg/kg的旱地土壤,培养2天,氧气浓度由210 ml/L下降到 30 ml/L时,N2O排放量由16 μg/kg增加到311 μg/kg,增加了17倍[7]。森林土壤氧气浓度由200 ml/L 降低20 ml/L时,N2O排放量也增加了 10 ~ 15倍[20-21]。本实验的供试水稻土壤,氧气浓度由200 ml/L 降低到20 ml/L,N2O的排放量仅增加了0.2 ~ 4.6倍,远低于旱地土壤和森林土壤的增加幅度。这一结果说明,水稻土 N2O排放量对氧气浓度变化的敏感程度明显低于旱地土壤和森林土壤。这可能与土壤微生物对环境的适应性有关[22]。N2O排放过程主要由相关的微生物及酶调控,研究发现,土壤微生物对温度、土壤重金属含量、土壤的酸碱度等均能产生适应性[23-25]。水稻土与旱地土壤和森林土壤相比,长期处于淹水状态,氧气浓度低于通气状况良好的旱地土壤和森林土壤。长期淹水条件下的N2O产生微生物,如硝化微生物可能对低氧的环境产生了一定的适应性,导致水稻土 N2O排放对氧气浓度变化的敏感程度低于旱地土壤和森林土壤。但由于本实验设计的最低氧气浓度仅为20 ml/L,不能确定 N2O排放量最大时氧气的临界浓度,同时也不能确定在不同的氧气浓度下,硝化作用和反硝化作用对 N2O排放的相对贡献,对此还需要进一步的研究。
3.2 铵态氮浓度、土壤理化性状对水稻土N2O排放的影响
N2O累积排放量随铵态氮添加量、土壤全氮含量和有机碳含量的增加而增加,这与前人的研究结果一致[26-27]。土壤的pH是影响硝化和反硝化作用及N2O在其产物中比例的重要因素之一[28]。在本试验中,N2O累积排放量与土壤pH呈正相关关系但相关系数并未达到显著水平(表3),这可能是因为土壤N2O的产生及排放过程是个复杂同时受多个因素影响的过程,本试验中无机氮含量、氧气浓度和有机碳含量对N2O产生和排放过程的影响可能在一定程度上掩盖了pH对N2O排放的影响,导致其相关性不显著。土壤pH同时影响硝化速率和硝化产物中N2O的比例,较高的土壤pH硝化速率较大,但N2O在硝化产物中的比例较低;相反,较低pH的土壤硝化速率较小,但 N2O在硝化产物中的比例较大。这种消长关系也是土壤pH与N2O排放量相关关系不显著的可能原因[29-30]。随着土壤黏粒含量的增加,N2O累积排放量增加,这与徐华等[31]的研究的结果相反。造成这种现象的原因可能是: ①黏粒含量高的土壤比黏粒含量低的土壤有机质含量高(表1),可为产生N2O的微生物提供更多的有机质。②本试验供试土壤在三角瓶中的厚度较薄,与田间试验相比,这样的土层厚度并不能使质地对 N2O气体扩散速率的影响很好地体现出来。
4 结论
在60% 最大持水量条件下,水稻土N2O排放通量随添加铵态氮浓度、氧气含量的下降而增加。土壤有机碳含量是影响稻田 N2O排放的重要因素。逐步回归分析表明,N2O累积排放量与铵态氮添加浓度、氧气浓度、土壤有机碳含量、黏粒含量间呈极显著的线性关系(R2=0.845, P<0.01)。但逐步回归分析并不能很好地解释各因素与 N2O排放之间复杂的关系,在不同的氧气浓度下N2O产生的过程及其相对贡献,还需进一步研究,以确定其产生机理,在源头上减少稻田N2O排放。
参考文献:
[1] IPCC.Contribution of working group Ⅰ to the fifth to the assessment report of the intergovernmental panel on climate change.Climate Change 2013: The Physical Science Basis[R].Cambridge, United Kingdom and New York NY, USA: Cambridge University Press
[2] 孙海军, 闵炬, 施卫明, 等.稻麦轮作体系养殖肥水灌溉对产量、氨挥发和氧化亚氮排放的影响[J].土壤, 2015,47(3): 503-508
[3] Zhang Y F, Sheng J, Wang Z C, et al.Nitrous oxide and methane emissions from a Chinese wheat-rice cropping system under different tillage practices during the wheat-growing season[J].Soil and Tillage Research, 2015,146: 261-269
[4] Pandey A, Mai V T, Vu D Q, et al.Organic matter and water management strategies to reduce methane and nitrous oxide emissions from rice paddies in Vietnam[J].Agriculture, Ecosystems and Environment, 2014, 186: 77-85
[5] Tiedje J M.Ecology of denitrification and dissimilatory nitrate reduction to ammonium[M]//Zehnder A J B.Biology of anaerobic microorganisms.New York:Wiley,1988: 179-244
[6] Ye R W, Averill B A, Tiedje J M.Denitrificationproduction and consumption of nitric oxide[J].Applied and Environmental Microbiology, 1994, 60: 1 053-1 058
[7] Zhu X, Burger M, Doane T A, et al.Ammonia oxidation pathways and nitrifier denitrification are significant sources of N2O and NO under low oxygen availability[J].Proceeding of the National Academy of Sciences of the United States of America, 2013, 110: 6 328-6 333
[8] Anderson I C, Poth M, Homstead J, et al.A comparison of NO and N2O production by the autotrophic nitrifier Nitrosomonas europaea and the heterotrophic nitrifier Alcaligenes faecalis[J].Applied and Environmental Microbiology, 1993, 59: 3 525-3 533
[9] Wood P.Monooxygenase and free radical mechanisms for biological ammonia oxidation[M]// Cole J A, Ferguson S J.The nitrogen and sulfur cycles.Cambridge: Cambridge University Press, 1987: 219-243
[10] Kremen A, Bear J, Shavit U, et al.Model demonstrating the potential for coupled nitrification denitrification in soil aggregates[J].Environment Science and Technology, 2005,39: 4 180-4 188
[11] Carrasco D, Fernández-valiente, Ariosa Y, et al.Measurement of coupled nitrification-denitrification in paddy fields affected by Terrazole, a nitrification inhibitor[J].Biology Fertility of Soils, 2004, 39: 186-192
[12] 蔡祖聪.尿素和 KNO3对水稻土无机氮转化过程和产物的影响 .Ⅰ 无机氮转化过程[J].土壤学报, 2003, 40(2),239-245
[13] Granli T, Bøckman O C.Nitrous oxide from agriculture[J].Norwegian Journal of Agricultural Science, 1994, 12: 128-130
[14] Cai Z C, Xing G X, Yan X Y, et al.Methane and nitrous oxide emissions from rice paddy fields as affected by nitrogen fertilizers and water management[J].Plant and Soil, 1997, 196(1): 7-14
[15] Zhu T B, Dang Q, Zhang J B, et al.Reductive soil disinfestation (RSD) alters gross N transformation rayes and reduces NO and N2O emissions in degraded vegetables soils[J].Plant and Soil, 2014, 382: 269-280
[16] Cai Z C, Zhang J B, Zhu T B, et al.Stimulation of NO and N2O emissions from soils by SO2deposition[J].Global Change Biology, 2012, 18: 2 280-2 291
[17] Khalil K, Mary B, Rebault P.Nitrous oxide production by nitrification and denitrification in soil aggregates as affected by O2concentration[J].Soil Biology and Biochemistry, 2004, 36: 687-699
[18] Bloomann A, Conrad R.Influence of O2availability on NO and N2O release by nitrification and denitrification in soils[J].Global Change Biology, 1998, 4: 387-396
[19] Baggs E M.Soil microbial sources of nitrous oxide: recent advances in knowledge, emerging challenges and future direction[J].Environmental Sustainability, 2011, 3: 321-327
[20] Burgin A J, Groffman P M.Soil O2controls denitrification rates and N2O yield in a riparian wetland[J].Journal of Geophysical Research, 2012, 1: 1-10
[21] Krämer M, Courad R.Influence of oxygen on production and consumption of nitric oxide in soil[J].Biology and Fertility of Soils, 1991, 11: 38-42
[22] Myers R J K.Temperature effects on ammonification and nitrification in a tropical soil[J].Soil Biology and Biochemistry, 1975, 7: 83-87
[23] Eno C.Nitrate production in the field by incubating the soil in polyethylene bags[J].Proceedings of Soil Science Society of America, 1960, 24: 277-279
[24] Ruyters S, Mertens J, Sprigael D, et al.Co-tolerance to zinc and copper of the soil nitrifying community and its relationship with the community structure[J].Soil Biology and Biochemistry, 2012, 44: 75-80
[25] Wang B Z, Zheng Y, Huang R, et al.Active ammonia oxidizers in an acidic soil are phylogenetically closely related to neutrophilic archaeon[J]. Applied and Environmental Microbiology, 2014, 80: 1 684-1 691
[26] Huang T, Gao B, Hu X K, et al.Ammonia-oxidation as an engine to generate nitrous oxide in an intensively managed calcareous Fluvo-aquic soil[J].Scientific Reports, 2014, 4: 3 950-3 959
[27] 李露, 周自强, 潘晓健, 等.不同时期施用生物碳对稻田 N2O和 CH4排放的影响[J].土壤学报, 2015, 52(4): 839-847
[28] De Boer W, Kowalchuk G A.Nitrification in acid soils: microorganisms and mechanisms[J].Soil Biology and Biochemistry, 2001, 33: 853-866
[29] Pål T M, Peter D, Lars R B.The N2O product ratio of nitrification and its dependence on long-term changes in soil pH[J].Soil Biology and Biochemistry, 2007, 39: 2 048-2 057
[30] Martikainen P J, De Boer W.Nitrous oxide production and nitrification in acidic soil from a Dutch coniferous forest[J].Soil Biology and Biochemistry, 1993, 25: 343-347
[31] 徐华, 邢光熹, 蔡祖聪, 等.土壤水分状况和质地对稻田N2O排放的影响[J].土壤学报, 2000, 37(4): 499-515
中图分类号:S153
DOI:10.13758/j.cnki.tr.2016.03.019
基金项目:①国家自然科学基金项目(41330744)、江苏省2014年度普通高校研究生科研创新计划项目(KYZZ_0212)、江苏省自然科学基金项目(BK20140062)和江苏高校优势学科建设工程基金资助项目(PAPD,164320H116)资助。
* 通讯作者(zccai@njnu.edu.cn)
作者简介:杨艳菊(1986—),女,河北唐山人,博士研究生,主要从事土壤氮转化的研究。E-mail:tsyangyanju@126.com
Effects of Oxygen Concentration on Nitrous Oxide Emissions from Paddy Soils
YANG Yanju1, CAI Zucong1, 2, 3 *, ZHANG Jinbo1, 2, 3
(1 Key Laboratory of Virtual Geographical Enviroment, Ministry of Education (Nanjing Normal University), Nanjing 210023,China; 2 State Key Laboratory Cultivation Base of Geographical Environment Evolution (Jiangsu Province), Nanjing 210023,China; 3 Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application,Nanjing 210023, China)
Abstract:In order to explore the effects of oxygen concentration and ammonium content on nitrous oxide emissions from paddy soils, six paddy soils with clay content ranged from 71.0 g/kg to 522 g/kg and pH ranged from 5.23 to 7.83 were collected in China.All soils were incubated at 25℃ and 60% water holding capacity in laboratory after added ammonium at N 10, 30,50 mg/kg soil and replaced the headspace gases with stock gases which oxygen concentrations were 200 ml/L, 100 ml/L, and 20 ml/L,respectively.The results showed that N2O emission flux increased with the increase of initial ammonium content but decreased with the increase of oxygen concentration.Stepwise regression analysis indicated that N2O accumulative emission was positively linearly correlated with the initial ammonium content, soil organic carbon and clay content but negatively with oxygen content (R2=0.845, P<0.01).The negative relationship between N2O emission and O2concentration might be attributed to the increases in N2O ratio in nitrification products and denitrification rate with the decrease in O2concentration.However, the effect of O2concentration on the relative contributions of nitrification and denitrification processes to N2O emissions from paddy soils need to be explored further.
Key words:Oxygen content; Nitrous oxide; Ammonium-N; Soil clay content; Paddy soils

