生物炭、秸秆和有机肥对砂姜黑土改性效果的对比研究①
高学振,张丛志,张佳宝*,丁宁宁( 封丘农田生态系统国家实验站,土壤与农业可持续发展国家重点实验室 (中国科学院南京土壤研究所), 南京 20008;2 中国科学院大学,北京 00049)
生物炭、秸秆和有机肥对砂姜黑土改性效果的对比研究①
高学振1,2,张丛志1,张佳宝1*,丁宁宁1
(1 封丘农田生态系统国家实验站,土壤与农业可持续发展国家重点实验室 (中国科学院南京土壤研究所), 南京 210008;2 中国科学院大学,北京 100049)
摘 要:砂姜黑土是广泛分布于我国黄淮海平原、具有多种障碍因子的典型中低产土壤。本研究通过小麦和玉米轮作盆栽试验,研究了生物炭、秸秆和有机肥3种有机物料对砂姜黑土性质的改良效果。结果表明:添加秸秆能显著提高土壤微生物生物量碳(MBC)和可溶性有机碳(DOC)含量,减小土壤线性延展系数(COLE);添加生物炭对砂姜黑土MBC和DOC影响不显著,但显著减小土壤COLE。对土壤磷脂脂肪酸(PLFA)含量的分析发现,添加秸秆显著提高了小麦灌浆期和玉米抽雄期土壤总磷脂脂肪酸、细菌、真菌、放线菌和腐生真菌的含量,而添加生物炭和有机肥对土壤总磷脂脂肪酸、细菌、真菌、放线菌、腐生真菌和真菌/细菌影响不显著。综上,生产实践中3种有机物料添加应根据各地砂姜黑土主要障碍因子不同而灵活选择。
关键词:生物炭;秸秆;有机肥;砂姜黑土;改性效果
砂姜黑土是广泛分布于我国黄淮海平原的中低产土壤,其主要原因是土壤过于黏重,土壤黏土矿物以2︰1型的膨胀性蒙脱石为主,从而引起一系列的不良物理、化学性状,表现为干收缩土壤坚实,湿膨胀土壤粘闭,适耕期短耕性差,土壤结构性能严重不良[1]。加之土壤有机质含量低,土壤养分供给能力不高,导致土壤极其贫瘠[2-3]。根据对第二次全国土壤普查数据分析,伴有上述不良障碍因子的砂姜黑土在安徽、河南、山东和江苏 4省的分布总面积约 228 万hm2,如果能有效消减这些障碍因子,增产潜力巨大。目前见诸报道的砂姜黑土改良措施主要有改进耕作方式,如在适耕期耕作,辅之少免耕、起垄种植等,以避免土壤结构恶化。另一方面通过外源物质进行改良,也具有一定的效果[4-6]。
外源物质包括秸秆、有机肥等,已有研究表明,施用秸秆和有机肥能改善土壤团聚程度、容重、保水保肥能力、养分状况等理化性质以及生物学性质[1,7-11]。生物炭是近年来广泛测试的一类新的外源物质,由于具有大比表面积、多孔性等特性,在土壤不良性状改良中得到广泛应用[12-15]。砂姜黑土因极为黏重,改良难度大,选择最有效的外源物质非常重要,但添加生物炭、有机肥和秸秆3种物质对砂姜黑土不良性状的改良效果鲜有报道,需要通过对比研究进行指导。因此,本研究以砂姜黑土为对象,通过冬小麦-夏玉米轮作盆栽试验,对比研究有机肥、秸秆和生物炭 3种有机物料单施与配施对砂姜黑土土壤性状的影响,以期为砂姜黑土地区土壤障碍因子的消减以及土壤肥力的培育提供指导。
1 材料与方法
1.1 试验材料
供试小麦和玉米品种分别为郑麦 9023、郑单958,有机肥为商品造粒鸡粪,生物炭为小麦秸秆或玉米秸秆与花生壳混合在500℃高温下焖烧制成,秸秆取自前季作物,即播种冬小麦时施用玉米秸秆,播种夏玉米时施用小麦秸秆。供试土壤采集于河南省周口市郸城县丁村乡高小庙村(33°38′N,115°23′E,海拔23 m)典型砂姜黑土0 ~ 20 cm 表层,其基本性质为:pH 7.6,阳离子交换量(CEC)209.9 mmol/kg,全氮 1.1 g/kg,全磷 1.0 g/kg,全钾15.3 g/kg,有机碳(OC)11.5 g/kg。土样经自然风干,过2 cm粗筛备用。试验用盆钵为高52.0 cm、上部内径44.6 cm、下部内径30.2 cm、底部有一出水孔的陶瓷盆。供试有机肥、生物炭和秸秆的基本理化性质见表1。
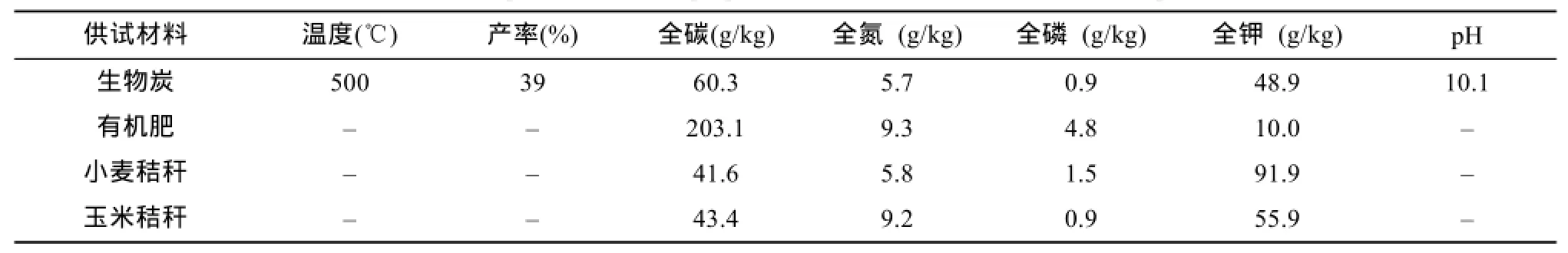
表1 供试生物炭、有机肥和秸秆的基本理化性质Table 1 Basic physicochemical properties of tested biochar, manure and crop stalks
1.2 试验设计
小麦盆栽试验时间为2012年10月20日到2013 年6月30日。设计为8个处理,即CK(对照,不添加改良物料),S(加秸秆),M(加有机肥),SM(加秸秆和有机肥),C(加生物炭),CS(加生物炭和秸秆),CM(加生物炭和有机肥),CSM(加生物炭、有机肥和秸秆);每个处理3次重复。每盆装土70 kg,添加改良物料的处理中,生物炭施用量为30 g/kg土,有机肥为1.04 g/kg土,玉米秸秆为10 g/kg土,这一添加比例是根据生产中每公顷实际生物炭、有机肥和秸秆用量计算而得。每个处理的化肥用量为:N 6.72 g/盆、P2O53.36 g/盆、K2O 3.36 g/盆,其中50% 的氮与全部磷钾肥以基肥施入,剩余氮用于小麦返青期追施。每盆播种小麦200粒,试验期间保持土壤湿度在田间持水量的65% 左右。
小麦收获后,将每个处理的土从盆中取出过筛,由于生物炭具有惰性,基本不分解,对生物炭处理的盆不再添加。而对于有机肥和秸秆处理的盆分别按1.04 g/kg土和10 g/kg土再次添加,重新装盆后用于玉米盆栽试验。每个处理的化肥用量为:N 13.44 g/盆、P2O56.72 g/盆、K2O 6.72 g /盆,其中50% 氮与全部磷钾肥以基肥施入,剩余氮肥于拔节期追施。每盆玉米播种 8粒,三叶期定植为 4棵。玉米试验时间为2013年7月20日到2013年10月29日,整个生育期间保持土壤湿度在田间持水量的65%左右。
1.3 样品采集与指标测定方法
选用微生物生物量碳(MBC)、可溶性碳(DOC)、磷脂脂肪酸(PLFAs)、土壤线性胀缩系数(COLE)、作物地上和地下生物量等指标,评价添加物对土壤微生物、理化性质以及作物生长的影响。具体方法如下:每盆分别用20 cm土钻于均匀分布的5点采集小麦返青、拔节、灌浆和成熟期,以及玉米拔节、抽雄、灌浆和成熟期的土壤,过2 mm湿筛用于MBC和DOC的测定。其中小麦灌浆期和玉米抽雄期分出部分土样冷冻干燥后用于测定PLFAs。
土壤MBC采用氯仿熏蒸-K2SO4浸提-重铬酸钾容量法进行测定;土壤 DOC采用 0.5 mol/L K2SO4浸提,0.45 μm水系滤膜过滤,重铬酸钾容量法进行测定[16]。土壤微生物 PLFAs提取方法采用修正的Bligh&Dyer方法[17],基本步骤如下:首先取2 g冷冻干燥后土样于干净的 Teflon试管内,用氯仿-甲醇-柠檬酸缓冲液(1︰0.2︰0.8,v/v/v)振荡提取脂类,通过SPE柱层析法分离得到 PLFAs,用 Frostegård等[18]的方法进行PLFAs系统命名。分离得到的PLFAs经碱性甲酯化后用气相色谱(Agilent6890)分析各种脂肪酸含量,用nmol/g来表示。COLE的测定是在玉米收获后,用100 mm(直径)×63.7(高)mm的环刀取土样,每盆重复5次,将所有环刀样在水中浸润36 h充分膨胀后,削平环刀样的上下土面,以 105℃烘干收缩,再用数显游标卡尺沿土柱圆周测量7个点高度进行平均,按公式计算COLE:COLE=L0/L105-1,其中,L0为环刀样初始高度(63.7 mm),L105:烘干样高度。
作物地上和地下生物量测定:小麦和玉米收获时,分别采集地上和地下部分,洗净后以80℃烘干,称量。
1.4 数据分析
测定数据用SPSS17.0进行分析。不同处理间的差异采用LSD法进行多重比较检验。
2 结果与讨论
2.1 不同处理作物生物量的变化
由表2可看出,各处理小麦地上生物量在238.4 ~266.2 g/盆。CM、CS、CSM处理小麦生物量比其他处理的生物量显著提高,而其他处理间没有显著性差异;地下生物量各处理间无明显差异。玉米地上生物量各处理间差异不显著,而地下生物量以添加生物炭处理(C、CS、CM、CSM)大于其他处理,且差异达显著水平(P<0.05)。

表2 小麦和玉米生物量(g/盆)Table 2 Biomasses of wheat and corn
2.2 不同处理土壤微生物生物量碳和可溶性有机碳含量的变化
2.2.1 小麦各生育期土壤 MBC和 DOC的含量变化 从表3可以看出,不同处理间小麦各生育期土壤的MBC含量有显著差异。在小麦返青期、拔节期和灌浆期,各添加秸秆和有机肥的处理均高于对照处理,添加秸秆的处理提高最显著。在返青期,与 CK相比,S、SM、CS、CSM处理MBC含量较高,其中在秸秆和有机肥配施下(SM)达到最大值174.9 mg/kg。拔节期时,各处理土壤MBC含量有所增加,其中处理CS、CSM、S和SM增加较为显著。到了小麦灌浆期时,所有处理MBC含量达到最大值,而后急剧下降。到成熟期时,除 SM处理外,其他处理土壤MBC含量均比返青期时低。由此可见,在小麦灌浆期时,土壤微生物活性最强。
土壤中DOC含量的变化与MBC含量的变化趋势类似。如表3所示,各处理土壤DOC含量在返青和拔节期呈增加趋势,灌浆或成熟期开始减小。处理间,返青期和拔节期,S、SM、CS、CSM处理高于其他处理,而在灌浆期,与除CK外的其他3个处理相比,DOC含量差异趋小。
小麦不同生育期土壤MBC和DOC含量的变化受温度、水分、作物生长和土壤生物活动等因素影响[19-23]。小麦返青之后,土壤温度逐步升高,小麦生命活动渐趋旺盛,根系分泌物增多等,都有利于土壤MBC和DOC含量增加;成熟期小麦生长停止,土壤含水量降低,MBC和DOC含量下降。不同处理间,加秸秆的4个处理,由于秸秆分解过程中,产生大量的活性有机碳[11],进入土壤后,使土壤DOC含量增加,从而给土壤微生物提供了充足的可直接利用的底物,促进土壤微生物生长和繁殖,因此土壤MBC含量也增加;而灌浆期土壤微生物活动强烈,消耗大量的DOC,从而使添加秸秆的4个处理DOC含量出现下降,而其他处理土壤微生物活动相对较弱,对DOC消耗相对较少;成熟期作物根部生命活动微弱,根系分泌物大量减少,土壤微生物活性减弱,对土壤有机物质中大分子有机物的降解减弱[24],因此各处理DOC均下降。
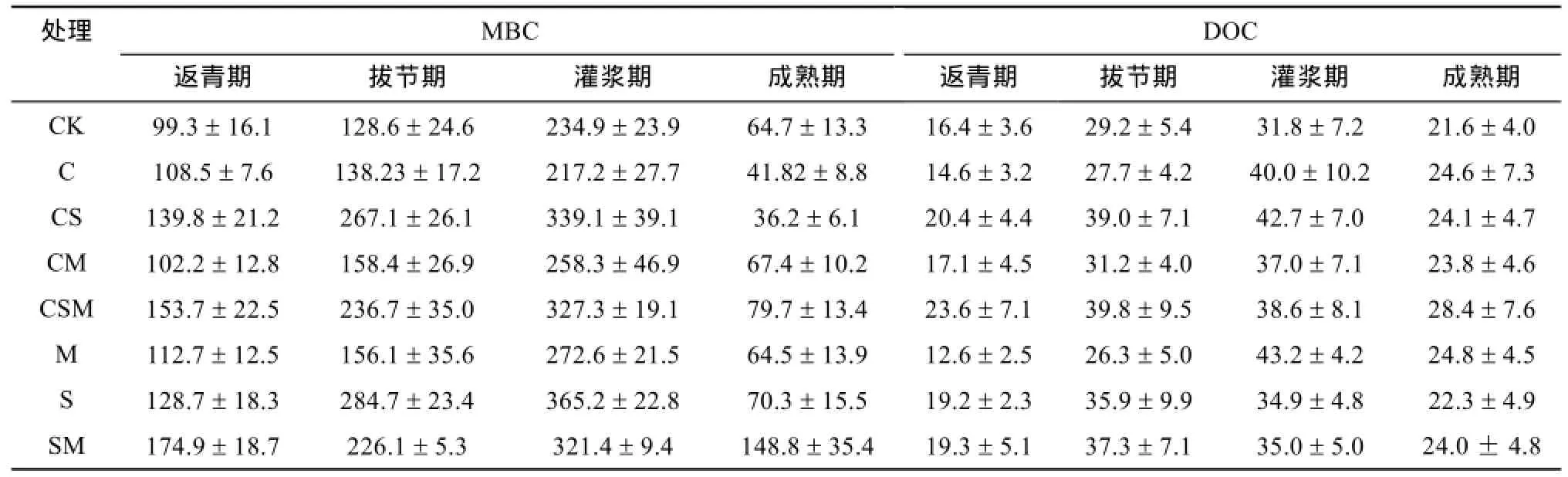
表3 小麦各生育期土壤MBC和DOC含量(mg/kg)Table 3 MBC and DOC contents in different wheat growth periods
2.2.2 玉米各生育期土壤 MBC与 DOC的含量变化 表4给出了玉米不同生育期土壤MBC及DOC含量的动态变化。由表4可看出,玉米各生育期土壤MBC含量的变化规律总体上与小麦各生育期的变化规律相同,基本都是随时间增加MBC含量升高,到灌浆期时达到最大,成熟期降低。与CK相比,加有秸秆的处理(CS、CSM、S、SM),其土壤MBC在各生育期均显著升高。而处理C、CM、M处理与CK相比无显著差异。
玉米各生育期土壤DOC含量的变化如表4所示。各处理土壤DOC含量在不同的生育期几乎都先升高后降低,并在灌浆期达到最大值。添加秸秆的4个处理S、SM、CS和CSM,在玉米各生育期土壤DOC含量均显著大于CK处理(S处理拔节期除外),尤其是在作物生长最旺盛的灌浆期,提高最为明显,分别比CK提高了41.0%、47.9%、57.1% 和48.0%。
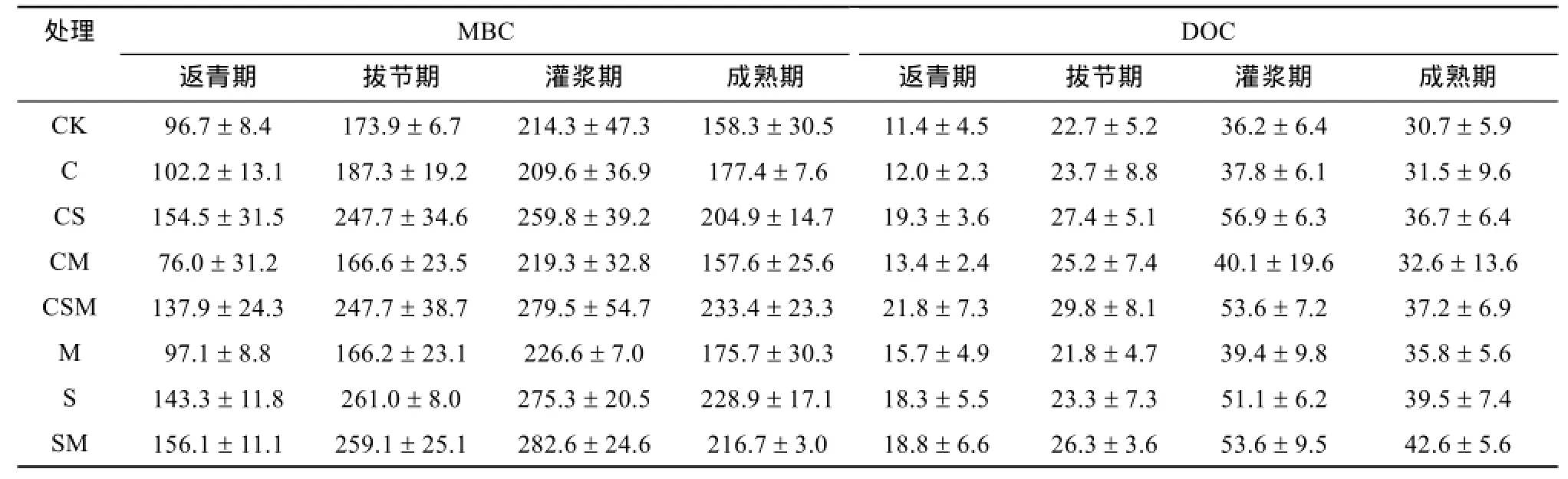
表4 玉米各生育期土壤MBC和DOC含量(mg/kg)Table 4 MBC and DOC contents in different corn growth periods
玉米不同生育期土壤MBC和DOC含量的变化与作物的生命活动规律基本一致,说明玉米生育期内土壤MBC和DOC含量可能主要受作物生命活动的影响。不同处理间,添加秸秆的4个处理土壤MBC和DOC含量显著高于其他处理,原因可能与小麦季类似。
2.3 不同处理土壤磷脂脂肪酸的变化
磷脂脂肪酸(PLFAs)是活体微生物细胞的重要组分,可以作为微生物生物量和群落结构变化的特征微生物“标记物”[25]。不同种类微生物PLFAs组成和含量差异大,可用来直接估价其微生物的生物量及群落结构[32]和定量地反映可繁殖或有潜在繁殖能力的不同类群微生物生物量和总生物量[33]。本试验分别测定了土壤微生物较为活跃的小麦灌浆期和玉米生长抽雄期土壤PLFAs,以14:0、i14:0、i15:0、a15:0、16:0、i16:0、16:1ω7c、16:1ω9c、17:0、i17:0、a17:0、cy17:0、17:1ω8c、18:0、18:1ω5c、18:1ω7c、cy19:0ω8c表征细菌[26-31];以16:1 ω5c、18:1 ω9c、18:2 ω6,9c表征真菌[26,29,31];以10Me16:0、10Me17:0、10Me18:0表征放线菌[30];以18:1 ω9c、18:2 ω6,9c表征腐生真菌[27]。不同处理下微生物生物量如表 5和表 6所示。
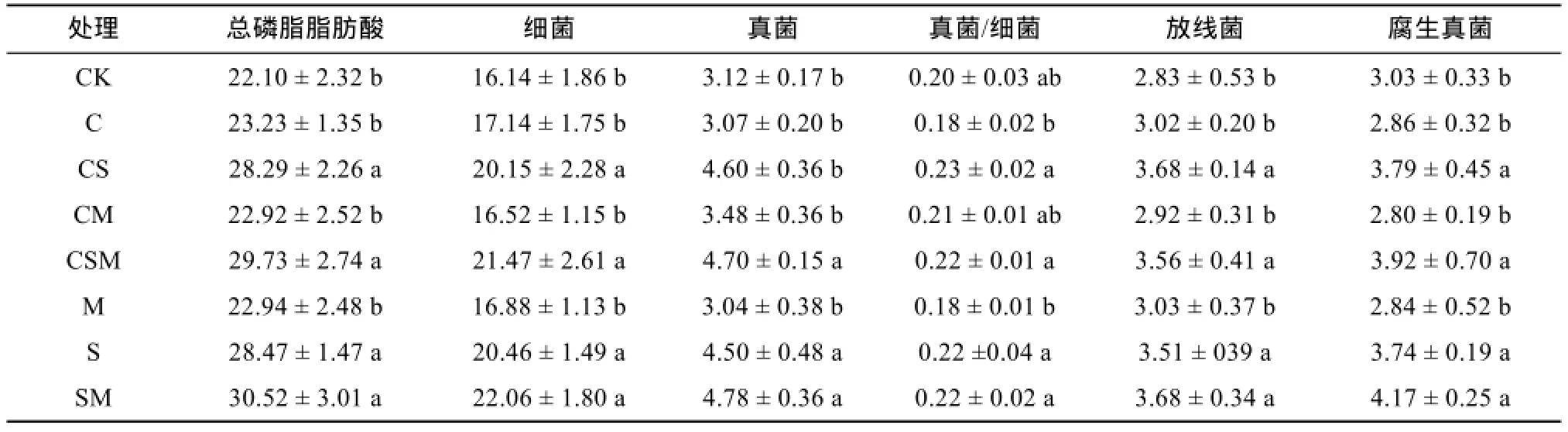
表5 小麦灌浆期土壤PLFAs含量(nmol/g)Table 5 Soil PLFAs contents at wheat grain-filling stage

表6 玉米抽雄期土壤磷脂脂肪酸含量(nmol/g)Table 6 Soil PLFAs contents at corn tasseling stage
小麦和玉米各处理中,添加秸秆均显著提高了供试土壤总磷脂脂肪酸、细菌、真菌、放线菌和腐生真菌含量。与CK相比,添加秸秆4个处理总磷脂脂肪酸含量小麦灌浆期和玉米抽雄期分别增加 28.1% ~38.2% 和 48.0% ~ 72.3%;土壤细菌含量分别增加24.8% ~ 36.7% 和72.7% ~ 104.2%,真菌含量增加44.2% ~ 53.2% 和97.5% ~ 105.7%,放线菌含量增加24.0% ~ 30.0% 和10.9% ~ 23.6%,腐生真菌含量增加23.4% ~ 37.6% 和128.5% ~ 150.4%。各添加秸秆处理真菌/细菌比均高于 CK处理,其中玉米抽雄期CSM处理与CK差异达显著水平。添加生物炭和有机肥对土壤总磷脂脂肪酸、细菌、真菌、放线菌、腐生真菌和真菌/细菌比影响不显著。
添加秸秆能够显著提高土壤总磷脂脂肪酸、细菌、真菌、腐生真菌和放线菌可能由于秸秆施入后,为微生物活动提供了大量的底物,促进相应处理土壤微生物繁殖[34]。真菌/细菌比可以反映两个微生物种群的相对丰度,是土壤生态系统缓冲能力的重要指标[35],该值越高则生态缓冲能力越高。添加秸秆的4个处理真菌/细菌比较其他处理均有所提高,说明秸秆改善了微生物栖息环境[36],提高了土壤生态缓冲能力。
2.4 不同处理土壤线性延展系数的变化
线性延展系数(COLE)用于表征土壤胀缩性,其值越大说明土壤胀缩性越强。如图1所示,与CK相比,单加生物炭的处理,COLE下降幅度最大,降至0.044;单加秸秆的处理COLE下降到0.050;单加有机肥处理则降至 0.058。添加生物炭显著减小土壤COLE,可能因为生物炭的加入改善了土壤结构[37-40],或是生物炭改变了黏土矿物胀缩性质[13]。
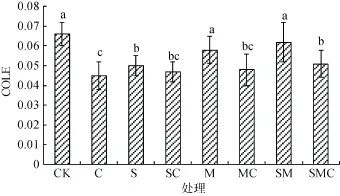
图1 不同处理对玉米收获后土壤延展系数的影响Fig.1 Effects of different treatments on soil COLE after corn was harvested
3 结论
生物炭对砂姜黑土土壤MBC和DOC含量影响不显著,但显著减小砂姜黑土胀缩性;添加秸秆能显著提高土壤MBC和DOC含量,减小土壤线性延展系数(COLE)。此外添加秸秆的处理显著提高了供试土壤总磷脂脂肪酸、细菌、真菌、放线菌和腐生真菌,其中腐生真菌含量增加最大。而添加生物炭和有机肥对土壤总磷脂脂肪酸、细菌、真菌、放线菌、腐生真菌和真菌/细菌影响不显著。
本研究中添加有机肥对土壤性质影响不显著,考虑在今后试验中增大有机肥用量;3种有机物料配施,土壤各性质均有较显著改善。综上,生产实践中3种有机物料添加应根据各地砂姜黑土主要障碍因子不同而灵活选择。
参考文献:
[1] 詹其厚, 袁朝良, 张效朴.有机物料对砂姜黑土的改良效应及其机制[J].土壤学报, 2003, 40(3): 420-425
[2] Brady N C, Weil R R.Chapter 12: soils organic matter [M].The Nature and Properties of Soils (13th Edition).Upper Saddle River, N J: Prentice-Hall, Inc.2002
[3] Wolf B, Snyder G H.Sustainable soils: The place of organic matter in sustaining soils and their productivity[M].New York: Food Products Press of the Haworth Press, 2003
[4] 薛豫宛, 李太魁, 张玉亭, 等.砂姜黑土农田土壤障碍因子消减技术浅析[J].河南农业科学.2013, 42(10): 66-69
[5] 袁振.砂姜黑土改良与质量提升的对策[J].宁夏农林科技, 2013, 54(3): 50-51
[6] 詹其厚, 张效朴, 袁朝良.秸杆还田改良砂姜黑土的效果及其机理研究[J].安徽农业大学学报, 2002, 29(1): 53-59
[7] 曾木祥, 张玉洁.秸秆还田对农田生态环境的影响[J].农业环境与发展, 1997, 14(1): 1-?7
[8] 吴婕, 朱钟麟, 郑家国, 等.秸秆覆盖还田对土壤理化性质及作物产量的影响[J].西南农业学报, 2006, 19(2): 192-195
[9] 田慎重, 王瑜, 李娜, 等.耕作方式和秸秆还田对华北地区农田土壤水稳性团聚体分布及稳定性的影响[J].生态学报, 2013, 33(22): 7 116-7 124
[10] 王晓娟, 贾志宽, 梁连友, 等.旱地施有机肥对土壤有机质和水稳性团聚体的影响[J].应用生态学报, 2012,23(1): 159-165
[11] 周江敏, 陈华林, 唐东民, 等?.秸秆施用后土壤溶解性有机质的动态变化[J].植物营养与肥料学报, 2008, 14(4): 678-684
[12] 韩光明.生物炭对不同类型土壤理化性质和微生物多样性的影响[D].沈阳农业大学, 2013
[13] Lu S G, Sun FF, Zong Y T.Effect of rice husk biochar and coal fly ash on some physical properties of expansive clayey soil (Vertisol)[J].Catena, 2014, 114: 37-44
[14] Chan K Y, Van Zwieten L, Meszaros I, et al.Agronomic values of greenwaste biochar as a soil amendment[J].Soil Research, 2008, 45(8): 629-634
[15] Van Zwieten L, Kimber S, Morris S, et al.Effects of biochar from slow pyrolysis of papermill waste on agronomic performance and soil fertility[J].Plant and soil,2010, 327(1/2): 235-246
[16] 鲁如坤.土壤农业化学分析方法[M].北京: 中国农业科技出版社, 2000
[17] Bligh E G, Dyer W J.A rapid method of total lipid extraction and purification[J].Canadian Journal of Biochemistry and Physiology, 1959, 37: 911-917
[18] Frostegård A, Tunlid A, Baatl E.Phospholipid fatty acid composition, biomass, and acitivity of microbial communities from two soil types experimentally exposed to different heavy metals[J].Applied and Environmental Microbiology, 1993, 59: 3 605-3 617
[19] He N P, Wang R M, Gao Y, et al.Changes in the temperature sensitivity of SOM decomposition with grassland succession: implications for soil C sequestration[J].Ecology and Evolution, 2013, 3(15): 5 045-5 054
[20] Zhou P, Li Y, Ren X E, et al.Organic carbon mineralization responses to temperature increases in subtropical paddy soils[J].Journal of Soils and Sediments, 2014, 14(1): 1-9
[21] Song B, Niu S, Zhang Z, et al.Light and heavy fractions of soil organic matter in response to climate warming and increased precipitation in a temperate steppe[J].PloS one,2012, 7(3): e33217.doi:10.1371/journal.pone.0033217
[22] Norton U, Mosier A R, Morgan J A, et al.Moisture pulses,trace gas emissions and soil C and N in cheatgrass and native grass-dominated sagebrush-steppe in Wyoming,USA[J].Soil Biology and Biochemistry, 2008, 40(6): 1 421-1 431
[23] Steenwerth K, Belina K M.Cover crops enhance soil organic matter, carbon dynamics and microbiological function in a vineyard agroecosystem[J].Applied soil ecology, 2008, 40(2): 359-369
[24] Kalbitz K, Schwesig D, Schmerwitz J, et al.Changes in properties of soil-derived dissolved organic matter induced by biodegradation[J].Soil Biology and Biochemistry, 2003,35(8): 1 129-1 142
[25] 颜慧, 蔡祖聪, 钟文辉.磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用[J].土壤学报, 2006, 43(5): 851-858
[26] 强学彩, 袁红莉, 高旺盛.秸秆还田量对土壤 CO2释放和土壤微生物量的影响[J].应用生态学报, 2004, 15(3): 469-472
[27] Gomez J D, Denef K, Stewart C E, et al.Biochar addition rate influences soil microbial abundance and activity in
temperate soils[J].European Journal of Soil Science, 2014,65: 28-39
[28] Ding N, Guo H C, Hayat T, et al.Microbial community structure changes duringAroclor 1242 degradation in the rhizosphere of ryegrass (Lolium multiflorum L.) [J].Research Article, 2009, 70: 305-314
[29] Wang Q K, Wang S L, He T X, et al.Response of organic carbon mineralization and microbial community to leaf litter and nutrient additions in subtropical forest soils[J].Soil Biology & Biochemistry, 2014, 71: 13-20
[30] Anders E, Watzinger A, Rempt F, et al.Biochar affects the structure rather than the total biomass of microbial communities in temperate soils[J].Agricultural and Food Science, 2013, 22: 404-423
[31] Kulmatiski A.Changing Soils to Manage Plant Communities: Activated Carbon as a Restoration Tool in Ex-arable Fields[J].Research Article, 2009, 101(19): 102-110?
[32] Mathew R P, Feng Y C, Githinji L, et al.Impact of notillage and conventional tillage systems on soil microbial communities[J].Applied and Environmental Soil Science,2012, doi:10.1155/2012/548620
[33] 齐鸿雁, 薛凯, 张洪勋.磷脂脂肪酸谱图分析方法及其在微生物生态学领域的应用[J].生态学报, 2003, 23(8): 1 577-1 580
[34] Govaerts B, Mezzalama M, Unno Y, et al.Influence of tillage, residue management, and crop rotation on soil microbial biomass and catabolic diversity[J].Applied Soil Ecology, 2007, 37(1): 18-30
[35] Bossio D A, Scow K M, Gunapala N, et al.Determination of soil microbial communities:Effects of agricultural management, season, and soil type on phospholipids fatty acid profiles[J].Microbial Ecology, 1998(36): 1-12
[36] Rajendran N, Matsuda O, Rajendran R, et al.Comparative description of microbial community structure in surface sediments of Eutrophic Bays[J].Marine Pollution Bulletin,1997, 34(1): 26-33
[37] 陈祯, 崔远来, 刘方平.不同灌溉施肥模式下土壤湿胀干缩特征曲线及其滞后效应[J].农业工程学报, 2013,29(11): 78-?84
[38] 王益, 王益权, 刘军, 等.黄土地区影响土壤膨胀因素的研究[J].干旱地区农业研究, 2005, 23(5): 93-?97
[39] 吴媛媛, 杨明义, 张风宝, 等.添加生物炭对黄绵土耕层土壤可蚀性的影响[J].土壤学报, 2016, 53(1): 81-92
[40] 谢祖彬, 刘琦, 许燕萍, 等.生物炭研究进展及其研究方向[J].土壤, 2011, 43(6): 857-861
中图分类号:S156.2
DOI:10.13758/j.cnki.tr.2016.03.008
基金项目:①国家小麦产业技术体系项目(CARS-03-02A,07B,08B)、中国科学院战略性先导科技专项 (XDB15030302,XDA0505050203)、国家自然科学基金面上基金项目(41471182)、中国科学院科技服务网络计划项目(KFJ-EW-STS-055-4)和中国科学院知识创新工程项目(ISSASIP1118)资助。
* 通讯作者(jbzhang@issas.ac.cn)
作者简介:高学振(1987—),男,山东烟台人,硕士研究生,主要从事土壤改良等方面的研究。E-mail: xzgao@issas.ac.cn
Comparison of Biochar, Straw and Manure in Improving Shajiang Black Soil
GAO Xuezhen1,2, ZHANG Congzhi1, ZHANG Jiabao1*, DING Ningning1
(1 State Experimental Station of Agro-Ecosystem in Fengqiu, State Key Laboratory of Soil and Sustainable Agriculture (Institute of Soil Science, Chinese Academy of Sciences), Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China)
Abstract:With various barrier factor, Shajiang black soil is a typical agricultural low-yield soil widely distributed in the in the Huanghuaihai Plain of China.A pot experiment was conducted to study the improvement of different organic materials (biochar, straw and manure) on Shajiang black soil.The results showed that straw addition significantly increased the contents of soil microbial carbon (MBC), dissolved organic carbon (DOC) and decreased the coefficients of linear extensibility (COLE).Straw addition increased soil microbial biomass phospholipid fatty acids (PLFAs), bacteria, fungi, saprophytic fungi and actinomycetes contents, and fungi/bacteria.Biochar and straw addition had no obvious influences on soil MBC, DOC, soil microbial biomass phospholipid fatty acids, bacteria, fungi, saprophytic fungi and actinomycetes contents, fungi/bacteria, but had significant negative influences on COLE.So the three organic materials should be selected according to the actual barrier factors in Shajiang black soil to be improved.
Key words:Biochar; Straw; Manure; Shajiang black soil; Improving effect

