低频超声对前列腺细胞及组织作用的研究进展
王 玉 综述,胡 兵 审校
上海交通大学附属第六人民医院超声医学科,上海超声医学研究所,上海 200233
专家述评
低频超声对前列腺细胞及组织作用的研究进展
王 玉 综述,胡 兵 审校
上海交通大学附属第六人民医院超声医学科,上海超声医学研究所,上海 200233

胡兵,教授,主任医师,博士生导师。上海交通大学附属第六人民医院超声医学科主任,上海超声医学研究所所长,上海交通大学医学影像学所副所长。1983年毕业于浙江大学医学院医疗系本科,1990年毕业于上海交通大学医学院生物医学工程系,师从周永昌教授。
现任中华医学会超声专业委员会副主任委员,中国超声医学工程学会副会长,上海市声学学会副理事长兼医学超声专业委员会主任委员,中国医师学会超声分会副会长。享受政府特殊津贴。先后获上海市优秀科技启明星、银蛇奖、全国卫生系统先进工作者称号。入选国家人事部“百千万人才工程”优秀学科带头人重点培养计划。长期从事临床超声的诊断和研究工作。目前致力于高强度聚焦超声(HIFU)肿瘤治疗研究、肾肿瘤、前列腺癌微创介入治疗研究以及女性盆底功能障碍疾病三维超声的研究。承担国家自然科学基金项目、部及市级课题多项。作为第一完成人获市部级科委科技进步奖二等奖二次,三等奖五次。
目前临床上治疗前列腺疾病的方法很多,但均存在一定的局限性,开发有效的微创疗法成为一项重要任务。近年来,随着超声技术的不断发展和改进,低频超声在前列腺疾病治疗中作用的研究越来越深入,低频超声不仅能诱导人前列腺癌细胞的凋亡及自噬、抑制癌细胞的侵袭转移,还可增加细胞膜的通透性,从而对前列腺增生组织和前列腺癌组织产生各种生物学效应。本文就这一领域的研究进展进行综述。
低频超声;前列腺疾病;生物效应;超声微泡
前列腺炎、前列腺增生、前列腺癌是危害男性健康和生活质量的常见疾病[1]。目前,临床治疗前列腺疾病的方法虽然很多,但由于药物的不良反应、血-前列腺屏障的存在及手术的创伤性等,均存在一定的局限性。因此,积极开发有效的微创疗法是目前面临的一项重要任务。低频超声通常指频率范围在20 kHz~1 MHz 的超声波。波长较长、声能吸收少、组织穿透力强及对正常组织损伤较小等是其特点[2]。其生物学效应包括机械效应、空化效应、热效应及化学效应等[3]。近年来,随着超声技术的不断发展和改进,研究低频超声在前列腺疾病治疗中的作用越来越深入,本文就这一领域的研究进展进行综述。
1 低频超声能诱导人前列腺癌细胞凋亡
陈旖旎等[4]采用频率为21 kHz、辐照时间为2 min、占空比为30%的超声联合微泡对前列腺癌细胞进行辐照,结果发现前列腺癌DU145细胞出现凋亡现象。林艳端等[5]通过对两种常见的人前列腺癌细胞DU145和PC3细胞进行研究,发现低频低功率超声联合微泡造影剂可明显诱导两种细胞发生早期凋亡,且对PC3细胞早期凋亡率的影响强于DU145细胞,这一结果有助于更系统地评估低频低功率超声联合微泡对不同时期前列腺癌的疗效。Bai等[6]进一步利用低频超声联合微泡辐照人前列腺癌PC3细胞后发现,单独超声治疗组和超声联合微泡治疗组的Bcl-2 mRNA及蛋白表达均较对照组减少,Bax mRNA及蛋白表达均较对照组增高,且以超声联合微泡组最明显,证实低频超声联合微泡能诱导人前列腺癌细胞凋亡,其机制可能是通过上调Bax及下调Bcl-2表达来实现(表1~2)。Xu等[7]的研究表明,低频超声可诱导人前列腺癌DU145细胞凋亡,其机制可能是通过下调小凹蛋白1(caveolin-1)和磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)的表达来实现。以上研究表明,低频超声能诱导人前列腺癌细胞凋亡,为治疗前列腺癌提供了一种新的策略。
表 1 各组细胞辐照24 h后细胞凋亡率(±s)

表 1 各组细胞辐照24 h后细胞凋亡率(±s)
#:与对照组比较,P<0.05;*:与单独超声组比较,P<0.05
组别 凋亡率(%)对照组 2.56±0.22单独超声组 5.40±0.25#超声联合微泡组 12.77±0.31#*
表 2 辐照后24 h各组细胞Bcl-2和Bax mRNA相对表达量(±s)

表 2 辐照后24 h各组细胞Bcl-2和Bax mRNA相对表达量(±s)
#:与对照组比较,P<0.05;*:与单独超声组比较,P<0.05
组别 Bcl-2 mRNA Bax mRNA对照组 97.12±25.97 8.63±0.87单独超声组 21.17±3.39# 28.00±7.00#超声联合为微泡组 4.75±2.11#* 140.30±26.02#*
2 低频超声能诱导人前列腺癌细胞自噬
林艳端等[8]使用低频超声联合微泡辐照人雄激素非依赖性前列腺癌PC3及DU145 细胞,发现低频超声联合微泡造影剂能明显诱导这两种细胞自噬,且对两者的作用无选择性(图1)。陈旖旎等[4]采用透射电镜观察频率为21 kHz的低频超声联合微泡对前列腺癌DU145细胞及正常前列腺上皮RWPE-1细胞的生物学作用,辐照2 min,占空比30%,结果发现对照组的两种细胞未出现自噬现象,而超声联合微泡组两种细胞均出现自噬。Wang等[9]的研究表明,低频超声联合微泡造影剂可上调人前列腺癌DU145细胞的自噬相关基因Beclin-1表达,导致自噬。以上研究表明,低频超声能诱导人前列腺癌细胞自噬,为低频超声对前列腺癌细胞作用机制的研究提供了新的方向。

图1 PC3细胞及DU145细胞经吖啶橙染色后荧光显微镜下所见的酸性囊泡及正常细胞
3 低频超声能抑制人前列腺癌细胞侵袭转移
Wang等[10]的研究表明,低频超声联合微泡可降低人前列腺癌DUl45细胞的侵袭转移能力。白文坤等[11]的研究表明,低频低能量超声联合微泡可抑制人前列腺癌PC3细胞的侵袭。Wei等[12]的研究表明,低频低能量超声联合微泡可抑制人前列腺癌细胞的转移,其机制可能是通过下调基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)和MMP-9蛋白表达来实现(图2)。林艳端等[13]使用频率为1 MHz的超声联合微泡辐照人前列腺癌PC3、DUl45细胞,并探索其对前列腺癌细胞凋亡、侵袭能力的影响,结果发现低频超声联合微泡可促进脂质体介导的Rac1-shRNA质粒转染两种人雄激素非依赖性前列腺癌细胞,最终通过抑制PC3、DU145细胞中Racl蛋白表达而促进细胞早期凋亡,同时可抑制其侵袭能力。

图 2 低频低能量超声联合微泡下调MMP-2和MMP-9蛋白表达
4 低频超声能增加细胞膜的通透性
Zhang等[14]使用低频超声辐照人前列腺癌DU145细胞,分别在即刻及6h后观察,结果发现低频超声联合微泡产生的声孔效应可影响不同时间点细胞的形态、细胞摄取钙黄绿素水平及细胞活性。Bai等[15]使用频率为21 kHz、声强为4.6 mW/cm2的低频超声联合微泡造影剂辐照人前列腺癌PC3细胞,发现低频超声联合微泡可促进增强型绿色荧光蛋白 (enhanced green fluorescent protein,EGFP)基因进入PC3细胞,而低频超声联合微泡组较对照组EGFP表达明显增加(图3)。Tata等[16]使用频率为932.7 kHz的超声辐照人前列腺癌细胞LnCap,结果表明其产生的空化效应可增加载入GFP基因的质粒转入此种细胞,转化率达65%。林艳端等[17]的研究表明,使用低频超声联合微泡造影剂可促进脂质体介导的野生型p53质粒转染人雄激素非依赖性前列腺癌DUl45细胞,明显提高其早期凋亡率,机制可能与上调p53蛋白、下调MDM2蛋白表达有关。Duvshani-Eshet等[18]应用频率为1 MHz的超声联合微泡介导pPEX基因转染,结果发现前列腺癌细胞的增殖、转移受到抑制,细胞凋亡增加,同时周围组织未受损伤。以上研究表明,超声联合微泡是一种新型非病毒转染的安全有效的基因治疗方法。Wang等[10]的研究表明,低频超声联合微泡治疗后24 h,单独超声组、单独盐酸米托蒽醌组及超声联合微泡+盐酸米托蒽醌组细胞增殖均受到抑制,以单独盐酸米托蒽醌组及超声联合微泡+盐酸米托蒽醌组最明显,其机制主要是通过增加细胞膜的通透性实现的。张蔚等[19]使用不同频率低频超声联合微泡促进脂质体介导的pEGFP质粒转染人前列腺癌PC3细胞,结果发现在相同的声强、相同的辐照面积下,随着超声频率升高,转染率呈下降趋势。Watanabe等[20]采用1 MHz、1.0 W/cm2、10%的占空比、辐照时间 60 s的超声照射3种超声微泡造影剂(Levovist、YM454、MRX-815H)以促进pBKCMV-luc质粒转染前列腺癌PC3细胞,结果发现在同等细胞存活率的情况下,不同超声微泡造影剂的转染率不同(YM454>MRX-815H>Levovist),同时发现含脂质体外壳的微泡转染率明显高于无脂质体外壳的微泡。以上研究表明,低频超声联合微泡造影剂能增加细胞膜的通透性,且进一步促进细胞内化疗药物的递送、基因的转染,从而提高疗效。

图 3 低频超声联合微泡促进脂质体介导的EGFP基因转染
5 低频超声对前列腺增生组织的作用
张唯力等[21]采用UGT 1025型超声基因转染仪,以频率1 MHz、声强0.5 W/cm2在体外对大鼠前列腺进行照射,结果显示超声辐照白蛋白微泡可增加良性前列腺增生大鼠的前列腺组织通透性。魏武然等[22]采用l MHz低频超声辐照慢性前列腺炎大鼠,发现低频超声联合微泡造影剂不仅可将药物靶向输送至病变部位,还能增加血-前列腺屏障的通透性,从而达到治疗前列腺疾病的目的。金龙等[23]采用频率831 kHz、峰值负压4.3 MPa、平均声强0.55 W/cm2的脉冲式非聚焦超声联合凝血酶原作用于前列腺,结果证实超声空化联合凝血酶原在一定程度上可阻断犬前列腺血流灌注,其可能机制是损伤破坏前列腺内的血管,造成血栓及血肿。戴君勇等[24]使用频率1 MHz、声强0.5 W/cm2的超声对大鼠增生前列腺进行照射,结果显示低频超声联合白蛋白微泡造影剂可增加抗雌激素药物4-羟基他莫昔芬(OHT)对大鼠前列腺增生的治疗作用,其机制可能是降低Bcl-2表达。Yang等[25]的研究表明,低频超声联合微泡能诱导犬良性前列腺增生组织的细胞凋亡,且可降低血前列腺特异性抗原(prostatespecific antigen,PSA)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)及超氧化物歧化酶(superoxide dismutase,SOD)表达(表3)。Lake等[26]用频率为750 kHz的低频超声进行实验,结果发现低频超声造成的组织毁损术能准确破坏前列腺组织,并起即时尿道减压的作用。
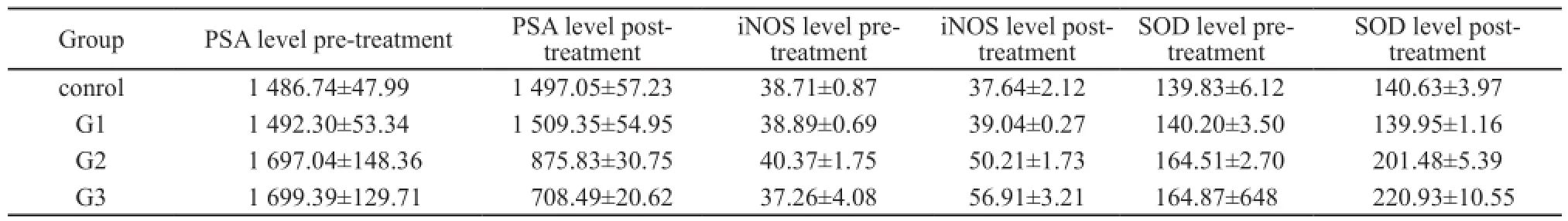
表 3 低频超声联合微泡降低PSA、iNOS和SOD表达
6 低频超声对前列腺癌组织的作用
Liu等[27]使用频率为831 kHz的低频超声对兔前列腺癌进行辐照,结果表明低频超声可打开血-前列腺癌屏障。南淑良等[28]使用80 kHz的低频超声辐照裸鼠人前列腺癌皮下移植瘤,辐照前在瘤体内注射EGFP质粒,3 d后用激光共聚焦显微镜观察并分析EGFP的平均荧光强度,同时进行病理学检查。结果发现,超声辐照组EGFP表达明显强于单纯裸质粒注射组,且EGFP的表达主要集中于细胞质;病理学检查表明低频超声辐照后,细胞形态发生明显改变,胞膜上形成空泡并有核碎裂等改变。Yang等[29]使用480 kHz 的射频消融仪联合频率20 kHz、声强1 W/cm2、占空比40%、微泡体积0.20 mL、辐照时间为3 min的低频超声治疗裸鼠前列腺癌皮下移植瘤,结果表明超声血管损毁术后,肿瘤组织血供恢复的主要原因可能是瘤组织微血管内血栓溶解;超声血管损毁术不仅能增大射频消融灶体积,还能促进射频消融术后残余灶的细胞凋亡及抑制残余灶的细胞增殖。Shen等[30]的研究则表明,低频超声联合微泡辐照人前列腺癌皮下移植瘤后,可将其血管损毁,延缓肿瘤生长,机制可能是通过降低环氧化酶-2 (cyclooxygenase 2,COX-2)及血管内皮生长因子(vascular endothelial growth factor,VEGF)表达来实现(图4)。
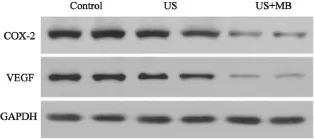
图 4 低频超声联合微泡降低COX-2和VEGF表达
综上所述,低频超声通过作用于前列腺细胞和组织,诱导人前列腺癌细胞凋亡、自噬,并抑制癌细胞侵袭转移,从而增加细胞膜及组织的通透性,打开血管内皮细胞间的紧密连接,增加血-前列腺屏障的通透性,促进药物或基因进入前列腺细胞及组织内,发挥治疗效果。此外,破坏前列腺组织微循环,形成局部毛细血管血栓,最终导致前列腺局部组织坏死或萎缩,从而使前列腺疾病得到治疗或缓解。
[1] 南淑良, 申锷, 胡兵. 低频超声联合微泡造影剂治疗前列腺疾病的研究进展 [J]. 中国医学影像学杂志, 2014,22(12): 950-952.
[2] YANG YU, BAI W, CHEN Y, et al. Optimization of low-frequency low-intensity ultrasound-mediated microvessel disruption on prostate cancer xenografts in nude mice using an orthogonal experimental design [J]. Oncol Lett, 2015, 10(5): 2999-3007.
[3] WOLLINA U, HEINIG B, NAUMANN G, et al. Effects of low-frequency ultrasound on microcirculation in venous leg ulcers [J]. Indian J Dermatol, 2011, 56(2):174-179.
[4] 陈旖旎, 白文坤, 胡兵, 等. 低频低能量超声联合微泡对前列腺细胞的影响 [J]. 声学技术, 2015, 34(4): 333-337.
[5] 林艳端, 申锷, 白文坤, 等. 低频低功率超声联合微泡对DU145细胞及PC3细胞早期凋亡的影响 [J]. 临床超声医学杂志, 2014, 16(1): 1-4.
[6] BAI W K, YANG S L, SHEN E, et al. Treatment of PC-3 cells with ultrasound combined with microbubbles induces distinct alterations in the expression of Bcl-2 and Bax [J]. Chin Scie Bull, 2013, 58: 3536-3540.
[7] XU W P, SHEN E, BAI W K, et al. Enhanced antitumor effects of low-frequency ultrasound and microbubbles in combination with simvastatin by downregulating caveolin-1 in prostatic DU-145 cells [J]. Oncol Lett,2014, l7(6): 2142-2148.
[8] 林艳端, 申锷, 白文坤, 等. 20 kHz低功率超声联合微泡诱导人前列腺癌PC3细胞及DU145细胞自噬 [J]. 中华医学超声杂志(电子版), 2014, 33(6): 65-68.
[9] WANG Y, CHEN Y, ZHANG W, et al. Up-regulation of Beclin-1 expression in DU-145 cells after irradiation by low-frequency ultrasound combined with microbubble [J]. Oncol Lett, 2015, 10(4): 2487-2490.
[10] WANG Y, BAI W K, SHEN E, et al. Sonoporation by low-frequency and low-power ultrasound enhances chemotherapeutic efficacy in prostate cancer cells in vitro [J]. Oncol Lett, 2013, 6(2): 495-498.
[11] 白文坤, 王玉, 陈旖旎, 等. 低频超声抑制人前列腺癌细胞PC-3侵袭的研究 [J]. 中华超声影像学杂志, 2014,23(9): 807-810.
[12] WEI C, BAI W K, WANG Y, et al. Combined treatment of PC-3 cells with ultrasound and microbubbles suppresses invasion and migration [J]. Oncol Lett, 2014,8(3): 1372-1376.
[13] 林艳端, 胡兵, 申锷. 超声联合微泡增强脂质体介导Rac1-shRNA质粒转染前列腺癌细胞及对其生物学行为的影响 [J]. 临床超声医学杂志, 2014, 16(6): 361-364.
[14] ZHANG J Z, SAGGAR J K, ZHOU Z L, et al. Different effects of sonoporation on cell morphology and viability [J]. Bosn J Basic Med Sci, 2012, 12(2): 64-68.
[15] BAI W K, WU Z H, SHEN E, et a1. The improvement of liposome-mediated transfection of pEGFP DNA into human prostate cancer cells by combining low-frequency and low-energy ultrasound with microbubbles [J]. Oncol Rep, 2012, 27(2): 475-480.
[16] TATA D B, DUNN F, TINDALL D J. Selective clinical ultrasound signals mediate differential gene transfer and expression in two human prostate cancer cell lines: LnCap and PC-3 [J]. Biochem Biophys Res Commun, 1997,234(1): 64-67.
[17] 林艳端, 申锷, 白文坤, 等. 低频超声联合微泡增强脂质体介导的野生型p53转染DU145细胞诱导早期细胞凋亡 [J]. 中华超声影像学杂志, 2014, 23(3): 258-262.
[18] D U V S H A N I-E S H E T M, B E N N Y O,MORGENSTERN A, et al. Therapeutic ultrasound facilitates antiangiogenic gene delivery and inhibits prostate tumor growth [J]. Mol Cancer Ther, 2007, 6(8): 2371-2382.
[19] 张蔚, 白文坤, 寿文德, 等. 比较不同频率低频超声联合微泡促进脂质体介导的pEGFP质粒转染人前列腺癌细胞的实验研究 [J]. 临床超声医学杂志, 2015, 17(3):145-148.
[20] WATANABE A, OTAKE R, NOZAKI T, et al. Effects of microbubbles on ultrasound-mediated gene transfer in human prostate cancer PC3 cells: comparison among Levovist, YM454, and MRX-815H [J]. Cancer Lett,2008, 265(1): 107-112.
[21] 张唯力, 戴君勇, 魏武然, 等. 超声辐照微泡对大鼠前列腺增生组织通透性的影响 [J]. 中国医学影像技术,2007, 23(1): 27-30.
[22] 魏武然, 张唯力, 戴君勇, 等. 超声微泡对大鼠前列腺中药物浓度的影响 [J]. 重庆医科大学学报, 2009, 34(9):1154-1156.
[23] 金龙, 吴盛正, 刘永亮, 等. 超声空化联合凝血酶原阻断犬前列腺血流灌注的初步研究[J]. 中国超声医学杂志,2013, 29(5): 460-463.
[24] 戴君勇, 张唯力, 魏武然, 等. 超声微泡造影剂介导4-羟基他莫昔芬治疗大鼠前列腺增生的实验研究 [J]. 中华超声影像学杂志, 2007, 16(7): 624-627.
[25] YANG S L, TANG K Q, BAI W K, et al. Effects of lowfrequency ultrasound combined with microbubbles on benign prostate hyperplasia [J]. Can Urol Assoc J, 2013,7(11-12): E681-E686.
[26] LAKE A M, HALL T L, KIERAN K, et al. Histotripsy:minimally invasive technology for prostatic tissue ablation in an in vivo canine model [J]. Urology, 2008, 72(3):682-686.
[27] LIU Y, YI S, ZHANG J, et al. Effect of microbubbleenhanced ultrasound on prostate permeability: a potential therapeutic method for prostate disease [J]. Urology, 2013,81(4): 921.
[28] 南淑良, 申锷, 白文坤, 等. 低频超声促进pEGFP质粒转染裸鼠人前列腺癌皮下移植瘤的实验研究 [J]. 中国超声医学杂志, 2014, 30(2): 171-174.
[29] YANG Y, BAI W, CHEN Y, et al. Low-frequency and low-intensity ultrasound-mediated microvessel disruption enhance the effects of radiofrequency ablation on prostate cancer xenografts in nude mice [J]. Mol Med Rep, 2015,12(5): 7517-7525.
[30] SHEN Z Y, SHEN E, ZHANG J Z, et al. Effects of lowfrequency ultrasound and microbubbles on angiogenesisassociated proteins in subcutaneous tumors of nude mice [J]. Oncol Rep, 2013, 30(2): 842-850.
Progress on effects of low-frequency ultrasound on prostatic tissues and cells
WANG Yu, HU Bing
(Department of Ultrasound in Medicine, Shanghai Sixth People's Hospital, Shanghai Jiao Tong University, Shanghai Institute of Ultrasound in Medicine, Shanghai 200223, China)
Correspondence to: HU Bing E-mail: binghu_stephen@163.com
There are many prostate disease treatments in clinic, but some limitations still exist. Developing an effective and minimally invasive treatment is an important task. In recent years, with the continuous development and the improvement of ultrasonic technology, the study of low-frequency ultrasound in the treatment of prostate disease is going deeply. Low-frequency ultrasound can not only induce apoptosis and autophagy and inhibit metastasis of prostate cancer cells, but also increase the permeability of cell membrane, resulting in biological effects on prostatic hyperplasia and prostate cancer tissues. The present paper summarizes the research progress in this field.
Low-frequency ultrasound; Prostate disease; Biological effect; Ultrasound microbubble
R445.1
A
1008-617X(2016)02-0093-06
国家自然科学基金(No: 81271597)
胡兵 E-mail:binghu_stephen@163.com
2016-06-03)

