谷氨酰胺对半滑舌鳎稚鱼非特异性免疫相关酶活力和低氧应激后HIF-1α表达的影响
刘经纬 麦康森 徐 玮 张彦娇 周慧慧 艾庆辉
(中国海洋大学农业部水产动物营养与饲料重点实验室, 中国海洋大学海水养殖教育部重点实验室, 青岛 266003)
谷氨酰胺对半滑舌鳎稚鱼非特异性免疫相关酶活力和低氧应激后HIF-1α表达的影响
刘经纬 麦康森 徐 玮 张彦娇 周慧慧 艾庆辉
(中国海洋大学农业部水产动物营养与饲料重点实验室, 中国海洋大学海水养殖教育部重点实验室, 青岛 266003)
为探讨饲料中谷氨酰胺对半滑舌鳎稚鱼非特异性免疫以及低氧应激后HIF-1α表达的影响, 实验共设计了4种谷氨酰胺添加量分别为0、0.5%、1.0%和2.0%的等氮等脂微颗粒饲料(游离谷氨酰胺测定值分别为0.03%、0.46%、0.91% 和1.73%), 饲喂35日龄半滑舌鳎稚鱼[平均干重(10.64±0.86) mg]。每天饱食投喂5次,养殖周期30d, 养殖结束后进行低氧应激实验。研究结果表明, 谷氨酰胺添加量为0.5%时半滑舌鳎稚鱼鱼体溶菌酶(LZM)活力显著高于未添加组(P<0.05)。饲料中不同谷氨酰胺水平对鱼体总一氧化氮合酶(TNOS)活力和诱导型一氧化氮合酶(iNOS)活力没有显著影响(P>0.05)。实验克隆了半滑舌鳎低氧应激关键基因——缺氧诱导因子1α (HIF-1α), 得到749 bp半滑舌鳎HIF-1α核心序列, 系统进化树分析表明半滑舌鳎HIF-1α氨基酸序列与大部分鱼类具有较高同源性。定量PCR结果显示, 饲料中谷氨酰胺水平对低氧应激后半滑舌鳎稚鱼内脏团HIF-1α表达量未产生显著影响(P>0.05)。综上所述, 在饲料中添加谷氨酰胺能够显著增强半滑舌鳎稚鱼鱼体溶菌酶活力(P<0.05), 提高非特异性免疫水平。
谷氨酰胺; 半滑舌鳎; 仔稚鱼; 非特异性免疫; HIF-1α; 基因克隆及定量
“条件必需氨基酸”谷氨酰胺(Glutamine)是机体内含量丰富的一种氨基酸, 在供能、蛋白质和核苷酸合成、免疫以及抗氧化等生理活动中发挥着重要的功能[1—5]。有关谷氨酰胺对哺乳动物免疫作用的研究较为深入, 近年来, 谷氨酰胺在鱼类免疫中的应用成为研究热点之一。仔稚鱼阶段的主要免疫方式为非特异性免疫[6]。溶菌酶是非特异性免疫防御中重要的组成部分, 其活力可以从一定程度上反映机体非特异性免疫水平[7]。此外, 一氧化氮(NO)作为一种由激活的巨噬细胞产生的分子, 除了参与细胞内和细胞间的信号调节以外, 还在抵御病原菌方面发挥着重要的免疫功能[8]。在美国红鱼(Sciaenops ocellatus)、杂交鲟(Acipenser schrenckii × Huso dauricus)和建鲤(Cyprinus carpio var. Jian)幼鱼中的研究发现, 在饲料中添加适量谷氨酰胺能够增强头肾巨噬细胞溶菌酶活力, 提高血清C3和 C4补体水平, 调节头肾和脾脏中细胞因子的基因表达[9—11]。但是有关谷氨酰胺对仔稚鱼非特异性免疫功能影响的研究还十分缺乏, 且作用机理并不明确。
低氧应激是仔稚鱼工厂化养殖过程中的潜在威胁之一, 适宜的营养状况有助于维持鱼体健康,增强免疫水平并提高机体抗应激能力[12]。缺氧诱导因子1 (HIF-1)是由缺氧诱导产生的转录激活因子, 在低氧应答的调控机制中起着核心作用, 可以通过控制相关基因表达来调节葡萄糖运输、糖酵解和血红细胞生成等生理过程从而增强机体对低氧的耐受性[13, 14]。HIF-1由α和β两个亚基组成, HIF-1β在细胞内呈结构性表达, 不受细胞氧浓度的调节,HIF-1α在低氧条件下大量表达, 是HIF-1的活性亚基[15]。相较于哺乳动物而言, 鱼类HIF-1的研究十分有限, 有关饲料中谷氨酰胺对鱼类HIF-1α表达的影响的研究还未见报道。
半滑舌鳎(Cynoglossus semilaevis Günther)是我国海水养殖中重要的经济鱼类, 由于其肉质细腻,营养丰富, 野生资源十分缺乏, 因而具有极高的经济价值。但是半滑舌鳎仔稚鱼阶段, 由于免疫系统发育并不完善、抗应激能力较弱, 因而死亡率较高。本实验旨在探讨在饲料中添加不同水平的谷氨酰胺对半滑舌鳎稚鱼非特异性免疫相关酶活力以及低氧应激后HIF-1α mRNA表达影响, 阐明谷氨酰胺在鱼类营养免疫中的作用机制, 为提高半滑舌鳎仔稚鱼成活率提供理论基础。
1 材料与方法
1.1 实验饲料
实验饲料配方以刘峰等[16]对半滑舌鳎微颗粒饲料开发的研究结果为基础并改进而成。以低温白鱼粉、磷虾粉、肉骨粉、鱿鱼粉和鱼肉水解蛋白作为主要蛋白源, 鱼油和大豆卵磷脂作为脂肪源,分别添加0、0.5%、1.0%和2.0%的谷氨酰胺, 并用甘氨酸调节总蛋白水平保持一致, 配制成4种等氮等脂的饲料。谷氨酰胺购自青岛福林生物技术有限公司(中国青岛), 纯度≥99%(表 1)。实验饲料的制作采用微黏合技术, 将所有原料经超微粉碎后充分混匀, 混匀的过程中搓入水、鱼油和大豆卵磷脂,随后制成颗粒饲料并恒温干燥, 最后将所得的颗粒饲料再破碎后过筛, 得到适宜粒径的实验饲料, 并储存在-20℃冰箱中备用, 以防止脂质过氧化。

表 1 实验基础饲料配方及化学组成(% 干物质)Tab. 1 Formulation and proximate analysis of the experimental diets (% dry matter)
1.2 实验动物与养殖条件
实验在山东省海阳市黄海水产有限公司进行,所用鱼苗为该场人工繁殖的35日龄半滑舌鳎稚鱼[平均干重(10.64±0.86) mg]。每个处理设3个重复,每个桶内鱼苗150尾(养殖桶规格为65 cm×65 cm× 90 cm, 水容积约200 L)。养殖期间, 采用循环水系统, 水温25—26℃, pH 7.8—8.0, 盐度29‰—30‰,氨氮含量≤0.19 mg/L。每天饱食投喂5次(6:00,9:00, 14:00, 18:00和21:00), 养殖周期30d。
1.3 应激实验
在30d养殖实验结束时, 从每个养殖桶中随机捞取8尾半滑舌鳎稚鱼, 放入装满海水的600 mL密封丝扣瓶中。当50%稚鱼死亡时, 将其余存活的稚鱼在冰面上解剖出内脏团并用1.5 mL无RNA酶的离心管收集, 迅速放入液氮中, 随后转移至-80℃冰箱储存以备随后进行基因表达分析。
1.4 取样与解剖
在实验结束后, 停食24h以充分排空肠道内容物后取样, 全部鱼苗用2 mL和5 mL离心管液氮冷冻随后转移至-80℃冰箱储存保存备用。在进行酶活力分析时, 将半滑舌鳎稚鱼全鱼称重后, 用0℃的生理盐水(pH 7.4)匀浆, 全鱼组织(g)和生理盐水(mL)的比例为1∶9。随后全鱼匀浆在3500 r/min转速下离心10min, 收集离心后的匀浆上清液, 用于随后的分析。
1.5 分析方法
非特异性免疫相关酶活力分析 半滑舌鳎稚鱼鱼体溶菌酶(LZM)检测方法(浊度比色法)参考Ellis[17]的方法; 以磷酸缓冲液(pH, 6.1)配制微壁溶球菌(Micrococcus lysodeikticus, Sigma, USA)悬液作反应底物, 组织匀浆与菌悬液按1∶19混合,25℃水浴反应10min后, 测定530 nm波长下一段时间内吸光值的变化, 每隔 1min 读数一次。LZM活力的测定结果表示为U/mg·protein, 每个活力单位(U)定义为每毫克可溶蛋白每分钟使吸光值降低0.001的倍数。
一氧化氮合酶(NOS)测定操作按照试剂盒说明书(南京建成生物工程研究所, 中国南京)。测定原理根据NOS可催化L-Arg和分子反应生成NO,NO与亲核性物质生成有色化合物, 在530 nm波长下测定吸光度, 根据吸光度大小可计算出NOS活力。NOS主要有两种类型——结构型(cNOS)和诱导型(iNOS)。cNOS主要存在于神经元和内皮细胞内, 依赖钙; iNOS主要存在于巨噬细胞内, 不依赖钙。根据此原理可以测定分型。NOS活力测定结果表示为U/mg·protein, 将每毫克组织蛋白每分钟生成1 nmol NO定义为一个酶活力单位(U)。
蛋白浓度的测定参照Bradford[18]的方法, 用牛血清蛋白(BSA,A-2153,Sigma, USA)作底物。
RNA提取、cDNA合成和缺氧诱导因子1α (HIF-1α)核心片段的克隆 半滑舌鳎内脏团总RNA提取按照Trizol法, 并将提取RNA用DNase (TaKaRa, Japan)处理去除其中残留DNA。利用NanoDrop ND-1000核酸分析仪(Wilmington, DE)测定RNA的质量和浓度, 并用1.2%琼脂糖凝胶电泳检验RNA完整性。按照PrimeScriptTMRT reagent Kit (PerfectRealTime)(TaKaRa, Japan)试剂盒说明书进行反转录合成cDNA第一条链。
参考许氏平鲉(Sebastes schlegelii)(GenBank No. KC918362.1)、欧洲鲈(Dicentrarchus labrax)(GenBank No. DQ171936.2)、点带石斑鱼(Epinephelus coioides)(GenBank No. AY735010.1)、细须石首鱼(Micropogonias undulates)(GenBank No. DQ363931.1)、金头鲷(Sparus aurata)(GenBank No. JQ308830.1)、川鲽(Platichthys flesus) (GenBank No. EF100709.1)、虹鳟(Oncorhynchus mykiss)(GenBank No. NM_001124288.1)、大西洋鲑(Salmo salar)(GenBank No. BT059247.1)的HIF-1α核苷酸序列, 利用Primer Premier 5.0 设计HIF-1α的简并引物(表 2)。

表 2 本实验中所用到的引物序列Tab. 2 Primers used in the current study
HIF-1α PCR扩增反应在Eppendorf Mastercycler gradient (Eppendorf, German)中进行, 反应程序设定: PCR 反应程序设置依次为: 94℃ 3min (预变性, 1个循环); 94℃ 30s (变性), 58℃ 30s (退火),72℃ 1min (延伸), 30次循环; 72℃ 10min (终延伸,1个循环)。PCR产物用1.2%琼脂糖凝胶电泳检测;目的片段产物经EazyPure Quick Gel Extraction Kit试剂盒回收并连接到pEasy-T1载体(TransGen Biotech, China); 转化到感受态细胞Escherichia coli TOP10中; 固体培养基37℃培养过夜; 经菌落PCR后, 挑选4个阳性克隆送生工生物工程(上海)股份有限公司进行测序, 在NCBI上BLAST比对测序结果。
序列分析 用DNAMAN对HIF-1α克隆片段进行氨基酸序列预测, Clustal X 进行氨基酸序列的多重比对分析后, 用MEGA4.0软件的Neighbour-Joining法(1000 runs)构建系统进化树。
HIF-1α实时荧光定量 根据克隆所得HIF-1α核心片段设计出特异性引物(表 2), 以甘油醛-3-磷酸脱氢酶(GAPDH)为内参, 进行定量PCR。反应体系为25 μL, 其中上、下游引物(10 μmol/L)各1 μL, 模板cDNA 1 μL, 2×SYBR Premix Ex TaqTM(TaKaRa, Japan) 12.5 μL和9.5 μL的无菌水。定量PCR的程序设定为95℃, 2min, 1个循环; 95℃, 10s,58.7℃ 10s, 72℃, 20s, 40个循环; 之后进行熔解曲线以检验每个PCR反应只有1个PCR产物。通过制作浓度标准曲线来进行的基因和内参基因扩增效率一致性检验, 扩增效率的计算公式E=10(-1/Slope)-1 (Slope为斜率)。在本实验中, HIF-1α和GAPDH的扩增效率分别为0.9884和0.9494。采用2-ΔΔCt方法计算HIF-1α的相对表达量[19]。
1.6 统计分析
实验结果采用SPSS 17.0软件进行统计分析, 在单因素方差分析(one-way ANOVA)达到显著水平(P<0.05)时, 采用Tukey's检验进行多重比较, 数据表示为平均值±标准误。
2 结果
2.1 非特异性免疫相关酶活力
LZM活力 不同的谷氨酰胺添加水平显著影响了半滑舌鳎稚鱼鱼体LZM活力(P<0.05)。鱼体LZM活力最高值出现在0.5%添加组, 显著高于未添加组(P<0.05), 但与1.0%和2.0%添加组没有显著差异(P>0.05, 图 1)。
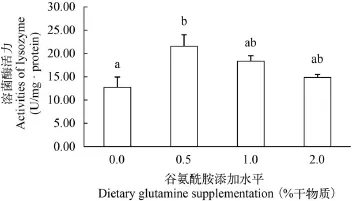
图 1 饲料中添加谷氨酰胺对半滑舌鳎稚鱼全鱼溶菌酶活力的影响Fig. 1 Effects of dietary glutamine supplementation on activities of lysozyme in whole body of C. semilaevis post larvae
NOS活力 饲料中游离谷氨酰胺含量为0、0.5%、1.0% 和2.0%时, 半滑舌鳎稚鱼鱼体总一氧化氮合酶(TNOS)活力分别为1.06、1.81、1.09和1.54 U/mg·protein (图 2), iNOS活力分别为0.81、1.42、1.00和1.11 U/mg·protein (图 3)。但是, 不同谷氨酰胺添加组半滑舌鳎稚鱼鱼体TNOS和iNOS活力均没有显著差异(P>0.05)。
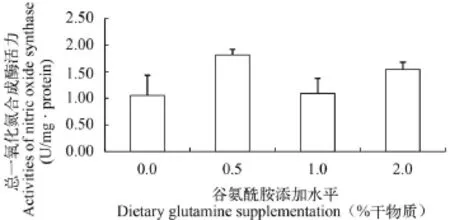
图 2 饲料中添加谷氨酰胺对半滑舌鳎稚鱼全鱼总一氧化氮合酶活力的影响Fig. 2 Effects of dietary glutamine supplementation on total activities of nitric oxide synthase in whole body of C. semilaevis post larvae
2.2 半滑舌鳎HIF-1α核心片段的克隆、序列分析及定量表达
HIF-1α核心片段的克隆和序列分析 片段克隆得到HIF-1α核心序列749 bp, 序列已提交到NCBI数据库, GenBank Accession No. KP723543。通过BLAST比对分析发现半滑舌鳎HIF-1α核苷酸序列与大黄鱼(Larimichthys crocea)(GenBank No. KM593915.1)相似性最高, 为94%; 与南极冰鱼(Chaenocephalus aceratus)(GenBank No. GU362090.1)的相似度为90%; 与鲢(Hypophthalmichthys molitrix)(GenBank No. HM146310.1)的相似度为81%; 与齐口裂腹鱼(Schizothorax prenanti)(GenBank No. KJ679876.1)的相似度为77%; 与林蛙(Rana temporaia)(GenBank No. EU262663.1)相似度为77%。

图 3 饲料中添加谷氨酰胺对半滑舌鳎稚鱼全鱼诱导型一氧化氮合酶活力的影响Fig. 3 Effects of dietary glutamine supplementation on activities of inducible nitric oxide synthase in whole body of C. semilaevis post larvae
将克隆的HIF-1α部分核酸序列经DNAMAN翻译, 得到半滑舌鳎HIF-1α氨基酸序列片段(249个氨基酸), BLASTP分析得到半滑舌鳎HIF-1α氨基酸片段与点带石斑鱼(GenBank No. AAW29027.1)的相似度最高, 为71%; 与短头壮绵鳚(Pachycara brachycephalum) (GenBank No. AAZ52828.1)的相似度为70%; 与河鲈(Perca fluviatilis)(GenBank No. ABO26717.1)的相似度为69%; 金头鲷(GenBank No. AFV39804.1)的相似度为68%, 与大西洋鲑(GenBank No. ACN10960.1)的相似度为61%; 与南极冰鱼(GenBank No. ADC55888.1)的相似度为54%;与人(Homo sapiens)(GenBank No. NP_851397.1)的相似度为48%; 与山羊(Capra hircus)(GenBank No.AEW10558.1)、家兔(Oryctolagus cuniculus)(GenBank No. NP_001076251.1)的相似度为47%;与小鼠(Mus musculus)(GenBank No. AAC53455.1)的相似度为46%。
根据半滑舌鳎与其他9种脊椎动物HIF-1α氨基酸序列构建脊椎动物NJ系统进化树, 半滑舌鳎HIF-1α与大西洋鲑、点带石斑鱼和金头鲷、河鲈等其他鱼类分聚一支; 人、山羊和小鼠等哺乳动物分聚为一支, 禽类聚为另一支(图 4)。

图 4 根据Neighbour-Joining法(1000 runs)构建的HIF-1α氨基酸序列进化树Fig. 4 A phylogenetic tree constructed by Neighbour-joining method (1000 runs) for amino acid sequences of HIF-1α
低氧应激后舌鳎内脏团HIF-1α的表达量
低氧应激后各处理组半滑舌鳎内脏团HIF-1α mRNA相对表达量接近, 虽然在未添加组表达量较高, 但各处理组之间HIF-1α mRNA表达量差异不显著(P>0.05, 图 5)。

图 5 饲料中添加谷氨酰胺对半滑舌鳎稚鱼低氧应激后内脏团HIF-1α的影响Fig. 5 Effects of dietary glutamine supplementation on HIF-1α mRNA expression in visceral mass of post larval C. semilaevis
3 讨论
3.1 谷氨酰胺对半滑舌鳎稚鱼非特异性免疫相关酶活力的影响
营养和免疫密切相关, 通过营养调控来提高鱼体抗病力已被证明是一种行之有效的方法[12]。已有研究结果显示, 谷氨酰胺可以促进鱼类生长、改善肠道结构, 并且在提高免疫力方面具有良好功效[9, 10, 20—23]。溶菌酶和补体等其他一些因子作为鱼体非特异性免疫的组成部分, 对杀灭病原菌具有重要作用。Cheng等[9, 21]的研究结果表明饲料中添加谷氨酰胺能够提高美国红鱼和杂交鲟(Morone chrysops × M. saxatilis)幼鱼头肾巨噬细胞中的溶菌酶活力; Zhu等[10]的研究得到类似结论, 发现饲料中添加丙氨酰-谷氨酰胺二肽对杂交鲟(A. schrenckii× H. dauricus)幼鱼血清溶菌酶活力具有促进作用。在本实验中, 谷氨酰胺添加水平为0.5%时鱼体溶菌酶活力显著高于未添加组(P<0.05), 说明谷氨酰胺对半滑舌鳎稚鱼的非特异性免疫能力也具有一定的促进作用, 与在幼鱼中的研究结论一致。
iNOS可以在致炎因子的刺激下迅速表达并产生大量NO, 从而起到杀菌作用[8]。Wei等[24]的研究表明, iNOS基因突变小鼠对寄生虫(Leishmania major)的感染率较高, 由角叉藻引起的非特异性抗炎反应降低。值得注意的是, NO虽然可以杀灭病原菌, 但是如果浓度过高、持续时间过长则会引起DNA损伤, 线粒体呼吸抑制等[25]。谷氨酰胺对NO的合成起着重要的调控作用, 能够剂量依赖性抑制精氨酸生成NO过程[26]。已有研究表明, 在斑点叉尾鮰巨噬细胞培养液中加入精氨酸和/或谷氨酰胺能够促进其产生NO[27]。本实验室先前在大菱鲆中的研究发现, 饲料中精氨酸和谷氨酰胺水平对大菱鲆幼鱼血清和肝脏中的iNOS活力的影响存在显著交互作用(P<0.05), 可以促进或抑制iNOS活力[28]。然而,在本实验中, 饲料中谷氨酰胺水平对半滑舌鳎稚鱼鱼体TNOS和iNOS活力均没有显著影响。推测本实验的研究结果与先前研究结论不一致的原因, 可能与取样时间点的差异有关。此外, 实验动物不同,生长阶段、环境因子、生理状态和代谢水平等也会对实验结果产生影响。
谷氨酰胺提高动物非特异性免疫能力的作用机理在哺乳类中的研究较为深入, 研究表明谷氨酰胺可以通过促进淋巴细胞增殖和激活巨噬细胞功能来增强哺乳动物的免疫力[29—32], 但在鱼类中相关研究还十分有限。已有研究表明, 谷氨酰胺可以提高血清补体水平[10, 11], 提高中性粒细胞氧化自由基产量、头肾巨噬细胞胞内和胞外超氧阴离子浓度[9]。在本实验中, 饲料中添加0.5%谷氨酰胺显著增强了鱼体LZM的活力, 推测谷氨酰胺对溶菌酶活力的提升作用机制可能与在哺乳动物中相似, 与促进淋巴细胞增殖和巨噬细胞产生细胞因子有关[10]。脾脏是鱼类重要的免疫器官, Hu等[11]研究发现饲料中添加谷氨酰胺后上调了建鲤幼鱼脾脏中TOR的磷酸化水平, 提高了脾脏蛋白质含量。谷氨酰胺对鱼类免疫作用研究的具体机制还需要进一步探讨。
3.2 半滑舌鳎HIF-1α基因克隆以及谷氨酰胺对半滑舌鳎稚鱼低氧应激后HIF-1α mRNA表达的影响
低氧应激所引起的相关基因表达的变化是鱼体适应低氧环境的重要途径。常氧条件下, HIF-1α在翻译后即被泛素-蛋白酶水解复合体降解, 在缺氧条件下HIF-1α降解被抑制并与HIF-1β结合形成二聚体HIF-1, HIF-1可以转移到细胞核内调节多种基因的转录[15]。Soitamo等[33]在虹鳟中第一次克隆到鱼类的HIF-1α基因序列, 随后其他学者陆续在虹鳟、草鱼(Ctenopharyngodon idellus)、波纹绒须石首鱼(Micropogonias undulatus)、斑马鱼、团头鲂(Megalobrama amblycephala)、欧洲鲈、胭脂鱼(Chinese sucker)等鱼种中克隆到了HIF-1α基因[34—39]。Blast比对结果显示, 本实验中所克隆到的半滑舌鳎HIF-1α基因序列片段与大部分鱼类具有较高的相似性。系统进化树分析结果显示舌鳎HIF-1α氨基酸序列与大西洋鲑的进化地位最近, 并且与其他鱼类紧密聚为一支, 与哺乳类和禽类的进化关系较远。
在本实验中, 饲料中不同谷氨酰胺水平对低氧应激后舌鳎内脏团HIF-1α mRNA表达量的影响不显著, 出现该现象的原因可能是由于HIF-1α在转录水平上不受营养调控[40, 41], 具体谷氨酰胺是否能在转录后水平上影响低氧应激后半滑舌鳎HIF-1α的表达还需要进一步的研究探讨。
综上所述, 饲料中添加谷氨酰胺能够显著增强半滑舌鳎稚鱼鱼体溶菌酶活力(P<0.05), 提高非特异性免疫水平, 但是饲料中谷氨酰胺水平对低氧应激后半滑舌鳎稚鱼HIF-1α mRNA表达量影响不显著(P>0.05)。
[1]Lacey J M, Wilmore D W. Is glutamine a conditionally essential amino acid [J]. Nutrition Reviews, 1990, 48(8):297—309
[2]Wu G, Bazer F W, Johnson G A, et al. Triennial growth symposium: Important roles for-glutamine in swine nutrition and production [J]. Journal of Animal Science, 2011,89(7): 2017—2030
[3]Coutinho F, Castro C, Rufino-Palomares E, et al. Dietary glutamine supplementation effects on amino acid metabolism, intestinal nutrient absorption capacity and antioxidant response of gilthead sea bream (Sparus aurata) juveniles [J]. Comparative Biochemistry and Physiology Part A: Molecular &Integrative Physiology, 2015, 191:9—17
[4]DeBerardinis R J, Cheng T. Q's next: the diverse functions of glutamine in metabolism, cell biology and cancer [J]. Oncogene, 2010, 29(3): 313—324
[5]Petry É R, Cruzat V F, Heck T G, et al. Alanyl-glutamine and glutamine plus alanine supplements improve skeletal redox status in trained rats: involvement of heat shock protein pathways [J]. Life Sciences, 2014, 94(2):130—136
[6]Magnadóttir B. Innate immunity of fish (overview) [J]. Fish & Shellfish Immunology, 2006, 20(2): 137—151
[7]Saurabh S, Sahoo P. Lysozyme: an important defence molecule of fish innate immune system [J]. Aquaculture Research, 2008, 39(3): 223—239
[8]Bogdan C, Nitric oxide synthase in innate and adaptive immunity: an update [J]. Trends in Immunology, 2015,36(3): 161—178
[9]Cheng Z, Buentello A, Gatlin D M. Effects of dietary arginine and glutamine on growth performance, immune responses and intestinal structure of red drum, Sciaenopsocellatus [J]. Aquaculture, 2011, 319(1): 247—252
[10]Zhu Q, Xu Q, Xu H, et al. Dietary glutamine supplementation improves tissue antioxidant status and serum nonspecific immunity of juvenile Hybrid sturgeon (Acipenser schrenckii♀× Huso dauricus♂) [J]. Journal of Applied Ichthyology, 2011, 27(2): 715—720
[11]Hu K, Zhang J X, Feng L, et al. Effect of dietary glutamine on growth performance, non-specific immunity, expression of cytokine genes, phosphorylation of target of rapamycin (TOR), and anti-oxidative system in spleen and head kidney of Jian carp (Cyprinus carpio var. Jian)[J]. Fish Physiology and Biochemistry, 2015, 41(3):635—649
[12]Pohlenz C, Gatlin D M. Interrelationships between fish nutrition and health [J]. Aquaculture, 2014, 431:111—117
[13]Robertson C E, Wright P A, Köblitz L, et al. Hypoxia-inducible factor-1 mediates adaptive developmental plasticity of hypoxia tolerance in zebrafish, Danio rerio [J]. Proceedings of the Royal Society B: Biological Sciences,2014, 281(1786): 20140637
[14]Haase V H. Regulation of erythropoiesis by hypoxia-inducible factors [J]. Blood Reviews, 2013, 27(1): 41—53
[15]Semenza G L. Hypoxia-inducible factors in physiology and medicine [J]. Cell, 2012, 148(3): 399—408
[16]Liu F. A study on protein sources screen and processingrelated technics in artificial microdiet for larvae of large yellow croaker (Pseudosciaena crocea) and tongue sole (Cynoglossus semilaevis) [D]. Thesis for Doctor of Science. Ocean University of China, Qingdao. 2007 [刘峰.大黄鱼和半滑舌鳎仔稚鱼人工微颗粒饲料蛋白源选择及其加工工艺相关研究. 博士学位论文, 中国海洋大学.青岛. 2007]
[17]Ellis A E. Lysozyme assays [J]. Techniques in Fish Immunology, 1990, 1: 101—103
[18]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(1): 248—254
[19]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2- ΔΔCtmethod [J]. Methods, 2001, 25(4): 402—408
[20]Lin Y, Zhou X Q. Dietary glutamine supplementation improves structure and function of intestine of juvenile Jian carp (Cyprinus carpio var. Jian) [J]. Aquaculture, 2006,256(1): 389—394
[21]Cheng Z, Gatlin D M, Buentello A. Dietary supplementation of arginine and/or glutamine influences growth performance, immune responses and intestinal morphology of hybrid striped bass (Morone chrysops × Morone saxatilis) [J]. Aquaculture, 2012, 362: 39—43
[22]Wang C A, Xu Q Y, Xu H, et al. Dietary l-alanyl-lglutamine supplementation improves growth performance and physiological function of hybrid sturgeon Acipenser schrenckii♀× A. baerii♂ [J]. Journal of Applied Ichthyology, 2011, 27(2): 727—732
[23]Wang G Q, Han Y T, Lu H M, et al. Effect of Ala-Gln feeding on growth, antioxidant level, and immunity of Cyprinus carpio var. Jian [J]. Acta Hydrobiologica Sinica, 2012, 36(5): 837—842 [王桂芹, 韩宇田, 芦洪梅.丙氨酰-谷氨酰胺投喂方式对建鲤生长, 抗氧化及免疫力的影响. 水生生物学报, 2012, 36(5), 837—842]
[24]Wei X Q, Charles I G, Smith A, et al. Altered immune responses in mice lacking inducible nitric oxide synthase [J]. Nature, 1995, 375: 408—411
[25]Jobgen W S, Fried S K, Fu W J, et al. Regulatory role for the arginine-nitric oxide pathway in metabolism of energy substrates [J]. The Journal of Nutritional Biochemistry, 2006, 17(9): 571—588
[26]Rhoads J M, Wu G. Glutamine, arginine, and leucine signaling in the intestine [J]. Amino Acids, 2009, 37(1):111—122
[27]Buentello J A, Gatlin D M. Nitric oxide production in activated macrophages from channel catfish (Ictalurus punctatus): influence of dietary arginine and culture media [J]. Aquaculture, 1999, 179(1): 513—521
[28]Zhang K K. Studies on nutritional metabolism of several functional amino acids for juvenile turbot (Scophthalmus maximus L.) [D]. Thesis for Doctor of Science. Ocean University of China, Qingdao. 2014 [张凯凯.大菱鲆幼鱼几种功能性氨基酸营养代谢的研究. 博士学位论文, 中国海洋大学. 青岛. 2014]
[29]Da Silva Lima F, Rogero M M, Ramos M C, et al. Modulation of the nuclear factor-kappa B (NF-κB) signalling pathway by glutamine in peritoneal macrophages of a murine model of protein malnutrition [J]. European Journal of Nutrition, 2013, 52(4): 1343—1351
[30]Roth E. Nonnutritive effects of glutamine [J]. The Journal of Nutrition, 2008, 138(10): 2025S-2031S
[31]Brasse-Lagnel C, Lavoinne A, Husson A. Control of mammalian gene expression by amino acids, especially glutamine [J]. Febs Journal, 2009, 276: 1826—1844
[32]Curi R, Newsholme P, Procopio J, et al. Glutamine, gene expression, and cell function [J]. Frontiers in Bioscience,2007, 12: 344—357
[33]Soitamo A J, Råbergh C M, Gassmann M, et al. Characterization of a hypoxia-inducible factor (HIF-1α) from rainbow trout [J]. Journal of Biological Chemistry, 2001,276(23): 19699—19705
[34]Law S H, Wu R S, Ng P K, et al. Cloning and expression analysis of two distinct HIF-alpha isoforms-gcHIF-1alpha and gcHIF-4alpha-from the hypoxia-tolerant grass carp, Ctenopharyngodon idellus [J]. BMC Molecular Bio-logy, 2006, 7(1): 15
[35]Rahman M S, Thomas P. Molecular cloning, characterization and expression of two hypoxia-inducible factor alpha subunits, HIF-1α and HIF-2α, in a hypoxia-tolerant marine teleost, Atlantic croaker (Micropogonias undulatus) [J]. Gene, 2007, 396(2): 273—282
[36]Rojas D A, Perez-Munizaga D A, Centanin L, et al. Cloning of hif-1α and hif-2α and mRNA expression pattern during development in zebrafish [J]. Gene Expression Patterns, 2007, 7(3): 339—345
[37]Shen R J, Jiang X Y, Pu J W, et al. HIF-1α and -2α genes in a hypoxia-sensitive teleost species Megalobrama amblycephala: cDNA cloning, expression and different responses to hypoxia [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2010, 157(3): 273—280
[38]Terova G, Rimoldi S, Corà S, et al. Acute and chronic hypoxia affects HIF-1α mRNA levels in sea bass (Dicentrarchus labrax) [J]. Aquaculture, 2008, 279(1):150—159
[39]Chen N, Chen L P, Zhang J, et al. Molecular characterization and expression analysis of three hypoxia-inducible factor alpha subunits, HIF-1α/2α/3α of the hypoxia-sen sitive freshwater species, Chinese sucker [J]. Gene, 2012,498(1): 81—90
[40]Wenger R H, Kvietikova I, Rolfs A, et al. Hypoxia-inducible factor-1 alpha is regulated at the post-mRNA level [J]. Kidney International, 1997, 51(2): 560—563
[41]Ke Q, Costa M. Hypoxia-inducible factor-1 (HIF-1) [J]. Molecular Pharmacology, 2006, 70(5): 1469—1480
EFFECTS OF DIETARY GLUTAMINE ON ACTIVITIES OF NON-SPECIFIC IMMUNE RELATED ENZYMES AND HIF-1α EXPRESSION AFTER HYPOXIA OF HALF-SMOOTH TONGUE SOLE POST LARVAE
LIU Jing-Wei, MAI Kang-Sen, XU Wei, ZHANG Yan-Jiao, ZHOU Hui-Hui and AI Qing-Hui
(Key Laboratory of Mariculture, Certificated by Education Ministry of China, Ocean University of China, Qingdao 266003, China)
To investigate effects of dietary glutamine on activities of non-specific immune related enzymes and antihypoxia stress capacity of half-smooth tongue sole (Cynoglossus semilaevis Günther) post larvae, four isonitrogenous and isolipidic experimental diets supplemented with 0, 0.5%, 1.0% and 2.0% gluta-mine (with dietary free glutamine estimated to be about 0.03%, 0.46%, 0.91% and 1.73%) were formulated and fed 5 times per day to C. semilaevis post larvae (35 days after hatching, 10.64±0.86 mg dry weight) for 30 days before hypoxia stress test. Results revealted that the 0.5% glutamine supplemented diet significantly increased activities of lysozyme in fish whole body compared to the control group (P<0.05), but different glutamine level did not impact the activities of total nitric oxide synthase and inducible nitric oxide synthase in fish whole body (P>0.05). C. semilaevis HIF-1α gene were cloned and 749 bp partial cDNA sequence were obtained, which shared high identities with many other fish species. Quantitative Real-time PCR showed that glutamine supplementation did not regulate the expressions of HIF-1α in fish after hypoxia stress (P>0.05). In summary, dietary glutamine could enhacne the activities of LZM and the non-specific immunity of C. semilaevis post larvae.
Glutamine; Cynoglossus semilaevis; Post larvae; Non-specific immune; HIF1-α; Gene cloning and expression
S963.7
A
1000-3207(2016)04-0736-08
10.7541/2016.97
2015-04-08;
2015-11-24
国家鲆鲽类产业技术体系(编号: CARS50-G08)资助 [Supported by the National Flatfish Industry System Construction Programme (No. CARS50-G08)]
刘经纬(1989—), 女, 河北承德人; 硕士; 研究方向为水产动物营养与饲料。E-mail: kivi_liu@163.com
艾庆辉, 教授; qhai@ouc.edu.cn

