饲料中添加壳聚糖季铵盐对凡纳滨对虾生长及非特异免疫的影响
钟国防吴国忠张明辉
(1. 上海海洋大学水产与生命学院, 上海 201306; 2. 中国科学院上海应用物理研究所, 上海 201216;3. 上海市水产技术推广站, 上海 200433)
饲料中添加壳聚糖季铵盐对凡纳滨对虾生长及非特异免疫的影响
钟国防1吴国忠2张明辉3
(1. 上海海洋大学水产与生命学院, 上海 201306; 2. 中国科学院上海应用物理研究所, 上海 201216;3. 上海市水产技术推广站, 上海 200433)
实验研究壳聚糖季铵盐对凡纳滨对虾生长性能及非特异性免疫能力的影响。在饲料中分别添加0、0.05%、0.10%、0.15%和0.20%的壳聚糖季铵盐, 制成5组等氮等能饲料。将900尾[初体质量(3.82±0.34) g]健康的凡纳滨对虾随机分成5组(45尾×4平行), 养殖时间56d。结果表明:饲料中添加壳聚糖季铵盐显著影响凡纳滨对虾的生长, 0.15%实验组凡纳滨对虾的增重率和特定生长率最佳(P<0.05)。饲料中添加壳聚糖季铵盐0.1%、0.15%和0.20%能显著提高凡纳滨对虾血清溶菌酶和碱性磷酸酶及酚氧化酶的活性(P<0.05)。饲料中添加壳聚糖季铵盐可显著提高凡纳滨对虾抗副溶血弧菌感染的能力(P<0.05), 0.15%组的保护效果最好, 其相对免疫保护率为33.24%。壳聚糖季铵盐能显著提高凡纳滨对虾的生长性能和抗病能力, 本实验条件下适宜的添加量为0.15%。
凡纳滨对虾; 壳聚糖季铵盐; 生长性能; 抗病力; 副溶血弧菌
凡纳滨对虾(Litopenaeusvannamei)又名南美白对虾, 是目前我国重要的养殖品种。近年来因抗逆性强的良种缺乏, 在集约化养殖过程中通常会由于养殖水质恶化而发病率很高, 养殖成功率不断降低。同时, 养殖生产中使用防病药物较多, 造成病原体耐药问题, 也可能造成养殖商品虾药物残留,影响食用安全。与其他的水生鱼类相比, 凡纳滨对虾免疫反应比较原始, 免疫能力主要来自于非特异性的防御机能[1], 提高其非特异性免疫力是提高养殖成活率的重要途径。因此, 寻找一种绿色、安全、环保的免疫增强剂是目前凡纳滨对虾养殖中亟待解决的问题。目前, 已有学者在这方面做了大量的研究, 结果发现, 壳聚糖不但能提高水产动物存活率和生长性能, 还能提高水产动物免疫力, 并且具有无残留、无抗药性等特点[2], 是一种良好的免疫增强剂。Wang等[3]研究发现对凡纳滨对虾腹血窦注射4 μg/g体重的壳聚糖, 可以增强其免疫能力和对溶藻弧菌(Vibrioalginolyticus)感染的抵抗能力。壳聚糖(Chitosan)又称甲壳质、壳多糖, 是唯一一种阳离子动物纤维和碱性多糖, 它可以通过水解、烷基化、酰基化、羧甲基化、磺化、硝化、卤化、氧化、还原、缩合和络合等反应, 生成各种具有不同性能的壳聚糖衍生物[4]。壳聚糖季铵盐(Chitosan quaternary ammonium salt)是为了克服壳聚糖溶解性不足而进行的季铵盐化改性的重要衍生物, 分子量小、比壳聚糖更易溶于水, 目前已在农业、食品、医药、纺织和生物医学工程等领域得到了广泛应用[5]。它不仅具有良好的生物相容性、抗菌抑菌, 而且来源丰富、价格经济, 对取代抗生素等水产用药物或免疫促进剂有广阔前景。目前有关壳聚糖季铵盐对凡纳滨对虾生长、免疫及机体经壳聚糖免疫强化后的抗感染能力的系统研究还没有相关报道。
本研究通过在凡纳滨对虾饲料中添加不同浓度的壳聚糖季铵盐, 观察其生长性能及血清中与非特异免疫相关的几种重要酶活性的变化来分析免疫酶活性与抗菌能力的相互关系, 采用人工注射副溶血弧菌(Vibrio Parahaemolyticus)感染的方法, 统计累计死亡率来进一步验证壳聚糖季铵盐在提高免疫力方面的作用效果, 为壳聚糖季铵盐的在凡纳滨对虾中的应用提供理论依据。
1 材料与方法
1.1 实验设计及实验饲料
在饲料中添加0、0.05%、0.10%、0.15%和0.20%的壳聚糖季铵盐, 制成5组等氮等能饲料(表 1)。壳聚糖季铵盐由中国科学院上海应用物理研究所提供, 饲料原料购自杭州海皇生物科技有限公司。原料经粉碎后过80目筛, 用绞肉机制粒(粒径2.5 mm), 风干后-20℃储存备用。实验共分为5个组, 将900尾[初体质量(3.82±0.34) g]健康凡纳滨对虾随机分成5组(45尾×4平行), 养殖时间56d。

表 1 饲料配方及营养组成表(干物质基础)Tab. 1 Ingredients and proximate compositions of experimental diets (DM basis) (% )
1.2 养殖管理
选择健壮且体型匀称的对虾先暂养两周, 称取900尾虾随机放入20个网箱(2 m×1.2 m×1.2 m)中,每个网箱45尾。实验共分5个实验组, 每组4个平行。每天投喂两次(07:00和18:00), 日投饲量为虾体重的3%—5%, 每两周取样称重调整投饲量, 每周测定水质指标, 养殖期间水温21—28℃, 溶解氧5.2—10.12 mg/L, 氨氮0—0.2 mg/L, 亚硝酸盐0—0.1 mg/L。养殖实验持续56d。
1.3 样品采集
养殖试验结束后, 停食24h取样, 每尾虾称重后,每平行取15尾虾的血淋巴液, 用肝素钠(125 U/ mL)防止凝固。同一平行的血淋巴液混合放入3个2 mL离心管中, 离心(10min, 8 000 r/min, 4℃)分离血清备用。取肝胰脏和肌肉置于-20℃冰箱中保存待测。
1.4 测定指标和方法
实验期结束后捞出网箱中虾, 计数称重, 并计算成活率、增重、饲料系数及特定生长率, 计算方法如下:
成活率(Survival ratio, %)=100×试验结束时尾数/试验开始时尾数;
增重 (Weight gain, WG, g)=末体重-初始体重;
饲料系数(Feed conversion ratio, FCR)=(投料量-残饵量)/(末体重-初始体重+死亡体重);
特定生长率(SGR, %/d) =100×(ln终末体重-ln初始体重)/实验天数。
饲料营养成分测定:水分测定用105℃常压干燥法, 粗灰分测定用550℃灼烧法, 粗蛋白质测定用杜马斯燃烧法[6], 粗脂肪测定用氯仿-甲醇法[7], 每个样品测3个重复。
超氧化物歧化酶(Superoxide dismutase, SOD,黄嘌呤氧化酶法), 碱性磷酸酶(ALP)采用南京建成生物工程研究所(江苏, 南京)购试剂盒测定。1个超氧化物歧化酶(SOD)活力单位(U)定义为每毫升血清中SOD抑制率达50%时所对应的SOD量。碱性磷酸酶(AKP): 1个单位(U)定义为每毫升血清在37℃与基质作用15min产生1 mg酚。酚氧化酶活力参照Ashida[8]和陈乃松[9]的方法稍加调整测定, 以实验条件下每分钟光密度值增加0.001为1个活性单位(U)。
1.5 攻毒实验
生长实验结束后, 每个平行取15尾虾, 进行攻毒实验。从腹腔注射0.05 mL(浓度为1.0×108cell/ mL)副溶血弧菌悬浊液进行人工感染, 对照组注射等剂量PBS缓冲液, 攻毒后各组分别继续投喂相应的实验饲料或基础饲料, 及时捞出死亡对虾, 记录死亡数量和死亡时间, 12d 后结束感染实验。攻毒所用副溶血弧菌菌种由上海海洋大学(张庆华)实验室提供, 将菌株扩大培养后, 用灭菌生理盐水洗脱,然后用法国梅里埃公司生产的浊度仪调到实验所需浓度。
1.6 数据处理
实验数据用SPSS 17.0 软件进行单因子方差分析(one-way ANOVA, LSD), 若存在显著差异则进行Duncan多重比较。所有统计值均以平均值±标准差(Mean±SD)表示, 显著水平定为P<0.05。
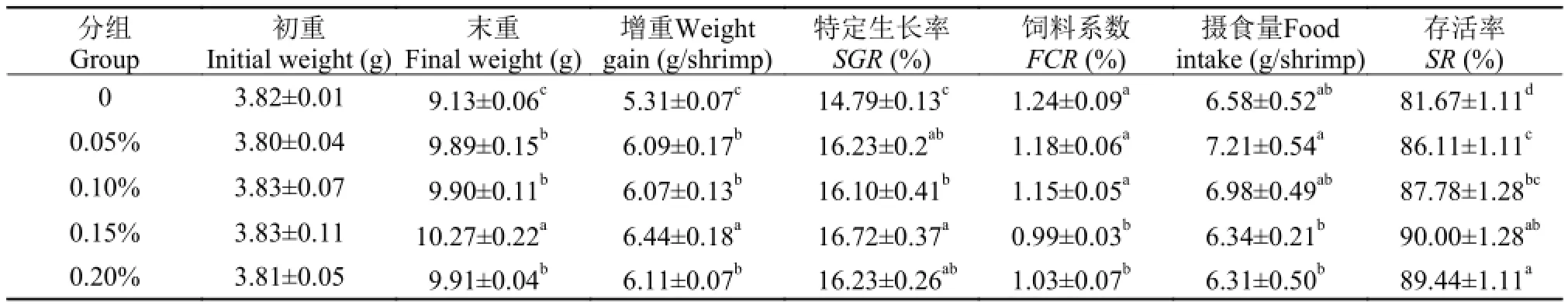
表 2 饲料中添加壳聚糖季铵盐对凡纳滨对虾生长性能的影响Tab. 2 Effects of adding chitosan quaternary ammonium salt in diets on the growth performance of Litopenaeus vannamei
2 结果
2.1 饲料中添加壳聚糖季铵盐对凡纳滨对虾生长性能的影响
壳聚糖季铵盐能显著影响凡纳滨对虾的生长性能, 实验组平均尾增重显著高于对照组(P<0.05),0.15%实验组增重最大, 比对照组提高了21.28%。各实验组特定生产率(SGR)均显著高于对照组,0.15%实验组SGR最佳P<0.05)。0.15%和0.20%的壳聚糖季铵盐能显著降低饲料系数(F C R)(P<0.05),且0.15%低于对照组和各实验组; 添加量为0.05%和0.10%的实验组摄食量有所增加, 但与对照组没有显著差异(P>0.05),但0.15%和0.20%组摄食量显著低于对照组(P<0.05); 壳聚糖季铵盐对凡纳滨对虾的成活率(SR)显著提高(P<0.05), 但添加量为0.15%和0.20%的实验组成活率不再出现显著差异(P>0.05)。
2.2 饲料中添加壳聚糖季铵盐对凡纳滨对虾非特异性免疫能力的影响
由表 3可知, 0.05%的壳聚糖季铵盐实验组与对照组血清溶菌酶的活性没有显著差异(P>0.05),但0.10%、0.15%和0.20%的实验组溶菌酶的活性显著高于对照组 (P<0.05), 0.15%和0.20%两个实验组之间溶菌酶的活性没有显著性差异(P>0.05)。0.05%的壳聚糖季铵盐实验组与对照组血清超氧化物歧化酶的活性没有显著差异(P>0.05), 但0.10%、0.15%和0.20%的实验组超氧化物歧化酶的活性显著高于对照组 (P<0.05), 0.15%和0.20%两个实验组之间超氧化物歧化酶的活性没有显著性差异(P>0.05)。0.05%的壳聚糖季铵盐实验组与对照组血清碱性磷酸酶的活性没有显著差异(P>0.05), 但0.10%、0.15%和0.20%的实验组碱性磷酸酶的活性显著高于对照组 (P<0.05), 0.15%和0.20%两个实验组之间碱性磷酸酶的活性没有显著性差异(P>0.05)。壳聚糖季铵盐能显著提高凡纳滨对虾血清酚氧化酶的活性(P< 0.05), 且0.15%显著高于其他各实验组。
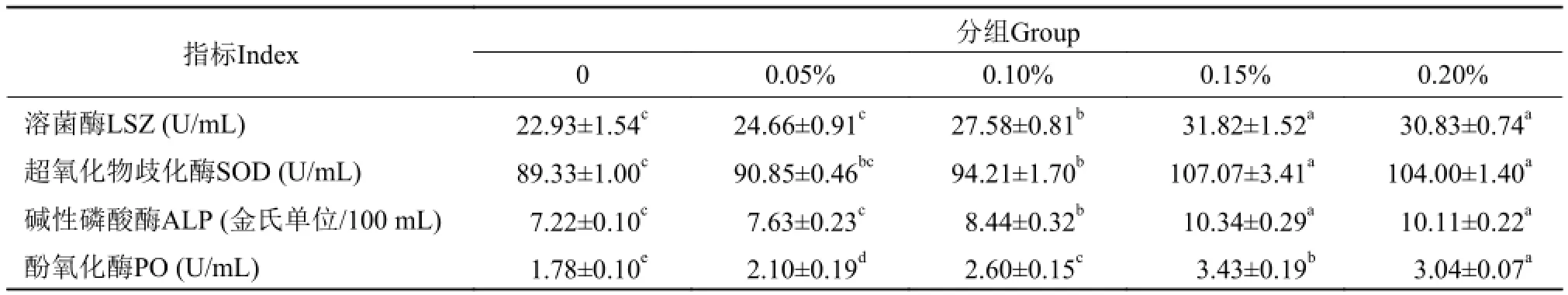
表 3 饲料中添加壳聚糖季铵盐对凡纳滨对虾非特异性免疫能力的影响Tab. 3 Effects of adding chitosan quaternary ammonium salt in diets on nonspecific immunity of Litopenaeus vannamei

表 4 凡纳滨对虾被副溶血弧菌感染后的累积死亡率Tab. 4 Cumulative mortality of L. vannamei challenged with V. parahaemolytics (%)
2.3 饲料中添加壳聚糖季铵盐对凡纳滨对虾攻毒后死亡率影响
由表 4可知, 感染副溶血弧菌后的第1天开始有虾死亡, 但前3天的死亡率都没有显著性差异(P>0.05), 从感染后第4天开始死亡率加速, 对照组的死亡率显著高于添加了壳聚糖季铵盐的实验组。对照组在感染后的第10 天死亡率为100%, 显著高于各实验组(P<0.05)。添加壳聚糖季铵盐的各实验组在感染后的第9天死亡率基本趋于稳定, 到第11天, 壳聚糖季铵盐添加量为0.10%、0.15%和0.20%的3个实验组凡纳滨对虾不再死亡。实验结果表明, 投喂0.05%、0.10%、0.15%和0.20%等不同梯度的壳聚糖季铵盐饲料可显著提高凡纳滨对感染副溶血弧菌后的存活率(P<0.05), 其免疫相对保护率分别为(6.67±6.67)%、(11.11±3.84)%、(33.33±6.67)%和(31.11±3.84)%, 当添加量达0.15%后效果显著。
3 讨论
3.1 壳聚糖季铵盐对凡纳滨对虾生长性能的影响
壳聚糖作为水产动物饲料添加剂, 可以降低饵料系数, 提高水生动物的生长性能。具体机制主要是通过改善肠道微生态环境, 促进动物消化吸收,提高饲料利用率。Ouattara等[10]认为壳聚糖可吸附菌体细胞壁上的带负电荷物质(如脂多糖、磷壁脂酸), 缓冲动物机体酸性内环境, 使菌体细胞壁破损,抑制细菌生长繁殖 ; 壳聚糖也能吸附或螯合进入肠道内的重金属及其他有害物质, 将其排出体外,以降低对生长的不良影响[11, 12]。在本实验中随着添加量的增加存活率逐渐提高, 可能与壳聚糖能调节脂肪代谢, 减少脂肪肝病的发生相关。壳聚糖能与胆汁酸络合,促使血液和肌肉中的胆固醇转化成胆汁酸, 从而降低胆固醇的浓度; 或者与脂肪、脂肪酸和胆固醇等脂类物质结合成络和物, 由于其产物有强疏水性, 且不能被胃酸水解, 不被消化系统吸收, 而随粪便排出[13]。目前有关壳聚糖在异育银鲫(Carassiusauratusgibelio)和暗纹东方鲀(Takifugu obscurus)的研究中发现, 饲料中添加不同浓度的壳聚糖可以提高肠道中蛋白酶和淀粉酶的活性, 从而可促进生长性能[14, 15]。壳聚糖在甲壳动物上的应用研究表明, 其适宜的添加量随养殖对象的不同而有差异。Tan等在克氏原螯虾(Procamgbarusclarkii)研究中发现, 饲料中添加不同浓度的壳聚糖其特定生长率呈先升高后降低的趋势, 以1.0%壳聚糖添加组最高[16], 而Niu等[17]在凡纳滨对虾的研究表明, 饲料中添加2 g/kg(0.2%)的壳聚糖就可显著提高对虾的生长性能。对于同一种虾, 其适宜的添加量则会随壳聚糖形式不同而有差异。本实验结果表明, 壳聚糖季铵盐在凡纳白对虾中的最适添加量为0.15%, 与Niu等[17]认为的2 g/kg(0.2%)并不一致, 这主要是壳聚糖季铵盐通过改性后分子量变小、更易溶于水, 其相关的性能优于壳聚糖所致。本实验结果还表明, 当壳聚糖季铵盐超过0.15%后, 生长性能并没有继续提高, 这主要是因为壳聚糖作为甲壳素脱乙酰基后的多糖类产物, 一定量的壳聚糖被虾吸收利用后可促进其几丁质酶的分泌, 使其顺利蜕壳生长[18], 过量添加会因壳聚糖具有很强的吸附蛋白质或离子的能力, 导致必需的营养物质被其吸附而降低消化吸收能力, 从而影响其生长[19]。
3.2 壳聚糖季铵盐对凡纳滨对虾非特性免疫能力的影响
凡纳滨对虾属于甲壳动物, 其免疫能力主要依靠天然的可诱导的非特异性免疫防御系统, 包括细胞免疫及体液免疫因子[20, 21]。壳聚糖作为重要的免疫增强剂在对虾非特异性免疫方面发挥着重要作用, 其具体的内在调节机制主要包括以下两方面:(1)调节机体血细胞总数, 激活体液免疫因子,提高存活率和抗感染力; (2)调控对虾体液免疫因子的基因表达量, 进而增强相关免疫因子的活性, 最终提高对虾的非特异性免疫防御能力[22]。Wang和Chen[23]通过对凡纳滨对虾体内注射4 μg/g体重的壳聚糖, 结果发现实验组免疫能力和对溶藻弧菌感染的抵抗能力显著高于对照组。在本实验中当壳聚糖季铵盐添加量为0.10%、0.15%和0.20%时, 可显著提高凡纳滨对虾血清中溶菌酶、酚氧化酶、超氧化物歧化酶和碱性磷酸酶的活性。溶菌酶是凡纳滨对虾体液免疫因子之一, 它不仅能增强机体巨噬细胞吞噬能力和消化功能, 还能破坏和消除侵入体内的异物, 从而实现机体的免疫防御[24]。在本研究中, 当壳聚糖季铵盐的添加量大于0.10%时可以显著提高血清溶菌酶活性, 而低浓度组血清溶菌酶活性与对照组没有差别。胡琳琳等[25]在凡纳滨对虾饲料中添加壳聚糖硫酸盐结果发现, 0.15‰和0.50‰的壳聚糖硫酸盐添加组对虾的溶菌酶和酚氧化酶活性均得到显著提高。酚氧化酶是对虾体内参与免疫反应的主要酶类之一, 它在一定刺激下即可被激活并产生一系列生物活性物质, 促进血细胞的吞噬和包裹作用最终提高免疫力[26]。研究表明极微量的多糖成分就可激活酚氧化酶原激活系统[27]。在本研究中, 饲料中壳聚糖季铵盐的添加量在0.05%—0.20%, 凡纳滨对虾血清酚氧化酶活性随着添加量增大而增高, 这说明壳聚糖季铵盐也能激活酚氧化酶原激活系统, 可以显著提高对虾血淋巴中的酚氧化酶活力。超氧化物歧化酶通过清除超氧阴离子自由基(O-2)在机体的氧化与抗氧化平衡中起着重要作用, 进而保护细胞免受损伤。目前有关多糖类免疫增强剂对凡纳滨对虾血清超氧化物歧化酶活力影响的研究结果存在较大差异。在本研究中, 壳聚糖季铵盐可以提高对虾血清超氧化物歧化酶活性, 但添加量过高其活性反而下降。张明等[28]用脂多糖注射到中国明对虾体中, 结果发现血清的超氧化物歧化酶活力显著高于对照组。王秀华等[29]在凡纳滨对虾饲料中添加肽聚糖, 结果发现添加量过高或过低, 其血清超氧化物歧化酶活性均略低于对照组, 但与对照组的差异不显著; 而日本囊对虾(Penaeusjaponicus)饲料中添加肽多糖, 对血清超氧化物歧化酶活性并不产生影响[30]。造成这些结果的差异除了养殖品种和养殖环境的不同外, 可能与饲料中维生素C的含量有关, 因为维生素C为抗氧化剂, 也可以清除体内超氧阴离子自由基[31]。碱性磷酸酶是组成溶酶体酶的重要部分, 直接参与磷酸化代谢和转移, 同时又在DNA和蛋白质和脂类代谢过程中发挥重要作用[32]。陈国福等[33]在研究中发现饲料中添加肽聚糖可提高凡纳滨对虾血清中碱性磷酸酶的活性, 同时育苗水体中加入肽聚糖对幼体非特异性免疫水平有显著的提升。同样在本实验中当壳聚糖季铵盐添加量达到0.10%时即可显著提高凡纳滨对虾血清中碱性磷酸酶的活性。综上所述, 根据凡纳滨对虾免疫相关酶活性的变化可以证明在饲料中添加壳聚糖季铵盐可提高凡纳滨对虾免疫力, 这与李云华等[34]在克氏原螯虾中的研究结果相似。此外, 毛文敏等[35]在克氏原螯虾的研究中还发现壳聚糖可以在一定程度上起到抵抗低温应激的作用, 有效防止免疫功能降低。
3.3 壳聚糖季铵盐对凡纳滨对虾抗感染能力的影响
水生动物攻毒后成活率是衡量其疾病抵抗力的重要指标, 而疾病抵抗力可反映出营养物质对机体免疫调节作用的效果。Anderson等[36]在给北美溪鳟注射和浸泡壳聚糖28d后进行攻毒实验, 最后发现两种处理方式的成活率分别为60%和50%。他认为主要原因是机体受壳聚糖刺激后, 类似于异物入侵从而激活体内的免疫应答系统, 使机体能更有效的抵抗即将入侵的病原体。Rajeshkumar等[37]将含有白斑病毒VP28基因的DNA片段放入壳聚糖纳米粒中饲喂凡纳滨对虾, 结果发现, 凡纳滨对虾对白斑病毒的抵抗力显著提高, 成活率明显上升。在本实验中以副溶血弧菌对实验虾进行攻毒试验, 结果发现, 添加不同梯度的壳聚糖季铵盐可显著提高对凡纳滨对虾抗副溶血弧菌感染的能力, 在攻毒后第4天添加壳聚糖季铵盐组累计死亡率开始显著性低于对照组, 至实验结束后累计死亡率0.15%添加量组最低为66.67%, 对照组为100%。这表明经壳聚糖季铵盐免疫强化后的凡纳滨对虾也可以有效抵抗副溶血弧菌的感染能力, 这也进一步论证了壳聚糖季铵盐可提高机体免疫功能, 保障存活率。
综上, 在本实验条件下, 综合考虑壳聚糖季铵盐对凡纳滨对虾生长性能、免疫相关酶活及抗副溶血弧菌感染的能力的影响, 建议壳聚糖季铵盐的最适添加量为0.15%, 饲料中过多添加壳聚糖季铵盐对凡纳滨对虾生长及非特异免疫力的作用效果反而不佳, 其具体原因还有待进一步研究。
[1]Wang L, Li G Y. Research progress of humoral immune in crustaceans [J]. Marine Sciences, 1992, (3): 18—19 [王雷, 李光友.甲壳动物的体液免疫研究进展. 海洋科学,1992, (3): 18—19]
[2]Xiao W W, Feng L, Liu Y, et al. Effects of chitosan on immune function of aquatic animals and its possible regulation mechanism [J]. Chinese Journal of Animal Nutrition, 2010, 22(3): 544—550 [肖伟伟, 冯琳, 刘扬, 等. 壳聚糖对水生动物免疫能力的影响及其可能的调节机制.动物营养学报, 2010, 22(3): 544—550]
[3]Wang S H, Chen J C. The protective effect of chitin and chitosan against Vibrio alginolyticus in white shrimp Litopenaeus vannamei [J]. Fish and Shellfish Immunology, 2005, 19(3): 191—204
[4]Liu G H, Zhang W J, Xie Z J. The function of chitosan biological activity and its application in animal production [J]. China Feed, 2010, 23(6): 27—29 [刘国花, 张文举, 谢正军. 壳聚糖的生物学功能及其在畜牧生产中的应用. 中国饲料, 2010, 23(6): 27—29]
[5]Hou Y J, Xu J, Zhou Y M, et al. Research progress of chitosan biological activity and its application in animal production [J]. Feed Industry, 2015, 36(2): 5—13 [侯玉洁, 徐俊, 周瑶敏, 等. 壳聚糖的生物学活性及其在动物生产中的应用. 饲料工业, 2015, 36(2): 5—13]
[6]Etheridge R D, Pesti G M, Foster E H. A comparison of nitrogen values obtained utilizing the Kjeldahl nitrogen and Dumas combustion methodologies (Leco CNS 2000)on samples typical of an animal nutrition analytical laboratory [J]. Animal Feed Science and Technology, 1998,73(1): 21—28
[7]Huang K, Wu H Y, Zhu D G, et al. Effects of dietary lipid levels on growth and fatty acid composition in hepatopancreas and muscle of pacific white leg shrimp Litopenaeus vannamei [J]. Fisheries Science, 2011, 30(5):249—255 [黄凯, 吴宏玉, 朱定贵, 等. 饲料脂肪水平对凡纳滨对虾生长, 肌肉和肝胰腺脂肪酸组成的影响. 水产科学, 2011, 30(5): 249—255]
[8]Ashida M. Purification and characterization of prophenoloxidase from the hemolymph of the silkworm Bombyx mori [J]. Archives Biochemistry Biophysics, 1971, 144(2):749—762
[9]Chen N S, Wei T T, Liao Y Z. Effects of housefly larva meal and β-glucanon growth and immunity of Litopenaeus vannamei [J]. Journal of Fisheries of China, 2007,31(6): 771—777 [陈乃松, 魏涛涛, 廖奕招. 蝇蛆粉和β-葡聚糖对凡纳滨对虾生长和免疫的影响. 水产学报,2007, 31(6): 771—777]
[10]Ouattara B, Simard R E, Piette G, et al. Inhibition of surface spoilage bacteria in processed meats by application of antimicrobial films prepared with chitosan [J]. International Journal of Food Microbiology, 2000, 62(1):139—148
[11]Wan Ngah W S, Teong L C, Hanafiah M. Adsorption of dyes and heavy metal ions by chitosan composites: A re-view [J]. Carbohydrate Polymers, 2011, 83(4): 1446—1456
[12]Varma A J, Deshpande S V, Kennedy J F. Metal complexation by chitosan and its derivatives: a review [J]. Carbohydrate Polymers, 2004, 55(1): 77—93
[13]Juang R S, Shao H J. A simplified equilibrium model for sorption of heavy metal ions from aqueous solutions on chitosan [J]. Water Research, 2002, 36(12): 2999—3008
[14]Chen Y, Zhou H Q, Leng X J, et al. Effects of chitosan on growth and digestive emzyme in allogynogenetic silver crucian carp [J]. Journal of Fishery Sciences of China,2006, 13(3): 440—445 [陈勇, 周洪琪, 冷向军, 等. 壳聚糖对异育银鲫生长和消化酶的影响. 中国水产科学,2006, 13(3): 440—445]
[15]Hua X M, Zhou H Q, Zhang Y F. Effect of dietary supplemental chitosan and probiotics on growth and some digestive enzyme activities in juvenile fugu obscurus [J]. Acta Hydrobiologica Sinica, 2005, 29(3): 299—305 [华雪铭, 周洪琪, 张宇峰, 等. 饲料中添加壳聚糖和益生茵对暗纹东方鲀幼鱼生长及部分消化酶活性的影响. 水生生物学报, 2005, 29(3): 299—305]
[16]Tan S H, Degnan B M, Lehnert S A. The penaeus monodonchitinase 1 gene is differentially expressed in the hepatopancreas during the molt cycle [J]. Marine Biotechnology, 2000, 2(2): 126—135
[17]Niu J, Liu Y J, Lin H Z, et al. Effects of dietary chitosan on growth, survival and stress tolerance of postlarval shrimp, Litopenaeus vannamei [J]. Aquaculture Nutrition,2011, 17(2): 406—412
[18]Ren X F, Zhou X, Zhang P, et al. The effects of dietary chitosan supplementation on the survival, serum biochemical indicators and non-specific immunity of Procambarus clarkia [J]. Freshwater Fisheries, 2013, 43(3):77—82 [任秀芳, 周鑫, 张萍, 等. 壳聚糖对克氏原螯虾存活、血清生化指标和非特异性免疫功能的影响. 淡水渔业, 2013, 43(3): 77—82]
[19]Shiau S Y, Yu Y P. Dietary supplementation of chitin and chitosan depresses growth in tilapia, Oreochromisniloticus ×O. aureus [J] Aquaculture, 1999, 179(1—4): 439—446
[20]Fan Y J. Researching progresses in shrimp non specific immunity and disease control [J]. Marine Sciences, 2002,26(4): 26—31 [樊廷俊. 对虾非特异性免疫与对虾疾病监控的研究进展. 海洋科学, 2002, 26(4) : 26—31]
[21]Smith V J, Ratcliffe N A. Cellular defense reactions of the shore crab, Carcinusmaenas: invivo hemocytic and histopathological responses to injected bacteria [J]. Invertebrate Pathology, 1980, 35(3): 65—74
[22]Zhang J. Effects of dietary immunostimulants on growth,non-specific immune response and stress resistance of juvenile pacific white shrimp, Litopenaeus vannamei [D]. Thesis for doctor of Science. Sun Yat-sen University,Guangzhou. 2012 [张健. 免疫增强剂对凡纳滨对虾幼虾生长、免疫及抗应激的影响. 博士学位论文, 中山大学.广州. 2012]
[23]Wang S H, Chen J C. The protective effect of chitin and chitosan against Vibrio alginolyticus in white shrimp Litopenaeus vannamei [J]. Fish and Shellfish Immunology, 2005, 19(3): 191—204
[24]Sonomi M, Jun-ichi H, Ikuo H. Expressionofjapanceseflounderc-typelysozyme cDNA in insect cells [J]. Developmental & Comparative Immunology, 2001, 25(5—6):439—445
[25]Hu L L, Fang W H, Gao L J, et al. Study on enhancement of Litopenaeus vannamei relied upon oral administration of chitosansulfate to resist the infection of white spots Yndrome virus [J]. MarineFisheries, 2008, 30(3):45—50 [胡琳琳, 房文红, 高露姣, 等. 壳聚糖硫酸酯提高凡纳滨对虾抗白斑综合征病毒感染力的研究. 海洋渔业, 2008, 30(3): 45—50]
[26]Xiao K Y, Deng S M, Xiang J G. The Immunization and Application of Aquatic Animals [M]. Beijing: Science Press. 2007, 139—142 [肖克宇, 邓时铭, 向建国. 水生动物免疫与应用. 北京: 科学出版社. 2007, 139—142]
[27]Wang X F, Fan Y J, Cong R S, et al. Effects of several immunostimulants on the number,ultrastructure of hemocytes and the yield, activities of phenoloxidase in Penaeus chinensis [J]. Journal of Fisheries of China, 2005,29(1): 66—73 [汪小锋, 樊廷俊, 丛日山, 等. 几种免疫促进剂对中国对虾血细胞数量、形态结构以及酚氧化酶产量和活性的影响. 水产学报, 2005, 29(1): 66—73]
[28]Zhang M, Wang L, Guo Z Y, et al. Effect of lipopolysaccharide and Vibrio anguillarum on the activities of phosphatase, superoxide dismutase and the content of hemocyanin in the serum of Fenneropenaeus chinesis [J]. Marine Sciences, 2004, 28(7): 22—25 [张明, 王雷, 郭振宇,等. 脂多糖和弧菌对中国对虾血清磷酸酶、超氧化物歧化酶和血蓝蛋白的影响. 海洋科学, 2004, 28(7):22—25]
[29]Wang X H, Song X L, Huang J. Effects of peptidoglycan (PG) preparation on humoral immune factors of Litopenaeus vannamei [J]. Journal of Fishery Sciences of China, 2004, 11(1): 26—30 [王秀华, 宋晓玲, 黄倢. 肽聚糖制剂对南美白对虾体液免疫因子的影响. 中国水产科学, 2004, 11(1): 26—30]
[30]Wang X H, Song X L, Huang J. Effect of peptidoglycan preparation on the relative non-specific immune factors in hemolymph of shrimp, Marsupenaeus japonicas [J]. High Technology Letters, 2004, 14(5): 78—81 [王秀华, 宋晓玲, 黄倢. 肽聚糖制剂对日本对虾非特异免疫因子的作用. 高技术通讯, 2004, 14(5): 78—81]
[31]Ai C X, Chen L Q, Gao L J. Effect of vitamin C on SOD,ALP and ACP activitiesof Chinese mitten-handed crab,Eriocheir sinensi [J]. Journal of Oceanography in Taiwan Strait, 2002, 21(4): 431—438 [艾春香, 陈立侨, 高露姣,等. Vc对河蟹血清和组织中超氧化物歧化酶及磷酸酶活性的影响. 台湾海峡, 2002, 21(4): 431—438]
[32]Zhou J, Song X L, Huang J, et al. Effect ofA 3α peptidoglycan on different tissues of superoxide dismutase and phosphatase activity in Paralichthys olivaceus [J]. Journal of Fishery Sciences of China, 2004, 11(4):296—301 [周进, 宋晓玲, 黄倢, 等. A3α肽聚糖对牙鲆不同组织中超氧化物歧化酶及磷酸酶活性的影响, 中国水产科学, 2004, 11(4) : 296—301]
[33]Chen G F, Zhang C G, Wang G Y, et al. Effect of A3α peptidoglycan on acid phosphatase and alkaline phosphatase activities in larval white leg shrimp Litopenaeus vannamei [J]. Fisheries Science, 2008, 27(11): 584—587[陈国福, 张春云, 王光玉, 等. A3α肽聚糖对凡纳滨对虾幼体酸性磷酸酶和碱性磷酸酶活力的影响. 水产科学,2008, 27(11): 584—587]
[34]Li Y H, Li T Y, Huang J F, et al. Effects of chitosan on enzyme activities related to immune function in Procamgbarus clarkia [J]. China Feed, 2009, (20): 28—30 [李云华, 李太元, 黄金凤, 等. 壳聚糖对克氏原螯虾几种免疫相关酶活性的影响. 中国饲料, 2009, (20): 28—30]
[35]Mao W M, Liu Q, Xu J, et al. Effect of chitosan on low temperature antistress to Procambarus clarkia [J]. Hubei Agricultural Sciences, 2013, 52(9): 2111—2113 [毛文敏,刘晴, 徐静, 等. 壳聚糖对克氏原螯虾抗低温应激的影响. 湖北农业科学, 2013, 52(9): 2111—2113]
[36]Anderson D P, Siwicki A K. Duration of protectionagainst Aeromonas salmonicida in brook trout immunostimulated with glucan or chitosan by injection orimmersion [J]. The Progressive Fish Culturist, 1994, 56: 258—261
[37]Rajeshkumar S, Venkatesan C, Sarathi M, et al. Oral delivery of DNA construct using chitosan nanoparticles to protect the shrimp from white spots yndrome virus (WSSV) [J]. Fish and Shellfish Immunology, 2009, 26(3):429—437
EFFECTS OF ADDING CHITOSAN QUATERNARY AMMONIUM SALT IN DIETS ON THE GROWTH PERFORMANCE AND NONSPECIFIC IMMUNITY OF LITOPENAEUS VANNAMEI
ZHONG Guo-Fang1, WU Guo-Zhong2and ZHANG Ming-Hui3
(1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China; 2. Shanghai Institute of Applied Physics, Chinese Academy of Sciences, Shanghai 201216, China; 3. Shanghai Fisheries Technical Extension Station, Shanghai 200433, China)
The current study investigated growth performance, nonspecific immunity of white shrimp (Litopenaeus vannamei) by supplementation of chitosan quaternary ammonium salt in diets with graded levels of 0 (control group),0.05%, 0.10%, 0.15% and 0.20% chitosan quaternary ammonium salt. Each diet was randomly fed to four cages of white shrimp with initial average weight (3.82±0.34) g in 20 cages (2.5 m×1.5 m×1 m) for 8 weeks. The result showed that the chitosan quaternary ammonium salt addition significantly improved growth performance with the best effect of weight gain and SGR in 0.15% group. The activity of lysozyme, alkaline phosphatase and phenol oxidase were significantly increased in the 0.1%, 0.15% and 0.20% trial groups (P<0.05). Chitosan quaternary ammonium salt effectively improved the ability of shrimp to resist the Vibrio parahaemolytics's infection (P<0.05) with the best performance in 0.15% trial group that is 33.24%. These data indicate that chitosan quaternary ammonium salt can significantly improve the growth performance and the ability resisting infection, and the optimum amount under current experimental condition is 0.15%.
Litopenaeus vannamei; Chitosan quaternary ammonium salt; Growth performance; Resistance to disease;Vibrio parahaemolytics
S963.7
A
1000-3207(2016)04-0712-08
10.7541/2016.94
2015-12-29;
2016-03-25
上海市科技兴农重点攻关项目[沪农科攻字(2014)第3-8号]; 水产动物遗传育种中心上海市协同创新中心(ZF1206)资助 [Supported by Shanghai Science and Technology Key Project for Promoting Agriculture (20140308); Shanghai University Knowledge Service Platform Project (ZF1206)]
钟国防(1974—), 男, 湖南临武人; 博士研究生; 主要研究方向为水产动物营养和水产健康养殖技术。E-mail: gfzhong@shou.edu.cn

