黄芪注射液对大鼠脑缺血再灌注后细胞凋亡的影响
孙艳秋
黄芪注射液对大鼠脑缺血再灌注后细胞凋亡的影响
孙艳秋
(河北省承德市中医院, 河北 承德 067000)
【摘 要】目的:探讨黄芪注射液对大鼠脑缺血再灌注损伤的保护作用及其可能的作用机制。方法:大鼠脑缺血再灌注模型的制备采用改良的四血管(4-VO)阻断法。采用TUNEL法检测海马神经元凋亡情况,RT-PCR法和免疫组织化学法分别检测caspase-3 mRNA及蛋白的表达。结果:模型组大鼠海马组织神经细胞凋亡指数及caspase-3表达均明显增多,与假手术组相比,差异具有统计学意义(P<0.05);而黄芪注射液可明显抑制脑缺血再灌注后的神经细胞凋亡,减少caspase-3的表达,与模型组相比,差异具有统计学意义(P<0.05)。结论:黄芪注射液对脑缺血再灌注大鼠脑损伤具有明显的脑保护作用,该作用机制可能与抑制caspase-3表达有关。
【关键词】黄 芪; 注射液; 脑缺血再灌注; caspase-3; 凋 亡
脑缺血再灌注后的神经细胞凋亡是脑损伤的重要标志,同时也可以作为检测药物疗效的指标[1]。细胞凋亡的发生是一个由基因调控的自主性、程序性细胞死亡过程,其中半胱氨酸天冬氨酸蛋白酶(caspase-3)的表达与细胞凋亡密切相关。黄芪注射液是中药黄芪提取物制成的针剂,每毫升含生药2g,是临床治疗缺血性脑血管病的常用药物,疗效确切[2],但目前对其发挥脑保护作用的具体机制尚无统一意见。本实验采用改良的四血管阻断法建立脑缺血再灌注大鼠模型,通过观察黄芪注射液对大鼠脑缺血再灌注损伤的保护作用及对caspase-3表达的影响,以探讨其治疗脑血管病的作用机制。
1 材料与方法
1.1 实验动物及试剂:选用成年健康SD大鼠72只,体质量220~280g,清洁级。原位细胞凋亡检测试剂盒购自Roche公司;兔抗大鼠caspase-3多克隆抗体购自美国Bioworld公司;免疫组化试剂盒购自北京中杉金桥公司;RT-PCR试剂盒购于大连宝生物公司。
1.2 方 法
1.2.1 分组及模型的制备:实验大鼠随机分为假手术组、模型组和黄芪注射液组(每组24只动物)。脑缺血再灌注大鼠模型的制备采用改良的四血管阻断法。首先采用直径0.5mm的电凝针烧灼双侧椎动脉,造成永久性闭塞。术后恢复24h,然后再分离双侧颈总动脉,用血管夹夹闭30min,造成短暂性脑缺血,然后松开血管夹恢复脑血流灌注。假手术组不夹闭血管,只需要切开皮肤后分离血管。黄芪注射液组造模前连续给药3d,每天腹腔注射黄芪注射液6mL/kg。
1.2.2 标本制备:脑血流恢复24h后从每组大鼠中随机选取8只,处死后取海马组织,石蜡包埋,制成4μm厚连续切片;而其余各组大鼠处死后于低温环境下分离海马组织,-80℃保存,备用。
1.2.3 TUNEL法检测细胞凋亡:石蜡切片经二甲苯脱蜡、酒精脱水后按TUNEL试剂盒具体方法操作染色后显微镜观察。凋亡细胞核呈棕黄色染色。于400倍光镜下计数海马CA1区中1/3段内凋亡细胞数,并计算凋亡指数(Apoptosis Index,AI)。AI=凋亡细胞数/总细胞数×100%。
1.2.4 RT-PCR法检测caspase-3 mRNA表达:称取冻存的各组大鼠海马组织,按试剂盒操作说明用TRIzol一步法提取RNA后并逆转录为cDNA,PCR仪扩增后采用2%的琼脂糖凝胶电泳鉴定PCR产物。数据分析使用的是凝胶分析软件Quantity one。
1.2.5 免疫组化法检测caspase-3蛋白表达:取各组大鼠海马组织的石蜡切片脱蜡至水,按试剂盒说明书步骤操作,caspase-3一抗浓度为1:100,DAB显色后封片观察。阴性对照片采用PBS代替一抗。于400倍光镜下随机选取4个视野进行观察,选用Med6.0软件测定阳性反应物的灰度值。
2 结 果
2.1 海马神经细胞凋亡指数:凋亡细胞的细胞核呈棕黄色细颗粒状,假手术组大鼠的海马区仅有少量细胞凋亡。与假手术组相比,则模型组大鼠海马组织的神经细胞凋亡指数则明显增高(P<0.05);,与模型组相比,黄芪注射液组大鼠海马组织神经细胞的凋亡指数明显减少(P<0.05),结果见表1。

表1 各组大鼠海马组织神经细胞凋亡情况
2.2 各组大鼠海马组织caspase-3表达情况:各组大鼠海马组织caspase-3的表达趋势在免疫组化和RTPCR结果是一致的。假手术组大鼠海马组织caspase-3 mRNA及蛋白均呈弱表达,而模型组大鼠海马组织caspase-3 mRNA及蛋白表达明显增多,与假手术组相比差异具有统计学意义(P<0.05);与模型组相比,黄芪注射液组大鼠海马组织caspase-3 mRNA及蛋白的表达明显减少,差异具有统计学意义(P<0.05),见图1,表2、3。

图2 各组大鼠海马组织Caspase-3 RT-PCR结果

表2 各组大鼠海马组织Caspase-3mRNA表达情况
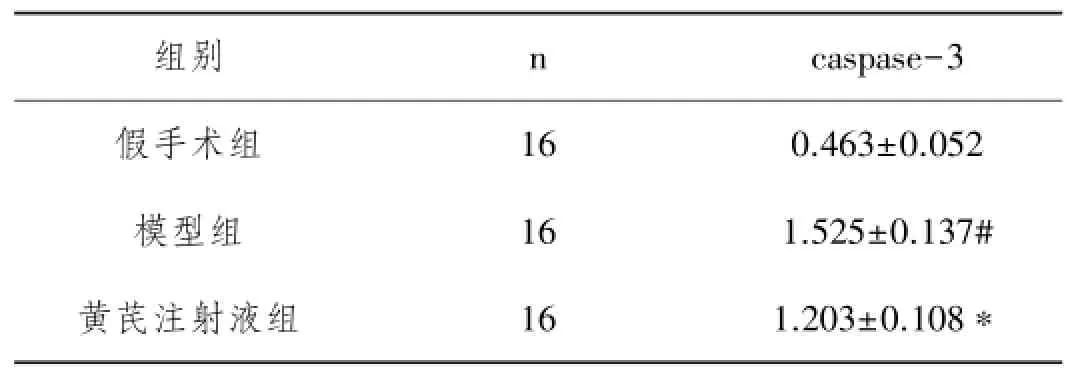
表3 各组大鼠海马组织Caspase-3蛋白表达情况
3 讨 论
脑血管病是目前世界上最常见的疾病之一,由于其发病率高、致残率高、死亡率高的特点,对人类生命及健康的危害性极大。缺血性脑血管病的主要治疗方法即溶栓治疗,目的是使脑血流恢复再灌注,但一些患者在缺血再灌注后不仅组织功能没有得到恢复,反而进一步加重缺血所导致的功能障碍和结构破坏,即脑缺血再灌注损伤。因此积极寻求预防及治疗脑缺血再灌注损伤的药物及治疗是治疗脑血管病的关键。
脑缺血再灌注后的神经细胞死亡与凋亡有关,这个观点是Shigeno等[3]于1990年首先提出的。细胞凋亡是由 caspase家族成员介导的蛋白酶级联反应。caspase家族是哺乳动物细胞凋亡的启动着和执行者,其中Caspase-3是整个凋亡过程的核心环节,它的激活可通过裂解DNA依赖性的蛋白激酶,改变其结构,最终导致细胞凋亡的发生[4]。
本实验采用先进的凋亡细胞检测技术TUNEL法来检测细胞凋亡。内源性核酸内切酶在核小体间切断DNA链,产生大量的3’-OH是细胞凋亡的生化反应特点,TUNEL法就是基于该原理而创建的,该方法可在组织切片上显示出尚未发生形态改变的早期凋亡细胞,并进行原位定量定性分析,是最常用亦为特异性细胞凋亡检测方法[5]。本研究通过TUNEL法检测细胞凋亡,结果显示在脑缺血再灌注大鼠的海马区可检测到较多的凋亡细胞,说明脑缺血再灌注后的神经细胞凋亡确是细胞死亡的途径之一,这一结果与既往研究结果相一致[6]。本研究还发现大鼠脑缺血再灌注前连续3d腹腔注射黄芪注射液可明显减少大鼠海马区的神经细胞凋亡,说明脑缺血后预防性应用黄芪注射液可以减少再灌注引起的脑损伤,从而起到脑保护作用。
【参考文献】
[1] 陈建珍,叶蓓.复方丹参注射液对大鼠脑缺血再灌注损伤细胞凋亡的影响[J].中国老年学杂志,2011,31(14):2711~2713.
[2] Lipton P.Ischemic cell death in brain neurons[J].Physiol Rev,1999,799(4):1431.
[3] Shigeno T,Yamaski Y,Kato G,et al.Reduction of delayed neuronal death by inhibition protein synthesis[J].Neurosci Lett,1990,120(1):117~119.
[4] 袁恒杰,陈宇华,任耘,等.丹参素钠对大鼠脑缺血再灌注损伤耐缺氧作用研究[J].中国医院药学杂志,2010,30 (18):1545~1549.
[5] Gavrieli Y,Shermany,Ben Sasson SA.Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation[J].Cell Biol,1997,119(3):493~501.
[6] 张亚丽,高维娟,闫凤霞,等.黄芪注射液抑制缺氧缺糖后复氧复糖大鼠海马神经细胞凋亡的研究[J].中国老年学杂志,2009,29(7):793~796.
【文章编号】1006-6233(2016)07-1147-03
【文献标识码】A 【doi】10.3969/j.issn.1006-6233.2016.07.036

