自噬抑制2-DG诱导内皮细胞凋亡
米 萱,杨 力,仇利红,宋雅娟,石 定,陈 琳,苏映军
实验研究
自噬抑制2-DG诱导内皮细胞凋亡
米 萱,杨 力,仇利红,宋雅娟,石 定,陈 琳,苏映军
目的 探讨2-脱氧-D-葡萄糖(2-DG)诱导人脐静脉血管内皮细胞发生凋亡与自噬及两者之间的关系。方法 传代培养人脐静脉血管内皮细胞,在常氧实验条件下,细胞被分为对照组,不同浓度的2-DG组、2-DG联合甘露糖组、阳性对照组(衣霉素组),利用MTS比色法检测2-DG对人脐静脉血管内皮细胞增殖活性的影响;利用Western blot免疫印记技术,检测细胞内质网应激相关蛋白-葡萄糖调节蛋白78(GRP78)的表达水平,以反映处理后的细胞内质网应激的水平变化;以Annexin V-PI流式细胞术检测人脐静脉血管内皮细胞凋亡。为了检测2-DG对细胞自噬的影响,引入自噬抑制剂3-MA, 采用Western blot 免疫印记技术,检测自噬相关蛋白Beclin 1和Atg 5的表达水平,以反映处理后的细胞自噬水平变化。结果 2-DG组细胞增殖活力明显降低,与对照组相比具有统计学意义,且该抑制作用呈剂量依赖性;2-DG联合甘露糖组增殖活力有所增加,与单独2-DG组相比具有统计学意义;2-DG组凋亡率明显增加,与对照组相比具有统计学意义,2-DG联合甘露糖组细胞凋亡减少,与单独2-DG组相比具有统计学意义;2-DG组GRP78蛋白水平增加,与对照组相比具有统计学意义;加入甘露糖后,GRP78蛋白水平减少,与单独2-DG组相比具有统计学意义;2-DG组 Beclin1和Atg5蛋白表达均有所增加,与对照组相比具有统计学意义;3-MA预处理细胞抑制自噬后,2-DG诱导的细胞凋亡增多,Beclin1和Atg5蛋白表达也有所减少,与2-DG组相比具有统计学意义。结论 2-DG显著抑制人脐静脉血管内皮细胞增殖,诱导人脐静脉血管内皮细胞凋亡及自噬;内质网应激可能是介导2-DG诱导细胞凋亡的相关作用机制;2-DG诱导的细胞自噬则能抑制细胞凋亡。
2-DG; 人脐静脉内皮细胞; 凋亡; 自噬; 内质网应激
2-脱氧-D-葡萄糖(2-deoxy-glucose,2-DG)是一种葡萄糖类似物,已有研究证实,2-DG可以抑制多种肿瘤细胞的增殖、分化和迁移,可作为包括肺癌、乳腺癌、骨肉瘤等多种肿瘤化疗的辅助用药,其作为新的抗肿瘤药物已进入Ⅱ期临床研究[1]。
研究发现,2-DG的抗肿瘤作用涉及多个不同机制,其中最经典的是其糖酵解抑制作用。 在组织缺氧的情况下, 2-DG能够和葡萄糖竞争性结合己糖激酶(HK),形成的产物不能被6-磷酸葡萄糖异构酶(PGI)利用转化,而使糖酵解停止,细胞能量“剥夺”,致使细胞死亡。1978年,R Datama等提出了2-DG对蛋白质糖基化有干扰作用,此后,众多研究对该作用的发生机制进行了验证[2](M Kurtoglu, 2007年)。研究发现,2-DG可诱导多个细胞系发生自噬[3-4]。在众多的自噬相关基因中,有两个重要的基因:Beclin1和Atg5,Beclin1为Atg6的同源类似物,参与自噬小体的形成,介导自噬的起始[5]。Atg5参与了两个泛素样连接系统,促进自噬小体的形成(N Mizushima, 2003年)。自2014年1月,第四军医大学西京医院采用2-DG诱导人脐静脉内皮细胞凋亡和自噬, 探讨2-DG诱导的凋亡和自噬之间的关系。
1 材料与方法
1.1 实验细胞及主要试剂 人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs, 美国SCIENCELL公司);2-脱氧葡萄糖(2-DG)、3-甲基腺素 (3-MA)、衣霉素(Tunicamycin)、甘露糖(D-mannose)购自美国SIGMA公司;内皮细胞培养液ECM(北京裕恒丰公司);MTS试剂(美国PROMEGA公司);凋亡检测试剂盒(北京宝赛生物技术有限公司);抗人多克隆抗体APG5、抗人多克隆抗体 Beclin1 购自美国SANTA CRUZ公司。
1.2 细胞培养 在37℃、5%CO2、饱和湿度条件下的细胞培养箱中,用含10%胎牛血清的ECM培养HUVECs细胞,待细胞达对数生长期后,用不同浓度的2-DG处理细胞。2-DG与D-mannose联合作用组中加入D-mannose,用以部分逆转细胞的N-连接糖基化。2-DG与3-MA联合作用组中的3-MA,于2-DG处理前1 h加入,预处理用以抑制细胞自噬。
1.3 MTS比色分析 用ECM培养液将HUVECs配成单个细胞悬液,接种浓度为1×105/ml,每孔体积100 μl接种于96孔板中。将接种细胞的96孔板置于37℃、5%CO2、饱和湿度条件下的细胞培养箱中培养24 h,对照组为空白对照,2-DG的工作浓度为:实验2组0.05 mmol/L、3组0.50 mmol/L、4组5.00 mmol/L;5~7组在2~4组的基础上加入D-mannose,D-mannose的工作浓度为0.50 mmol/L;8组为Tunicamycin组,工作浓度为1 μg/ml,Tunicamycin为N-连接糖基化抑制剂,可以诱导ERS。细胞经处理24 h后, 每孔加入20 μl MTS溶液(cell Titer 96 Aqueous One Solution Reagant),在37℃、5%CO2、饱和湿度条件下孵育4 h后,在酶标仪上分析,设定读取波长为570 nm,记录各孔光密度(OD)值。
1.4 Annexin V-PI流式分析 培养细胞密度达到90%左右,此时细胞处于对数生长期,收集细胞并计数后,将细胞接种于6孔培养板,按实验要求分组铺板,待细胞贴壁后,加药处理。将事先配好的4种药用培养基稀释,对细胞进行换液加药。
分组为Control、2-DG 10 mmol/L、2-DG 10 mmol/L+1 mmol/L D-mannose、2-DG 10 mmol/L+2 mmol/L 3-MA、2 mmol/L 3-MA。将接种好的细胞置于37℃、5%CO2细胞培养箱中,培养24 h后,进行流式检测。先将细胞离心,转速1500 r/min,5 min后收集细胞,吸去上清液,用PBS洗涤细胞2次,离心,小心吸去上清液,残留约50 μl的PBS,每管细胞样品中加入500 μl Binding Buffer轻轻重悬细胞。加入5 μl Annexin V-FITC混匀后,加入10 μl Propidium Iodide,混匀。室温避光孵育15 min。随即上流式机进行检测。
1.5 Western blot免疫印记实验 利用Western blot 免疫印迹法检测细胞的GRP78和Beclin1、Atg5蛋白水平。收集实验处理过的细胞, 用预冷的PBS洗涤2次,将室温融化的裂解液混入体积1%的PMSF,加入相应体积的裂解液,置于冰上静置5 min。于低温冷冻离心机中离心,4℃,12 000 r/min,离心10 min,分离得到的上清液即为蛋白质抽提物。用 BCA 法测定蛋白浓度后,通过蛋白上样、SDS-PAGE电泳、转膜、孵育一抗、二抗、 ECL底物发光、封闭等步骤后,将胶片进行扫描,用凝胶图像处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值,以GAPDH为内参,计算出目的条带的相对光密度值。

2 结果
2.1 2-DG抑制HUVECs细胞增殖 对照组HUVECs的增殖活力最大,与对照组相比,细胞活力随着2-DG浓度的增加而逐渐减小,0.05 mmol/L 2-DG处理组只能小幅度抑制HUVECs的活力,5.00 mmol/L 2-DG对HUVECs的抑制作用最为明显。而5~7组分别在2~4组的基础上加入D-mannose后,增殖活力分别有所增加,且具有统计学意义(P<0.01)。如图1所示,2-DG能明显抑制细胞增殖,且其增殖抑制作用呈剂量依赖性,浓度越高,抑制作用越强;而加入了D-mannose后,抑制作用相应减弱。
2.2 2-DG促进HUVECs细胞凋亡 将细胞分为Control、2-DG 10 mmol/L、10 mmol/L 2-DG+1 mmol/L D-mannose、10 mmol/L 2-DG+2 mmol/L 3-MA、2 mmol/L 3-MA组。各组药物作用于HUVEC细胞24 h后,利用Annexin V-FITC/PI双染色法,检测药物作用24 h后HUVEC细胞凋亡。结果显示:与对照组相比,2-DG作用组早期凋亡率增多,晚期凋亡细胞及坏死细胞群均明显增多,加入D-mannose后,早期凋亡率降低,晚期凋亡细胞及坏死细胞群减少。3-MA预处理组与单纯2-DG组相比,早期凋亡细胞和晚期凋亡细胞均有所增加,且差异具有统计学意义(P<0.01)。见图2。
2.3 2-DG促进HUVECs细胞未折叠蛋白反应 将细胞分为Control、2-DG 10 mmol/L、2-DG 5 mmol/L、2-DG10 mmol/L+1 mmol/L D-mannose、2-DG 5 mmol/L+1 mmol/L D-mannose、衣霉素1 μg/ml组进行不同处理。Western blot 免疫印迹结果显示,在2-DG的作用下,GRP78蛋白表达水平增多,与对照组相比具有统计学意义(P<0.01);2-DG联合D-mannose作用于细胞后,GRP78蛋白表达水平相应减少,与单纯2-DG实验组相比具有统计学意义(P<0.01)。见图3 。
2.4 2-DG诱导HUVECs细胞自噬 将细胞分为Control、2-DG 10 mmol/L、2-DG 5 mmol/L、2-DG 10 mmol/L+2 mmol/L 3-MA、2-DG 5 mmol/L+2 mmol/L 3-MA、2 mmol/L 3-MA组,分别予以不同处理。Western blot检测分析发现,以10 mmol/L 2-DG、5 mmol/L 2-DG处理细胞24 h后,Atg5的蛋白水平明显高于对照组,且与对照组相比差异具有统计学意义(P<0.01)。加入3-MA预处理1 h后,再以10 mmol/L 2-DG、5 mmol/L 2-DG处理细胞24 h,Atg5的蛋白水平明显降低,与单纯2-DG实验组相比,其差异具有统计学意义(P<0.01,图4a)。Beclin1蛋白表达水平也呈现出相似的趋势(图4b) 。
3 讨论
糖酵解抑制剂 2-脱氧葡萄糖对肿瘤细胞具有抑制增殖和诱导凋亡的作用。研究发现,在胰腺癌细胞系(MiaPaPa2)和乳腺癌细胞系(SKBR3)中,2-DG可以上调内质网应激蛋白GRP78、GRP94以及CHOP的表达,引发未折叠蛋白反应(UPR),诱导细胞凋亡[2]。在TCL(T细胞型白血病)细胞中,2-DG上调UPR相关基因的转录,且甘露糖可以逆转UPR和细胞凋亡,但其对能量剥夺并无明显的逆转作用[6]。
本实验中,随着2-DG浓度的增加,2-DG处理后HUVECs增殖活力逐渐降低,验证了2-DG的增殖抑制作用。根据前期预实验结果,我们选择浓度为10 mmol/L的2-DG诱导HUVECs凋亡,结果显示,常氧状态下,2-DG对细胞的增殖抑制和促进凋亡的作用,可以被外源性的甘露糖逆转。本实验也发现,2-DG上调GRP78 (内质网应激相关蛋白)的表达,而甘露糖与2-DG联合处理细胞后,GRP78表达下调,与单纯2-DG实验组相比,差异具有统计学意义(P<0.01),即2-DG可诱导UPR,且可被甘露糖部分逆转。因为甘露糖可以逆转UPR和细胞凋亡,证明2-DG可以通过诱导UPR和ERS,影响细胞生存,也就是说,2-DG诱导的细胞凋亡,很有可能是由内质网应激相关凋亡途径介导的。
研究发现,2-DG可诱导多个细胞系发生自噬活化。机制中研究较多的是AMPK途径。有文献指出,2-DG通过内质网应激诱导自噬[3-4]。在多个细胞系中证实,2-DG可通过ERS诱导AMPK磷酸化[7]。在肺癌细胞系、LNCaP、胶质细胞瘤中,证实了2-DG通过激活AMPK、抑制mTOR、激活自噬[7-8]。
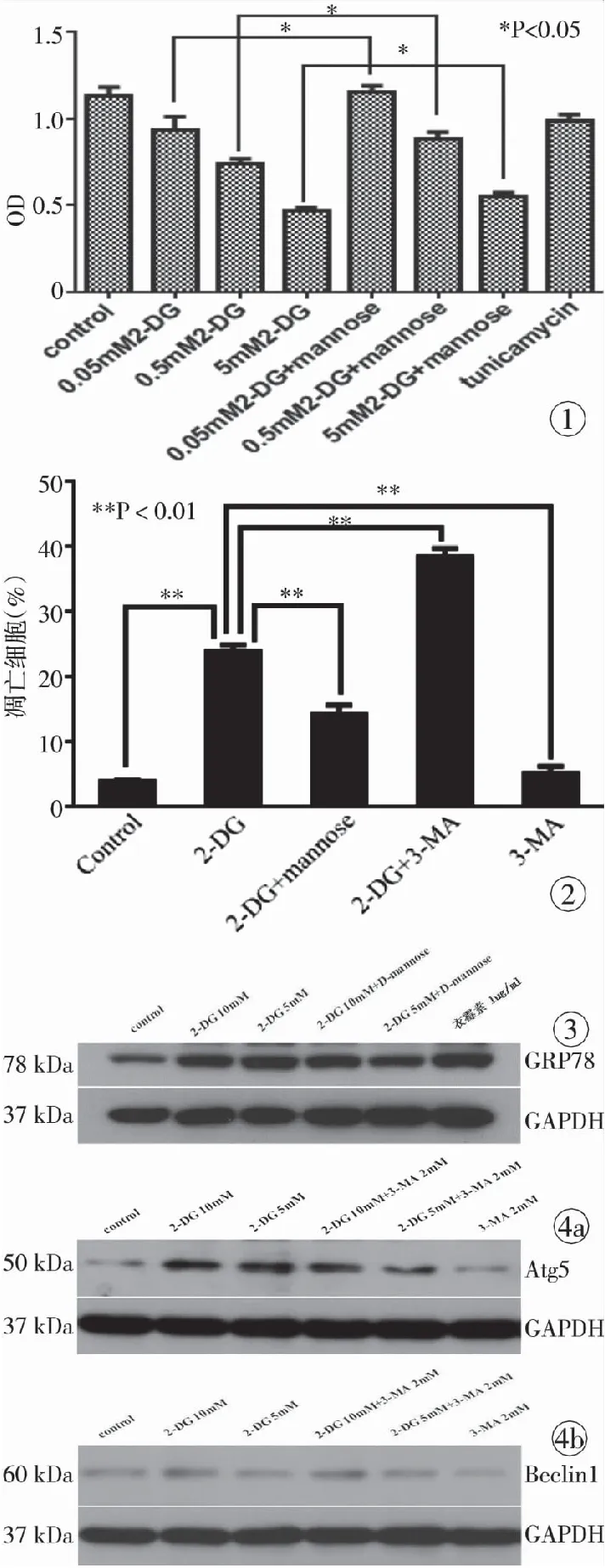
图1 2-DG对 HUVEC增殖抑制作用及mannose对其部分逆转 图2 Annexin V-FITC /PI 双染色法检测细胞凋亡 图3 Western blot 检测GRP78蛋白水平 图4 Western blot 检测蛋白水平 a. Atg5. b. Beclin1.
Fig 1 Inhibition of 2-DG on proliferation of HUVECs and partially reversion of mannose on it. Fig 2 Apoptotic cells detected by Annexin V-FITC/PI double staining. Fig 3 The protein level of GRP78 detected by Western blot. Fig 4 The protein level detected by Western blot. a. Atg5. b. Beclin1.
我们发现,2-DG可以上调Beclin1和Atg5蛋白表达,证实2-DG能诱导细胞自噬。2-DG可以诱导HUVECs细胞发生凋亡和自噬,利用公认的自噬抑制剂3-MA抑制自噬后,发现2-DG诱导的细胞凋亡增加,说明虽然2-DG同时诱导了细胞自噬和凋亡,但自噬可能更多的是抑制细胞凋亡,发挥细胞保护的作用。由此我们得出结论,2-DG与自噬抑制剂联用可以降低2-DG诱导的自噬活化,增强2-DG对内皮细胞的毒性作用。
众所周知,婴幼儿血管瘤是以血管内皮细胞增生为特征的良性肿瘤。增殖期血管瘤通常表现为血管内皮细胞增殖活跃,我们以HUVECs为研究对象,推测2-DG对血管瘤内皮细胞的作用。本课题组的前期实验发现,2-DG对HUVECs的生物学功能有抑制作用[9],而且对裸鼠皮下移植血管瘤瘤体生长有抑制作用。虽然大量研究证实,内质网应激不但能够促凋亡,也能够诱导自噬,但是,在内质网应激过程中,自噬和凋亡的转换机制尚不清楚[10]。至于2-DG诱导自噬的相关分子通路以及自噬和凋亡之间的转换机制,有待下一步研究。
[1] Ben Sahra I, Laurent K, Giuliano S, et al. Targeting cancer cell metabolism: the combination of metformin and 2-deoxyglucose induces p53-dependent apoptosis in prostate cancer cells[J]. Cancer Res, 2010,70(6):2465-2475.
[2] Liu H, Kurtoglu M, Cao Y, et al. Conversion of 2-deoxyglucose-induced growth inhibition to cell death in normoxic tumor ce-lls[J]. Cancer Chemother Pharmacol, 2013,72(1):251-262.
[3] Xi H, Kurtoglu M, Liu H, et al. 2-Deoxy-Dglucose activates autophagy via endoplasmic reticulum stress rather than ATP depleti-on[J]. Cancer Chemother Pharmacol, 2011,67(4):899-910.
[4] Xi H, Barredo JC, Merchan JR, et al. Endoplasmic reticulum stress induced by 2-deoxyglucose but not glucose starvation activates AMPK through CaMKKβ leading to autophagy[J]. Biochemical pharmacology, 2013,85(10):1463-1477.
[5] Barth S, Glick D, Macleod KF. Autophagy: assays and artifac-ts[J]. J Pathol, 2010,221(2):117-124.
[6] Zagorodna O, Martin SM, Rutkowski DT, et al. 2-Deoxyglucose-induced toxicity is regulated by Bcl-2 family members and is enhanced by antagonizing Bcl-2 in lymphoma cell lines[J]. Oncogene, 2012,31(22):2738-2749.
[7] Priebe A, Tan L, Wahl H, et al. Glucose deprivation activates AMPK and induces cell death through modulation of Akt in ovarian cancer cells[J]. Gynecol Oncol, 2011,122(2):389-395.
[8] Wu H, Zhu H, Liu D X, et al. Silencing of elongation factor-2 kinase potentiates the effect of 2-deoxy-D-glucose against human glioma cells through blunting of autophagy[J]. Canc Res, 2009,69(6):2453-2460.
[9] 程 静, 张冠华, 易成刚, 等. 2-脱氧-D-葡萄糖对人脐静脉内皮细胞的作用[J]. 中国美容整形外科杂志, 2014,25(4):248-251.
[10] Matsumoto H, Miyazaki S, Matsuyama S, et al. Selection of autophagy or apoptosis in cells exposed to ER-stress depends on ATF4 expression pattern with or without CHOP expression[J]. Biol Open, 2013,2(10):1084-1090.
Autophagy inhibits endothelial cell apoptosis induced by 2-DG
MIXuan,YANGLi,QIULi-hong,SONGYa-juan,SHIDing,CHENLin,SUYing-jun.
(InstituteofPlasticSurgery,XijingHospital,TheFourthMilitaryMedicalUniversity,Xi′an710032,China)
YANGLi,Email:yangli@fmmu.edu.cn
Objective To explore the autophagy and apoptosis of human umbilical vein endothelial cells (HUVECs) induced by 2-deoxidation-D-glucose (2-DG) and the relationship between them. Methods HUVECs cultured under normoxia conditions were divided into control group, 2-DG group, 2-DG combined with mannose group and positive control group (tunicamycin group). The effects of the proliferation activity of 2-DG on HUVECs were evaluated by MTS assay at 24 hours after culture. The expression level of the Endoplasmic Reticulum Stress (ERS)-related protein, glucose regulated protein 78 (RP78), was detected by Western blot to check the changes of ERS after treatment. The level of HUVECs apoptosis was detected by flow cytometry; the autophagy inhibitor 3-MA was introduced into this experiment so as to detect the effects of 2-DG on cell autophagy, then the expression levels of Beclin1 and Atg5 were detected by Western blot technique to reflect the changes of autophagy after treatment. Results Compared with the control group, the cell proliferation activity of the 2-DG group was significantly decreased, and this inhibition was dose-dependent. Proliferation activity of the 2-DG joint mannose group increased compared with the 2-DG group, with a significant difference. The apoptosis rate of the 2-DG group increased significantly compared with the control group with a significant difference, and the apoptosis rate of the 2-DG joint mannose group decreased significantly compared with the 2-DG group. The GRP78 protein level of the 2-DG group increased, compared with the control group with a significant difference. After adding mannose, the GRP78 protein level reduced significantly, compared with the 2-DG group. Beclin1 and Atg5 protein levels of the 2-DG group increased, as compared with the control group, with a significant difference. After 3-MA pretreatment, the 2-DG-induced apoptosis rate increased, Beclin1 and Atg5 protein expression levels also decreased significantly, compared with the 2-DG group. Conclusion 2-DG significantly inhibited the proliferation of HUVECs and induced HUVECs apoptosis and autophagy. ERS may mediate the cell apoptosis effect of 2-DG. However, autophage may reduce the apoptosis.
2-deoxy-glucose; HUVEC; Apoptosis; Autophagy; Endoplasmic Reticulum Stress
陕西省社会发展攻关计划项目(2014K11-03-09-11)
710032 陕西 西安,第四军医大学西京医院 全军整形外科研究所
米 萱(1988-),女,陕西西安人,住院医师,硕士研究生.
杨 力,710032,第四军医大学西京医院 全军整形外科研究所,电子信箱:yangli@fmmu.edu.cn
10.3969/j.issn.1673-7040.2016.04.017
R329.2
A
1673-7040(2016)04-0242-04
2016-02-10)

