副猪嗜血杆菌OmpP2刺激猪肺泡巨噬细胞炎性因子mRNA转录及致炎机制初步分析
何 欢,陈新诺,曾 泽,任玉鹏,汤 承,张 斌,岳 华
(西南民族大学生命科学与技术学院,成都 610041)
副猪嗜血杆菌OmpP2刺激猪肺泡巨噬细胞炎性因子mRNA转录及致炎机制初步分析
何欢,陈新诺,曾泽,任玉鹏,汤承,张斌*,岳华*
(西南民族大学生命科学与技术学院,成都 610041)
摘要:为了研究副猪嗜血杆菌(Haemophilus parasuis,HPS)弱毒株11型H465株OmpP2刺激猪肺泡巨噬细胞(PAMs)炎性因子mRNA的转录和对NF-κB和MAPKs信号通路的影响,提取并纯化HPS血清11型H465株的OmpP2,分别用5、10 μg·mL-1OmpP2刺激PAMs 6、12 h后收集细胞,提取总RNA和蛋白质。将提取的RNA反转录成cDNA,运用RT-PCR检测炎性因子(IL-1α、IL-1β、IL-6、IL-8和TNF-α)mRNA转录水平。利用Western blot方法检测ERK1/2、JNK、P38、P65和IκBα蛋白表达量的变化。结果表明:HPS H465株的OmpP2能够显著地诱导IL-1α、IL-1β、IL-6、IL-8和TNF-α的mRNA转录水平上调(P<0.05),同时能够引起JNK、P65蛋白表达水平显著升高和 IκBα 蛋白表达水平显著降低 (P<0.05)。上述结果证实了HPS 血清11型H465株的OmpP2能够通过调节MAPKs信号通路中JNK蛋白以及NF-κB信号通路中P65蛋白和IκBα蛋白降解促进炎性因子IL-1α、IL-1β、IL-6、IL-8和TNF-α的转录。
关键词:副猪嗜血杆菌;OmpP2;炎性因子;NF-κB和MAPK信号通路
副猪嗜血杆菌(Haemophilusparasuis,HPS)是猪上呼吸道的一种共栖菌,在特定的条件下侵入机体而引起严重的全身性疾病,以纤维素性多发性浆膜炎、关节炎和脑膜炎为主要特征的革拉泽病(Glässer’s disease)[1]。该病已成为全球范围内影响养猪业的一种重要细菌性疾病。根据热稳定抗原和琼脂扩散的方法,HPS至少可分为15个血清型,1、5、10、12、13和14型毒力最强,2、4和15型为中等毒力菌株,血清型3、6、7、8、9和11型为弱毒力菌株,还有一些不定型的菌株[2]。HPS的毒力因子和致病机制一直都是研究热点,HPS OmpP2是含量最为丰富的外膜蛋白,属于微孔蛋白,也是受关注度最高的外膜蛋白[3]。研究发现HPS OmpP2蛋白的序列具有丰富的遗传多样性,存在两种结构类型,即参考菌株中强毒力的血清型菌株中OmpP2基因存在两处连续碱基缺失,而参考菌株无毒力菌株中OmpP2基因没有出现这种缺失情况,暗示了这种缺失现象主要出现在强毒力血清型的菌株中[4]。通过基因缺失株的构建,发现HPSOmpP2基因参与了HPS对宿主细胞的黏附入侵,诱导炎症反应和抵抗血清中补体系统杀菌作用等一系列的功能[5]。另外,HPS血清5型Nagasaki株OmpP2蛋白能够诱导猪肺泡巨噬细胞(PAMs)炎性细胞因子IL-1α、IL-1β、IL-6及IL-8转录水平的显著上调[6],说明OmpP2能够诱导宿主细胞产生较强的炎性免疫应答。在本研究中,作者运用Real-Time PCR和Western blot方法研究HPS血清11型H465株的OmpP2诱导PAMs炎性因子的表达及对MAPK和NF-κB信号通路的影响。
1材料与方法
1.1材料
1.1.1菌株及细胞系所用的HPS血清5型Nagasaki株和血清11型H465株由本实验室保存,PAMs(3D4/2)购自ATCC公司。
1.1.2主要试剂及配制胰蛋白胨大豆琼脂 (Trypticase soy agar,TSA)、胰蛋白胨大豆肉汤 (Trypticase soy broth,TSB) 购自青岛海博生物技术公司;RMPI 1640培养液和胎牛血清购自Gibco公司;RIPA裂解液、PMSF、BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司。PrimeScriptTMRT 试剂盒、SYBR Premix Ex TaqTM、TaqDNA聚合酶、Trizol等购自宝生物工程(大连)有限公司。1.1.3主要仪器恒温培养箱和CO2细胞培养箱购自Thermo公司;高速离心机购自Eppendorf公司;凝胶成像系统购自TANO公司;荧光定量PCR仪(7300 Real Time PCR System)购自Applied Biosystems公司。
1.2方法
1.2.1OmpP2的提取纯化及鉴定参照B.Zhang等[5]提取OmpP2的方法,将-80 ℃冻存的HPS 血清5型Nagasaki株和血清11型H465株在TSA(含新生牛血清和NAD)平板上复苏,37 ℃培养18~24 h。然后挑取单菌落在TSB(含新生牛血清和NAD)肉汤中于37 ℃、180 r·min-1振荡培8~12 h,收集菌体,用PBS洗三次并用TE buffer重悬,加入1.3 g溶菌酶、1 mol·L-1MgCl2、DNase及RNase处理后离心收集菌体,再用TX buffer(TE+2% TritionX-100)洗涤后加入胰蛋白酶,37 ℃振荡1~2 h,离心收集沉淀溶于含有0.25% SLS的HEPES buffer中,于-80 ℃保存。将提取的OmpP2蛋白进行SDS-PAGE和考马斯亮蓝R-250染色分析。同时,提纯的蛋白质进行基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-TOF)鉴定。1.2.2 猪肺泡巨噬细胞(PAMs)的培养及处理在12孔板上用含10%胎牛血清的RPMI 1640培养液37 ℃ 5% CO2培养PAMs。用5和10 μg·mL-1H465株的OmpP2刺激PAMs,用Nagasaki株的OmpP2作为阳性对照,用含有0.25% SLS的HEPES buffer作为阴性对照,每种处理细胞的方法设置3个平行,在6和12 h后收集细胞。
1.2.3RNA的抽提及cDNA的合成加入Trizol收集PAMs,提取细胞总RNA,溶于10 μL DEPC处理水,取1 μL利用Prime ScriptTMRT 试剂盒将RNA反转录成cDNA,并置于-20 ℃待用。
1.2.4Real-Time PCR以RPL4作为内参基因[7],运用Real-Time PCR对OmpP2刺激PAMs后细胞因子IL-1α、IL-1β、IL-6、IL-8及TNF-α编码基因的相对转录量进行测定。RT-PCR反应体系为20 μL:cDNA 2 μL,SYBR premix ExTaqTM10 μL,引物F/R均为0.5 μL。反应条件:95 ℃预变性3 min;95 ℃ 30 s;57 ℃ 31 s;共40个循环,同时设定加入ddH2O作为阴性对照。引物序列见表1,所有引物均由生工生物工程(上海)有限公司合成。
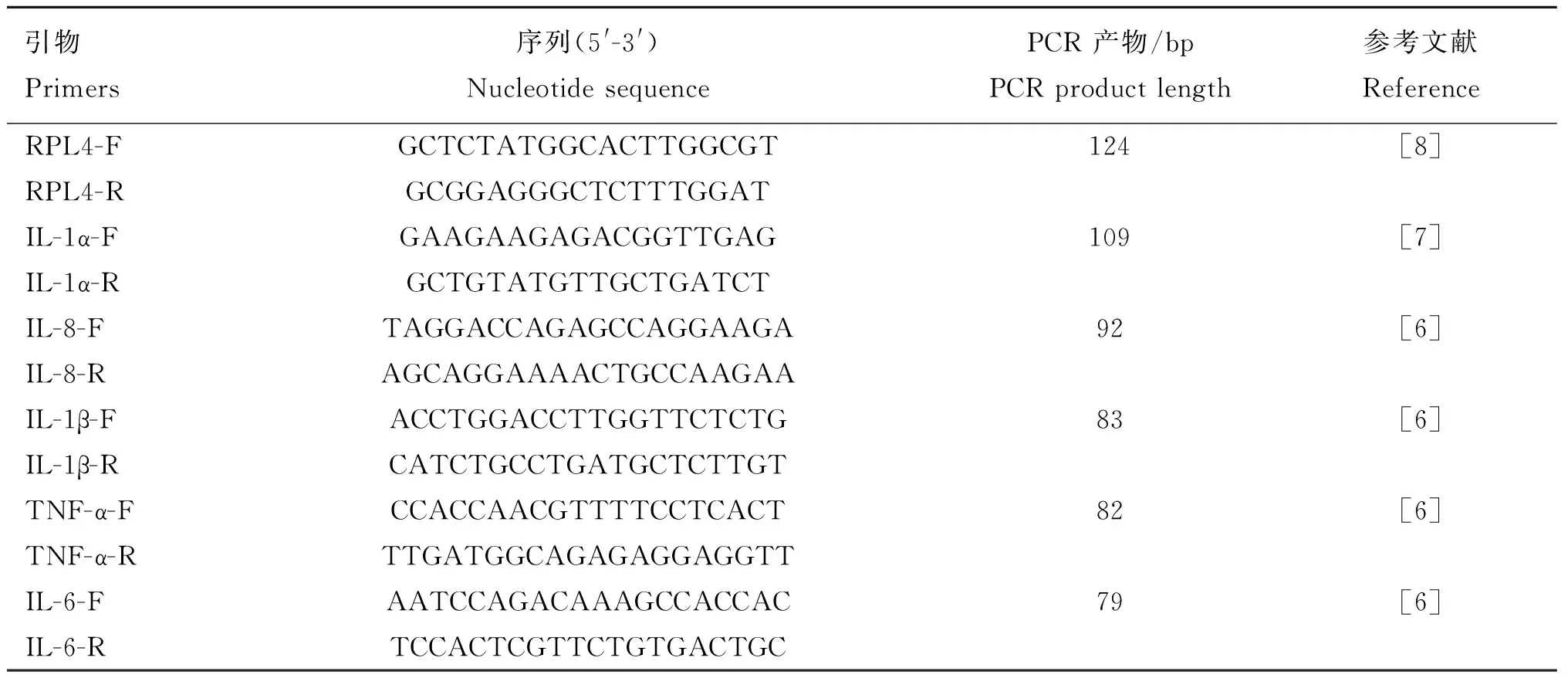
表1 炎性因子及管家基因引物序列
1.2.5Western blot按照RIPA裂解液说明书提取蛋白质,并用BCA蛋白质浓度测定试剂盒测定提取的蛋白质浓度。取50 μg蛋白质经SDS-PAGE电泳后,电转移至PVDF膜上,并在5%脱脂乳中室温封闭2 h,TBST清洗3次,每次10 min,加入1∶1 000稀释的一抗(NF-κB P65、IκBα、ERK1/2、P38、JNK和β-actin购自美国Cell Signaling公司)4 ℃孵育过夜,TBST清洗3次,每次10 min,加入1∶5 000稀释的辣根过氧化物酶标记的二抗(羊抗兔IgG和羊抗鼠IgG购自美国Abbkine公司)37 ℃孵育2 h,TBST清洗3次,每次10 min,每种信号蛋白质的检测设置3个平行。利用 FusionCapt 软件(Vilber Lourmat,德国)成像系统观察蛋白质条带并计算其灰度值。
1.2.6数据分析参照K.Livak等[8]的介绍,不同组别中各炎性因子含量通过2-ΔΔCT法进行比较,所有数据用SPSS软件进行统计分析。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2结果
2.1纯化OmpP2蛋白的SDS-PAGE分析
将提取的OmpP2蛋白进行SDS-PAGE和考马斯亮蓝R-250染色分析。结果显示Nagasaki株和H465株的纯化OmpP2电泳后条带大小与A.Ruiz等[9]所报道的电泳条带大小一致,见图1,目的条带在36.6~38.5 ku范围内。最后用MALDI-TOF-TOF进行鉴定,表明提纯的蛋白质就是OmpP2。
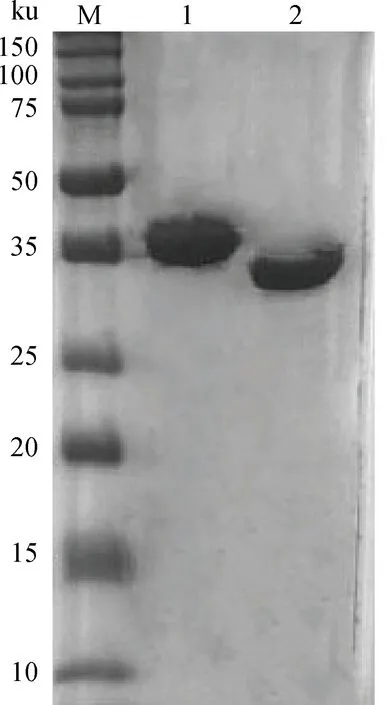
M.蛋白质相对分子质量标准;1.H465株的OmpP2;2.Nagasaki株的OmpP2M.Protein molecular weight marker;1.HPS H465 strain OmpP2;2.HPS Nagasaki strain OmpP2图1 纯化OmpP2蛋白的SDS-PAGE分析Fig.1 SDS-PAGE analysis of purified OmpP2
2.2OmpP2刺激PAMs 细胞因子的mRNA转录水平分析
用5、10 μg·mL-1不同剂量的HPS Nagasaki株和H465株的OmpP2刺激PAMs,用RT-PCR检测6和12 h后炎性因子(IL-1α、IL-1β、IL-6、IL-8和TNF-α)的mRNA转录水平。与Nagasaki株相比,H465株的OmpP2也能够诱导炎细胞因子IL-1α、IL-1β、IL-6、IL-8和TNF-α的mRNA转录水平上调(图2)。
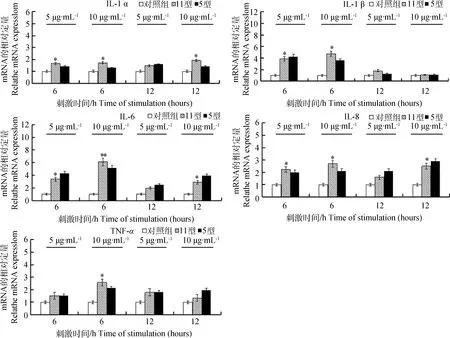
与对照组相比,*.差异显著( P<0.05 ),**.差异极显著(P<0.001)When compared with the control group,* represent significant difference (P<0.05),** represent extremely significant difference (P < 0.001)图2 OmpP2刺激PAMs 后IL-6、IL-8、IL-1α、IL-1β和TNF-α 的mRNA转录水平的变化Fig.2 The mRNA transcription level change of IL-6,IL-8,IL-1α,IL-1β and TNF-α after OmpP2 stimulated PAMs
H465株OmpP2刺激细胞6 h后,5和10 μg·mL-1的OmpP2试验组均可引起IL-1α炎细胞因子的mRNA转录水平显著上调(P<0.05),且较 Nagasaki株分别高0.3倍和0.5倍;5 和10 μg·mL-1试验组均可引起IL-1β炎性因子的mRNA转录水平显著上调(P<0.05),且10 μg·mL-1的试验组较 Nagasaki株高1.2倍;10 μg·mL-1试验组结果表明IL-6炎细胞因子的mRNA转录水平极显著上调(P<0.001),较Nagasaki株变化高1倍;5 和10 μg·mL-1试验组均可引起IL-8炎细胞因子的mRNA转录水平显著上调(P<0.05),分别较 Nagasaki株高0.3倍和0.6倍;10 μg·mL-1试验组可引起TNF-α炎细胞因子的mRNA转录水平显著上调(P<0.05),且较 Nagasaki株高0.5倍;H465株的OmpP2刺激细胞12 h后,10 μg·mL-1试验组可引起IL-1α炎细胞因子的mRNA转录水平显著上调(P<0.05),较Nagasaki株高0.5倍;两浓度的OmpP2均能引起对炎性因子IL-1β炎细胞因子的mRNA转录水平上调,但作用不显著;10 μg·mL-1试验组可引起IL-6、IL-8炎细胞因子的mRNA转录水平显著上调(P<0.05),较Nagasaki株分别低1倍和0.4倍;两浓度的OmpP2均能引起对TNF-α炎性细胞因子的mRNA转录水平上调,但作用不显著。
2.3OmpP2对NF-κB和MAPK信号通路的影响分析
用5、10 μg·mL-1不同剂量的HPS H465株纯化OmpP2刺激PAMs,对照组加入0.25% SLS的HEPES buffer刺激PAMs。通过Western blot方法检测HPS H465株OmpP2对NF-κB信号通路中IκBα和P65以及MAPK通路中ERK1/2、P38、JNK蛋白的表达量,结果见图3。与对照组相比较,H465株OmpP2刺激细胞6 h后,ERK1/2、JNK和P38的蛋白质表达量均呈升高趋势;IκBα蛋白的表达量有所下降,P65蛋白表达量均随着剂量的增高呈现升高趋势,且显著差异(P<0.05或P<0.001)。H465株OmpP2刺激细胞12 h后ERK1/2和P38蛋白表达量均呈升高趋势;JNK蛋白表达量均随着剂量的增高呈现显著升高(P<0.05);IκBα蛋白的表达量有所下降,在10 μg·mL-1试验组有显著下降的作用(P<0.05);P65蛋白表达量均随着剂量的增高呈现显著升高(P<0.05或P<0.001)。
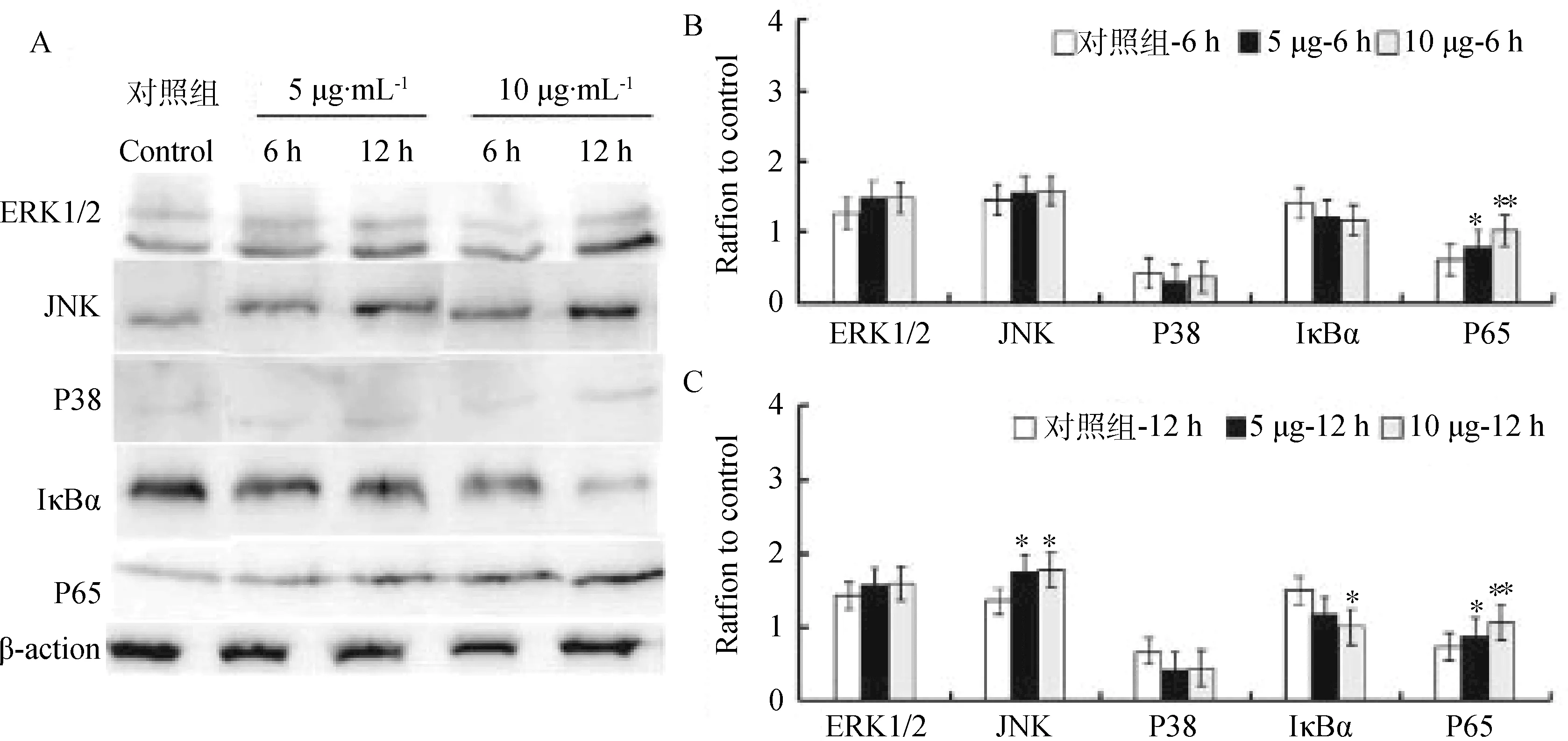
与对照组相比,*.差异显著(P<0.05 ),**.差异极显著(P<0.001)When compared with the control group,* represent significant difference (P<0.05),** represent extremely significant difference (P<0.001)图3 HPS H456的OmpP2在刺激PAMs 激活NF-κB和MAPKs信号通路中的作用Fig.3 The effects of OmpP2 on the nuclear factor-κB (NF-κB) and mitogen-activated protein kinases (MAPKs) signaling pathway in HPS H456-OmpP2 stimulated PAMs
3讨论
研究发现HPS在急性感染过程中,常常引起败血症、弥漫性血管内凝血等休克炎性症状[10-12]。这表明HPS能够突破猪气管上皮细胞的屏障作用进入血液循环系统,通过产生一些免疫激活介质激活宿主的炎性反应应答。国外多项研究表明多种革兰阴性细菌(包括大肠杆菌、流感嗜血杆菌、伤寒沙门菌及脑膜炎奈瑟球菌)的膜孔蛋白均能诱导宿主细胞产生炎性免疫应答[13-15]。前期研究发现HPS的强毒株血清型5型(Nagasaki株)外膜蛋白P2(OmpP2)能够刺激猪肺泡巨噬细胞(PAMs)炎性因子转录水平上调[6]。作者利用纯化的血清11型H465株OmpP2刺激PAMs研究其多种炎性因子的mRNA转录水平的变化,证实了血清11型H465株OmpP2同血清5型一致都能使IL-6、IL-8、IL-1α、IL-1β和TNF-α五种炎性因子的转录水平上调,但两种血清型所引起的转录水平的差异无明显的统计学意义。因此推测HPS弱毒株血清型OmpP2能够调节IL-6、IL-8、IL-1α、IL-1β及TNF-α等炎性因子的表达。
MAPK和NF-κB是参与调节炎症反应的重要信号通路[16-17],可被炎症因子、肿瘤因子等多种胞外刺激活化,进一步合成并释放炎性因子,再通过体循环或旁分泌作用于整个机体组织细胞,引起炎症反应[18-20]。激活的PAMs通过一系列的内源性感染途径以及自身分泌蛋白的刺激释放内源性炎性因子TNF-α以及炎性细胞会产生IL-6、IL-8、IL-1α、IL-1β等炎性因子,继而使细胞产生炎性反应激发肺部急性炎症[6]。作者利用Western blot方法研究HPS 11型H465株OmpP2对MAPK和NF-κB信号通路的影响,研究结果表明JNK和P65蛋白表达量都有显著升高(P<0.05或P<0.001),推测HPS 血清11型H465株的OmpP2能够调节MAPKs信号通路中JNK蛋白以及NF-κB信号通路中P65蛋白和IκBα蛋白的降解促进炎性因子的表达。因此,OmpP2可能是研发HPS疫苗的一个重要的潜在切入点,开发出针对相应信号通路转导的抑制剂或是激活剂,为多种疾病的发病机制研究和药物疫苗的开发提供了重要的理论支持,同时也为深入了解OmpP2影响HPS诱导炎性因子产生的分子机制提供参考,对于HPS基础生物学和致病机制的研究具有重要意义。
4结论
HPS弱毒株血清11型H465株的OmpP2与强毒株血清型5(Nagasaki株)相比,同样能够调节IL-6、IL-8、IL-1α、IL-1β及TNF-α等炎性因子的表达;在致病机制方面研究发现H465株的OmpP2能够通过调节MAPKs信号通路中JNK蛋白以及NF-κB信号通路中P65蛋白和IκBα蛋白的降解来促进炎性因子表达。
参考文献(References):
[1]CAI X,CHEN H,BLACKALL P J,et al.Serological characterization ofHaemophilusparasuis isolates from China[J].VetMicrobiol,2005,111(3-4):231-236.
[2]RAPP-GABRIELSON V J,GABRIELSON D A.Prevalence ofHaemophilusparasuisserovars among isolates from swine[J].AmJVetRes,1992,53(5):659-664.
[4]赵倩,汤承,杨发龙,等.副猪嗜血杆菌ompP2基因的结构特征及其与毒力的联系[J].中国科学:生命科学,2010,40(6):522-532.
ZHAO Q,TANG C,YANG F L,et al.The correlation between structural characterization ofompP2 gene and virulence ofHaemophilusparasuis[J].ScientiaSinica:Vitae,2010,40(6):522-532.(in Chinese)
[5]ZHANG B,XU C,ZHANG L,et al.Enhanced adherence to and invasion of PUVEC and PK-15 cells due to the overexpression of RfaD,ThyA and Mip in the ΔompP2 mutant ofHaemophilusparasuisSC096 strain[J].VetMicrobiol,2013,162(2-4):713-723.
[6]ZHOU S,HE X,XU C,et al.The outer membrane protein P2 (OmpP2) ofHaemophilusparasuisinduces proinflammatory cytokine mRNA expression in porcine alveolar macrophages[J].VetJ,2014,199(3):461-464.
[7]CINAR M U,ISLAM M A,UDDIN M J,et al.Evaluation of suitable reference genes for gene expression studies in porcine alveolar macrophages in response to LPS and LTA[J].BMCResNotes,2012,5:107.
[8]LIVAK K,SCHMITTGEN T D.Analysis of relative gene expression date using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[9]RUIZ A,OLIVEIRA S,TORREMORELL M,et al.Outer membrane proteins and DNA profiles in strains ofHaemophilusparasuisrecovered from systemic and respiratory sites[J].JClinMicrobiol,2001,39(5):1757-1762.
[10]陆承平.兽医微生物学[M].北京:中国农业出版社,2007:144-146.
LU C P.Veterinary microbiology[M].Beijing:China Agriculture Press,2007:144-146.(in Chinese)
[11]OLIVEIRA S,PIJOAN C.Haemophilusparasuis:new trends on diagnosis,epidemiology and control[J].VetMicrobiol,2004,99(1):1-12.
[12]VAHLE J L,HAYNES J S,ANDREWS J J.Experimental reproduction ofHaemophilusparasuisinfection in swine:clinical,bacteriological,and morphologic findings[J].JVetDiagnInvest,1995,7(4):476-480.
[13]GALDIERO M,D’AMICO M,GORGA F,et al.Haemophilusinfluenzae porin contributes to signaling of the inflammatory cascade in rat brain[J].InfectImmun,2001,69(1):221-227.
[14]RAY A,CHATTERJEE N S,BHATTACHARYA S K,et al.Porin of Shigella dysenteriae enhances mRNA levels for Toll-like receptor 2 and MyD88,up-regulates CD80 of murine macrophage,and induces the release of interleukin-12[J].FEMSImmunolMedMicrobiol,2003,39(3):213-219.
[15]MASSARI P,GUNAWARDANA J,LIU X,et al.Meningococcal porin PorB prevents cellular apoptosis in a toll-like receptor 2- and NF-kappaB-independent manner[J].InfectImmun,2010,78(3):994-1003.
[16]KIM H J,LEE H S,CHONG Y H,et al.p38 mitogen-activated protein kinas up-regulates LPS-induced NF-κB activation in the development of lung injury and RAW 264.7 macrophages[J].Toxicology,2006,225(1):36-47.
[17]RAVANTI L,TORISEVA M,PENTTINEN R,et al.Expression of human collagenase-3(MMP-13)by fetal skin fibroblasts is induced by transforming growth factor β via p38 mitogen-activated protein kinase[J].FASEBJ,2001,15(6):1098-1100.
[18]LIU Y W,CHEN C C,TSENG H P,et al.Lipopolysaccharide-induced transcriptional activation of interleukin-10 is mediated by MAPK- and NF-kappaB-induced CCAAT /enhancer-binding protein delta in mouse macrophages[J].CellSignal,2006,18(9):1492- 1500.
[19]LEE J I,BURCKART G J.Nuclear factor kappa B:important transcription factor and therapeutic target[J].JClinPharmacol,1998,38(11):981-993.
[20]CHANG L,KARIN M.Mammalian MAP kinase signalling cascades[J].Nature,2001,410(6824):37-40.
(编辑白永平)
doi:10.11843/j.issn.0366-6964.2016.07.016
收稿日期:2015-12-25
基金项目:国家自然科学基金(31302119);四川省教育厅创新项目(14ZB046);公益性行业(农业)科研专项(201303034-1);西南民族大学研究生创新科研项目(CX2015SZ074)
作者简介:何欢(1991-),女,蒙古族,辽宁康平人,硕士生,主要从事动物病原分子生物学研究,E-mail:1252469322@qq.com *通信作者:张斌,E-mail:binovy@sina.com;岳华,E-mail:yhua900@163.com
中图分类号:S852.613
文献标志码:A
文章编号:0366-6964(2016)07-1428-07
The Initial Research of OmpP2 inHaemophilusparasuisInduces Pro-inflammatory Cytokine mRNA Transcription and Inflammatory Mechanism in Porcine Alveolar Macrophages
HE Huan,CHEN Xin-nuo,ZENG Ze,REN Yu-peng,TANG Cheng,ZHANG Bin*,YUE Hua*
(CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China)
Abstract:The aim of this study was to explore the role of out membrane protein P2 (OmpP2) in Haemophilus parasuis serovar 11 reference H465 strain to induce pro-inflammatory cytokine mRNA transcription,and NF-κB and MAPKs signaling pathways in porcine alveolar macrophages (PAMs).The OmpP2 was extracted from the H.parasuis H465 and stimulated in PAMs with 5 and 10 μg·mL-1for 6 and 12 hours.The total RNA and cells protein were extracted and the RNA was reversed into cDNA.The mRNA transcription levels of IL-1α,IL-β,IL-6,IL-8 and TNF-α were detected by Real-time PCR,and the protein of NF-κB P65,IκBα,ERK,JNK and P38 were detected by Western blot.The result showed that the mRNA transcription of IL-1α,IL-β,IL-6,IL-8 and TNF-α in PAMs induced by the OmpP2 from H.parasuis were significantly up-regulated (P<0.05),and the protein of JNK,P65 in PAMs induced by the OmpP2 from H.parasuisis significantly increased and the protein of IκBα was significantly declined(P<0.05).The above results exhibit that the OmpP2 could effectively activate the JNK and P65 proteins and increase the degradation of IκBα in NF-κB and MAPKs signaling pathways to promote the pro-inflammatory cytokines expression.
Key words:Haemophilus parasuis;OmpP2;pro-inflammatory cytokines;MAPKs/ NF-κB signaling pathways

