不同体系改性粘土对浒苔(Ulva prolifera)微观繁殖体去除及萌发的影响
张悦,宋秀贤,李靖,曹西华,俞志明
(1.中国科学院 海洋研究所 海洋生态与环境科学重点实验室,山东 青岛 266071;2.青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,山东 青岛 266071;3.中国科学院大学,北京 100049)
不同体系改性粘土对浒苔(Ulva prolifera)微观繁殖体去除及萌发的影响
张悦1,2,3,宋秀贤1,2*,李靖1,2,3,曹西华1,2,俞志明1,2
(1.中国科学院 海洋研究所 海洋生态与环境科学重点实验室,山东 青岛 266071;2.青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,山东 青岛 266071;3.中国科学院大学,北京 100049)
摘要:本文研究了2种无机改性粘土在3种不同改性配比下对浒苔微观繁殖体去除效果及萌发的影响。结果发现,去除率随改性粘土及改性剂用量的增加而升高,相同条件下硫酸铝(AS)改性粘土对浒苔微观繁殖体的去除效果优于聚合氯化铝(PAC)改性粘土,其中1∶5 PAC改性粘土在0.5 g/L时去除率为62%,AS改性粘土则可达到80%。添加改性粘土后上层水体中浒苔微观繁殖体相对萌发率随改性粘土及改性剂用量的升高而降低,总体系相对萌发率表现为先升后降趋势,在改性剂浓度为0.1 g/L时相对萌发率达到最高。两种改性体系中微观繁殖体在1∶3配比、1.0 g/L浓度下均未能萌发。该结果显示,改性粘土可以有效去除浒苔微观繁殖体并抑制其萌发,这为我国绿潮灾害的防控提供了一种新思路。
关键词:浒苔; 微观繁殖体;改性粘土;去除;萌发
1引言
浒苔(Ulvaprolifera)是形成绿潮的主要藻类之一,在欧洲、亚洲、北美洲和大洋洲都有其大量聚集的记录[1]。自2007年起,黄海海域每年都会出现浒苔的大规模暴发,其分布面积高达上万平方千米,对当地渔业、水产养殖、海洋环境、景观和生态服务功能造成了一定的影响[2]。目前,浒苔的治理主要以现场机械打捞为主,此方法相对比较被动,且耗费了大量的人力物力。而针对浒苔治理的实验室研究主要集中在使用HCl、NaClO等化学试剂对其进行灭杀[3],但此方法不仅应用成本较高,且会对海洋环境和生态系统造成很大的破坏[4]。因此,寻求一种快速有效、成本节约、环境安全的治理方法已成为解决我国绿潮灾害的迫切需求。
浒苔大规模暴发与其复杂多样的繁殖方式有着密不可分的联系,其在孢子体、配子体世代繁殖过程中会产生大量的孢子、配子及接合形成的合子,这些阶段的藻细胞可通称为微观繁殖体[5]。浒苔微观繁殖体广泛分布在南黄海海域,并能以繁殖体库的形式度过冬天,为来年春季暴发提供“种源”[6—8]。研究表明,在春季浒苔生物量增长过程中,微观繁殖体萌发较成体生长更为关键,对微观繁殖体进行有效防控是绿潮治理的瓶颈所在[7]。目前,有关浒苔微观繁殖体的研究大多集中在其生活史策略[9—11]、分布情况[6,12]等,而控制微观繁殖体数量及萌发率的有效方法研究相对较少。
改性粘土法作为国际上藻华应急处置的首选方法,在我国已成功应用于2008年奥帆赛、2010年亚运会、2011年国际泳联世锦赛和2011年深圳大运会等重大赛事中,有效地对比赛水域的藻华进行了控制与去除,保障了赛事的顺利进行[13]。李靖等[14]通过研究发现PAC改性粘土可以有效去除浒苔微观繁殖体并降低其萌发率。但改性剂类型、改性配比变化对浒苔微观繁殖体的去除及萌发有何影响尚未见报道。本研究根据浒苔微观繁殖体的形态及生理特点,将其视为一种微藻,在不同改性粘土环境下探究其去除及萌发结果,旨在筛选出合适的改性粘土体系及浓度,为绿潮防控的实际应用提供理论依据。
2材料与方法
2.1去除实验
浒苔样品采自青岛第一海水浴场潮间带,选择颜色深绿的健康藻体,使用灭菌海水反复冲洗并去除表面附着物,于L1培养基中暂养,温度 (20±1)℃,光强50~60 μmol/ (m2·s),光暗比L∶D=12 h∶12 h。浒苔微观繁殖体诱导方法参见文献[15]。收集诱导后的微观繁殖体培养液,以血球计数板计数其初始微观繁殖体密度为3.2×105cell/mL。取50根50 mL具塞比色管,各添加50 mL微观繁殖体培养液用以进行去除实验。
实验用土取自江苏高岭土,采用的两种无机改性剂为聚合氯化铝(PAC)和硫酸铝(AS)。依据俞志明等[16]的改性方法,分别按1∶3、1∶5、1∶10改性配比制备6种50 g/L的PAC及AS改性粘土母液。对照组比色管中不添加改性粘土,1∶3 PAC改性粘土组分别添加0.1 mL、0.3 mL、0.5 mL、1.0 mL相应的改性粘土母液(1∶5、1∶10 PAC改性粘土组及AS各配比改性粘土组添加方法同上),使得其所对应的改性粘土终浓度分别为0 g/L、0.1 g/L、0.3 g/L、0.5 g/L、1.0 g/L,每组设置2个平行。加入改性粘土后0.5 h、1 h、2 h、3 h、4 h、6 h分别于比色管中上层取样,鲁格试剂固定后以血球计数板进行计数。
2.2萌发实验
去除实验结束后,于各比色管中上层水体中取1 mL至24孔板,再将水体与底层絮体重新混合后取1 mL至24孔板,分别进行萌发培养,每组设置4个平行。培养温度 (20±1)℃,光照度50~60 μmol/ (m2·s),光暗比L∶D=12 h∶12 h。待萌发进行5 d后,观察计数微观繁殖体萌发情况。用Olympus倒置显微镜观察萌发幼苗的形态,并拍照记录。微观繁殖体萌发数N的计算公式为:
(1)
式中,x为显微镜下多个视野中观察到的萌发数目;n为观察的视野个数;D为培养皿的底面直径;d为显微镜下一个视野的直径,d=目镜视场数/物镜倍率。
以实验组微观繁殖体与对照组微观繁殖体萌发数量相比,得各实验组相对萌发率:
(2)
以萌发的微观繁殖体数与该组去除实验后水体中剩余微观繁殖体数量相比,得各实验组上层水体中微观繁殖体的绝对萌发率:
(3)
式中,Ni为实验组萌发数目;N0为对照组萌发数目;Nj为去除实验结束后水体中剩余微观繁殖体数目。
2.3数据分析
本研究的数据分析方法主要是单因素方差分析(ANOVA),在α=0.01的显著水平下,如果p>0.01,表明不存在显著差异。所涉及数据用SPSS22.0分析处理,图表在Origin9.0中绘制。
3结果
3.1不同改性粘土对浒苔微观繁殖体的去除效果
添加改性粘土后,各组微观繁殖体密度随时间逐渐降低(图1)。对照组微观繁殖体存在一定的自然附着沉降。各实验组微观繁殖体密度在0.5 h内迅速降低,其中0.5 g/L的1∶5 AS改性粘土在0.5 h内的去除率就可达43.8%,至添加改性粘土4 h后微观繁殖体密度基本不再变化。计算出6 h后各实验组的去除率可知最终去除效果(图2)。本研究中改性粘土用量、改性配比及改性剂种类均影响浒苔微观繁殖体最终去除效果。结果表明,在相同改性剂及改性配比条件下,实验组均表现出去除率随着改性粘土用量增加而逐渐升高的规律。其中1∶5配比下PAC改性粘土在0.1~1.0 g/L浓度下浒苔微观繁殖体去除率由37.5%升高至68.8%,同配比的AS改性粘土在4个浓度下的去除率则由63.8%升高为81.9%。在同一改性剂及改性粘土浓度下,各实验组去除率随改性粘土中改性剂用量的增加呈逐渐升高的趋势。0.5 g/L PAC改性粘土在1∶10、1∶5、1∶3这3个配比下的去除率分别为61.9%、62.2%和62.8%,而同浓度AS改性粘土在3个配比下的去除率分别为71.6%、80.0%和80.2%。综上,PAC和AS改性粘土能够有效去除浒苔繁殖体,其去除率随着改性粘土浓度及改性剂用量的增加而升高,在1∶3配比、1.0 g/L改性粘土浓度条件下去除率最高(分别为70.0%和83.8%),且在相同改性剂配比及改性粘土用量情况下,AS改性粘土去除率均高于PAC改性粘土。

图1 不同改性粘土作用下浒苔微观繁殖体密度随时间的变化Fig.1 Ulva prolifera microscopic propagules density changes over time under different modified clay conditions

图2 不同改性粘土对浒苔微观繁殖体的最终去除效果Fig.2 Final removal efficiency in different modified clay conditions on Ulva prolifera microscopic propagules
3.2不同改性粘土对浒苔微观繁殖体萌发的影响
为更加清晰地将各实验组与对照组进行比较,本部分以实验组萌发数与对照组萌发数的比值(即相对萌发率)来表示各实验组浒苔微观繁殖体的萌发情况。结果显示,各实验组上层水体中浒苔微观繁殖体的萌发率均远小于对照组(相对萌发率小于100%)(p<0.01),1∶10配比下0.1 g/L PAC改性粘土相对萌发率最高,但也仅为14.5%(图3)。在相同改性剂及改性配比条件下,水体中浒苔微观繁殖体的相对萌发率随改性粘土用量的增加而下降。而在同一改性剂及改性粘土浓度下,相对萌发率随着改性比例的升高而降低,即随着改性剂用量增加相对萌发率逐渐降低。对比PAC和AS两改性体系在各改性粘土浓度下的相对萌发率发现,在0.1 g/L时,PAC改性粘土在各配比下相对萌发率均高于AS改性粘土组;而在0.3 g/L、0.5 g/L时,各配比下二者相对萌发率接近,相对萌发率均小于8.5%;在改性粘土浓度为1.0 g/L时,PAC改性粘土体系在1∶3配比下未见成功萌发幼苗,1∶5、1∶10配比下的相对萌发率分别为0.4%和5.1%,而AS改性粘土体系在全部3种改性配比条件下其相对萌发率均近乎为0。为了排除去除效果对水体中剩余微观繁殖体萌发率的影响,又以萌发数与剩余水体中微观繁殖体总数的比值计算出各实验组的绝对萌发率(图4)。通过计算绝对萌发率发现,各组的绝对萌发率最高仅为7.6%。在同改性剂相同改性配比条件下,随着改性粘土用量增加,绝对萌发率总体呈下降趋势。

图3 上层水体中浒苔微观繁殖体相对萌发率Fig.3 Relative germination rate of Ulva prolifera microscopic propagules in upper water column
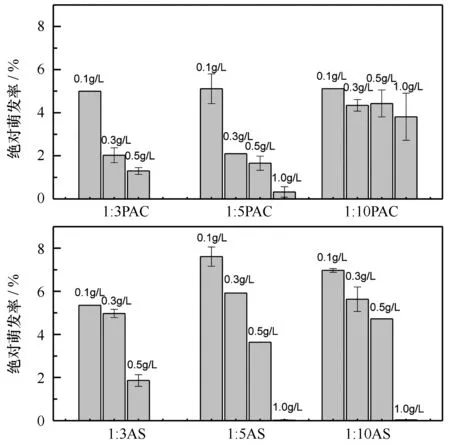
图4 上层水体中浒苔微观繁殖体绝对萌发率Fig.4 Absolute germination rate of Ulva prolifera microscopic propagules in upper water column
絮凝结束后,上层水体与底层絮体中都存在着一定数量的微观繁殖体,将两部分组成的整体统称为一个总体系。分别计数上层水体与下层絮体中萌发的幼苗数,与各部分相对应的体积进行整理计算后得到总体系浒苔微观繁殖体的萌发情况(图5)。结果显示,所有实验组萌发率均远小于对照组(p<0.01),其中1∶10配比0.1 g/L的PAC改性粘土浓度相对萌发率最大,为35.6%。在1∶3配比1.0 g/L浓度下,两种改性粘土体系的底层絮体与上层水体中几乎均未见成功萌发幼苗。随着改性粘土浓度的增加,相对萌发率在特定改性配比下呈先升后降的趋势,且随改性剂用量减少,相对萌发率最高值所对应的改性粘土浓度逐渐增大,即1∶3、1∶5、1∶10配比下相对萌发率最大值分别出现在改性粘土用量为0.3、0.5、1.0 g/L。通过计算发现,3种配比在此3个浓度下对应的改性剂浓度同为0.1 g/L(表1、表2),即当改性剂浓度低于0.1 g/L时相对萌发率升高,高于0.1 g/L时相对萌发率降低。

图5 总体系微观繁殖体相对萌发率Fig.5 Relative germination rate of microscopic propagules in total water column

浓度1∶31∶51∶10改性剂浓度/g·L-1相对萌发率改性剂浓度/g·L-1相对萌发率改性剂浓度/g·L-1相对萌发率0.1g/L0.0317.20%0.0218.74%0.0119.70%0.3g/L0.10*29.07%*0.0628.64%0.0320.39%0.5g/L0.1718.17%0.10*35.88%*0.0524.95%1.0g/L0.330.00%0.2014.62%0.10*27.39%*
注:其中*为相对萌发率最高值对应的改性剂浓度及相对萌发率。

表2 AS改性粘土各配比浓度下的改性剂浓度及其相对萌发率
注:其中*为相对萌发率最高值对应的改性剂浓度及相对萌发率。

图6 上层水体中萌发的浒苔幼苗形态Fig.6 Morphology of Ulva prolifera germilings developed from upper water columnA1-A2: 对照组;B1-B3:0.1、0.3、0.5 g/L的1∶3 PAC改性粘土组;C1-C4:0.1、0.3、0.5、1.0 g/L的1∶5 PAC改性粘土组;D1-D4:0.1、0.3、0.5、1.0 g/L的1∶10 PAC改性粘土组;b1-b3:0.1、0.3、0.5 g/L的1∶3 AS改性粘土组;c1-c4:0.1、0.3、0.5、1.0 g/L的1∶5 AS改性粘土组;d1-d4:0.1、0.3、0.5、1.0 g/L的1∶10 AS改性粘土组;标尺为100 μmA1-A2: control;B1-B3:0.1,0.3,0.5 g/L of 1∶3 PAC modified clay;C1-C4: 0.1,0.3,0.5,1.0 g/L of 1∶5 PAC modified clay;D1-D4: 0.1,0.3,0.5,1.0 g/L of 1∶10 PAC modified clay;b1-b3: 0.1,0.3,0.5 g/L of 1∶3 AS modified clay;c1-c4: 0.1,0.3,0.5 ,1.0g/L of 1∶5 AS modified clay;d1-d4: 0.1,0.3,0.5 ,1.0g/L of 1∶10 AS modified clay;the scale bars represent 100 μm
实验后期对萌发的浒苔幼苗进行了形态学观察(图6),结果发现,上层水体中萌发的幼苗形态呈现一定的规律性,具体表现为对照组幼苗生长良好,主枝粗状呈鲜绿色、细胞分布密集且规律;各实验组随改性粘土浓度的增加,幼苗逐渐发育不良,表现为主枝细弱呈黄褐色、细胞分布稀疏。PAC改性粘土体系在1∶3、1∶5、1∶10配比时出现发育不良幼苗的最低改性粘土浓度分别为0.3 g/L、0.5 g/L、1.0 g/L;AS改性粘土在3种配比下出现发育不良幼苗的最低改性粘土浓度分别为0.1 g/L、0.3 g/L、0.5 g/L,即PAC改性剂浓度大于0.1 g/L、AS改性剂浓度大于0.03 g/L时,会显著影响浒苔幼苗的生长发育。但在底层絮体中萌发的幼苗未见相同形态规律。
4讨论
以往的研究表明,虽然对于不同种类的微藻去除效果有差异,但改性粘土是一种普适性的微藻去除材料,可快速有效地去除中肋骨条藻(Skeletonemacostatum)、塔玛亚历山大藻(Alexandriumtamarense)、东海原甲藻(Prorocentrumdonghaiense)[17]、赤潮异弯藻(Heterosigmaakashiwo)[18]、抑食金球藻(Aureococcusanophagefferens)[19]等多种藻华生物。浒苔微观繁殖体作为我国绿潮暴发的“种源”,其长约6~12 μm,宽约2~5 μm[16],个体微小且相近,同样可将其视作一种微藻。本结果中同配比同浓度下PAC改性粘土去除动力学曲线趋势及变化规律与前人研究[14]基本吻合。在此基础上,本研究采用新的改性剂AS,制备了AS改性粘土,分别探究了粘土矿物在不同改性配比与不同改性剂体系下对浒苔微观繁殖体的去除效果。结果显示,AS改性粘土对浒苔微观繁殖体的去除效果优于同配比同浓度下的PAC改性粘土。两者通过不同的作用机制实现了对藻细胞的絮凝沉降。PAC改性剂能够使得原本带负电的粘土矿物表面电位转化呈正电性,从而与带负电的藻细胞由相互排斥转变为静电吸引,同时增强桥联作用而使得粘土颗粒的有效作用半径增大[20],因此提升了去除效率。AS改性剂则主要是通过铝离子水解形成大量的无定形氢氧化铝,在改性粘土沉降过程中通过网捕卷扫作用与藻细胞形成较大的“絮状物”从而共同沉降下来。已有的研究表明,去除率高低与粘土溶液能否与藻华生物形成“絮状物”以及形成的“絮状物”大小有关,形成“絮状物”愈大去除率愈高[21]。本研究中,改性粘土浓度及改性剂浓度的增大提高了改性粘土与藻细胞间的碰撞几率及吸附能力,产生更多的有效碰撞,形成了更大的“絮状物”,因而其去除率随之升高。
改性粘土能够有效去除上层水体中的浒苔微观繁殖体,抑制其萌发,同时还使得萌发后浒苔幼苗的正常生长发育受到影响。添加改性粘土后上层水体中实验组萌发率显著低于对照组,且随着改性粘土用量的增加,相对萌发率呈逐渐下降的趋势,该结果与前人的研究[14]一致。去除率与相对萌发率呈负相关关系(图2、图3),去除率最高组相对萌发率为0,而相对萌发率最高的组其去除率仅有31.3%。这是由于添加了改性粘土后去除了水体中大部分的微观繁殖体,使得上层水体中剩余的微观繁殖体密度减小,萌发基数变小,因此较高的去除率对相对萌发率的降低具有很大贡献。通过计算各实验组的绝对萌发率来单纯考察添加改性粘土对水体中剩余微观繁殖体萌发的影响(图4),发现各实验组绝对萌发率均在7.6%以下,且随着改性粘土用量增加绝对萌发率逐渐下降,这说明改性粘土的添加对水体中未被去除的微观繁殖体起到了萌发抑制作用。推测原因为絮凝沉降过程中,上层水体中部分未被沉降的微观繁殖体可能与改性粘土颗粒发生了碰撞,且改性粘土浓度越高,碰撞机率越大,碰撞的过程中会对微观繁殖体造成一定的物理损伤,影响了其正常萌发。通过水体中萌发的浒苔幼苗形态特点(图6)发现,除了使得微观繁殖体萌发率降低,改性粘土的添加不利于水体中未被去除的浒苔微观繁殖体正常生长发育。在浒苔的生长过程中,充足的氮、磷是其光合色素尤其是叶绿素合成的必要条件。李信书等[22]的研究认为,当外界缺氮时,浒苔会通过释放叶绿素氮来合成蛋白质。一系列研究表明,改性粘土能够吸附水体中的氮、磷等营养元素,粘土颗粒的表面铝/硅结构比是控制营养盐吸附的主要因素,铝含量越高吸附能力越大[23—25]。因此随着改性剂铝含量增加,即当PAC浓度大于0.10 g/L、AS浓度大于0.03 g/L时,改性粘土对营养盐的吸附沉降作用可使得所观察到的上层水体中幼苗色素体逐渐稀疏,表现为生长发育不良。

图7 粘土浓度对微观繁殖体萌发的影响Fig.7 Effect of clay concentration on microscopic propagules germination
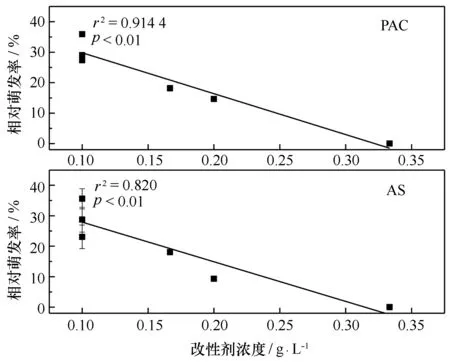
图8 改性剂对微观繁殖体萌发的影响Fig.8 Effect of modifier concentration on microscopic propagules germination
浒苔微观繁殖体在总体系中的萌发情况与上层水体中的萌发情况有所不同。改性粘土絮凝沉降了水体中大部分微观繁殖体,因此底层絮体中含有更密集的微观繁殖体,这部分的萌发情况在总体系中占据主导地位。各实验组萌发率随改性粘土用量的增加呈现先升后降的趋势,在改性剂浓度为0.1 g/L时达到最高。推测原因为:改性剂浓度小于0.1 g/L时,PAC及AS改性粘土对微观繁殖体的静电吸附作用或网捕卷扫作用都相对有限,形成的絮体结构比较松散,加之微观繁殖体本身具有一定的运动能力,微观繁殖体容易脱离絮体束缚。在此环境下,改性粘土对营养盐吸附能力也较弱,通过吸附营养盐对微观繁殖体起到的萌发抑制作用有限。此外,微观繁殖体并不能在水体中直接萌发生长,需要附着基附着[8],且粗糙的附着条件更适宜其附着[26]。故在改性剂作用有限时,粘土为微观繁殖体萌发提供了一定的附着条件,促进其萌发(图7)。当改性剂浓度大于0.1 g/L时,改性剂对微观繁殖体的萌发抑制具有主导地位。因此,对此条件下各实验组进行的回归分析表现为相对萌发率随改性剂浓度升高而下降(图8)。在改性剂浓度较大时,形成的絮体结构更为紧密,使得大量的微观繁殖体被包埋其中,絮凝体的包埋作用会阻碍浒苔微观繁殖体附着,不利于其存活与生长[27—28]。Li等[29]的研究表明,在低光条件下,浒苔基因序列发生变化,表现出衰亡迹象以及一系列包括DNA复制、转录、翻译、糖酵解、柠檬酸循环和丙酮酸代谢障碍。因此包埋在絮体中的浒苔微观繁殖体可能会由于营养盐、光照等条件限制,萌发受到抑制。除此之外,改性剂本身含有一定量的铝离子。有研究表明,铝会与细胞壁上带负电的果胶结合,影响细胞的延展和细胞壁组分的合成[30]。当铝含量达一定浓度时会对藻细胞产生毒性,使其细胞膜电位改变[31]、光合效率降低[32]、细胞分裂受阻[33],因此改性剂达一定浓度时会对微观繁殖体造成直接损伤,影响其正常的生理生化反应,不利于其萌发生长。
5结论
本文比较分析了2种无机改性粘土在3种不同改性配比下对浒苔微观繁殖体的去除效果及萌发的影响,得到的主要结论如下:
(1)改性粘土可以快速有效地去除浒苔微观繁殖体,去除率随着改性粘土及改性剂用量的增加而升高。同配比同浓度条件下,AS改性粘土去除效果优于PAC改性粘土,其在1∶5配比0.5 g/L时的去除效率可达80%以上。
(2)添加适量改性粘土可以有效降低水体中浒苔微观繁殖体的萌发率,成功抑制其萌发,同时不利于萌发后浒苔幼苗的正常生长发育。
(3)改性粘土对浒苔微观繁殖体萌发的影响十分复杂,在有效去除了水体中大部分微观繁殖体的同时,粘土颗粒为底层絮体中微观繁殖体萌发提供了一定的附着条件,而通过一定程度的粘土改性则可有效抑制微观繁殖体萌发。
参考文献:
[1]宋宁而,王琪. 日本的浒苔治理经验及其对我国的启示[J]. 海洋信息,2009(3): 15-19.
Song Ninger,Wang Qi. The management experience ofEnteromorphaspp. outbreak in Japan and its enlightenment to China[J]. Marine Information,2009(3): 15-19.
[2]国家海洋局. 2013年海洋灾害公报[EB/OL]. http://www.coi.gov.cn/gongbao/zaihai/201403/t20140324_30692.html,2014-03-24.
State Oceanic Administration. Marine disaster bulletin 2013[EB/OL]. http://www.coi.gov.cn/gongbao/zaihai/201403/t20140324_30692.html,2014-03-24.
[3]乔方利,马德毅,朱明远,等. 2008年黄海浒苔爆发的基本状况与科学应对措施[J]. 海洋科学进展,2008,26(3): 409-410.
Qiao Fangli,Ma Deyi,Zhu Mingyuan,et al. The basic conditions and scientific countermeasures in the Yellow Sea for the outbreak ofUlvaproliferain 2008[J]. Advances in Marine Science,2008,26(3): 409-410.
[4]刘春兰. 青岛浒苔暴发因素的探讨及对策[J]. 安徽农业科学,2013,41(4): 1695-1698.
Liu Chunlan. Discussion on factors for outbreak ofEnteromorphain Qingdao and countermeasures[J]. Journal of Anhui Agricultural Sciences,2013,41(4): 1695-1698.
[5]Hoffmann A J,Santelices B. Banks of algal microscopic forms: hypotheses on their functioning and comparisons with seed banks[J]. Marine Ecology Progress Series,1991,79: 185-194.
[6]Liu Feng,Pang Shaojun,Zhao Xiaobo,et al. Quantitative,molecular and growth analyses ofUlvamicroscopic propagules in the coastal sediment of Jiangsu province where green tides initially occurred[J]. Marine Environmental Research,2012,74: 56-63.
[7]Lotze H K,Schramm W,Schories D,et al. Control of macroalgal blooms at early developmental stages:PilayellalittoralisversusEnteromorphaspp.[J]. Oecologia,1999,119(1): 46-54.
[8]刘湘庆. 黄海绿潮形成过程中漂浮绿藻及微观繁殖体时空分布研究[D]. 青岛: 国家海洋局第一海洋研究所,2014.
Liu Xiangqing. Distributions of floating green algae and micro-propagules in the formatting and developing processes in the Yellow Sea[D]. Qingdao: The First Institute of Oceanography,State Oceanic Administration,2014.
[9]王晓坤,马家海,叶道才,等. 浒苔(Enteromorphaprolifera)生活史的初步研究[J]. 海洋通报,2007,26(5): 112-116.
Wang Xiaokun,Ma Jiahai,Ye Daocai,et al. Preliminary study on the life history ofEnteromorphaprolifera[J]. Marine Science Bulletin,2007,26(5): 112-116.
[10]Gao Shan,Chen Xiaoyuan,Yi Qianqian,et al. A strategy for the proliferation ofUlvaprolifera,main causative species of green tides,with formation of sporangia by fragmentation[J]. PLoS One,2010,5(1): e8571.
[11]Lin Apeng,Shen Songdong,Wang Jianwei,et al. Reproduction Diversity ofEnteromorphaprolifera[J]. Journal of Integrative Plant Biology,2008,50(5): 622-629.
[12]Huo Yuanzi,Liang Hua,Wu Hailong,et al. Abundance and distribution ofUlvamicroscopic propagules associated with a green tide in the southern coast of the Yellow Sea[J]. Harmful Algae,2014,39: 357-364.
[13]林勇新. 形态特征及藻源有机质对改性粘土絮凝有害藻华生物效率的影响[D]. 青岛: 中国科学院海洋研究所,2013.
Lin Yongxin. Influence of aggregates morphology and algal organic materials on the efficiency of modified clays deployed in mitigation of HAB organisms[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences,2013.
[14]李靖,孙雷,宋秀贤,等. 改性粘土对浒苔(Ulvaprolifera)微观繁殖体去除效果及萌发的影响[J]. 海洋与湖沼,2015,46(2): 345-350.
Li Jing,Sun Lei,Song Xiuxian,et al. Removal of microscopic propagule and its germination ofUlvaproliferawith modified clay[J]. Oceanologia et Limnologia Sinica,2015,46(2): 345-350.
[15]张晓红. 温度、盐度等环境因子对浒苔(Enteromorphaprolifera)及繁殖体生长的影响[D]. 青岛: 国家海洋局第一海洋研究所,2011.
Zhang Xiaohong. Preliminary study on temperature,salinity and other environmental factors effect the visible thalli and microscopic propagules ofEnteromorphaprolifera[D]. Qingdao: The First Institute of Oceanography,State Oceanic Administration,2011.
[16]俞志明,邹景忠,马锡年. 一种提高粘土矿物去除赤潮生物能力的新方法[J]. 海洋与湖沼,1994,25(2): 226-232.
Yu Zhiming,Zou Jingzhong,Ma Xinian. A new method to improve the capability of clays for removing red tide organisms[J]. Oceanologia et Limnologia Sinica,1994,25(2): 226-232.
[17]卢光远. 改性粘土治理藻华对主要营养元素循环及藻毒素的影响[D]. 青岛: 中国科学院青岛海洋所,2014.
Lu Guangyuan. Effects of HABs mitigation by modified clay on major nutrient cyclings and algal toxins[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences,2014.
[18]吴萍,俞志明,杨桂朋,等. 新型表面活性剂改性粘土去除赤潮藻研究[J]. 海洋与湖沼,2006,37(6): 511-516.
Wu Ping,Yu Zhiming,Yang Guipeng,et al. Remediation from harmful algae bloom with organo-clay processed surfactant[J]. Oceanologia et Limnologia Sinica,2006,37(6): 511-516.
[19]张雅琪,俞志明,宋秀贤,等. 改性黏土对褐潮生物种Aureococcusanophagefferens的去除研究[J]. 海洋学报,2013,35(3): 197-203.
Zhang Yaqi,Yu Zhiming,Song Xiuxian,et al. Study on removal of brown tide-Aureococcusanophagefferensby modified clay[J]. Haiyang Xuebao,2013,35(3): 197-203.
[20]俞志明,邹景忠,马锡年,等. 粘土矿物去除赤潮生物的动力学研究[J]. 海洋与湖沼,1995,26(1): 1-6.
Yu Zhiming,Zou Jingzhong,Ma Xinian,et al. Study on the kinetics of clays removing red tide organisms[J]. Oceanologia et Limnologia Sinica,1995,26(1): 1-6.
[21]曹西华. 有机改性粘土去除赤潮生物的机制与方法研究[D]. 青岛: 中国科学院海洋研究所,2004.
Cao Xihua. Studies on mechanism and methodology of organo-clay in removing red tide organisms[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences,2004.
[22]李信书,徐军田,姚东瑞,等. 富营养化与生长密度对绿潮藻浒苔暴发性生长机制的影响[J]. 水产学报,2013,37(8): 1206-1212.
Li Xinshu,Xu Juntian,Yao Dongrui,et al. Effects of nitrogen and phosphorus on the growth,photosynthesis and pigments ofUlvaprolifera[J]. Journal of Fisheries of China,2013,37(8): 1206-1212.
[23]俞志明,马锡年,谢阳. 粘土矿物对海水中主要营养盐的吸附研究[J]. 海洋与湖沼,1995,26(2): 208-214.
Yu Zhiming,Ma Xinian,Xie Yang. Study of main nutrients adsorption on clays in seawater[J]. Oceanologia et Limnologia Sinica,1995,26(2): 208-214.
[24]Swartzen-Allen S L,Matijevic E. Surface and colloid chemistry of clays[J]. Chemical Reviews,1974,74(3): 385-400.
[25]卢光远,宋秀贤,俞志明,等. 改性黏土絮凝海洋原甲藻对水体中氮、磷的影响研究[J]. 中国环境科学,2014,34(2): 492-498.
Lu Guangyuan,Song Xiuxian,Yu Zhiming,et al. Effects of flocculation ofProrocentrummicansby modified clay on nitrogen and phosphorus[J]. China Environmental Science,2014,34(2): 492-498.
[26]Callow M E,Jennings A R,Brennan A B,et al. Microtopographic cues for settlement of zoospores of the green fouling algaEnteromorpha[J]. Biofouling,2002,18(3): 229-236.
[27]Park C S,Hwang E K. An investigation of the relationship between sediment particles size and the development of green algal mats (Ulvaprolifera) on the intertidal flats of Muan,Korea[J]. Journal of Applied Phycology,2011,23(3): 515-522.
[28]D’antonio C M. Role of sand in the domination of hard substrata by the intertidal algaRhodomelalarix[J]. Marine Ecology Progress,1986,27(3): 263-275.
[29]Li Youxun,Zhang Xiaowen,Xu Dong,et al. Differential gene expression inUlvaproliferaunder low light and low temperature conditions[J]. Current Genetics,2012,58(4): 235-244.
[30]林咸永,唐剑锋,李刚,等. 铝胁迫下小麦根细胞壁多糖组分含量的变化与其耐铝性的关系[J]. 浙江大学学报(农业与生命科学版),2005,31(6): 724-730.
Lin Xianyong,Tang Jianfeng,Li Gang,et al. Aluminum-induced change in cell-wall polysaccharide content of wheat roots in relation to aluminum tolerance of wheat[J]. Journal of Zhejiang University (Agriculture and Life Sciences),2005,31(6): 724-730.
[31]Kisnierien⊇ V,Sakalauskas V. The effect of aluminium on bioelectrical activity of theNitellopsisobtusacell membrane after H+-ATPase inhibition[J]. Open Life Sciences,2007,2: 222-232.
[32]Danilov R A,Ekelund N G A. Effects of short-term and long-term aluminium stress on photosynthesis,respiration,and reproductive capacity in a unicellular green flagellate (Euglenagracilis)[J]. Acta Hydrochimica et Hydrobiologica,2002,30(4): 190-196.
[33]Claesson A,Törnqvist L. The toxicity of aluminium to two acido-tolerant green algae[J]. Water Research,1988,22(8): 977-983.
收稿日期:2015-12-03;
修订日期:2016-02-24。
基金项目:国家自然科学基金资助项目(41276115);中国科学院战略性先导科技专项(A类)资助项目(XDA11020302);联合基金项目“海洋生态与环境科学”资助项目(U1406403)。
作者简介:张悦(1990—),女,山东省德州市人,主要从事有害藻华治理及其生态效应研究。E-mail:zhangyue90715@163.com *通信作者:宋秀贤,研究员,博士生导师。E-mail:songxx@qdio.ac.cn
中图分类号:Q949.2
文献标志码:A
文章编号:0253-4193(2016)08-0093-10
Effect of different modified clay on the removal and germination of Ulva prolifera microscopic propagules
Zhang Yue1,2,3,Song Xiuxian1,2,Li Jing1,2,3,Cao Xihua1,2,Yu Zhiming1,2
(1.KeyLaboratoryofMarineEcologyandEnvironmentalSciences,InstituteofOceanology,ChineseAcademyofSciences,Qingdao266071,China; 2.LaboratoryofMarineEcologyandEnvironmentalScience,QingdaoNationalLaboratoryforMarineScienceandTechnology,Qingdao266071,China; 3.UniversityofChineseAcademyofSciences,Beijing100049,China)
Abstract:Two kinds of inorganic modified clay with three modifier/clay ratios were compared on the effect of removal and germination of Ulva prolifera microscopic propagules. The results indicated that removal efficiency increased with the rising amount of modified clay and modifier. AS modified clay was more effective than PAC modified clay,under the same concentration and modifier/clay ratio. The removal efficiency of 1∶5 PAC modified clay under 0.5 g/L was 62 percent while AS modified clay was up to 80 percent. According to the data calculated after removal experiment,relative germination rate of microscopic propagules in upper water column decreased with the increasing of modified clay and modifier. In total water column,the relative germination rate rose firstly then fell with the peak at 0.1 g/L of modifier. Microscopic propagules treated with 1∶3 modified clay failed to germinate under the concentration of 1.0 g/L in both AS and PAC modified clay. In general,suitable concentration of modified clay can remove the Ulva prolifera microscopic propagules effectively and inhibit their germination successfully,which provides a new possible way for the prevention and control of green tide disasters.
Key words:Ulva prolifera; microscopic propagules; modified clay; removal; germination
张悦,宋秀贤,李靖,等. 不同体系改性粘土对浒苔(Ulvaprolifera)微观繁殖体去除及萌发的影响[J].海洋学报,2016,38(8):93—102,doi:10.3969/j.issn.0253-4193.2016.08.010
Zhang Yue,Song Xiuxian,Li Jing,et al. Effect of different modified clay on the removal and germination ofUlvaproliferamicroscopic propagules[J]. Haiyang Xuebao,2016,38(8):93—102,doi:10.3969/j.issn.0253-4193.2016.08.010

