依达拉奉对高氧损伤小鼠肺组织中白介素-4、干扰素-γ、转化生长因子-β1的影响
张国强,高荣荣,张爱梅,林新宇,张立明
(1.潍坊医学院 儿科学教研室,山东 潍坊 261053;2.山东省潍坊市人民医院 新生儿科,山东 潍坊 261041)
依达拉奉对高氧损伤小鼠肺组织中白介素-4、干扰素-γ、转化生长因子-β1的影响
张国强1,高荣荣1,张爱梅2,林新宇2,张立明2
(1.潍坊医学院 儿科学教研室,山东 潍坊 261053;2.山东省潍坊市人民医院 新生儿科,山东 潍坊 261041)
目的探讨依达拉奉对新生小鼠高氧肺损伤的治疗作用,为临床防治新生儿高氧肺损伤提供理论依据。方法将新生小鼠随机分为空气+生理盐水组、空气+依达拉奉组、高氧+生理盐水组、高氧+依达拉奉组,于实验第3、7、10、14和21天取材,测定肺组织中白介素-4(IL-4)、干扰素-γ(IFN-γ)、肺组织中转化生长因子-β1(TGF-β1)表达的变化。结果随着吸氧时间的延长,高氧组IL-4、IFN-γ含量均高于空气组且比例失衡,TGF-β1表达越多并肺组织结构紊乱;依达拉奉治疗组IFN-γ含量显著增高,IL-4含量明显降低,IFN-γ/IL-4比值更接近正常组,TGF-β1表达降低,肺组织结构较高氧组好转。结论高氧可导致新生小鼠急性肺损伤;依达拉奉可调节IFN-γ、IL-4的含量及比例,降低TGF-β1的表达,发挥对高氧肺损伤的防治作用。
依达拉奉;肺损伤;高氧;白介素-4;干扰素-γ;转化生长因子-β1;新生小鼠
氧疗是新生儿缺氧性疾病重要的治疗方式之一,过去的研究十分注重高氧对视网膜的影响,忽视了对视网膜以外重要器官的作用。干扰素-γ(Interferon-γ,IFN-γ)的抗纤维化与白介素-4(Inter-leukin-4,IL-4)的促纤维化在高氧肺损伤中起重要作用。本实验利用高氧致新生小鼠肺损伤动物模型,应用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)、免疫组织化学法测定IL-4、IFN-γ及转化生长因子-β1(transforming growth factorβ1,TGF-β1)在小鼠肺组织中的表达变化,探讨自由基清除剂依达拉奉对高氧肺损伤的治疗作用,为新生儿高氧肺损伤的临床防治提供理论基础。
1 材料与方法
1.1动物材料
昆明小鼠由济南朋悦实验动物繁育有限公司提供[许可证号:SCXK(鲁)20140007],实验过程中对动物的处置符合动物伦理学标准。
1.2试剂与设备
依达拉奉购自国瑞药业,小鼠IFN-γ ELISA试剂盒、TGF-β1抗体购自博士德生物工程有限公司(编号:EK0375、BA0290),IL-4 ELISA试剂盒购自欣博盛生物科技有限公司(产品目录号:EMC003. 96),放射免疫分析(radio immunoprecipitation assay,RIPA)裂解液、蛋白酶抑制剂苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)购自碧云天生物技术研究所(编号P0013B、ST506),其余生化试剂均为国药分析纯。DYC-Ⅰ型动物常压高氧实验舱、ML-Y数字智能测氧仪、Dapex气体分析仪、Eppendorf排枪、酶标仪、精密天平、高速离心机等。
1.3实验方法
1.3.1建立高氧肺损伤模型200只自然分娩的昆明小鼠随机分为空气+生理盐水组(Ⅰ组)、空气+依达拉奉组(Ⅱ组)、高氧+生理盐水组(Ⅲ组)、高氧+依达拉奉组(Ⅳ组)4组,每组50只。每组又随机分为3、7、10、14和21 d 5个亚组,每个亚组10只。Ⅰ组、Ⅱ组在空气中饲养;Ⅲ组、Ⅳ组于生后12 h内置于氧舱中,维持氧浓度90%~95%;钠石灰吸收二氧化碳CO2,使其浓度<0.5%,以变色硅胶保持湿度60%~70%。隔日更换垫料、干燥剂,并将各组母鼠互换,防止母鼠氧中毒并保持哺乳条件一致,给予依达拉奉(5 mg/kg)或等量生理盐水腹腔注射,1次/ 12 h,保持室温25~26℃。
1.3.2组织取材与检测分别于实验第3、7、10、14 和21天取材。ELISA如下:将小鼠断头放血,迅速剪开胸腔,取出双肺,吸水纸拭去表面血迹,称重,放入置于冰上的研钵中,倒入适量液氮,快速将其研成均匀粉末状,加入其9倍重量的含蛋白抑制剂PMSF的RIPA裂解液(RIPA∶PMSF=100∶1),5 min研磨1次,裂解30 min后将匀浆移入离心管中,4℃、12 000 r/min离心15 min,将上清液移入Eppendorf管中,置入-20℃冰箱保存,统一检测。IFN-γ浓度检测步骤如下:将标准品、样品分别加入酶标板孔中,37℃(下同)孵育90 min,甩去液体后加入生物素标记的抗小鼠IFN-γ抗体工作液,反应60 min,洗板后加入亲和素-生物素-过氧化物酶复合物工作液,反应30 min,洗板后加入3,3',5,5'-四甲基联苯胺显色液,避光反应20 min后加入终止液显色,于450nm处测定光密度值,用标准品计算出曲线后,进一步得出样品浓度;IL-4浓度检测方法大致相同。免疫组织化学法如下:小鼠麻醉后,采取肺/体循环双重灌注后将肺组织迅速浸泡于10%中性甲醛液中,石蜡包埋、切片、脱蜡至水、抗原修复、封闭后采用链霉亲和素-生物素-过氧化物酶复合物技术显色,复染,封片,于400倍下每张切片随机选10个视野,用Image-pro plus 6.0进行图像分析,细胞核和/或胞浆呈棕黄色为阳性细胞,阳性细胞越多,颜色越深,平均光密度越大。
1.4统计学方法
采用SPSS 20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用t检验,P<0.05为差异有统计学意义。
2 结果
2.1各组肺组织中IL-4的含量变化
高氧+生理盐水组(Ⅲ组)肺组织中IL-4含量较空气+生理盐水组(Ⅰ组)增加;给予依达拉奉治疗后,高氧+依达拉奉组(Ⅳ组)IL-4含量较高氧+生理盐水组下降,差异有统计学意义,见表1。
2.2各组肺组织中IFN-γ的含量变化
高氧+生理盐水组(Ⅲ组)肺组织中IFN-γ含量与空气+生理盐水组(Ⅰ组)比较,经t检验,差异有统计学意义,Ⅲ组 IFN-γ含量较Ⅰ组增加;给予依达拉奉治疗后,IFN-γ含量与Ⅲ组比较,经t检验,差异有统计学意义,其含量继续增加,7 d起增加更明显。见表2。
2.3各组肺组织中IFN-γ/IL-4比值的变化
高氧+生理盐水组(Ⅲ组)IFN-γ/IL-4明显低于空气+生理盐水组(Ⅰ组),给予依达拉奉治疗后,IFN-γ/IL-4比值更接近于Ⅰ组。见图1。
表1 肺组织中IL-4的含量变化 (n=10,pg/ml,±s)

表1 肺组织中IL-4的含量变化 (n=10,pg/ml,±s)
组别21 d空气+生理盐水(Ⅰ组) 117.69±4.91 126.85±7.69 123.82±9.25 142.27±7.47 130.01±12.62空气+依达拉组(Ⅱ组) 115.93±6.38 130.58±4.52 125.87±5.84 140.31±5.86 135.05±9.36高氧+生理盐水组(Ⅲ组) 211.53±8.21 283.53±9.18 294.49±13.73 330.47±8.63 324.37±13.74高氧+依达拉奉组(Ⅳ组) 130.63±8.64 154.85±9.56 161.21±7.31 183.23±9.37 175.65±12.83 t值(Ⅰ组vsⅢ组) 22.933 40.142 30.530 58.342 44.374 P值(Ⅰ组vsⅢ组) 0.000 0.000 0.000 0.000 0.000 t值(Ⅲ组vsⅣ组) 16.142 29.371 25.683 45.632 27.853 P值(Ⅲ组vsⅣ组) 0.000 0.000 0.000 0.000 0.000 3 d 7 d 10 d 14 d
2.4肺组织形态及TGF-β1的表达
随着吸氧时间延长,高氧+生理盐水组(Ⅲ组)肺组织水肿、充血及血管扩张,炎症细胞浸润逐渐加重,肺组织结构紊乱;而高氧+依达拉奉组(Ⅳ组)肺组织结构较Ⅲ组明显好转。正常新生小鼠肺组织内TGF-β1含量微弱;高氧+生理盐水组(Ⅲ组)TGF-β1含量逐渐增加,高氧+依达拉奉组(Ⅳ组)较空气+生理盐水组(Ⅰ组)TGF-β1含量增加,但较Ⅲ组表达减少,差异有统计学意义。见表3和图2。

图1 肺组织中IFN-γ/IL-4比值的变化
表2 肺组织中IFN-γ的含量变化 (n=10,pg/ml,±s)
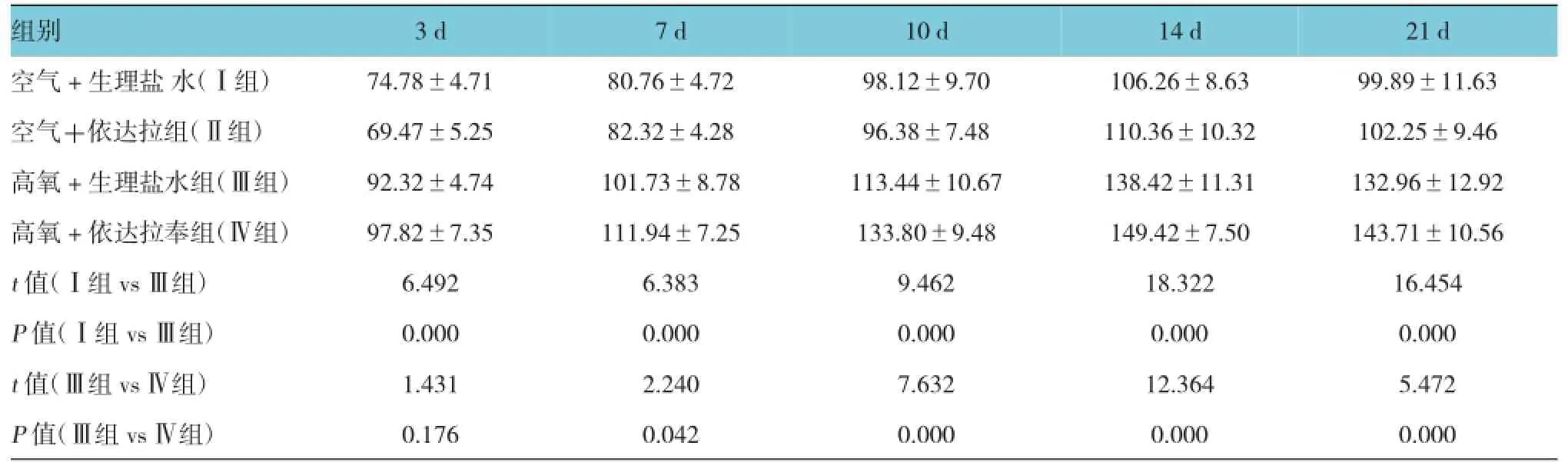
表2 肺组织中IFN-γ的含量变化 (n=10,pg/ml,±s)
组别21 d空气+生理盐水(Ⅰ组) 74.78±4.71 80.76±4.72 98.12±9.70 106.26±8.63 99.89±11.63空气+依达拉组(Ⅱ组) 69.47±5.25 82.32±4.28 96.38±7.48 110.36±10.32 102.25±9.46高氧+生理盐水组(Ⅲ组) 92.32±4.74 101.73±8.78 113.44±10.67 138.42±11.31 132.96±12.92高氧+依达拉奉组(Ⅳ组) 97.82±7.35 111.94±7.25 133.80±9.48 149.42±7.50 143.71±10.56 t值(Ⅰ组vsⅢ组) 6.492 6.383 9.462 18.322 16.454 P值(Ⅰ组vsⅢ组) 0.000 0.000 0.000 0.000 0.000 t值(Ⅲ组vsⅣ组) 1.431 2.240 7.632 12.364 5.472 P值(Ⅲ组vsⅣ组) 0.176 0.042 0.000 0.000 0.000 3 d 7 d 10 d 14 d
表3 肺组织中TGF-β1的平均光密度 (±s)
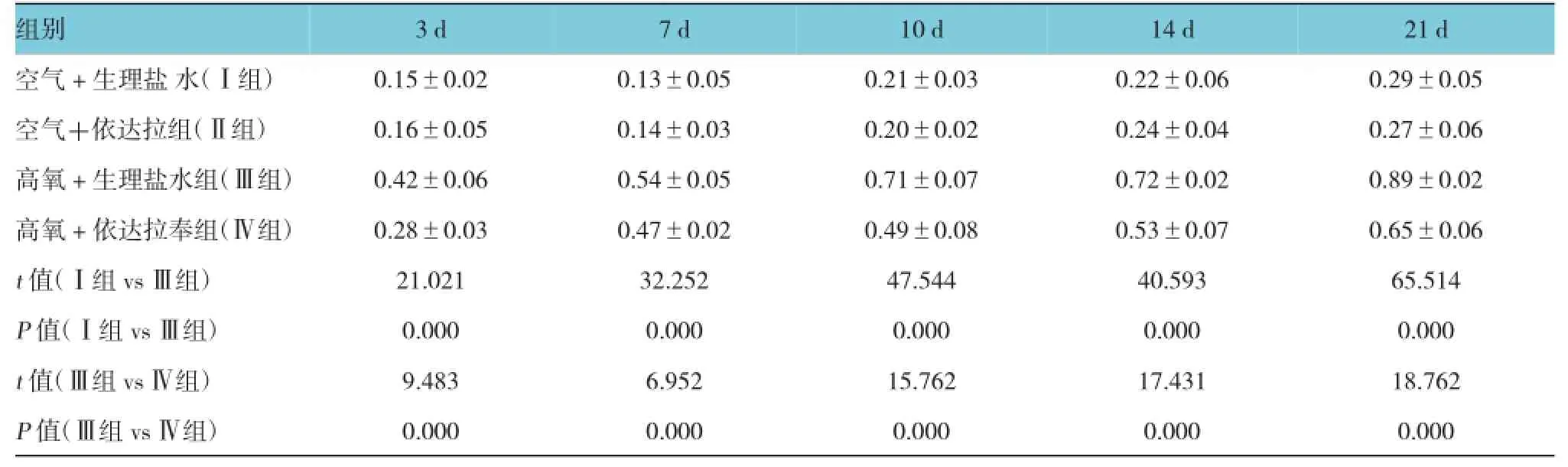
表3 肺组织中TGF-β1的平均光密度 (±s)
3 d组别21 d空气+生理盐水(Ⅰ组) 0.15±0.02 0.13±0.05 0.21±0.03 0.22±0.06 0.29±0.05空气+依达拉组(Ⅱ组) 0.16±0.05 0.14±0.03 0.20±0.02 0.24±0.04 0.27±0.06高氧+生理盐水组(Ⅲ组) 0.42±0.06 0.54±0.05 0.71±0.07 0.72±0.02 0.89±0.02高氧+依达拉奉组(Ⅳ组) 0.28±0.03 0.47±0.02 0.49±0.08 0.53±0.07 0.65±0.06 t值(Ⅰ组vsⅢ组) 21.021 32.252 47.544 40.593 65.514 P值(Ⅰ组vsⅢ组) 0.000 0.000 0.000 0.000 0.000 t值(Ⅲ组vsⅣ组) 9.483 6.952 15.762 17.431 18.762 P值(Ⅲ组vsⅣ组) 0.000 0.000 0.000 0.000 0.000 7 d 10 d 14 d

图2 各组肺组织中TGF-β1含量比较 (免疫组织化学法染色×400)
3 讨论
文献报道,给予90%氧3 d即可诱发小鼠急性肺损伤,损伤程度与暴露时间成正比[1]。高氧所造成的肺损伤机制尚不完全明确,但活性氧具有的细胞毒性作用、炎症因子诱导等作用,会促进肺内相关炎症细胞因子的分泌,损伤肺泡上皮、血管内皮等生物膜系统,导致肺水肿及肺内结构性改变[2]。因此,增加抗氧化物质,以拮抗活性氧的负面作用,调节氧化/抗氧化平衡,理论上可以防治高氧性损伤[3]。
依达拉奉是强效自由基清除剂,临床主要用于治疗急性缺血性脑梗死[4-5]。文献报道,依达拉奉可以减轻大鼠的急性肺损伤[6-7],减轻高氧状态下细胞的损伤[8],保护肝缺血再灌注后引起的肺损伤[9],与其他药物联合应用可治疗急性肺损伤/急性呼吸窘迫综合征[10]。
小鼠肺组织发育经历假腺期、小管期、原始肺泡期、肺泡期4个阶段,在时序上与人类相似。不同之处在于:新生小鼠肺只发育至大体形态,近似于人类28周胎龄肺结构,生后3 d肺泡开始形成[11]。3 d龄以前给予高氧吸入会导致肺泡的发育及成熟受到阻碍[12],这与早产儿高氧肺损伤相似。本研究用生后12 h新生小鼠模仿新生儿出生后因各种原因,特别是危重患儿在呼吸机辅助通气下吸入高浓度氧后造成的肺损伤。
IL-4是Th2类细胞因子,可以刺激肺内成纤维细胞增生,同时促进其他Th2型细胞因子,抑制Th1型细胞因子的生成,使Th1/Th2平衡向Th2优势方向发展,引起肺纤维化[13]。IFN-γ是Th1类细胞因子,可以抗感染,抗增殖,调节免疫,拮抗IL-4[14],已有吸入IFN-γ治疗肺纤维化的报道[15]。
TGF-β1可以促进多种炎症细胞的表达,而聚集的炎症细胞又能释放TGF-β1,形成交互放大效应;在肺纤维化过程中TGF-β1与结缔组织生长因子、血管内皮生长因子等密切相关[16]。本实验将TGF-β1作为观察肺组织损伤的形态学指标。
本实验中高氧组肺组织中IL-4、IFN-γ含量均高于空气组且比例失衡,肺组织中TGF-β1明显增多,肺组织损伤渐加重;给予依达拉奉治疗后IFN-γ上升明显(7 d起两组比较差异有统计学意义),IL-4含量明显降低,IFN-γ/IL-4比例更接近于高氧+生理盐水组,TGF-β1表达减少,肺损伤减轻。提示依达拉奉对高氧诱导的新生小鼠急性肺损伤具有保护作用。作为自由基清除剂,依达拉奉可以直接转移电子给氧自由基进而将其直接清除。另有研究证实,依达拉奉可以增强抗氧化酶的活性[17],抑制活性氧的产生[18],减轻甚至消除氧化基团对细胞的破坏,刺激前列环素生成,减少炎症介质的表达[19-20];参与血红素加氧酶-1和PI3K/Akt途径,上调血红素加氧酶-1的表达,减轻细胞脂质过氧化反应和DNA氧化损伤[21]。
综上所述,依达拉奉对新生小鼠高氧肺损伤具有保护作用,为临床防治新生儿高氧肺损伤提供新思路。
[1]马丽亚,常立文.L-NAME对新生大鼠高氧肺损伤的影响[J].同济医科大学学报,2000,29(2):157-159.
[2]DUTKA T L,VERBURG E,LARKINS N,et al.ROS-mediated decline in maximum Ca2+-activated force in rat skeletal muscle fibers following in vitro and in vivo stimulation[J].PLoS One,2012,7(5):e35226.DOI:10.1371/journal.pone.0035226.
[3]SCHOELERM,LOETSCHERP D,ROSSAINTR,etal. Dexmedetomidine is neuroprotective in an in vitro model for traumatic brain injury[J].Bmc Neurology,2012,12(1):1-7.
[4]KIKUCHI K,KAWAHARA KI,UCHIKADO H,et al.Potential of edaravone for neuroprotection in neurologic diseases that do not involve cerebral infarction(Review)[J].Experimental Therapeutic Medicine,2011,2(5):771-775.
[5]李平,汪波.依达拉奉联合溶栓治疗急性脑梗死的疗效及对氧自由基清除效果的影响[J].中国现代医学杂志,2015,25(28):49-52.
[6]YANG T,ZHANG J,SUN L,et al.Combined effects of a neutrophil elastase inhibitor(sivelestat sodium)and a free radical scavenger(edaravone)on lipopolysaccharide-induced acute lung injury in rats[J].Agents Actions,2012,61(6):563-569.
[7]施梦,王宜青,庞烈文,等.依达拉奉对大鼠急性肺损伤的干预作用[J].中华胸心血管外科杂志,2009,25(6):402-405.
[8]ZHANG G L,ZHANG W G,DU Y,et al.Edaravone ameliorates oxidative damage associated with Aβ25-35 treatment in PC12 cells[J].Journal of Molecular Neuroscience,2013,50(3):494-503.
[9]UCHIYAMA M,TOJO K,YAZAWA T,et al.Edaravone prevents lung injury induced by hepatic ischemia-reperfusion[J]. Journal of Surgical Research,2015,194(2):551-557.
[10]WANG Z,LI R,LIU Y,et al.Protective effects of edaravone combined puerarin on inhalation lung injury induced by black gunpowder smog[J].International Immunopharmacology,2015,26(1):125-132.
[11]MUND S,STAMPANONI M J.Developmental alveolarization of the mouse lung[J].Developmental Dynamics,2008,237(8):2108-2116.
[12]NICHOLAS F,INGRID B,PHILIP H,et al.Disruption of the interactionbetweentherieskeiron-sulfurproteinandcytochrome B in the yeast bc1 complex owing to a human disease-associatedmutationwithincytochromeB[J].European Journal of Biochemistry,2004,271(7):1292-1298.
[13]VASAKOVA M,STERCLOVA M,MATEJ R,et al.IL-4 polymorphisms,HRCT score and lung tissue markers in idiopathic pulmonary fibrosis[J].Human Immunology,2013,74(10):1346-1351.
[14]KLINGSBERG R C,MUTSAERS S E,LASKY J A.Current clinical trials for the treatment of idiopathic pulmonary fibrosis[J]. Respirology,2010,15(1):19-31.
[15]FUSIAK T,SMALDONE G C,CONDOS R.Pulmonary fibrosis treated with inhaled interferon-gamma(IFN-γ)[J].Journal of Aerosol Medicine Pulmonary Drug Delivery,2015,28(5):406-410.
[16]LONG X,SHANSHAN X,RENFENG G,et al.Transforming growth factor β3 attenuates the development of radiation-induced pulmonary fibrosis in mice by decreasing fibrocyte recruitment and regulating IFN-γ/IL-4 balance[J].Immunology Letters,2014,162(1):27-33.
[17]REYES Y A B,TAKEHIKO S,HIDEKI A,et al.MCI-186 (edaravone),a free radical scavenger,attenuates ischemia-reperfusion injury and activation of phospholipase A(2)in an isolated rat lung model after 18 h of cold preservation[J].European Journal of Cardio-Thoracic Surgery,2006,29(3):304-311.
[18]ZHAO Z Y,LUAN P,HUANG S X,et al.Edaravone protects HT22 neurons from H(2)O(2)-induced apoptosis by inhibiting the MAPK signaling pathway[J].Cns Neuroscience Therapeutics,2012,19(3):163-169.
[19]CHEN W,ZHOUHENG Y,JUAN Z,et al.Targeting reactive oxygen species by edaravone inhalation in a rat hyperoxic lung injury model:role of inflammasome[J].Undersea and Hyperbaric Medicine,2013,40(6):505-511.
[20]ZHANG W,GUO Y,YU S,et al.Effects of edaravone on the expression of β-defensin-2 mRNA in lung tissue of rats with myocardial ischemia reperfusion[J].Molecular Medicine Reports,2013,7(5):1683-1687.
[21]CAO H,FENG Y,NING Y,et al.Edaravone protects rats and human pulmonary alveolar epithelial cells against hyperoxia in jury:heme oxygenase-1 and PI3K/Akt pathway may be involved[J]. Experimental Lung Research,2015,41(7):404-414.
(申海菊 编辑)
Impact of Edaravone on hyperoxic lung injury in neonatal mice
Guo-qiang Zhang1,Rong-rong Gao1,Ai-mei Zhang2,Xin-yu Lin2,Li-ming Zhang2
(1.Department of Pediatrics,Weifang Medical College,Weifang,Shandong 261053,China;2.Department of Neonatal Medicine,Weifang People's Hospital,Weifang,Shandong 261041,China)
Objective To explore the effects of Edaravone in hyperoxic lung injury in neonatal mice so as to provide experimental and theoretical evidences for controlling hyperoxic lung injury in neonate.Methods Neonatal mice were randomly divided into air+normal saline,air+Edaravone,hyperoxia+normal saline,hyperoxia+Edaravone groups.At the end of exposure(on the 3rd,7th,10th,14th and 21st day),IL-4 and IFN-γ in lung homogenate were evaluated by ELISA,and TGF-β1and optical density(OD)in lung slices were determined using immunohistochemical stain and computerized graphic analysis techniques.Results With the increasing time of exposure,IL-4,IFN-γ and TGF-β1of the hyperoxic group were increasing and higher than those in the air group,lung injury also aggravated.Compared to the hyperoxic group,the treatment group showed increased IFN-γ and decreased IL-4 and TGF-β1;histopathological changes were alleviated as well.Conclusions Hyperoxia can result in acute lung injury in neonatal mice.Edaravone can regulate the content and ratio of IFN-γ and IL-4,decrease the expression of TGF-β1,thus play a role in prevention and treatment of hyperoxic lung injury.
Edaravone;lung injury;hyperoxia;IL-4;IFN-γ;TGF-β1;neonatal mouse
R363
A
10.3969/j.issn.1005-8982.2016.09.006
1005-8982(2016)09-0029-05
2015-11-20
张立明,E-mail:13963659081@163.com

