siRNA沉默热休克蛋白27对雌激素心血管保护作用的影响*
周琴,邓华菲,谭玉林,曾新艳,颜复生,罗桐秀,易光辉
(1.湘南学院 病理生理学教研室,湖南 郴州 423000;2.湘南学院第一附属医院,湖南 郴州 423000;3.南华大学 心血管疾病研究所,湖南 衡阳 421001)
·论著·
siRNA沉默热休克蛋白27对雌激素心血管保护作用的影响*
周琴1,邓华菲1,谭玉林1,曾新艳2,颜复生2,罗桐秀1,易光辉3
(1.湘南学院 病理生理学教研室,湖南 郴州 423000;2.湘南学院第一附属医院,湖南 郴州 423000;3.南华大学 心血管疾病研究所,湖南 衡阳 421001)
目的通过基因沉默技术,研究热休克蛋白27(HSP27)对雌激素介导的心血管保护作用的影响。方法人脐静脉内皮细胞(HUVEC)转染HSP27 siRNA,免疫荧光法检测siRNA转染效率,Western blot和逆转录-聚合酶链反应(RT-PCR)检测HUVEC中HSP27蛋白和mRNA表达水平;1×10-7mol/L雌二醇(E2)处理转染HSP27 siRNA的HUVEC,24 h后采用硝酸还原酶法检测培养基中一氧化氮(NO)的含量,酶联免疫吸附法(ELISA)检测细胞间黏附分子-1(ICAM-1)、内皮素-1(ET-1)的含量。结果HSP27 siRNA能降低HSP27蛋白和mRNA表达。1×10-7mol/L E2可促进HUVEC分泌NO,同时降低ICAM-1和ET-1水平。转染HSP27 siRNA后,E2介导内皮细胞分泌NO和ICAM-1受到抑制。但沉默HSP27对E2抑制内皮细胞分泌ET-1无明显影响。结论HSP27可能通过雌激素来影响内皮细胞分泌NO和ICAM-1,参与心血管的保护。
雌激素;人脐静脉内皮细胞;热休克蛋白27;小干扰RNA;一氧化氮;内皮素-1;细胞间黏附分子-1
Results HSP27 siRNA sequence significantly reduced the expression of HSP27 in protein and mRNA levels. E2 at the level of 1×10-7mol/L could obviously promote the secretion of NO from HUVECs,and decrease the ICAM-1 and ET-1 levels.After transfection with HSP27 siRNA,E2-mediated secretion of NO and ICAM-1 by HUVECs was inhibited.However,the level of ET-1 had no significant change.Conclusions HSP27 may influence the role of E2 on the secretion of NO and ICAM-1 in HUVECs,and protect the cardiovascular system.
动脉粥样硬化是多种心血管疾病的发病基础,其病变早期主要损伤血管内皮细胞。雌激素能调节内皮细胞分泌血管活性物质,维持血管张力,还能通过雌激素受体(estrogen receptor,ER)促进内皮细胞增殖,调节内皮细胞功能,从而起到血管保护作用。有研究发现热休克蛋白27(heat shock protein 27,HSP27)具有抗动脉粥样硬化的作用,动脉粥样硬化斑块较正常血管壁组织分泌HSP27减少,提示HSP27通过保护血管壁来对抗动脉粥样硬化的发展[1-2]。雌激素在雌激素受体的参与下,可诱导多种细胞产生HSP27[2-3]。本研究的前期细胞实验也证实生理浓度(1×10-9~1×10-7mol/L)的雌二醇(Estradiol,E2)能诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)中HSP27表达上调,其中以1×10-7mol/L E2作用最为明显[4]。研究表明,HSP27的血管壁保护作用与雌激素相关[5],那么HSP27的这种抗动脉粥样硬化作用是否是通过增强雌激素的内皮保护作用实现的呢?本研究采用小干扰RNA(small interfering RNA,siRNA)技术阻断HUVEC内HSP27的表达,以一氧化氮NO、内皮素-1(endothelin-1,ET-1)和细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)作为观察内皮细胞功能的指标,观察HSP27对雌激素诱导的内皮保护作用的影响,以期从内皮细胞角度说明HSP27在对抗动脉粥样硬化过程中与雌激素的相关性,为进一步探讨雌激素保护心血管系统的机制提供依据。
1 材料与方法
1.1材料
HUVEC细胞株购于中国科学院上海细胞生物学研究所,达尔伯克必需基本培养基(dulbecco's minimum essential medium,DMEM)购于美国Gibco公司,胎牛血清购于杭州四季青生物研究所,雌二醇购于美国 Sigma公司,Lipofectamine 2000、HSP27 siRNA、Mock RNA购于美国Invitrogen公司,兔抗人HSP27抗体购于美国Abzoom公司,HSP27、GAPDH引物购于长沙艾杰生物技术有限公司,NO检测试剂盒购于南京建成生物工程研究所,人ET-1酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒购于武汉华美生物工程有限公司,人ICAM-1 ELISA试剂盒购于武汉博士德生物工程有限公司,其他相关试剂均为进口或国产分析纯。
1.2细胞培养及分组
HUVEC贴壁生长于含10%胎牛血清的DMEM双抗培养基中,将细胞静置在37℃、5%二氧化碳CO2培养箱中进行培养。每2~3天更换培养基,使用胰蛋白酶对生长融合的细胞进行消化传代,取对数生长期的细胞用于实验。实验分为5组:①对照组:使用DMEM培养基常规孵育;②MOCK组:转染Mock RNA(对基因无RNA干扰作用的双链RNA);③E2组:加入1×10-7mol/L E2(E2用DMEM溶解稀释)处理细胞;④HSP27 siRNA组:细胞转染HSP27 siRNA;⑤HSP27 siRNA+E2组:1×10-7mol/L E2与转染HSP27 siRNA的细胞共同孵育。各组作用时间为24 h。
1.3HSP27 siRNA的设计合成
经筛靶验证,确定后续干扰实验所用的HSP27 siRNA模板如下:正向引物5'-ACGGUCAAGACCAA GGAUGdTdT-3';反向引物5'-CAUCCUUGGUCUUG ACCGUdTdT-3'。对基因无RNA干扰作用的Mock RNA序列为:正向引物5'-UUCUCCGAACGUGUCA CGUdTdT-3';反向引物5'-ACGUGACACGUUCGGA GAAdTdT-3'。以上siRNA均由美国Invitrogen公司设计合成。
1.4细胞转染
转染前24 h消化细胞,将细胞传代于6孔板,第2天按 Lipofectamine 2000转染试剂说明书配制RNA-Lipofectamine 2000混合液,按照浓度梯度加入Cy3荧光标记的siRNA,在室温下放置15 min。吸去6孔培养板中的培养基,用磷酸盐缓冲溶液(phosphate buffer saline,PBS)清洗1次,加入配制好的转染混合液和培养基,再将细胞放入培养箱中培养。24 h后弃去培养基,PBS洗涤,倒置荧光显微镜观察,只有成功转染的细胞才能看到Cy3红色荧光。
1.5转染细胞鉴定
转染48 h后提取细胞总蛋白和RNA,分别用Western blot和逆转录 -聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测HSP27蛋白和mRNA的表达。
1.5.1Western blot检测细胞内HSP27蛋白表达收集并裂解上述培养24 h HUVEC,提取蛋白并测定浓度[用二喹啉甲酸法定量蛋白]。以等量蛋白上样进行12%十二烷基硫酸钠-聚丙烯酰胺电泳。电泳结束后转移至聚偏二氟乙烯膜,5%脱脂牛奶4℃封闭过夜,按抗体说明书稀释后加入兔抗人HSP27一抗,4℃孵育过夜,加入辣根过氧化物酶标记的羊抗兔IgG二抗(1︰5 000稀释),4℃孵育2 h,三羟甲基氨基甲烷缓冲盐溶液洗涤后显色,胶片曝光,Lab Works 3.0软件分析结果,以标准浓度的β-actin作内参照。
1.5.2RT-PCR检测细胞内HSP27 mRNA水平细胞总RNA按Trizol试剂盒说明书提取。取总RNA 2μg,逆转录试剂盒逆转录合成cDNA,再取逆转录产物1.0μl进行HSP27和GAPDH的PCR循环,引物序列见表1。PCR循环条件为:94℃预变性5 min,95℃变性30s,65℃退火30s,72℃延伸40s,共35个循环,72℃继续延伸10 min。反应完成后,在1.2%的琼脂糖凝胶中电泳,UVP型凝胶图像分析系统对电泳条带进行积分吸光度测定和分析。
1.6硝酸还原酶法检测NO水平
将细胞接种于6孔培养板,每孔2 ml,细胞贴壁后弃去旧培养液,用PBS冲洗3遍,加入新鲜无血清培养液和各种处理因素继续培养,相应时间后收集细胞培养液,离心取上清液,硝酸还原酶法检测NO水平,按照NO检测试剂盒说明书操作,分光光度计于550 nm处检测。
1.7ELISA法检测ICAM-1及ET-1水平
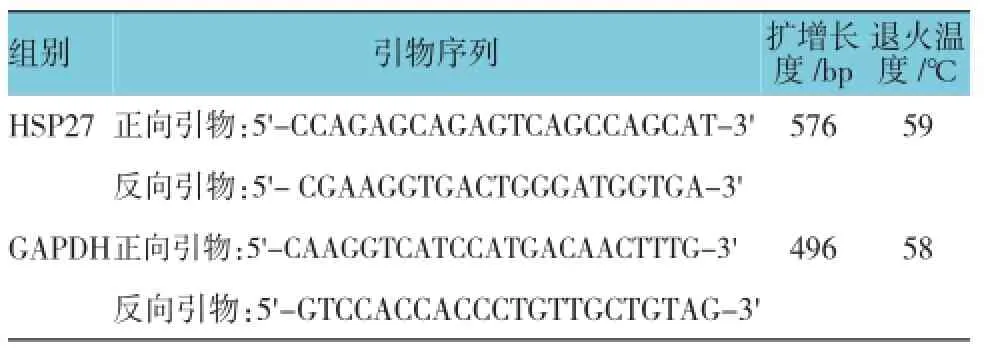
表1PCR引物序列及反应条件
细胞处理完后,收集培养液,采用ELISA法检测ICAM-1及ET-1含量,具体步骤参照ELISA检测试剂盒说明书,每个样本复3孔,待反应结束后,酶标仪450 nm处测吸光度值,重复测3次,取平均值进行统计学分析。
1.8统计学方法
采用SPSS 22.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较用方差分析及SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1细胞转染鉴定
HUVEC转染24 h后,用荧光倒置显微镜鉴定转染效率。结果显示,内皮细胞在荧光显微镜下呈现红色荧光,表明大部分细胞已成功转染siRNA。见图1。
2.2HUVEC中HSP27 mRNA及蛋白表达
空白对照、Mock RNA转染和HSP27 siRNA转染3个实验组培养48 h后,分别采用RT-PCR法和Western blot法检测HSP27 mRNA和蛋白的表达水平,进一步检测转染效率。HSP27 mRNA水平比较发现,HSP27 siRNA转染能降低内皮细胞中HSP27 mRNA表达水平(见图2)。RNA干扰对HSP27蛋白的影响与HSP27 mRNA表达的改变相似(见图3)。
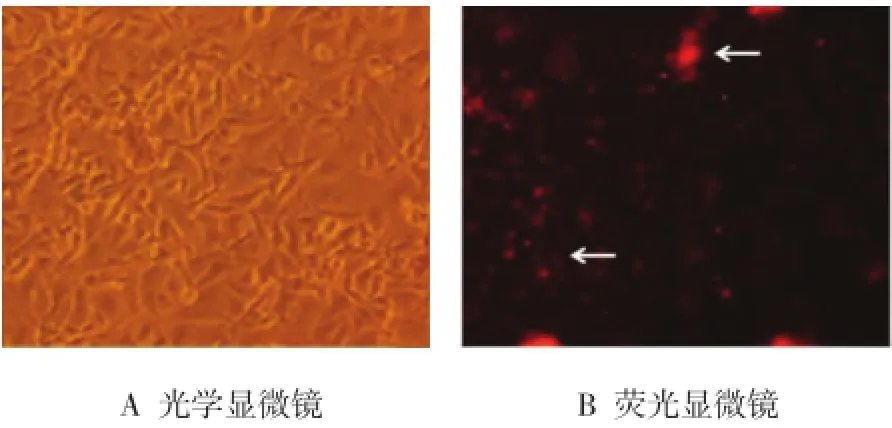
图1 荧光显微镜鉴定siRNA转染效率 (×20)
2.3HSP27 siRNA对雌激素介导的HUVEC分泌NO、ET-1和ICAM-1的影响
采用硝酸还原酶法和ELISA法检测HUVEC分泌NO、ET-1和ICAM-1的水平。1×10-7mol/L E2可明显促进内皮细胞分泌NO(与对照组比较,P= 0.006),同时降低ICAM-1和ET-1水平(与对照组比较,P=0.000和0.023)。HSP27 siRNA+E2组与对照组培养基中NO含量比较,差异无统计学意义(P= 0.447),但与E2组比较NO分泌明显减少(P=0.000),说明沉默HSP27可抑制E2对内皮细胞分泌NO的调节作用。HSP27 siRNA+E2组与HSP27 siRNA组的NO水平比较差异无统计学意义(P=0.189),也提示E2对内皮细胞分泌NO的调节作用与HSP27有关。值得注意的是单独沉默HSP27,内皮细胞分泌NO相对对照组明显减少(P=0.003),说明HSP27对内皮细胞分泌NO可能有直接作用。见表2。
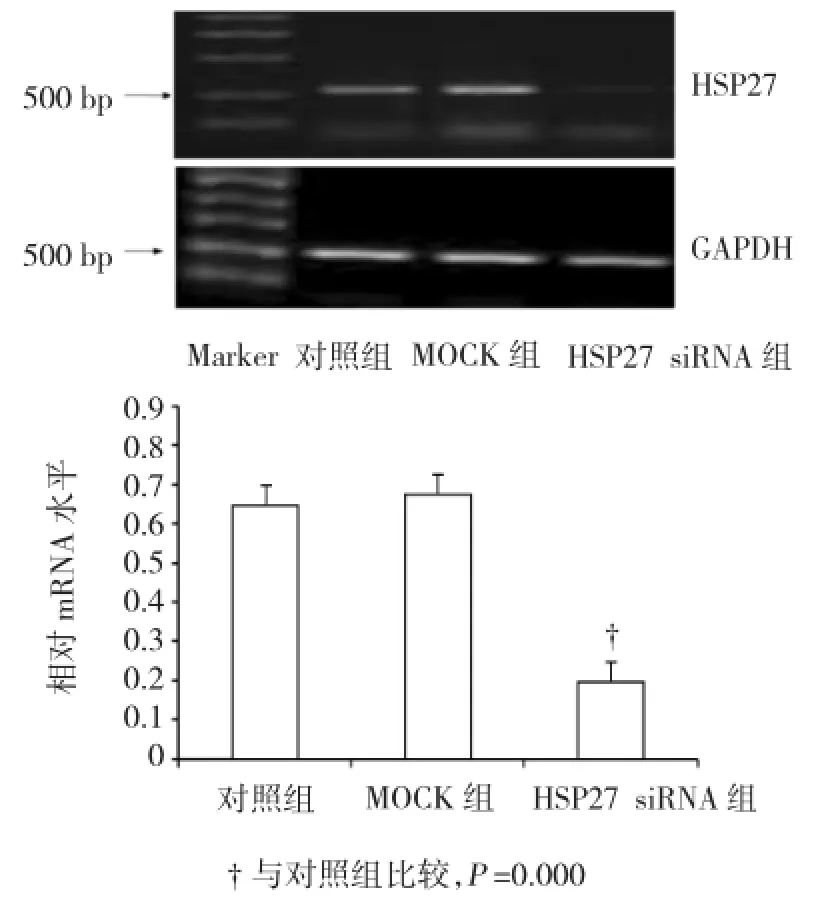
图2HUVEC中HSP27 mRNA表达
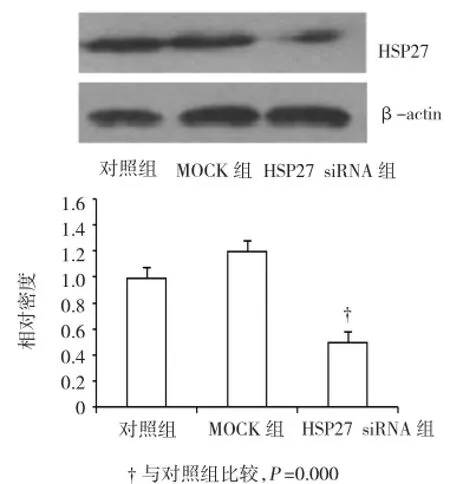
图3HUVEC中HSP27蛋白表达水平
HSP27 siRNA+E2组内皮细胞分泌ICAM-1水平相对对照组明显降低(P=0.024),与E2组比较却显著升高(P=0.010),与HSP27 siRNA组比较差异无统计学意义(P=0.052),提示HSP27 siRNA可明显干扰E2介导内皮细胞分泌ICAM-1。另外,HSP27 siRNA组与对照组比较ICAM-1水平差异无统计学意义(P=0.118),提示HSP27 siRNA对内皮细胞分泌ICAM-1没有直接影响。
HSP27 siRNA+E2组内皮细胞分泌ET-1较对照组明显降低(P=0.028),与E2组比较差异无统计学意义(P=0.056),说明沉默HSP27对E2抑制内皮细胞分泌ET-1无明显影响。
表2siRNA沉默HSP27基因对E2诱导HUVEC分泌NO、ICAM-1、ET-1的影响 (n=8±s)
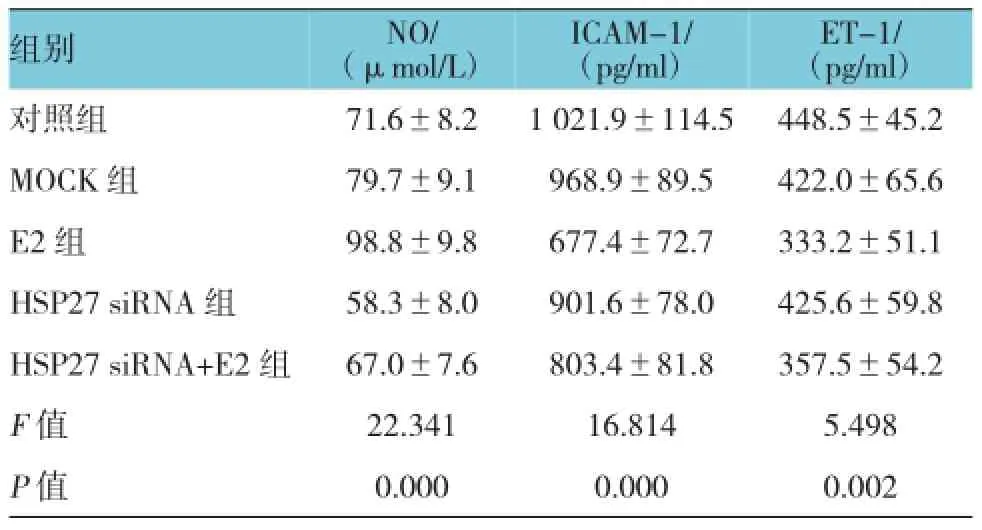
表2siRNA沉默HSP27基因对E2诱导HUVEC分泌NO、ICAM-1、ET-1的影响 (n=8±s)
组别ET-1/ (pg/ml)对照组 71.6±8.2 1 021.9±114.5 448.5±45.2 MOCK组 79.7±9.1 968.9±89.5 422.0±65.6 E2组 98.8±9.8 677.4±72.7 333.2±51.1 HSP27 siRNA组 58.3±8.0 901.6±78.0 425.6±59.8 HSP27 siRNA+E2组 67.0±7.6 803.4±81.8 357.5±54.2 F值 22.341 16.814 5.498 P值 0.000 0.000 0.002 NO/ (μmol/L)ICAM-1/ (pg/ml)
3 讨论
近年来,心脑血管疾病一直高居威胁人类健康的疾病榜首,维持血管内皮细胞的完整性和防止内皮功能障碍是阻碍心血管疾病发生发展的重要环节。NO、ET-1和ICAM-1都由内皮细胞合成、分泌。其中NO、ET-1作用于血管平滑肌细胞,调节平滑肌细胞增殖和血管活性。ICAM-1则可调节细胞间的黏附作用。此外,NO、ET-1和ICAM-1都属于炎症介质,NO和ET-1分泌失衡,ICAM-1表达增多,可导致内皮细胞损伤,促进动脉粥样硬化发生、发展。雌激素可抑制内皮细胞表达ICAM-1,以及单核细胞趋化蛋白,减少单核细胞的黏附和迁移,同时还能通过激活PI3K/Akt途径来调节NO、前列腺素I2和ET-1的表达[6],调节血管活性,起到血管保护作用,是一种冠状动脉粥样硬化性心脏病的保护因素。然而,随机临床试验,如妇女健康研究和心脏与雌激素/黄体酮替代治疗研究显示,激素替代疗法对血管益处少,绝经后激素治疗甚至导致乳腺和子宫的不良事件[7-8]。尽管如此,最近仍有临床试验支持卵巢类固醇激素在血管系统中的有利影响的观点[9]。这可能与雌激素开始替代治疗的时间[10]、剂量以及给药途径[11]有关。激素替代疗法的不稳定性使人们开始将雌激素防治心血管疾病作用的研究转向新的方向。
HSP27是一种重要的分子伴侣,具有抗炎、抗氧化应激以及抑制细胞凋亡等作用。有研究表明,HSP27能保护血管壁,动脉粥样硬化患者血清HSP27水平较正常人低[1-2],增加血清HSP27水平既能减少新动脉粥样硬化病变的形成,又可增强斑块的稳定性[12]。HSP27 siRNA能明显抑制纤溶酶诱导的血管平滑肌细胞凋亡。有动物实验指出,动脉粥样硬化早期过表达HSP27可明显减小病变区域,但只发生在雌性鼠,性别比较差异有统计学意义[13]。然而,慢性动脉粥样硬化持续过表达HSP27,可明显减少胆固醇蓄积,从而减少泡沫细胞数量,使病变区域缩小[14],并且与性别无关[15]。这说明HSP27可能对慢性动脉损伤有潜在的保护作用,性别比较差异无统计学意义。此外,HSP27还可减少纤溶酶诱导的血管平滑肌细胞凋亡,有利于防治不稳定斑块破裂[16]。有研究表明,HSP27重组体(recombinant HSP27,rHSP27)能降低血清胆固醇[17]和清道夫受体-A (scavenger receptor-A,SR-A)[18]水平,使泡沫细胞形成减少,提示rHSP27可作为治疗动脉粥样硬化的新靶点。SEIBERT等[12]也认为HSP27是动脉粥样硬化的生物学标志和治疗靶点。
雌激素可诱导多种细胞表达HSP27,其相互作用与ER有关[2-3]。其中作用于血管壁的主要是ERβ,ERβ激活可上调HSP27表达,并促进雌激素的血管保护作用,同时对女性生殖系统没有影响[19]。雌激素可诱导HSP27短暂磷酸化[20]。磷酸化的HSP27可通过稳定内皮细胞和平滑肌细胞肌动蛋白细胞骨架来防止血管病变[21]。而动脉粥样硬化的危险因素——低密度脂蛋白可使血管平滑肌细胞中HSP27去磷酸化[22]。雌激素还可促进巨噬细胞分泌释放HSP27[5,15],并通过与SR-A的相互作用抑制胆固醇的摄取[23]。有动物实验证实HSP27的动脉保护作用与雌激素有关[5]。本实验研究siRNA阻断HSP27基因表达对E2介导的内皮保护作用的影响,结果显示,E2可促进HUVEC分泌NO,同时降低ICAM-1和ET-1水平,这与国内外的一些研究一致。HUVEC转染HSP27 siRNA后,E2明显抑制内皮细胞分泌NO和ICAM-1。但沉默HSP27基因后内皮细胞分泌ET-1水平没有明显改变。由此推测HSP27可能通过雌激素来调节内皮细胞分泌NO和ICAM-1,参与心血管的保护,从而对抗动脉粥样硬化的发生、发展。至于HSP27是否参与雌激素对其他心血管的保护,以及HSP27与雌激素之间的具体作用机制,仍需要进一步的研究。
[1]MARTIN-VENTURA J L,DURAN M C,BLANCO-COLIO L M,et al.Identiflcation by a differential proteomic approach of heat shock protein 27 as a potential marker of atherosclerosis[J].Circulation,2004,110(15):2216-2219.
[2]MILLER H,POON S,HIBBERT B,et al.Modulation of estrogen signaling by the novel interaction of heat shock protein 27,a biomarker for atherosclerosis,and estrogen receptor β[J].Arterioscler Thromb Vasc Biol,2005,25(3):10-14.
[3]AL-MADHOUN A S,CHEN Y X,HAIDARI L,et al.The interaction and cellular localization of HSP27 and ERβ are modulated by 17β-estradiol and HSP27 phosphorylation[J].Molecular and Cellular Endocrinology,2007,270(1/2):33-42.
[4]周琴,张青海,邓华菲,等.雌激素对人脐静脉内皮细胞HSP27表达的影响[J].临床与病理杂志,2014,34(5):520-523.
[5]RAYNER K,SUN J F,CHEN Y X,et al.Heat Shock protein 27 protects against atherogenesis via an estrogen-dependent mechanism:role of selective estrogen receptor beta modulation[J].Arte riosclerosis Thrombosis and Vascular Biology,2009,29(11):1751-1756.
[6]YUAN P,WU W H,GAO L,et al.Oestradiol ameliorates monocrotaline pulmonary hypertension via NO,prostacyclin and endothelin-1 pathways[J].Eur Respir J,2013,41(5):1116-1125.
[7]WATERS D D,GORDON D,ROSSOUW J E,et al.Women's ischemic syndrome evaluation:current status and future research directions.report of the national heart,lung and blood institute workshop:lessons from hormone replacement trials[J].Circulation,2004,109(6):53-55.
[8]WILD R A,WU C,CURB J D,et al.Coronary heart disease events in the women's health initiative hormone trials:effect modification by metabolic syndrome:a nested case-control study within the Women,Health Initiative randomized clinical trials[J].Menopause,2013,20(3):254-260.
[9]LIND S L,LARS L,LANDBO T C,et al.Effect of hormone replacement therapyon cardiovascular events in recently postmenopausal women:randomised trial[J].BMJ,2012,345(14):e6409.
[10]MAKI P M,HENDERSON V W.Hormone therapy,dementia,and cognition:the Women's Health Initiative 10 years on[J]. Climacteric,2012,15(3):256-262.
[11]KHALIL R A.Estrogen,vascular estrogen receptor and hormone therapy in postmenopausal vascular disease[J].Biochem Pharmacol,2013,86(12):1627-1642.
[12]SEIBERT T A,HIBBERT B,CHEN Y X,et al.Serum heat shock protein 27 levels represent a potential therapeutic target for atherosclerosis:observations from a human cohort and treatment of female mice[J].J Am Coll Cardiol,2013,62(16):1446-1454.
[13]RAYNER K,CHEN Y X,MCNULTY M,et al.Extracellular release of the atheroprotective heat shock protein 27 is mediated by estrogen and competitively inhibits acLDL binding to scavenger receptor-a[J].Circ Res,2008,103(2):133-141.
[14]CUERRIER C M,CHEN Y X,DOMINIQUE T,et al.Chronic over-expression of heat shock protein 27 attenuates atherogene-sis and enhances plaque remodeling:a combined histological and mechanical assessment of aortic lesions[J].PLoS One,2013,8(2).DOI:10.1371/journal.pone.0055867.
[15]CHEN Y X,RAYNER K,DEB-RINKER P,et al.Over-expression of HSP27 provides chronic atheroprotection:reductions in foam cell content and inflammatory responses[J].Circulation,2008,118:410.
[16]MARTIN-VENTURA J L,NICOLAS V,HOUARD X,et al.Biological significance of decreased HSP27 in human atherosclerosis[J].Arterioscler Thromb Vasc Biol,2006,26(6):1337-1343.
[17]CHEN Y X,ZHAO X L,MCNULTY M,et al.Recombinant HSP27 therapy reduces serum cholesterol levels and experimental atherogenesis[J].Circulation,2009,120:1153.
[18]RAIZMAN J E,CHEN Y X,SEIBERT T,et al.Heat shock protein-27 attenuates foam cell formation and atherogenesis by down-regulating scavenger receptor-A expression via NF-κB signaling[J].Biochim Biophys Acta,2013,8(12):1721-1728.
[19]SUN J,MA X,RAYNER K,et al.Selective activation of estrogen receptor β attenuates atherogenesis and represses cholesterol-associated immune-inflammatory responses[J].Circulation,2008,118:482.
[20]STICE J P,MBAI F N,CHEN L,et al.Rapid activation of nuclear factor κB by 17β-estradiol and selective estrogen receptormodulators:pathwaysmediatingcellularprotection[J]. Shock,2012,38(2):128-136.
[21]ROBINSON A A,DUNN M J,MCCORMACK A,et al.Protective effect of phosphorylated Hsp27 in coronary arteries through actin stabilization[J].J Mol Cell Cardiol,2010,49(3):370-379.
[22]GARCÍA-ARGUINZONIS M,PADRÓ T,LUGANO R,et al. Low-density lipoproteins induce heat shock protein 27 dephosphorylation,oligomerization,and subcellular relocalization in human vascular smooth muscle cells[J].Arterioscler Thromb Vasc Biol,2010,30(6):1212-1219.
[23]MOORE KJ,FREEMAN MW.Scavenger receptors in atherosclerosis:beyond lipid uptake[J].Arterioscler Thromb Vasc Biol,2006,26(8):1702-1711.
(申海菊 编辑)
Influence of siRNA-mediated HSP27 knockdown on estrogen-mediated cardiovascular protection*
Qin Zhou1,Hua-fei Deng1,Yu-lin Tan1,Xin-yan Zeng2,Fu-sheng Yan2,Tong-xiu Luo1,Guang-hui Yi3
(1.Department of Pathophysiology,Xiangnan University,Chenzhou,Hunan 423000,China;2.The First Affiliated Hospital,Xiangnan University,Chenzhou,Hunan 423000,China;3.Institute of Cardiovascular Diseases,University of South China,Hengyang,Hunan 421001,China)
Objective To investigate the influence of HSP27 on the cardiovascular protection of estrogen by gene silencing technique.Methods HSP27 siRNA was transfected to human umbilical vein endothelial cells(HUVECs).The transfection efficiency was assessed by immunofluorescence technique.The expressions of HSP27 mRNA and protein in HUVECs were determined by RT-PCR and Western blot,respectively.HUVECs transfected with HSP27 siRNA were incubated with 1×10-7mol/L estradiol(E2)for 24 hours.The level of nitric oxide(NO)in medium was determined by nitrite/nitrate colorimetric method,and the levels of intercellularadhesion molecule-1(ICAM-1)and endothelin-1(ET-1)in the supernatant were determined by ELISA.
R363
A
10.3969/j.issn.1005-8982.2016.09.001
1005-8982(2016)09-0001-06
2015-07-01
*
国家自然科学基金(No:81270360);湖南省科技厅科技计划重点项目(2014FJ2012);湖南省教育厅项目(No:11C1179);湖南省郴州市科技局项目(No:[2011]29);湖南省重点建设学科(No:2011-76)
易光辉,E-mail:ghyi6108@163.com

