正加速度暴露对大鼠肠黏膜通透性的影响*
邱杰,唐合兰,陈英,王建昌,颜伟,杨春敏
(中国人民解放军空军总医院 干部病房,北京 100142)
正加速度暴露对大鼠肠黏膜通透性的影响*
邱杰,唐合兰,陈英,王建昌,颜伟,杨春敏
(中国人民解放军空军总医院 干部病房,北京 100142)
目的分析正加速度(+Gz)暴露下大鼠外周血D-乳酸及二胺氧化酶(DAO)含量的变化,探讨+Gz暴露对大鼠肠黏膜通透性的影响及机制。方法32只雄性SD大鼠随机分成4组,每组8只,分别标记为A组(正常对照组)、B组(+5 Gz组)、C组(+10 Gz组)、D组(重复暴露组)。采用动物离心机模拟+Gz暴露,B、C组大鼠分别以+5和+10 Gz暴露5 min,D组大鼠重复暴露于+5 Gz 1.5 min,+10 Gz 2 min,+5 Gz 1.5 min,除A组外,其他各组大鼠每日暴露1次,持续5 d。实验结束后次日麻醉大鼠,取大鼠肠黏膜标本及外周血清,镜下观察大鼠肠道组织病理学特点,并检测各组大鼠血清D-乳酸及DAO水平。结果除A组外,其他各组大鼠小肠组织肉眼及光镜下观察均有损伤,损伤程度D组>C组>B组;与A组比较,其他各组大鼠血清D-乳酸及DAO水平均明显升高(P<0.05),血清D-乳酸水平C组低于D组(P<0.01);血清DAO水平B组低于C组和D组(P<0.05)。结论+Gz暴露可增加大鼠肠道黏膜通透性,破坏大鼠肠道机械屏障,损伤程度与+Gz暴露值有关。
正加速度;肠道通透性;机械屏障;D-乳酸;二胺氧化酶
肠道是机体与外界直接发生联系的组织之一。肠道不断遭受各种抗原刺激物(如食物蛋白、细菌及其降解产物等)的损伤,所以必须具有超强的抗损伤能力及阻碍各种有害物质进入机体的功能。肠道的这种屏障功能称为肠道屏障[1]。肠道屏障由机械屏障、生物屏障、化学屏障及免疫屏障组成。随着对肠道屏障研究的逐渐深入,许多学者发现,机械屏障是肠道屏障最为重要的组成部分,其功能的正常发挥主要依赖于肠黏膜上皮细胞及细胞间紧密连接的完整性[2],当肠道黏膜完整性受损,通透性增高时,血清中D-乳酸及二胺氧化酶(diamine oxidase,DAO)水平也明显升高,二者是反映肠黏膜机械屏障功能的良好指标。随着现代高性能战斗机的不断发展,对战斗机的机动性要求越来越高,使得飞行员在飞行过程中必须承受远远超出人类生理耐受力的加速度,对飞行员的身体健康造成极大威胁,据统计,在航空航天医学中,消化系统疾病位居飞行员住院原因的前3位[3],加速度暴露对机体的影响与防护依然是目前航空航天医学的主要研究课题之一。本研究通过模拟正加速度(positive acceleration,+Gz)模型,检测+Gz暴露下大鼠外周血D-乳酸及DAO水平,以探讨+Gz暴露对大鼠肠黏膜机械屏障的损伤及机制,进而为飞行员肠病的防治提供依据。
1 材料与方法
1.1实验动物及分组
32只雄性SD大鼠[中国军事科学院实验动物中心,许可证号:SCXK-(军)-2015-0004],体重(180± 10)g。领回大鼠后适应性喂养1周。喂养条件:中央恒温下饲养,温度(23±2)℃,保持定时通风及适当湿度,食用大小鼠维持饲料(北京科澳协力饲料有限公司),自由饮食。将大鼠随机分成4组,分别标记为正常对照组(A组)、+5 Gz组(B组)、+10 Gz组(C组)、重复暴露组(D组)组,每组8只。
1.2试剂与仪器
动物离心机,由航天航空医学研究所提供,动物离心机是在地面条件下模拟飞行时加速度的设备,离心机转臂半径1 m,采用梯形+Gz作用曲线,G值增长率一般为1 G/s,由计算机程序进行控制,可模拟出不同加速度值、增长率和作用时间。DAO试剂盒,购自南京建成科技有限公司,D-乳酸试剂盒,购自博世生物技术有限公司。台式离心机、925低温冰箱、分光光度仪、戊巴比妥钠、无菌动物手术器械均由航天航空医学研究所提供。
1.3正加速度暴露方法
本实验采用动物离心机模拟+Gz暴露。实验时采用特制的固定装置承载实验动物,将实验动物俯面固定于离心机转臂远端,头朝向离心机轴心方向,每只实验动物专用1个固定盒。每次4只大鼠同时上机。A组大鼠不做处理,B组大鼠以+5 Gz旋转5 min,C组大鼠以+10 Gz旋转5 min,D组大鼠暴露于+5 Gz 1.5 min,+10 Gz 2 min,+5 Gz 1.5 min。每日暴露1次,持续5 d。
1.4标本采集与指标测定
+Gz暴露5 d后所有大鼠禁食不禁水12 h,称重量后用3%戊巴比妥钠按1.5 ml/kg腹腔内注射麻醉,固定大鼠,剃毛后沿大鼠腹正中线打开腹腔,手术切口约2 cm,轻轻拨开腹腔脏器,暴露腹主动脉,采集血标本4 ml,立即全血离心(4℃、3 000 r/min离心15 min),取上清液置于离心管(Eppendorf,EP)管中,置入-80℃冰箱冷冻保存,比色法检测肠黏膜D-乳酸及DAO水平,具体操作方法严格参照试剂盒说明书进行。游离小肠组织,肉眼观察小肠组织特点,在距幽门10 cm处取2 mm×10 mm的小肠组织,40 g/L的中性甲醛溶液中固定,经常规梯度乙醇脱水,二甲苯透明,石蜡包埋,切片,苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色处理后,在光学显微镜下观察小肠黏膜形态结构变化。
1.5统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间正态分布的计量资料比较用单因素方差分析(One-way,ANOVA),LSD进行组间均数的两两比较,P<0.05为差异有统计学意义。
2 结果
2.1正加速度暴露前后大鼠小肠组织大致肉眼观
正常对照组大鼠小肠黏膜呈淡红色,表面光滑完整,无充血、水肿,无出血、糜烂(见图1A);+Gz暴露后的小肠组织出现散在出血点,+10 Gz组和重复暴露组可见条索状出血带,严重者可见大面积出血斑,伴有周围组织弥漫性充血、水肿及明显糜烂(见图1B)。
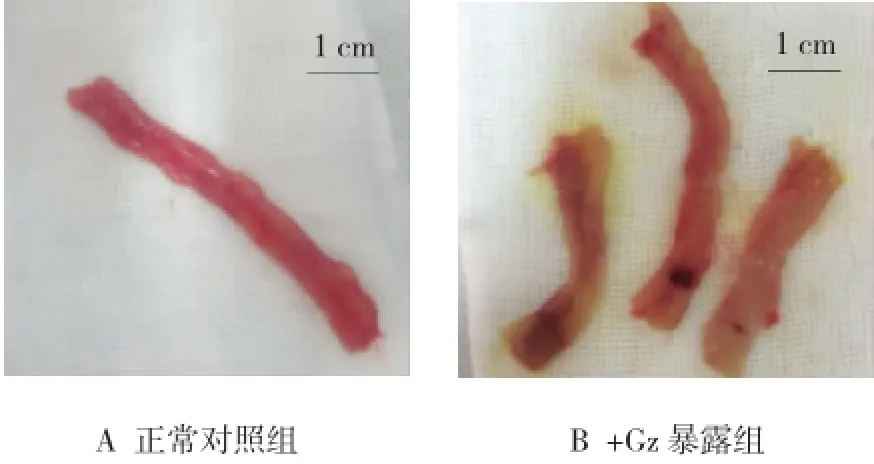
图1 正常对照组及+Gz暴露后小肠组织大致肉眼观
2.2正加速度暴露下各组大鼠小肠黏膜光镜下病理特征
正常对照组大鼠小肠黏膜结构完整,绒毛较长,呈指状突起,排列整齐、密集,少量淋巴细胞浸润;+5 Gz组大鼠小肠黏膜固有层水肿,部分绒毛高度缩短,绒毛间隙增宽,排列不整齐,少量中性粒细胞、淋巴细胞浸润;+10 Gz组大鼠小肠黏膜固有层萎缩,绒毛间隙显著增宽,部分绒毛融合、缩短,绒毛横径增宽,排列不整齐,部分上皮细胞变形、坏死,大量淋巴细胞浸润;重复暴露组大鼠小肠黏膜绒毛萎缩、低矮,隐窝变浅,绒毛间排列杂乱,上皮细胞变性、坏死、脱落,大量中性粒细胞、淋巴细胞浸润。可见+Gz暴露值越高,黏膜损伤越重,重复暴露组损伤最重。见图2。
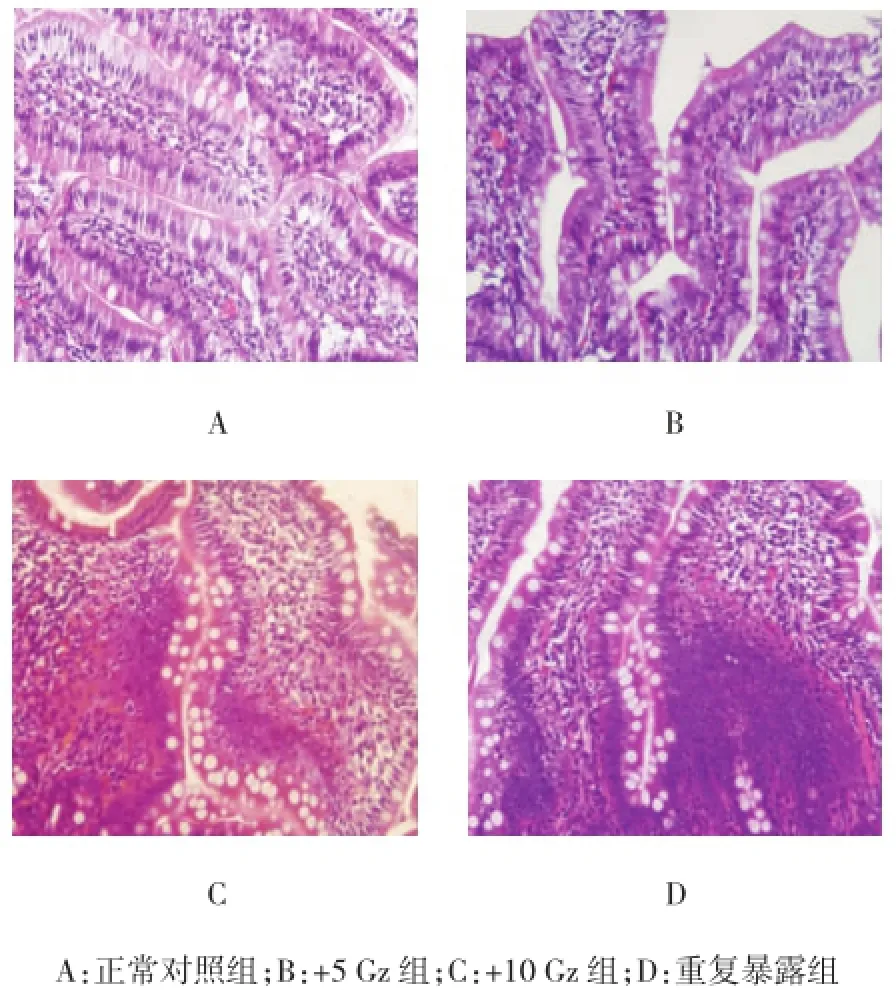
图2 正加速度暴露下大鼠小肠黏膜光镜下病理特征(HE染色×40)
2.3正加速度暴露后各组大鼠血清D-乳酸及DAO水平
各组大鼠血清D-乳酸水平比较,+5 Gz组、+10 Gz组、重复暴露组均高于正常对照组(t=6.055、5.499 和15.498,P=0.000);+5Gz组低于+10 Gz组,但差异无统计学意义(t=0.178,P=0.861);+10 Gz组低于重复暴露组(t=5.372,P=0.000)。
各组大鼠血清DAO水平比较,+5 Gz组、+10 Gz组、重复暴露组均高于正常对照组(t=3.244、4.867 和7.741,P=0.000);+5 Gz组低于+10 Gz组(t=2.429,P=0.029),+10 Gz组虽然低于重复暴露组,但差异无统计学意义(t=1.446,P=0.170)。可见+Gz值越高,D-乳酸及DAO的水平相对越低。见图3和附表。
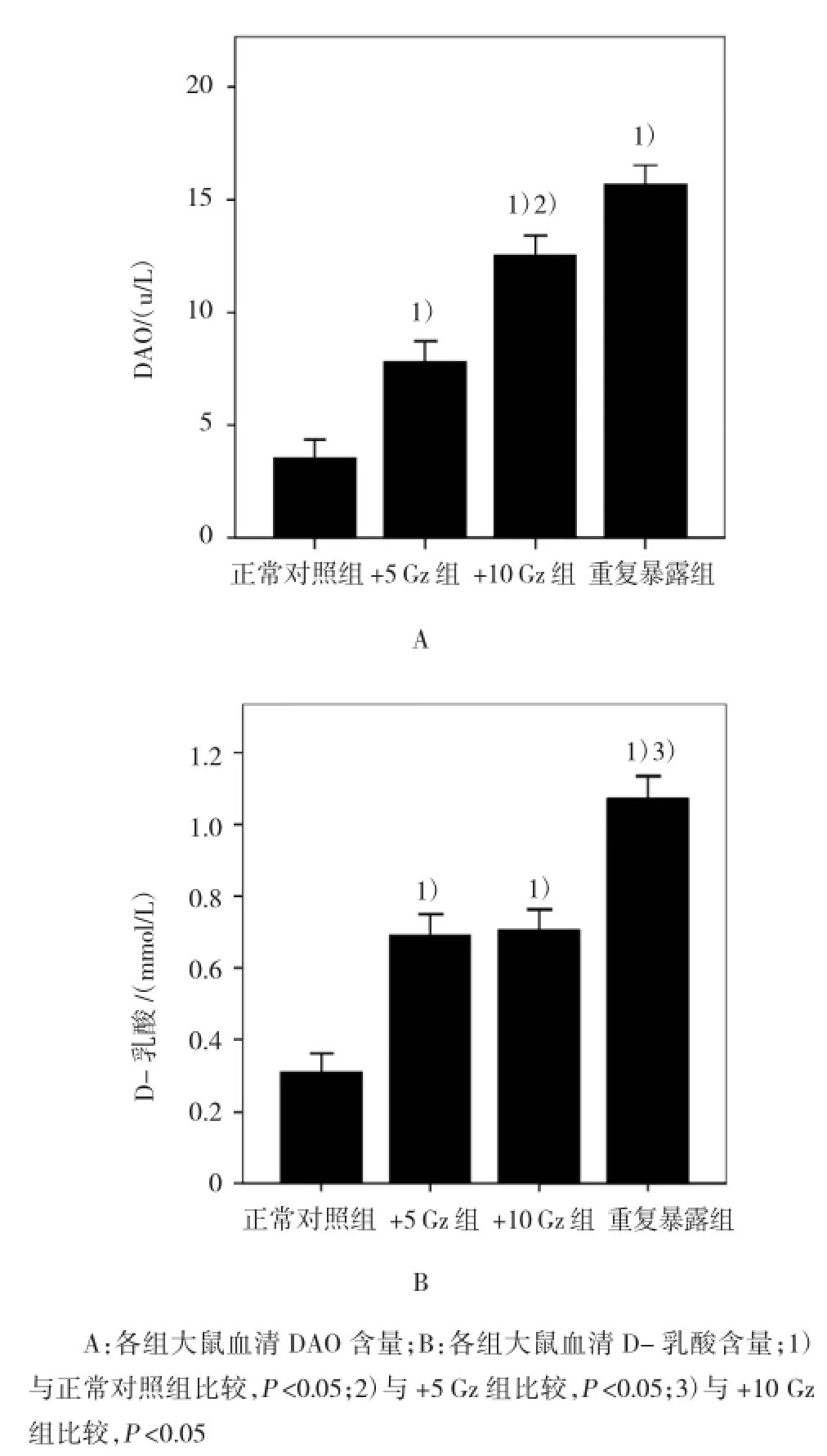
图3 比色法测定各组大鼠血清DAO、D-乳酸水平
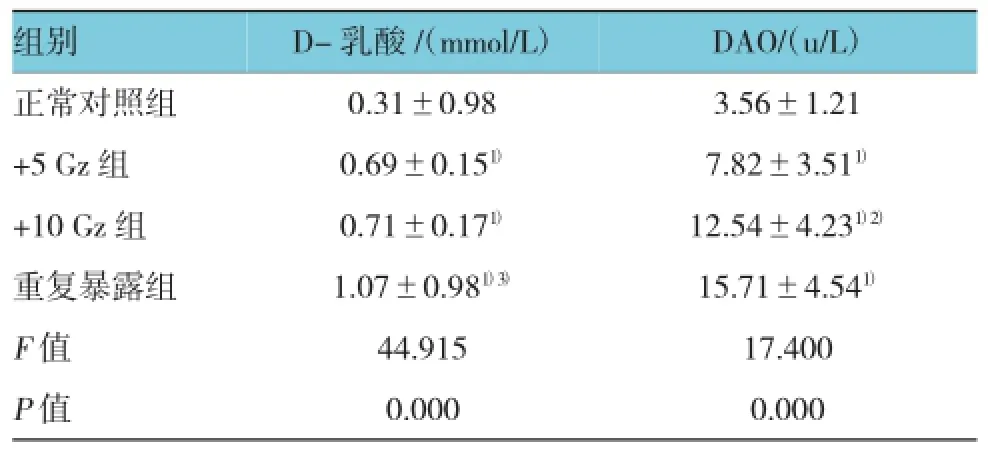
附表 不同正加速度暴露后实验性大鼠血清D-乳酸及DAO的含量 (n=8±s)
附表 不同正加速度暴露后实验性大鼠血清D-乳酸及DAO的含量 (n=8±s)
注:1)与正常对照组比较,P<0.05;2)与+5 Gz组比较,P<0.05;3)与+10 Gz组比较,P<0.05
组别DAO/(u/L)正常对照组 0.31±0.98 3.56±1.21 +5 Gz组 0.69±0.151) 7.82±3.511)+10 Gz组 0.71±0.171) 12.54±4.231)2)重复暴露组 1.07±0.981)3) 15.71±4.541)F值 44.915 17.400 P值 0.000 0.000 D-乳酸/(mmol/L)
3 讨论
飞行员在高空飞行时,产生的向心加速度方向是由座舱底部到座舱盖,同时飞行员也会受到与加速度方向相反的惯性离心力作用,其方向由头端指向足,航空医学中称此为+Gz[4]。近年来,国内外学者多数利用离心机模拟加速度暴露进行相关实验研究[5-7]。与以往研究一样,本研究采用的动物离心机由计算机程序控制,操作准确,方便,可重复。目前已有大量研究证实+Gz暴露可引起记忆力减退、心肌缺血、胃溃疡、炎症性肠病等[8-10],对全身各组织系统均有不同程度影响,但关于肠道屏障方面的研究较少。本研究主要从肠道屏障方面探讨+Gz暴露引起肠道损伤的相关因素,并设置多种+Gz值,以比较不同程度+Gz暴露对大鼠肠道屏障的影响,为进一步加强飞行员胃肠病防护提供新的启示。
近年来,人们对于肠道的研究已不仅仅局限于肠道的消化吸收功能,随着对全身炎症反应综合征、炎症性肠病、肠源性感染等疾病的进一步认识,肠道的屏障功能越来越受到重视[11-12]。肠道屏障包括机械屏障、生物屏障、化学屏障及免疫屏障,前3者属于肠黏膜非特异性免疫屏障,后者为肠黏膜的特异性免疫屏障,肠道机械屏障由肠黏膜上皮细胞、上皮细胞侧面的细胞连接、上皮基膜及上皮表面的菌膜组成,可防止肠腔的大分子物质向肠壁渗透、肠壁固有层的物质进入肠腔,是肠道屏障的结构基础。肠黏膜通透性是反映肠道黏膜机械屏障受损的重要指标,研究证实,炎症、创伤、休克、大出血等应激性刺激导致肠道黏膜出现形态学变化之前,肠黏膜通透性已经增高[13]。
血清D-乳酸及DAO水平可较好地反映肠黏膜通透性及机械屏障受损程度。D-乳酸是细菌发酵的代谢产物,肠道内多种细菌均可产生,如克雷伯杆菌、大肠杆菌、乳酸杆菌属、拟杆菌属等。通常情况下,哺乳动物组织不能或仅能缓慢代谢D-乳酸,因为D-乳酸只有在D-乳酸脱氢酶的作用下才能被降解,而哺乳类动物体内只有L-乳酸脱氢酶,不具备将其快速降解的酶系统[14]。当肠道受到各种刺激导致机械屏障受损时,肠道黏膜通透性增高,肠道内细菌产生的D-乳酸可透过肠道进入血液循环,故检测体循环中D-乳酸水平,可反映肠道通透性变化及机械屏障损伤程度。DAO是存在于肠黏膜上层绒毛胞浆中具有高度活性的细胞内酶,其活性与肠黏膜绒毛高度及肠黏膜细胞的核酸和蛋白合成密切相关。DAO主要存在于小肠黏膜上层绒毛中,在其他组织中含量很少,其含量变化主要源自肠黏膜坏死细胞脱落,DAO释放增加,DAO通过肠道细胞间隙进入淋巴管、血管,使肠黏膜DAO活性降低,体循环中DAO含量升高,故检测外周血DAO活性亦可反映小肠黏膜上皮损伤程度,是评价肠道机械屏障较为理想的指标[15-17]。
本实验中笔者观察到+Gz暴露后大鼠肠道充血,甚至出现散在出血点,小肠上皮细胞变性、坏死、脱落于肠腔,肠绒毛出现不同程度形态学改变,使细胞间紧密连接破坏,细胞间隙增大,肠道通透性增强,肠道机械屏障受损,肠道中D-乳酸及DAO通过受损肠壁释放入血,造成外周血中D-乳酸及DAO水平明显升高,实验中笔者还观察到随+Gz值的增大,血清D-乳酸及DAO水平也随之升高,说明机械屏障损伤程度与+Gz暴露值有关。肠道屏障受损,使肠道自我保护能力下降,同时肠道内各种细菌及毒素通过肠壁释放入血,造成机体内环境紊乱,从而引起消化系统乃至全身各系统疾病,影响飞行员飞行质量。
经分析,+Gz暴露造成肠黏膜机械屏障的损伤可能有以下几个原因:①肠黏膜缺血、缺氧损伤。+Gz应激状态下机体血液重新分配,同时个体受到惯性离心力作用,导致组织及血液的移位,肠道血流减少,有效循环不足。此外,实验和临床研究都证明,体循环灌流恢复以后,胃肠道等内脏器官仍处于低灌流状态[18],即胃肠道是最早发生缺血,却又最晚得到恢复的器官。一系列的血流动力学改变加重肠黏膜缺血,引起肠上皮细胞内氧供量减少,氧耗量增加,当超过上皮细胞的代偿能力时,细胞内出现厌氧代谢、酸中毒,并激活黄嘌呤氧化酶产生过量氧自由基,损伤肠上皮细胞,破坏肠道黏膜[19]。②肠源性内毒素血症。杨加玲等[20]研究证实,过度训练后的大鼠肠黏膜出现内毒素易位。同样,高水平的+Gz刺激下,肠道受到缺血、缺氧、感染等打击,肠黏膜通透性提高,肠道细菌大量繁殖,产生大量内毒素,穿透受损肠壁进入血液循环,形成肠源性内毒素血症[21]。内毒素一方面可刺激单核-巨噬细胞系统,直接引起肠黏膜水肿、糜烂、溃疡和出血;另一方面,内毒素还是炎症级联反应最重要的触发剂,可引起肿瘤坏死因子、血小板活化因子及白介素等多种炎症介质和细胞因子释放,造成多种组织和器官损害,形成恶性循环,提高肠壁通透性,进一步促使肠源性内毒素血症的发生[22]。③肠黏膜营养障碍。肠黏膜营养障碍可影响肠道上皮细胞的增生,造成肠黏膜萎缩。研究证实,谷氨酰胺能明显改善肠道血流量及肠上皮黏液层的功能,并可增强肠道免疫[23]。飞行员在应激状态下,对谷氨酰胺利用量增加,造成机体谷氨酰胺的相对缺乏,使肠道绒毛上皮脱落,绒毛高度降低,黏膜萎缩,隐窝变浅,毛细血管充血[24],肠黏膜通透性提高,机械屏障遭到破坏。
综上所述,笔者认为,+Gz暴露可破坏肠黏膜机械屏障,并且破坏程度与+Gz暴露值有关。针对+Gz暴露引起的肠道屏障功能障碍,飞行训练时飞行员可采取一定的预防性措施,比如给予一定营养支持,以增强肠道屏障功能,减轻飞行过程中加速度暴露对飞行员身体健康造成的损害。但对同一加速度刺激下,不同时间D-乳酸及DAO水平的变化尚不清楚,将在以后的研究中继续探索。
[1]肖献忠.病理生理学[M].第2版.北京:高等教育出版社,2008:236.
[2]BAI C H,LIU H,LI S Y,et al.The protective effects of sacral nerve electrostimulation on intestinal mucosal mechanical barrier in rats with spinal cord injury[J].Chinese Journal of Applied Physiology,2014,30(5):471-474.
[3]刘军莲,高建义,李勇枝,等.飞行员疾病谱研究进展[J].航天医学与医学工程,2011,24:151-156.
[4]耿喜臣,颜桂定,金朝.航空加速度生理学的研究与应用[J].航空军医,2004,32:186-189.
[5]SMITH C,GOSWAMI N,ROBINSON R,et al.The relationship between brain cortical activity and brain oxygenation in the prefrontal cortex during hypergravity exposure[J].J Appl Physiol,2013,114(7):905-910.
[6]IWASAKI K,OGAWA Y,AOKI K,et al.Cerebral circulation during mild+Gz hypergravity by short-arm human centrifuge[J].J Appl Physiol,2012,112(2):266-271.
[7]赵洪礼,吴战军,孙跃,等.高+Gz值暴露对胃黏膜损伤的防治性研究[J].实用医药杂志,2010,27(6):245-247.
[8]ALIKHANNI M,KHOO E,ALYAMI B,et al.Osteogenic effect of high-frequency acceleration on alveolar bone[J].J Dent Res,2012,91(4):413-419.
[9]WHINNERY T,FORSTER E M,ROGERS P B.The+Gz-induced loss of consciousness curve[J].Extrem Physiol Med,2014,2:3-9.
[10]史斌,张洪义.高正加速度对消化系统功能影响的研究进展[J].解放军医学院学报,2014,35:197-199.
[11]GOLL R.Intestinal barrier homeostasis in inflammatory bowel disease[J].Scand J Gastroenterol,2015,50(1):3-12.
[12]CHAWLA B K,TEITELBAUM D H.Profound systemic inflammatoryresponsesyndromefollowingnon-emergentintestinal surgery in children[J].J Pediatr Surg,2013,48(9):1936-1940.
[13]BISCHOFF S C,BARBARA G,BUURMAN W,et al.Intestinal permeability-a new target for disease prevention and therapy[J]. BMC Gastroenterol,2014,14:189.
[14]BAO J,TAN S,YU W,et al.The effect of peritoneal air exposure on intestinal mucosal barrier[J].Gastroenterol Res Pract,2014,2014:674875.
[15]ZHANG J W,ZHANG G X,CHEN H L,et al.Therapeutic effect of Qingyi decoction in severe acute pancreatitis-induced intestinal barrier injury[J].World J Gastroenterol,2015,21:3537-3546.
[16]ZHAO Y,QIN G,SUN Z,et al.Effects of soybean agglutinin on intestinal barrier permeability and tight junction protein expression in weaned piglets[J].Int J Mol Sci,2011,12(12):8502-8512.
[17]ZHANG W,SHEN Z Y,SONG H L,et al.Protective effect of bone marrow mesenchymal stem cells in intestinal barrier permeability after heterotopic intestinal transplantation[J].World J Gastroenterol,2014,20(23):7442-7451.
[18]GROSSIE V B,WEISBRODT N W,MOORE F A,et al.Ischemia/reperfusion-induceddisruptionofratsmallintestine transit is renteral nutrition[J].Nutrition,2001,17(11):939-943.
[19]陈璐,陈英,杨春敏,等.持续正加速度对实验性大鼠胃溃疡愈合质量的影响[J].世界华人消化杂志,2013,21(19):1841-1846.
[20]杨加玲,顾明.过度训练对大鼠小肠粘膜机械屏障的影响及谷氨酰胺的干预作用[J].中国运动医学杂志,2011,30(4):345-349.
[21]杨丽娜.肠缺血再灌注损伤与肠源性细菌/内毒素移位[J].中国血液流变学杂志,2011,21:370-373.
[22]DE PUNDER K,PRUIMBOOM L.Stress induces endotoxemia and low-grade inflammation by increasing barrier permeability[J]. Front Immunol,2015,15(6):223.
[23]WANG X,PIERRE J F,HENEGHAN A F,et al.Glutamine improves innate immunity and prevents bacterial enteroinvasion during parenteral nutrition[J].J Parenter Enteral Nutr,2015,39(6):688-697.
[24]WANG B,WU G,ZHOU Z.Glutamine and intestinal barrier function[J].Amino Acids,2015,47(10):2143-2154.
(申海菊 编辑)
Effects of positive acceleration exposure on intestinal permeability in rats*
Jie Qiu,He-lan Tang,Ying Chen,Jian-chang Wang,Wei Yan,Chun-min Yang (Cadres Ward,General Hospital of Air Force of Chinese PLA,Beijing 100142,China)
Objective To explore the effect of positive acceleration(+Gz)on mechanical barrier of intestinal mucosa in rats and its mechanism.Methods Thirty two male SD rats were randomly divided into 4 groups,i.e.group A(control group),group B(+5 Gz value group),group C(+10 Gz value group)and group D (repeated exposure group)with 8 in each group.The animal centrifuge was used to simulate the exposure of acceleration.+5 Gz value group and+10 Gz value group were continuously exposed to the respective value for 5 min;repeated exposure group was continuously exposed to+5 Gz value for 1.5 min,+10 Gz value for 2 min and+5 Gz value for 1.5 min.The three groups were exposed to the respective acceleration for 5 d.Intestinal mucosa tissue and blood samples were taken on the next day after experiment.Intestinal mucosal injury was observed under light microscope.Blood samples were used to examine the level of D-lactate and diamine oxidase(DAO).Results Except for the group A,intestinal mucosal injury was observed in the other three groups,it was the most serious in the group D,followed by the groups C and B.Compared with the group A,the blood content of D-lactate and DAO significantly increased in the other three groups(P<0.05).The level of D-lactate in the group C was significantly lower than that in the group D(P<0.01).The level of DAO in the group B was significantly lower than that in the groups C and D(P<0.05).Conclusions Positive acceleration exposure can cause intestinal injury in rats.The changes of the content of D-lactate and DAO in blood suggest that positive acceleration exposure can weaken the function of mechanical barrier of intestinalmucosa in rats.
positive acceleration;intestinal permeability;mechanical barrier;D-lactate;diamine oxidase
R852.21
A
10.3969/j.issn.1005-8982.2016.09.002
1005-8982(2016)09-0007-05
2015-11-26
*
全军十二五后勤科研计划基金(No:AKJ11J004)
杨春敏,E-mail:chunmyang9816@163.com;Tel:15611161269

