鹿茸水溶性蛋白质提取条件的优化及组分1)
赵玉红 张立钢 张睿
(东北林业大学,哈尔滨,150040) (东北农业大学) (东北林业大学)
鹿茸水溶性蛋白质提取条件的优化及组分1)
赵玉红张立钢张睿
(东北林业大学,哈尔滨,150040)(东北农业大学)(东北林业大学)
摘要以梅花鹿(Cervus nippon Temminck)鹿茸为原料,采用缓冲溶液提取水溶性蛋白质,在单因素试验的基础上,利用Box-Behnken设计试验优化鹿茸水溶性蛋白质的提取条件,采用Sephadex G-100凝胶层析和SDS-PAGE电泳对提取物组分进行分析。结果表明:鹿茸水溶性蛋白质的最佳提取工艺条件为pH=9.18,料液比1.0 g∶60.4 mL,提取时间5.9 h,在此条件下蛋白提取量为90.84 mg·g-1。采用Sephadex G-100凝胶层析对鹿茸水溶性蛋白质进行分离得到3个吸收峰,经SDS-PAGE电泳测定,其相对分子质量分别为66 000、29 000、14 000。鹿茸水溶性蛋白质主要为小分子蛋白质。
关键词梅花鹿;鹿茸;水溶性蛋白质
梅花鹿鹿茸是梅花鹿(Cervus nippon Temminck)雄鹿密生茸毛的未骨化的幼角[1]。鹿茸作为哺乳动物界唯一存在的可快速重生的组织器官[2-3],其中含有蛋白质、氨基酸、脂肪酸、磷脂、多糖等多种有机成分,还含有人体必需的多种常量和微量元素[1]。鹿茸蛋白占鹿茸总质量的52%以上[4],具有调节免疫、促进伤口愈合、改善性功能、抗疲劳、抗肿瘤、抗炎、抗氧化等多种生物学效应[5-6]。
鹿茸水溶性成分主要包括蛋白质、氨基酸、多糖等,其中蛋白质和多糖是具有生物功能的活性物质。Sui et al.[7]采用生理盐水和pH=4.0、pH=10.0的缓冲溶液对鹿茸中蛋白质进行提取,用STD裂解缓冲液提取其中可溶性蛋白质,并用胰蛋白酶进行酶解,对产物采用RPLC-ESI-MS/MS进行分析,其酸性和碱性缓冲溶液提取蛋白对人脐静脉内皮细胞具有明显增殖效果。严铭铭[8]从梅花鹿茸中分离纯化得到5种蛋白质CNTPⅠ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和1个多肽CNT14,发现蛋白CNTPⅢ和多肽CNT14同源性与已知蛋白序列相比小于50%。董万超等[9]将二杠梅花鹿茸经40%乙醇提取,分离、纯化,获得梅花鹿茸多肽Ⅰ和Ⅱ组分。王华等[10]从梅花鹿鹿茸中提取了天然鹿茸总多肽(VATP),通过HPLC纯化,分离出了相对分子质量为200~600的小肽活性组分(VAP-B2)。王丰等[11]通过凝胶层析、离子交换层析以及HPLC法,从马鹿茸中分离得到一种相对分子质量为3 095.1的多肽。
本研究以梅花鹿鹿茸为原料,利用水溶液对鹿茸蛋白质进行提取,在单因素试验基础上,利用Box-Behnken中心组合试验优化提取鹿茸水溶性蛋白质的提取工艺,并对产物组分进行分级和分子质量分析,旨在优化鹿茸蛋白质提取的适宜工艺条件,提高鹿茸蛋白质提取效率,节约生产成本。为发现鹿茸提取物中新的活性物质,为鹿茸水溶性蛋白质的进一步应用及工业化生产提供依据。
1材料与方法
1.1材料
梅花鹿鹿茸:黑龙江省大庄园集团提供。鹿茸为二杠锯茸,具有典型分枝,为带血茸,皮黑褐,亮泽,断面含血充分、均匀,呈暗红色。单枝质量不低于125 g。
1.2方法
1.2.1鹿茸的预处理及提取方法
取冷冻鲜茸,剥皮,去除残余鹿茸血,将去血的鹿茸切成2~5 mm的小块,冻干后经粉碎机粉碎,过40目筛,鹿茸粉密封备用。用不同pH的缓冲溶液浸泡鹿茸干粉,得鹿茸蛋白粗提物。
1.2.2提取工艺条件优化
(1)单因素试验设计
选取缓冲溶液pH、料液比、提取时间3个因素为主要影响因素。①缓冲溶液pH对鹿茸水溶性蛋白质提取效果的影响。精确称取鹿茸粉末1 g,分别在pH为2.6、5.0、7.0、8.0(磷酸二氢钠-柠檬酸缓冲溶液)、9.0、10.0(碳酸钠-碳酸氢钠缓冲溶液)、12.0(氯化钾-氢氧化钠缓冲溶液),提取2 h,料液比1 g∶20 mL的条件下提取,测定不同pH条件下提取的蛋白质质量分数。②料液比对鹿茸水溶性蛋白质提取效果的影响。精确称取鹿茸粉末1 g,分别在料液比为1 g∶20 mL、1 g∶30 mL、1 g∶40 mL、1 g∶50 mL、1 g∶60 mL、1 g∶70 mL、1 g∶80 mL、1 g∶90 mL、1 g∶100 mL,pH=9.0,提取2 h的条件下提取,测定不同料液比条件下提取的蛋白质质量分数。③提取时间对鹿茸水溶性蛋白质提取效果的影响。精确称取鹿茸粉末1 g,分别在时间为1、2、4、6、8 h,pH=9.0,料液比1 g∶60 mL的条件下提取,测定不同提取时间下提取的蛋白质质量分数。
(2)Box-Behnken中心组合设计
在单因素试验的基础上应用Box-Behnken的中心组合设计原理设计响应面试验。用SAS9.0软件对响应面结果进行分析。响应面试验的因素和水平编码值见表1。

表1 响应面分析因素水平编码
1.2.3蛋白质质量分数测定
采用考马斯亮蓝G-250法测定蛋白质质量分数。标准曲线回归方程为y=0.005 9x+0.013 7,R2=0.995 2。
1.2.4鹿茸蛋白质的分离纯化
(1)水提物中蛋白质的初步分离
取鹿茸缓冲溶液提取物,加入80%硫酸铵,搅拌均匀,使硫酸铵完全溶解,于冰箱中4 ℃冷藏过夜,使蛋白沉淀析出,高速离心,得粗蛋白,-20 ℃冷冻备用。
(2)Sephadex G-100排阻层析
凝胶的预处理:准确称取4 g Sephadex G-100于烧杯中,加入200 mL蒸馏水,浸泡72 h,使凝胶充分溶胀,倾去水分和表层的细小颗粒及杂质。溶胀后如果仍有细小颗粒存在,可以充分搅拌或超声处理以打碎细小颗粒,必须保证葡聚糖凝胶的均一性。凝胶充分溶胀后,用蒸馏水反复洗涤2~3次后,于冰箱4 ℃冷藏备用。
装柱:取洁净的层析住,垂直固定在铁架台上,不可倾斜,关闭下端出口,在柱中加入约1/3柱床体积的洗脱液,边轻轻搅拌边将葡聚糖凝胶匀浆通过内壁一侧倾入柱中,待凝胶沉积1~2 cm后,打开层析柱下端出口,流速一般为0.3~0.6 mL·min-1;同时不断缓慢加入凝胶悬液,待沉积胶面上升至标记处时,灌胶完毕;关闭出水口,静置片刻,等凝胶完全沉降后,接上恒流泵,用3~5倍柱床体积的平衡液平衡柱子24 h,使柱床稳定。装柱过程应始终注意速度,以防有气泡进入。
经过初步分离的鹿茸蛋白质,溶于pH=8.0的磷酸盐缓冲溶液中,上样质量浓度为20 g·L-1,上样体积为1 mL(5%)。层析柱规格为1.0 cm×40.0 cm,径高比为1∶25,流速0.5 mL·min-1,5 mL·管-1收集流出液。分别用紫外/可见光分光光度计(280 nm处)检测紫外吸收峰。根据洗脱曲线收集合并相同的组分,-20 ℃冷冻备用。
(3)SDS-PAGE电泳
SDS不连续凝胶垂直电泳,3%浓缩胶,15%分离胶。
1.2.5数据处理
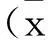
2结果与分析
2.1单因素试验
2.1.1pH对鹿茸水溶性蛋白质提取效果的影响
pH为2.6、5.0、7.0、8.0、9.0、10.0、12.0时,鹿茸水溶性蛋白质提取量分别为17.23、48.75、63.38、65.47、81.75、77.00、64.46 mg·g-1。可见,在缓冲溶液pH<7时,蛋白质的提取量是随着pH的升高而增加的,而由pH=7到pH=8附近又趋于平稳,即蛋白质提取量不随pH改变而有明显变化。从pH=8到pH=9过程中蛋白质提取量又随着pH升高而继续升高,到pH=9以后,随着pH增大,蛋白质提取量呈降低趋势,当pH=9时蛋白质的提取量最大。
2.1.2料液比对鹿茸水溶性蛋白质提取效果的影响结果
料液比为1 g∶20 mL、1 g∶30 mL、1 g∶40 mL、1 g∶50 mL、1 g∶60 mL、1 g∶70 mL、1 g∶80 mL、1 g∶90 mL、1 g∶100 mL时,鹿茸水溶性蛋白质提取量分别为77.17、78.38、79.20、80.36、82.19、79.96、75.72、73.29、70.90 mg·g-1。可见,料液比小于1 g∶60 mL时,蛋白质提取量是随着料液比的增加而增加,从料液比1 g∶60 mL到1 g∶100 mL阶段,蛋白质的提取量随着料液比增加而明显降低。料液比为1 g∶60 mL时蛋白质提取量最大。
2.1.3提取时间对鹿茸水溶性蛋白质提取效果的影响
提取时间为1、2、4、6、8 h时,鹿茸水溶性蛋白质提取量分别为64.40、66.69、72.28、82.96、73.04、71.77 mg·g-1。可见,提取时间小于6 h时,随着提取时间的增加蛋白质的提取量增加,直到提取6 h时蛋白质提取量达到最大(82.96 mg·g-1)。提取时间从6 h到12 h蛋白质提取量又随着时间的增加而减少。
2.2鹿茸水溶性蛋白质提取工艺条件优化
试验采用Box-Behnken设计原理,二次旋转多元回归试验设计,共计17个试验点,其中12个析因点,5个零点。以提取时间(X1)、料液比(X2)、pH(X3)3个因素为自变量,以蛋白质质量分数为响应值,试验方案及结果见表2。

表2 Box-Behnken试验设计及试验数据
应用SAS 9.0软件对回归系数显著性进行分析,结果见表3。
各因素经回归拟合后,解得回归方程为:
Y=92.059 2-1.334 8X1-0.317 9X2+5.339 1X3-
8.682 1X1X1-9.826 4X2X2-7.665 4X3X3-
3.050 8X1X2-1.017 3X1X3+2.101 0X2X3。
式中:Y为蛋白质量分数;X1为提取时间;X2为料液比;X3为pH。

表3 回归系数显著性分析结果

表4 回归方程检验结果
对此二元回归模型进行方差分析,其回归系数R2=0.9897,R2越接近1,证明拟合度越高,全体自变量与因变量之间的多元回归关系就越显著,且模型的p值小于0.01,表明该模拟二次方程极显著,失拟性结果不显著(p>0.05),所以该模型的拟合度很好,可用该模型对未知条件下提取鹿茸蛋白的工艺进行理论预测。由表5的p值可知,各因素对结果的影响由大到小为:pH值、提取时间、液料比。其中,X3、X1X1、X2X2、X3X3、X1X2对Y的影响极显著(p<0.01),X1、X2X3对Y的影响显著(p<0.05),说明试验因素对响应值的影响不是简单的线性关系,其中二次项对响应值的影响较大,交互项的作用较小。
根据回归方程,做出响应面及等高线图,考察所拟合的响应面的形状,分析3因素对蛋白质量分数的影响。响应面图和等高图见图1。从pH与提取时间响应面和等高线图可以看出,最优点趋近于pH=9.0和提取时间为6 h,并在这2点附近取得最大值。从等高线图可看出,pH比提取时间对蛋白提取量的影响大。从pH与料液比响应面和等高线可以看出,最优点趋近于pH=9.0和料液比为1 g∶60 mL,并在这2点附近取得最大值。从等高线图可看出,pH比料液比对蛋白提取量的影响大。从料液比与提取时间响应面和等高线可以看出,最优点趋近于料液比为1 g∶60 mL和提取时间为6 h,并在这2点附近取得最大值。从等高线图可看出,料液比比提取时间对蛋白提取量的影响大。
利用SAS 9.0软件对该试验设计进行脊岭分析,最终确定了鹿茸蛋白的最优提取条件为pH=9.18,料液比1.0 g∶60.4 mL,提取时间5.90 h。
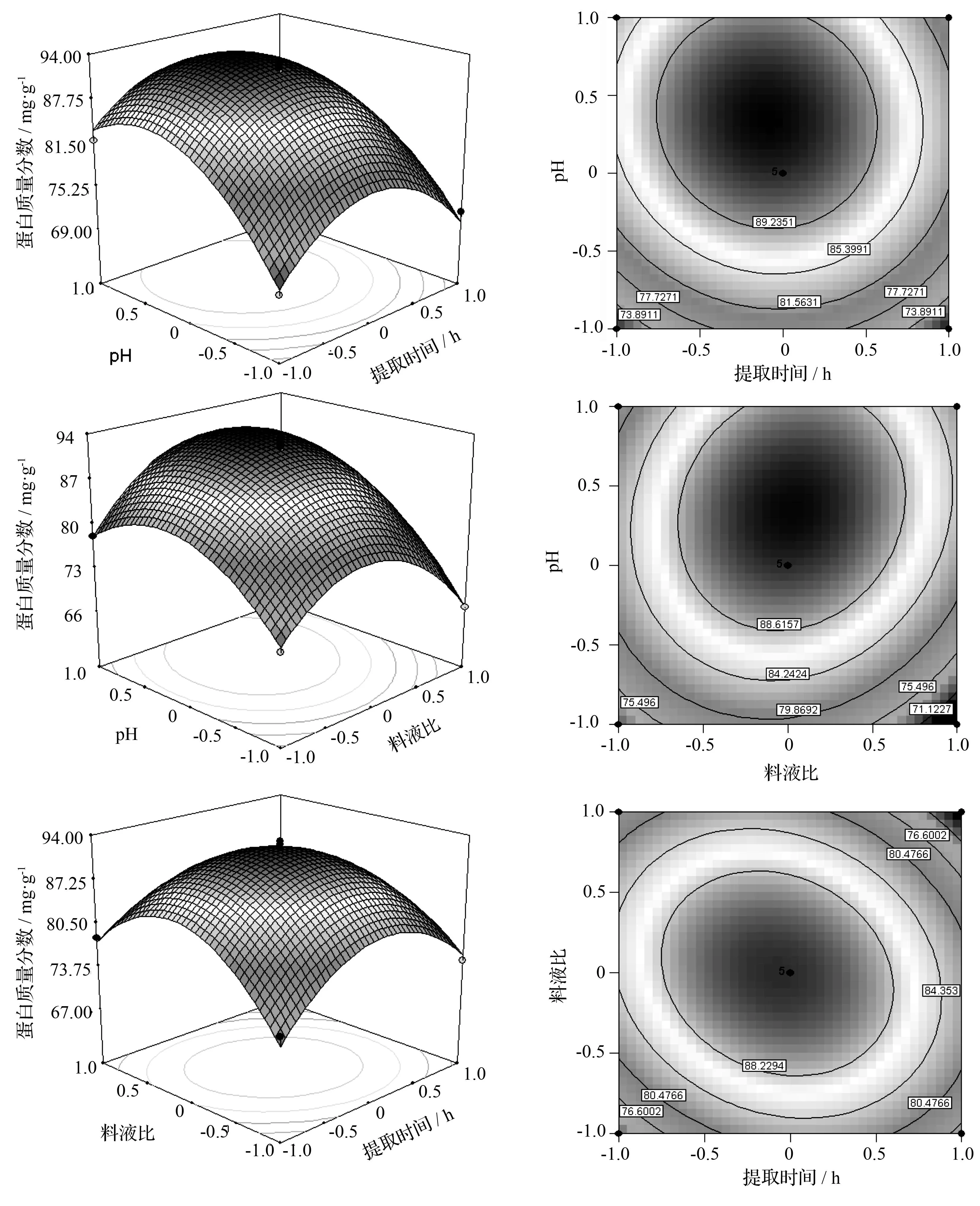
图1 梅花鹿鹿茸蛋白质量分数与提取因素的响应面和等高线图
为了验证拟合数据的可行性,在得到的最佳提取条下,进行鹿茸蛋白提取验证试验,3次平行试验得到实际平均蛋白提取量为90.84 mg·g-1,是理论预测值的97.54%,十分接近理论预测值。因此,响应面法对鹿茸蛋白提取条件的优化是可行的,得到的鹿茸蛋白的提取条件具有实际的应用价值。
2.3Sephadex G-100排阻层析结果
用Sephadex G-100葡聚糖凝胶对经过初步分离得到的鹿茸蛋白进行的纯化、收集洗脱峰部分,结果见图2。从图2可知,经Sephadex G-100凝胶层析后得到了3个吸收峰,依次为Ⅰ、Ⅱ和Ⅲ,其中第1个吸收峰较大,后两个吸收峰较小,这说明鹿茸水溶性蛋白质的分子质量范围主要集中在这3处。
2.4蛋白分子质量分布
用SDS-PAGE电泳测定粗蛋白及经分离纯化后蛋白质的分子质量分布(图3)。由图3可以看出,3个组分的相对分子质量从高到低依次为66 000、29 000和14 000,说明鹿茸中的蛋白质分子质量主要集中在这3个分子质量范围内,且Sephadex G-100层析柱能够有效地将鹿茸蛋白质各个分子质量范围的蛋白质分离开,效果显著。

图2 鹿茸水溶性蛋白质Sephadex G-100凝胶排阻层析曲线
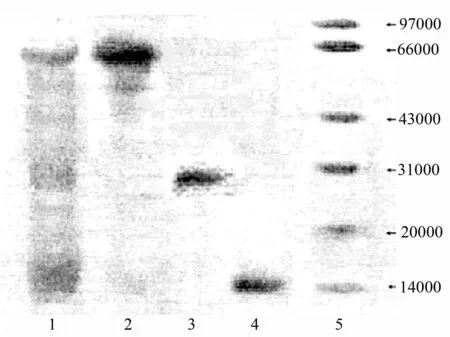
1.经硫酸铵分离后的粗总蛋白;2.组分Ⅰ;3.组分Ⅱ;4.组分Ⅲ;5.蛋白Marker。
图3鹿茸水溶性蛋白质SDS-PAGE电泳图
3结论
通过对梅花鹿鹿茸中的水溶性蛋白质进行提取条件优化并对其组分进行分析可知:鹿茸水溶性蛋白质的最佳提取条件为:pH=9.18,料液比1.0 g∶60.4 mL,提取时间5.9 h,在此条件下蛋白提取量为90.84 mg·g-1。通过Sephadex G-100凝胶层析,得到了3个吸收峰,经SDS-PAGE电泳测定,相对分子质量分别为66 000、29 000、14 000。鹿茸水溶性蛋白质主要为小分子蛋白质。
参考文献
[1]傅雷,孙艺平,赵心宇,等.鹿茸的化学成分以及药理作用研究进展[J].时珍国医国药,2007,18(4):805-806.
[2]KIERDORF U, LI C Y, PRICE J S.Improbable appendages: Deer antler renewal as a unique case of mammalian regeneration[J].Seminars in Cell & Developmental Biology,2009,20(5):535-542.
[4]李和平.中国茸鹿品种(品系)的鹿茸化学成分[J].东北林业大学学报,2003,31(4):26-28.
[5]WU F F, LI H Q, JIN L J, et al.Deer antler base as a traditional Chinese medicine: A review of its traditional uses, chemistry and pharmacology[J].Journal of Ethnopharmacology,2013,145(2):403-415.
[6]桂丽萍,郭萍,郭远强.鹿茸化学成分和药理活性研究进展[J].药物评价研究,2010,33(3):237-240.
[7]SUI Z G, YUAN H M, LIANG Z, et al.An activity-maintaining sequential protein extraction method for bioactive assay and proteome analysis of velvet antlers[J].Talanta,2013,107(30):189-194.
[8]严铭铭.人参鹿茸中蛋白多肽的纯化及活性研究[D].长春:长春中医药大学,2007.
[9]董万超,张秀莲,刘春华,等.梅花鹿茸多肽新成分的提取分离及其生物效应研究[J].特产研究,2000(2):7-10.
[10]王华,林喆,刘强,等.鹿茸寡肽的制备及其促成骨细胞的增殖作用[J].高等学校化学学报,2008,29(9):1791-1796.
[11]王丰,梅子青,周秋丽,等.鹿茸多肽的分离纯化及药理活性[J].吉林大学学报(理学版),2003,41(1):111-114.
第一作者简介:赵玉红,女,1968年8月生,东北林业大学林学院,副教授。E-mail:zhao@nefu.edu.cn。
收稿日期:2015年12月18日。
分类号S865.42;R284.2
Component and Optimization of Extraction Conditions for Water Soluble Protein from Deer Antler//
Zhao Yuhong(Northeast Forestry University, Harbin 150040, P.R.China); Zhang Ligang(Northeast Agricultural University); Zhang Rui(Northeast Forestry University)//
Journal of Northeast Forestry University,2016,44(7):120-124.
Antler velvet from Cervus nippon Temm inck was used as raw material, and water-soluble protein was extracted with buffer solution.The extraction condition was optimized by Box-Benhnken central composite experiment based on single factor tests.The components were analyzed with Sephadex G-100 gel filtration chromatography and SDS-PAGE.The optimized extraction conditions of water soluble protein were pH of 9.18, solid-liquid ratio of 1.0 g∶60.4 mL, and extraction time of 5.9 h with the protein yield of 90.84 mg/g.Three peaks were got with Sephadex G-100 gel filtration chromatography.The molecular weight of protein was investigated by SDS-PAGE with 66 kD, 29 kD and 14 kD.Water-soluble protein from antler velvet was small molecular protein.
KeywordsCervus nippon Temminck; Deer antler; Water soluble protein
1)中央高校科学前沿与交叉学科创新基金项目(2572014CAQ02);黑龙江省高校科技成果产业化前期研发培育项目(1254CGZH14)。
责任编辑:程红。

