籽用西瓜种质资源SSR分析及初级核心种质库构建
石 磊,王 萍,杨 静,王丰丰,孙晓华
(内蒙古农业大学 农学院,内蒙古野生蔬菜种质资源与创新重点实验室,呼和浩特010019)
籽用西瓜种质资源SSR分析及初级核心种质库构建
石磊,王萍*,杨静,王丰丰,孙晓华
(内蒙古农业大学 农学院,内蒙古野生蔬菜种质资源与创新重点实验室,呼和浩特010019)
摘要:采用SSR分子标记技术对50份不同来源的籽用西瓜材料进行遗传多样性研究,并基于SSR分子标记聚类分析采用最小距离逐步抽样法构建籽瓜初级核心种质库。研究表明:(1)从106对SSR随机引物中筛选出扩增条带清晰、多态性高的31对引物,共得到138条清晰可辨条带,其中多态性条带115条,占83.33%,平均Shannon’s信息指数(I)为0.419 3,平均Nei’s多样指数(h)为0.272 4,平均有效等位基因数(Ne)为1.458 0,平均等位基因数(Na)为1.981 4,说明50份籽瓜种质具有丰富的遗传多样性。(2)用NTsys2.10e软件对种质资源聚类分析表明,种质间的遗传相似系数介于0.57~0.91之间,其中来源地相同的个别种质间遗传相似系数却很小,而来源地不同的个别种质间的遗传相似系数却很高。(3)采用最小距离逐步抽样法,按70%、60%、50%、40%、30%、20%、10%的比例抽样后,各个核心子集遗传多样性指数总体上变化不明显,但各抽样比例相比,以抽样比例20%获得10份初选种质的 Ne、 h和 I达到最高值,说明抽样20%构建的初级核心种质对原始种质具有很好的代表性。
关键词:籽用西瓜;SSR分子标记;种质资源;遗传多样性;核心种质
籽用西瓜(Citrulluslanatusssp.vulgarisvar.megalaspermusLin et Chao)简称籽瓜,属于葫芦科普通西瓜亚种中的籽瓜变种,俗称“打瓜”、“瓜籽瓜”,主要以种子为食用器官,常根据种子颜色分为黑籽瓜和红籽瓜两大品种[1]。籽瓜的瓜瓤和瓜皮具有多种微量矿质元素和果胶,长期食用能够调节人体新陈代谢,祛除胃寒,溶蚀软化血管,增强免疫力,排除体内沉积毒素,净化小环境。近年来,随着栽培面积的不断扩大,复种指数增加,籽瓜的一些病害日趋严重,加之长期采用不规范的常规繁殖留种,造成各地栽培品种良莠不齐、混杂退化,致使品质下降、产量不稳,籽瓜产业的发展受到严重制约。因此,开展籽瓜种质资源遗传多样性研究,并建立核心种质库,对于籽用西瓜育种及种质资源的保存利用具有重要意义。
植物遗传多样性资源是生物遗传的基础。近年来随着遗传资源的急剧减少,种质资源的保存利用成为急需解决的问题。Frankel[2-3]和Brown[4]研究提出核心种质的概念,即以最小的资源份数最大限度地代表该物种的遗传多样性,在一定程度上解决了这一问题。近年来国内外关于核心种质的研究较多,但多是基于农艺表型性状,表型性状易受环境因素的影响。因此,只按照表型性状构建核心种质方法是片面的。分子标记辅助育种的研发表明,其能够在短期内获得大量的遗传信息,且能稳定、高效地反映种质资源群体中个体间的亲缘关系。近年来,温景辉[5]、张维瑞等[6]、刘娟等[7]、白成科等[8]采用分子标记技术分别研究山葡萄、桂花、野杏、山茱萸等植物种质遗传多样性并构建核心种质都得到了准确的结果。
赵虎基等[9]用RAPD标记对籽用西瓜的8个品种(系)和西瓜种内其它变种的4个品种(系)进行了遗传多样性分析。张建农[10]用RAPD标记对4个籽用西瓜、2个野生西瓜和不同生态类型瓤用西瓜等34个品种(系)进行遗传多样性分析。柳唐镜等[11]用RAPD标记对不同的红籽瓜种质资源亲缘关系进行分析。与前人相比,本研究运用SSR分子标记技术对19个不同来源地的50份籽(西)瓜种质材料进行遗传多样性分析,并基于聚类分析结果采用最小遗传距离逐步抽样法(LDSS)构建籽瓜的初级核心种质库,能够较为全面地为中国籽瓜种质资源的评价提供参考,为今后进一步构建籽瓜核心种质奠定基础,也为籽瓜种质资源的保护利用及育种工作提供理论依据。
1材料和方法
1.1材料
本研究所收集的50份籽(西)瓜材料来自个19省区,甘肃13份,内蒙古5份,新疆、湖南、美国各4份,宁夏、广东各3份,陕西、前苏联各2份,剩余的10份分别来自10个省区。其中含野生型种质2份,普通西瓜2份。所有材料已经过多代的自交纯化。供试50份籽(西)瓜材料(表1)种植于内蒙古农业大学试验田。参考钱韦等[12]的取样方法,于2014年8月采集了生长旺盛期的籽瓜幼嫩叶片,将不同材料叶片放入有标记的塑封袋中,立即暂时存入冰盒,带回实验室置于-80 ℃冰箱中冷冻备用。
1.2PCR反应
采用DNA提取试剂盒(天根生化有限公司)提取50份材料的基因组DNA,用1%琼脂糖凝胶电泳和紫外分光光度计检测DNA纯度和浓度,-20 ℃保存备用。选用106对随机引物以提取的籽瓜基因组DNA为模板进行PCR反应,筛选出电泳条带清晰、多态性高、重复性好的31对引物(表2),分别对50份样品基因组DNA进行PCR扩增。PCR反应体系为20 μL[13],模板DNA 2 μL(约50 ng/μL),引物2 μL,25 mmol/L MgCl21.8 μL,2.5 mmol/L dNTPs 2 μL,10×TaqBuffer 2 μL,TaqDNA Polymerase 0.1 μL(5 U/μL),ddH2O 11.1 μL。PCR扩增程序反应在BYQ6031 E-505型PCR仪上进行,程序为:94 ℃预变性4 min,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,35个循环,最后72 ℃伸5 min,4 ℃保存以备电泳,扩增产物用6%变性聚丙烯酰胺凝胶于80 V电压下预电泳30 min,后在70 W恒定电压下电泳90 min左右,银染后拍照记录。

表1 供试籽瓜材料及来源
Table 1Continued
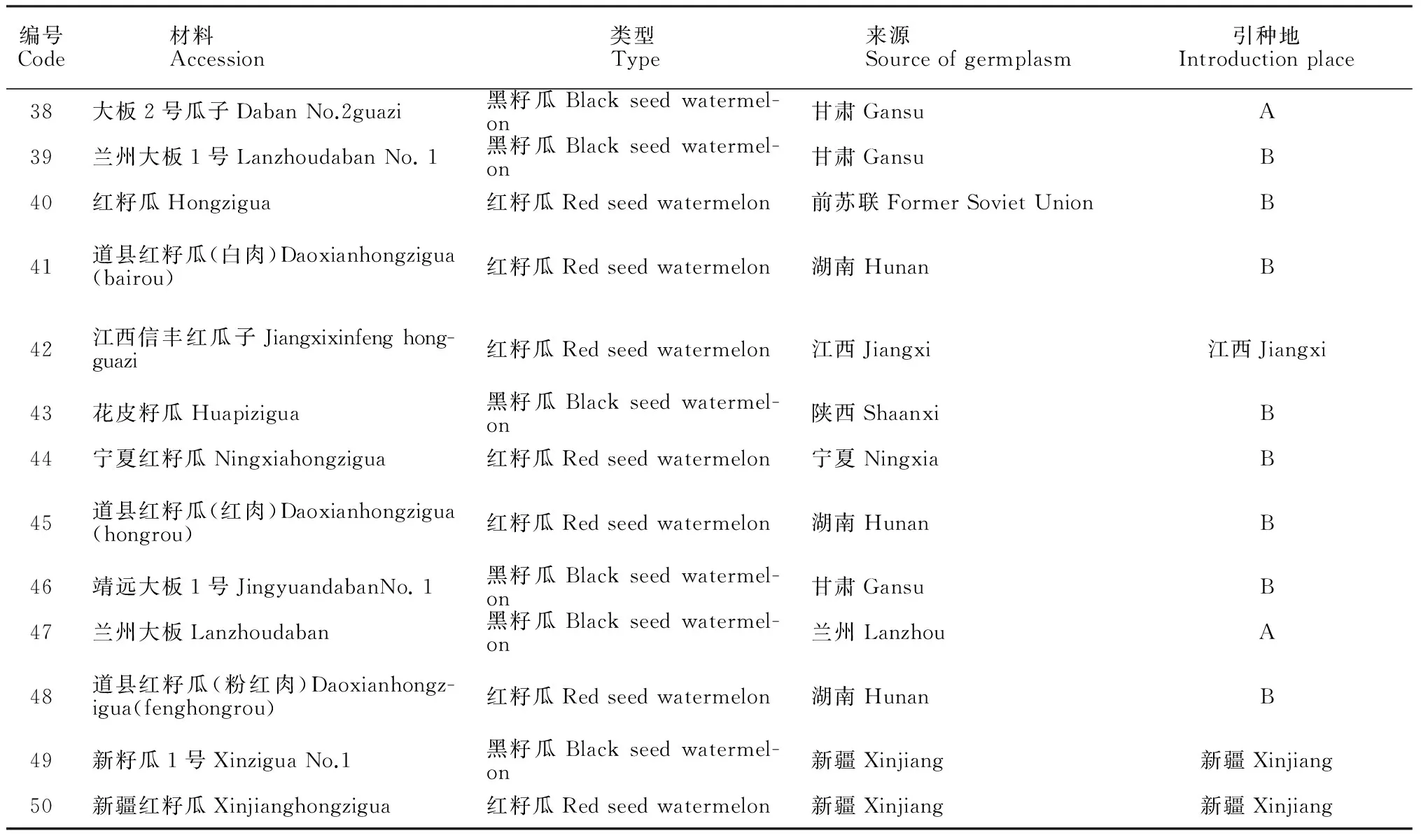
编号Code材料Accession类型Type来源Sourceofgermplasm引种地Introductionplace38大板2号瓜子DabanNo.2guazi黑籽瓜Blackseedwatermel-on甘肃GansuA39兰州大板1号LanzhoudabanNo.1黑籽瓜Blackseedwatermel-on甘肃GansuB40红籽瓜Hongzigua红籽瓜Redseedwatermelon前苏联FormerSovietUnionB41道县红籽瓜(白肉)Daoxianhongzigua(bairou)红籽瓜Redseedwatermelon湖南HunanB42江西信丰红瓜子Jiangxixinfenghong-guazi红籽瓜Redseedwatermelon江西Jiangxi江西Jiangxi43花皮籽瓜Huapizigua黑籽瓜Blackseedwatermel-on陕西ShaanxiB44宁夏红籽瓜Ningxiahongzigua红籽瓜Redseedwatermelon宁夏NingxiaB45道县红籽瓜(红肉)Daoxianhongzigua(hongrou)红籽瓜Redseedwatermelon湖南HunanB46靖远大板1号JingyuandabanNo.1黑籽瓜Blackseedwatermel-on甘肃GansuB47兰州大板Lanzhoudaban黑籽瓜Blackseedwatermel-on兰州LanzhouA48道县红籽瓜(粉红肉)Daoxianhongz-igua(fenghongrou)红籽瓜Redseedwatermelon湖南HunanB49新籽瓜1号XinziguaNo.1黑籽瓜Blackseedwatermel-on新疆Xinjiang新疆Xinjiang50新疆红籽瓜Xinjianghongzigua红籽瓜Redseedwatermelon新疆Xinjiang新疆Xinjiang
注:A. 中国农业科学院蔬菜花卉研究所;B. 国家西甜瓜种质资源平台(河南,郑州)。
None: A. Vegetable and Flower Research Institute of Chinese Academy of Agricultural Sciences;B. The platform of watermelon and muskmelon germplasm resources (Henan, Zhengzhou)
1.3数据分析
利用0、1矩阵统计方式构建SSR数据库。采用POPGENE32软件分析扩增产物的多态位点数、多态位点比率、Shannon’s信息指数等遗传多样性指数。采用NTsys2.10e[14]聚类分析软件UPGMA法进行聚类分析,构建聚类图。
1.4初级核心种质库构建及其评价
用NTsys2.10e软件对种质资源聚类分析后,采用最小距离逐步抽样法(LDSS)构建核心种质[15]。具体方法为:通过观察50份种质的UPUMA聚类图,将遗传相似系数较大的种质组合随机删除1份,再将剩余的种质再次聚类分析;再次删除遗传相似系数较大的成对种质中的1份种质。以此类推,直到筛选出能够达到要求的核心种质。第1次抽样时,选出一定份数种质,运用NTsys2.10e软件对其进行聚类分析;第2次抽样在第1次抽样聚类分析的基础上进行,以此类推。每次抽样后,均采用POPGENE32软件分别对构建的核心种质的SSR-PCR扩增数据进行核心种质的遗传多样性分析,进而评价初级核心种质的代表性。
2结果与分析
2.1SSR标记的多态性分析
从106对SSR引物中共筛选出31对多态性好、条带清晰的引物,分别对50份材料进行PCR扩增,图1为引物P1、P43对50份籽瓜材料进行PCR扩增的电泳图。由图1可以看出每个样品体系中均得到了清晰、丰富的条带,可进行下一步的多样性分析。31对引物(表2)对50份材料共扩增出138条条带。有115条重复性好、清晰的多态性条带,多态性条带比率高达83.33%。表明本研究所收集的籽瓜种质资源在分子水平上具有丰富多态性,种质具有很好的代表性。
(1)首次揭示在郎酒高温制曲进程中,细菌与真核微生物种类具多样性,但细菌与真核微生物变化趋势差异显著。
2.2籽瓜种质资源遗传多样性分析
遗传多样性分析结果(表3)显示,50个材料的扩增条带平均Shannon’s信息指数为0.419 3,平均Nei’s多样指数为0.272 4,平均有效等位基因数为1.458 0,这50份种质资源在分子水平上具有丰富的遗传多样性,具有很高的代表性。
2.3SSR聚类分析
31对随机引物对50份籽(西)瓜种质进行SSR扩增,得到115条多态性条带,通过NTsys软件处理,在获得的相似系数矩阵中,相似系数范围为0.57~0.91,其中种质29和33之间的相似系数最小,表明两者的亲缘关系最远,而亲缘关系最近的1组种质是32和36,相似系数都为0.87。从基于SSR标记的聚类树状图中可知(图2),在相似系数为0.657处,50份籽(西)瓜种质可分为6组。第一组:2份野生种质,29(野籽瓜)和33(PI542120);第二组:30(磴口籽瓜)和34(GN-1);第三组:4(陕西红籽)和6(黑大片-2);第四组:5(黑崩筋)和47(兰州大板);第五组:40[红籽瓜(苏联)]和44(宁夏红籽瓜);第六组:剩余的40份种质资源,相似系数范围为0.661~0.910。

1~50.编号同表1图1 引物P1(A)和P43(B)对50份籽瓜材料的PCR扩增图谱1~50.Same as Table 1Fig. 1 PCR products from primer P1(A)and P43(B) with 50 seed watermelon accessions

引物Primer序列Sequence总带数No.ofbands多态性条带Polymorphibands多态性比率Percentageofpolymorphicband/%P1FTCTGTGTGGATGCAAATGGT6583.33RGCTAATCGAGCCCAGTTACGP2FTCAAAAGGTTTGCCCTAAATGAAA5240.00RTGCTGATCTCCCATTCTTAACCTCP4FGCAAAGATTGTCTATGAAGCAGCA44100.00RGCTCATTGGCTTCTTGAATCTGTTP5FTGCTTCAAAATCTATTCACAATTTGC5360.00RTTCTTGGTTTCGGGTTTCTTTACAP6FAAACCATGATTTTACAGGGGATCA33100.00RTTTCTGTCTTCTTTTGACCAATGCP10FTGGTTGAAATCAATAAAAAGTGAA44100.00RTGGATGTTTTTGGCATTTGAP11FTTAGCCTAAGCAAGGGTTTTT3266.67RAAGTACACATTTTAAACAATCAATCCAP12FTCAAACCGACTGCCATATCA3266.67RAGCTTGTCTTCCTGGCCTTTP13FAAAATTACATCTTAAATGCGCC44100.00RGGAACATTGACTTCAATCAGCAP14FTTCTTGAAACTCAACCCTCAAA5360.00RAAAGCGTGTCGAGTGTGAGAP15FTGGATCATTTGACAGATTTAGCGA44100.00RCATCACAGTTAACGATCACAAGGCP19FTGTTGAGATTCTTTGATTTCAACTGT6583.33RTGGGTCAAAGTATTTTTGCTTTTTP20FATGGTTCATTTTCACGTTCG6583.33RAAAAATCAAGCAAAGAACAACATP21FTTCCACACCAAGGAGGTAGG44100.00RCATGTCATTCGATAAAGCAGAAA
Table 2Continued
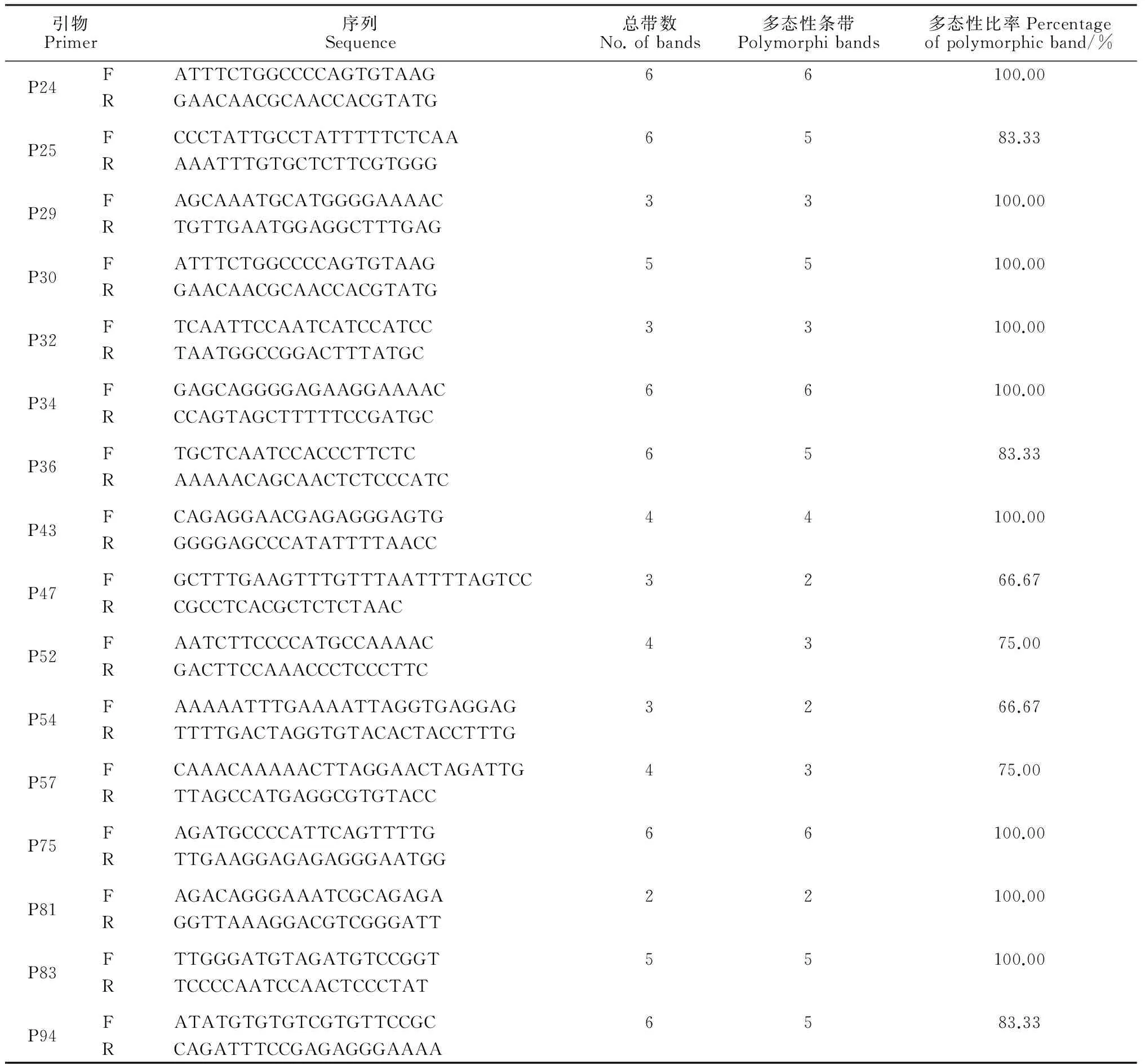
引物Primer序列Sequence总带数No.ofbands多态性条带Polymorphibands多态性比率Percentageofpolymorphicband/%P24FATTTCTGGCCCCAGTGTAAG66100.00RGAACAACGCAACCACGTATGP25FCCCTATTGCCTATTTTTCTCAA6583.33RAAATTTGTGCTCTTCGTGGGP29FAGCAAATGCATGGGGAAAAC33100.00RTGTTGAATGGAGGCTTTGAGP30FATTTCTGGCCCCAGTGTAAG55100.00RGAACAACGCAACCACGTATGP32FTCAATTCCAATCATCCATCC33100.00RTAATGGCCGGACTTTATGCP34FGAGCAGGGGAGAAGGAAAAC66100.00RCCAGTAGCTTTTTCCGATGCP36FTGCTCAATCCACCCTTCTC6583.33RAAAAACAGCAACTCTCCCATCP43FCAGAGGAACGAGAGGGAGTG44100.00RGGGGAGCCCATATTTTAACCP47FGCTTTGAAGTTTGTTTAATTTTAGTCC3266.67RCGCCTCACGCTCTCTAACP52FAATCTTCCCCATGCCAAAAC4375.00RGACTTCCAAACCCTCCCTTCP54FAAAAATTTGAAAATTAGGTGAGGAG3266.67RTTTTGACTAGGTGTACACTACCTTTGP57FCAAACAAAAACTTAGGAACTAGATTG4375.00RTTAGCCATGAGGCGTGTACCP75FAGATGCCCCATTCAGTTTTG66100.00RTTGAAGGAGAGAGGGAATGGP81FAGACAGGGAAATCGCAGAGA22100.00RGGTTAAAGGACGTCGGGATTP83FTTGGGATGTAGATGTCCGGT55100.00RTCCCCAATCCAACTCCCTATP94FATATGTGTGTCGTGTTCCGC6583.33RCAGATTTCCGAGAGGGAAAA

表3 最小距离逐步抽样法构建籽瓜核心种质的遗传多样性

图2 50份籽瓜种质资源的UPGMA聚类图Fig. 2 UPGMA dendrogram of 50 edible seed watermelon germplasms

图3 主成分散点图Fig. 3 The principal component scatterplot
2.4基于SSR标记的主成分分析
对基于SSR标记的数据进行主成分分析,结果显示:第一主成分的方差贡献率为9.13%,第二主成分的方差贡献率为7.42%,第三主成分的方差贡献率为5.74%,累计方差贡献率为22.84%。根据每份籽瓜种质的主成分之值,绘制第一、二主成分散点图(图3)。
从图3可知,50份籽(西)瓜种质被分成4组,29(野籽瓜)和33(PI542120)单独划分出来分成一组,5(黑崩筋)独自可分一组,表明这3份种质与其它份种质遗传距离较远。而其余份种质相对紧密的聚合在一起,表明它们之间的亲缘关系非常近。虽然主成分分析和聚类分析对50份籽(西)瓜种质的分类结果基本一致,都能将野生西瓜种质、普通西瓜种质与籽瓜种质区分开来,但它们所反映的信息不同。聚类分析在揭示密切相关的个体间的关系时能够提供更丰富的信息,而主成分分析偏重于在不同群体之间的聚类上提供更多的信息。
先对50份籽(西)瓜种质的聚类分析,其结果再用最小距离逐步抽样法(LDSS)进行构建核心种质。共抽样7次,每次抽样构建籽瓜核心种质的遗传多样性如表3。由表3可以看出,随着抽样种质数目的减少,遗传多样性参数总体上变化较小;有效等位基因数目变化较小,且抽样6的有效等位基因数目最高;Nei’s基因多样性指数和Shannon’s信息指数均略有增加,而在抽样6中达到最高值;多态性位点百分率呈现下降趋势,在抽样7下降较明显。抽样6所构建的种质库的抽样数是抽样前的20%。
原始种质除去核心种质后保留下来的种质资源叫做保留种质[16]。从表3可看出核心种质保留了原种质20%的样品,多态性位点数、等位基因数、有效等位基因数、Nei’s遗传多样性指数和Shannon信息指数的保留率分别为94.93%、97.47%、101.84%、108.88%和108.71%,可见核心种质能很好地代表原种质遗传多样性。综合上述分析,取抽样6为初级核心种质(图4)。

图4 抽样6构建的籽瓜核心种质库聚类图Fig. 4 Dendrogram of core collection of seed watermelon No.6 sampling
3讨论
本研究SSR分子标记聚类结果显示,筛选出的31对SSR引物,对50份来自个19省区种质资源PCR扩增出138条清晰的多态性条带,多态性条带比率高达83.33%,表明本研究收集到的籽瓜种质资源在分子水平上具有丰富的多态性。于海彬等[17]用筛选出的12条RAPD随机引物在51份籽(西)瓜种质间共扩增出80条谱带。其中74条为多态性条带,多态性条带的比率为92.50%,12条随机引物的平均Shannon多样性信息指数为0.7295;用不同分子标记方法对籽瓜种质研究结果证明了籽瓜DNA分子水平上的高度多态性和代表性。
本实验聚类分析中,其遗传相似系数介于0.57~0.91之间,除个别种质外,50个种质聚类结果与地区来源有较高的一致性,表明其亲缘关系比较近,遗传范围狭窄。在相似系数为0.594时,将50份籽(西)瓜种质分为两大类,2份野生种质广东野生籽瓜(29)和美国野生籽瓜PI542120(33)单独聚为一类,剩余48份种质聚为另一大类,说明这两份野生种质的基因组和其所携带的遗传信息与其它种质之间的差异较大,表明了野生型与栽培型籽瓜种质间亲缘关系较远,2份野生种质间遗传关系较近,而栽培型的籽瓜间遗传关系较近。这与赵虎基等前人研究结果相似[9,11,17]。
通过主成分分析和聚类分析也揭示出了地理上的来源对籽瓜种质资源亲缘关系影响不大。例如,红籽瓜(27)和大板2号瓜子(38)的遗传相似系数为0.866,建阳月子籽瓜(32)和点心(83)(36)的遗传相似系数为0.874。2种籽瓜所处地理位置和生态环境不同,却在分子水平上聚为同一类,表明来自不同地区的种质资源之间在分子水平上亲缘关系较近。另外,来自同一地区的种质亲缘关系不一定近,例如来自甘肃省的8份种子类型为大板的籽瓜资源,其中大板红籽瓜(放射网)(11)、大板红籽瓜(绿网)(15)、甘肃大板1号(18)、大板瓜子(26)、大板2号瓜子(38)、靖远大板1号(46)亲缘关系比较近,而兰州大板1号(39)、兰州大板(47)与它们比较相对较远。综上所述,这可能是由于籽瓜在漫长的发展史中各地区相互引种交流,造成各地区籽瓜出现品种混杂、同名异物和同物异名等的现象。这种现象还需进一步的深入探讨和研究。
核心种质构建是种质资源研究的热点。形态标记作为研究核心种质的指标,有简便和研究费用低等优点,但形态标记的数量少,易受环境条件的影响,对资源的鉴定和分类不够精准,在反映品种间遗传差异的问题上不够真实[18];DNA分子标记是近年来发展起来的一种十分有效快速的手段,其中简单重复序列(simple sequence repeat,SSR)标记技术具有共显性、结果可靠、重复性好的特点[19],所以在对核心种质的评价上,利用SSR分子标记进行评价相比其它标记具有其独特的优点。
李自超等[20]认为各物种适宜的核心种质规模不应简单化而定,对应具体的物种,应按照该物种的遗传多样性来定。本实验对50份籽(西)瓜种质资源进行最小距离逐步抽样法构建核心种质,并对各抽样进行遗传多样性分析,结果表明随着抽取种质数目的减少,各种质库遗传多样性参数变化较小,几个参数出现了峰值变化,但多态性位点百分率呈现下降趋势。综合上述分析,确定20%的核心子集抽样6为初级核心种质库。抽样6的Nei’s基因多样性指数和Shannon’s信息指数分别为0.296 6和0.455 8,而且多态位点比率和等位基因数均达到抽样前的94%以上,符合核心种质资源代表初始种质资源遗传多样性达到70%~80%的要求[21],表明抽样比例为20%的抽样6所构建的种质库具有较高的代表性,更能代表原始群体的遗传多样性。种质资源合理的聚类分组、取样方法、取样比例是构建核心种质的关键之一,后期还需利用更多方法探讨籽瓜种质的核心种质。
丰富的遗传多样性是物种具有更高的适应和存活能力的基础,从而才能提高物种的进化、繁殖以及优化遗传结构的能力[22]。所以,对现存籽瓜种质资源应该采取一些有效的保护措施。通过建立核心种质库,收集、保存具有较高遗传多样性的种质资源,这些具有丰富的基因多样性资源的地区是将来育种的优良种质库的来源,在制定保护措施和对其利用时应多加注意。
参考文献:
[1]柳唐镜, 汪李平. 籽瓜(籽用西瓜)产业前景展望[J]. 北京农业, 2007, 11: 13-15.
LIU T J, WANG L P. Prospect of the industry of seed watermelon[J].BeijingAgriculture, 2007, 11: 13-15.
[2]FRANKEL O H. Genetic manipulation: impact on man and society[M]// ARBER W, II.I.MENSEE R, PEACOCK W J. Genetic Perspectives of Germplasm Onservation. London: Cambridge University Press, 1989: 161-170.
[3]FRANKEL O H.BROWN A H D. Crop genetic resources: conservation &. evolution[M]//HOLDEN J H W, WILLIAMSJ T,etal. Current Plant Genetic Resources Today-A Critical Appraisal. London: George Allen &. Urwin Ltd, 1984: 249-257.
[4]BROWN A H D. Core collections: a practical approach to genetic resources management[J].Genome, 1989, 31: 818-824 .
[5]温景辉. 基于SSR分子标记的山葡萄种质遗传多样性研究与核心种质构建[D]. 吉林: 吉林农业大学, 2011.
[6]张维瑞, 袁王俊, 尚富德. 基于AFLP分子标记的桂花品种核心种质的构建[J]. 西北植物学报, 2012, 32(7): 1 349-1 354.
ZHANG W R, YUAN W J, SHANG F D. Construction of core collection of sweet osmanthus cultivars based on AFLP molecular markers[J].ActaBotanicaBoreali-OccidentaliaSinica, 2012, 32(7): 1 349-1 354.
[7]刘娟, 廖康, 赵世荣, 等. 利用ISSR分子标记构建新疆野杏核心种质资源[J]. 中国农业科学, 2015, 48(10), 2 017-2 028.
LIU J, LIAO K, ZHAO S R,etal. Using ISSR markers to construct Xinjiang wild apricot germplasm resources[J].ChineseAgriculturalScience, 2015, 48(10): 2 017-2 028.
[8]白成科, 俞君如, 于凤, 等. 山茱英种质资源的ISSR遗传多样性分析与初级核心种质库的构建[J]. 西北植物学报, 2009,29(12): 2 401-2 407.
BAI C K, YU J R, YU F,etal. Genetic diversity and construction of primary core germplasm inCornusofficinalisby ISSR marker[J].ActaBotanicaBoreali-OccidentaliaSinica, 2009, 29(12): 2 401-2 407.
[9]赵虎基,乐锦华,李红霞,等. 籽用西瓜品种(系)间亲缘关系的RAPD分析[J]. 果树学报, 1999, 16(3): 235-238.
ZHAO H J, LE J H, LI H X,etal. Genetic relationships of seed watermelon varieties (lines) RAPD analysis[J].JournalofFruitScience, 1999, 16(3): 235-238.
[10]张建农. 籽用西瓜种质资源利用和耐贮性生理机理的研究[D]. 兰州: 甘肃农业大学, 2005.
[11]柳唐镜, 于海彬, 张棵, 等. 红籽瓜种质资源亲缘关系RAPD分析[J]. 中国农学通报, 2010, 26(22): 264-270.
LIU T J, YU H B, ZHANG K,etal. RAPD analysis of genetic relationship of Red Seed Watermelon germplasm resources[J].ChinaAgriculturalBulletin, 2010, 26(22): 264-270.
[12]钱韦, 葛颂, 洪德元. 采用RAPD和ISSR标记探讨中国疣粒野生稻的遗传多样性[J]. 植物学报, 2000, 42(7): 741-750.
QIAN W, GE S, HONG D Y. Assessment of genetic variation ofOryzagrarzulatedetected by RAPDs and ISSRs[J].ActaBotanicaSinica, 2000, 42(7): 741-750.
[13]周鹏, 王萍, 石磊, 等. 籽用西瓜SSR体系的建立与优化[J]. 内蒙古农业大学学报, 2015, 29(12): 2 401-2 407.
ZHOU P, WANG P, SHI L,etal. Establishment and optimization of SSR system for seed used watermelon[J].JournalofInnerMongoliaAgriculturalUniversity, 2015, 29(12): 2 401-2 407.
[14]ROHI.F F J. NTSYSpc:Numerical taxonomy and multivariate analysis system, Version2.1[CP]. New York:Exeter Software, 2000.
[15]胡晋, 徐海明, 朱军. 基因型值多次聚类法构建作物种质资源核心库[J]. 生物数学学报, 2000, 15(1): 103-109.
HU J, XU H M, ZHU J. Constructing core collection of crop germplasm by multiple clusters based on geno typic values[J].JournalofBiomathematics, 2000, 15(1): 103-109.
[16]BROWN A H D. The core collection at the crossroad.//: Core Collection of Plant Genetic resources[PGR]. A Wiley-Sayce Publication, 1995, 3-19.
[17]于海彬. 籽用西瓜种子生长发育规律与种质资源遗传多样性研究[D]. 武汉: 华中农业大学, 2010.
[18]李慧峰, 卢森权, 李彦青, 等. 广西甘薯核心种质构建初探[J]. 广西农业科学, 2010, 41(7): 732-735.
LI H F, LU S Q, LI Y Q,etal. Preliminary study on constructing core collection of sweet potato germplasmin of Guangxi[J].GuangxiAgriculturulSciences, 2010, 41(7): 732-735.
[19]徐海明, 胡晋, 邱英雄. 利用分子标记和数量性状基因型值构建作物核心种质库的研究[J]. 生物数学学报,2005, 20(3): 351-355.
XU H M, H J, QIU Y X. Study on the construction of core collection of crops by using molecular markers and quantitative trait loci[J].JournalofBiomathematics, 2005, 20(3): 351-355.
[20]李自超, 张洪亮, 孙传清, 等. 植物遗传资源核心种质研究现状与展望[J]. 中国农业大学学报, 1999, 4(5): 51-62.
LI Z C, ZHANG H L, SUN C Q,etal. Status and prospects of core collection in plant germplasm resource[J].JournalofChinaAgriculturalUniversity, 1999, 4(5): 51-62.
[21]GU X F, YANG A F, MENG H,etal. In vitro induction of tetraploid plants from diploidZizyphusjujubaMill, cv. Zhanhua[J].PlantCellReports, 2005, 24(11): 671-676.
[22]FRANKHAM R, BALLOU J D, BRISCOE D A. Introduction to Conversation Genetics[M]. Cambridge:Cambridge Univer City Press, 2002: 10-36.
(编辑:宋亚珍)
文章编号:1000-4025(2016)06-1125-10
doi:10.7606/j.issn.1000-4025.2016.06.1125
收稿日期:2016-03-16;修改稿收到日期:2016-05-09
基金项目:内蒙古自然科学基金(2016MS0356);内蒙古科技计划(20090707,2010704,20110711,20120212);内蒙古高寒地区高产安全蔬菜生产的研究与创新(NDPYTD2013-3)
作者简介:石磊(1989-),男,在读硕士研究生,主要从事蔬菜种质资源与种质创新研究。E-mail:1010969973@qq.com *通信作者:王萍,副教授,硕士生导师,主要从事蔬菜种质资源与种质创新研究。E-mail:wangping@imau.edu.cn
中图分类号:Q346+.5;Q789;S651
文献标志码:A
Genetic Diversity Analysis and Construction of Seed Watermelon Core Germplasm Resources by SSR
SHI Lei,WANG Ping*,YANG Jing,WANG Fengfeng,SUN Xiaohua
(College of Agronomy,Inner Mongolia Agricultural University,Key Laboratory of Wild Peculiar Vegetable Germplasm Resource and Enhancement,Hohhot 010019,China)
Abstract:The genetic diversity of 50 seed watermelon germplasm from different places were analyzed by SSR molecular marker and the primary core collection was constructed by Least Distance Step-wise Sampling(LDSS).The results showed that:(1) 31 pairs of primers which showed high polymorphism were selected from 106 SSR primers, showed 115 polymorphic bands in 138 bands owning 83.33% polymorphic loci, the average of Shannon information index(I), Nei’s genetic diversity(h),effective number of alleles(Ne) and number of alleles(Na) by POPGENE32 analysis was 0.419 3, 0.272 4, 1.458 0 and 1.981 4, respectively, which indicated high genetic diversity in 50 seed watermelon accessions. (2) The clustering result showed that genetic similarity coefficient ranged 0.57-0.91. Some germplasms distributed in different origins and far geographic distance showed high genetic similarity coefficient in 50 accessions. (3) The germplasm were sampled by the method of LDSS and ratio at 70%, 60%, 50%, 40%, 30%, 20% and 10%, and the genetic diversity parameters of each core subset was compared. The results showed that the change of genetic diversity parameters of each core subset was not clear with the samples reduced in six samplings. But the percentage of polymorphic loci, Ne, h and I of 10 primary accessions were obtained by sampling proportion 20%. It showed that the primary core collection from 20% sampling could well represent the genetic diversities of the whole collection.
Key words:seed watermelon; SSR molecular marker; germplasm resources; genetic diversity; core collection

