猪细小病毒病灭活疫苗的安全性和抗体消长规律的研究
李晓艳 刘超 何平有 郁宏伟/瑞普(保定)生物药业有限公司
猪细小病毒病灭活疫苗的安全性和抗体消长规律的研究
李晓艳 刘超 何平有 郁宏伟/瑞普(保定)生物药业有限公司
猪细小病毒病是由细小病毒科猪细小病毒(PPV)感染猪引起的胚胎感染及死亡,而母猪并不表现明显症状的猪繁殖障碍性疾病。妊娠前期的母猪易感染,主要引起母猪流产、胎儿死亡、胎儿畸形、木乃伊胎、弱胎及不孕等,同时还可引起仔猪发生皮炎和腹泻,与猪圆环病毒协同感染是导致断奶仔猪多系统衰竭综合症的主要原因之一。本病目前已广泛分布于世界各地,并呈现出与猪蓝耳病毒、圆环病毒感染、猪伪狂犬病毒以及猪瘟病毒混合感染的严重态势,给世界范围内的养猪业造成了极大的损失。
目前,对于由PPV引起的猪繁殖障碍尚缺乏有效的治疗方法,唯一的防制措施就是对易感猪进行疫苗免疫。不同厂家生产的疫苗免疫,其免疫效果参差不齐,猪体免疫后有时出现发热、食欲不振、接种部明显红肿块、疫苗免疫后保护率低和疫苗持续期较短。针对目前情况,我公司对猪细小病毒病灭活疫苗的抗体消长规律和安全性研究,现报告如下。
一、材料
(一)病毒毒株、细胞与血清
猪细小病毒RP株、ST细胞均由瑞普(保定)生物药业有限公司经扬州优邦公司转让资源克隆获得;犊牛血清购自Hyclone公司;猪细小病毒标准阳性血清购自美国VMRD公司;阴性血清由本公司研发中心实验室制备并保存。
(二)参考疫苗
进口疫苗产地:德国,批号:20150501。
(三)试剂
胰酶购自GIBCO公司;BEI购自FLUCA公司。
二、方法
(一)疫苗制备
按照“猪细小病毒病灭活疫苗规程草案”制备3批疫苗,批号分别为20150301批、20150402批和20150403批。
(二)安全性试验
1.乳鼠安全性试验。取3~5日龄乳鼠25只,随机分为5组,5只/组,分别免疫3批疫苗,0.1 ml/只,观察10 d,同时设进口疫苗对照和空白对照组。
2.仔猪安全性试验。取4~6周龄仔猪25头,随机分为5组,5头/组,其中3组分别皮下注射3批疫苗,4 ml/只,观察21 d,同时设进口疫苗对照和空白对照组。
(三)疫苗HI抗体消长情况
取体重350 g~400 g健康豚鼠25只,随机分为5组,5只/组,其中3组分别皮下注射3批疫苗,0.5 ml/只,并设进口疫苗对照和空白对照组,免前先心脏采血1 ml,免后每月采血,连续采血6月,分离血清后检测HI抗体滴度。
三、结果
(一)疫苗制备
采用同步接毒的方式,病毒接种剂量为培养液体积的1%,结果运用单克隆ST细胞培养纯化后的PPV病毒制备的灭活疫苗其抗原含量比克隆前增加1个~2
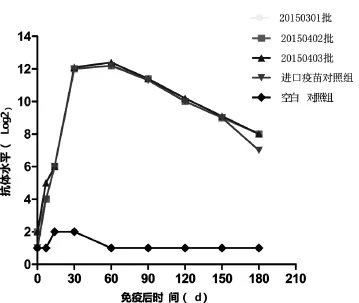
图1 猪细小病毒病灭活疫苗HI抗体比较
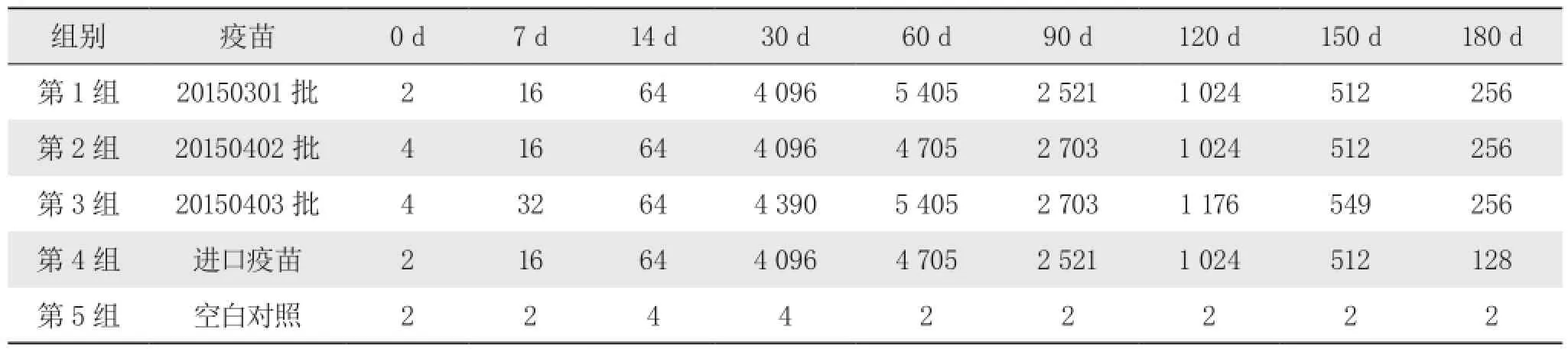
表1 猪细小病毒病灭活疫苗HI抗体检测结
四、讨论
猪用灭活疫苗的安全高效和副作用小是此项研究的关键。病毒滴度高,细胞培养物的牛血清含量低,灭活剂浓度低且中和彻底是灭活疫苗研究要重点着手解决的问题。
本研究运用单克隆细胞株培养纯化的PPV毒株,极大的提高猪细小病毒的病毒滴度,降低生产成本。病毒液采用新型灭活剂二乙烯亚胺(BEI)对猪细小病毒(PPV)进行灭活,通过灭活验证以及安全性试验。表明对PPV的灭活是彻底的、安全的,疫苗免疫乳鼠、仔猪均无不良反应,免疫豚鼠后产生较高的抗体水平。
本试验将猪细小病毒病灭活疫苗接种豚鼠进行抗体消长规律的研究,在免疫后14 d全部产生抗体反应,免疫后60 d血清HI抗体达到高峰(1∶5 405),免疫后180 d仍可达到1∶256,与进口疫苗的对比结果显示,3批猪细小病毒灭活疫苗均已达到同类进口疫苗标准。
(略)

