半乳糖凝集素-3联合HGF诱导大鼠骨髓间充质干细胞分化为肝样细胞*
吴增城,康利民,2,李 阳,郭 斌,冯 磊,彭 青,潘明新△
(1.南方医科大学珠江医院肝胆二科/“器官衰竭防治”国家重点实验室/“器官衰竭防治”协同创新中心/广东省人工器官与组织工程研究中心,广州 510282;2.云南省普洱市人民医院肝胆外科 665000)
半乳糖凝集素-3联合HGF诱导大鼠骨髓间充质干细胞分化为肝样细胞*
吴增城1,康利民1,2,李阳1,郭斌1,冯磊1,彭青1,潘明新1△
(1.南方医科大学珠江医院肝胆二科/“器官衰竭防治”国家重点实验室/“器官衰竭防治”协同创新中心/广东省人工器官与组织工程研究中心,广州 510282;2.云南省普洱市人民医院肝胆外科665000)
[摘要]目的探索半乳糖凝集素-3(Gal-3)联合肝细胞生长因子(HGF)诱导大鼠骨髓间充质干细胞(BMSCs)向肝样细胞分化的可行性及最佳诱导条件,并对诱导后的细胞进行鉴定。方法离心、贴壁培养分离大鼠BMSCs,流式细胞术鉴定表面标志。取第3代细胞进行分组诱导培养,A组:0 μg/mL Gal-3+20 ng/mL肝细胞生长因子(HGF);B组:0.1 μg/mL Gal-3+20 ng/mL HGF;C组:0.5 μg/mL Gal-3+20 ng/mL HGF;D组:1.0 μg/mL Gal-3+20 ng/mL HGF;E组:2.0 μg/mL Gal-3+20 ng/mL HGF;阳性对照组:SD大鼠肝脏细胞IAR20。分别于诱导后7、14、21、28 d时段进行细胞形态学观察、免疫荧光染色检测、实时荧光定量核酸扩增检测(Q-PCR)鉴定其诱导分化情况。结果分组诱导培养后,各组BMSCs形态逐渐向肝样细胞转化,与大鼠原代肝脏细胞IAR20相似,其中28 d时间段,C组转化成IAR20相似细胞比例最高;各组甲胎蛋白(AFP)、清蛋白(ALB) 荧光染色阳性率明显增高,并且在28 d时间点C组AFP、ALB的荧光染色阳性率最高;C组AFP、ALB mRNA表达明显增加,同时以28 d时间点表达量达到峰值。结论Gal-3联合HGF能有效诱导大鼠BMSCs分化为肝样细胞,分化后的肝样细胞能分泌肝细胞特异性产物AFP、ALB,且其诱导效率与诱导培养时间和Gal-3浓度有关。
[关键词]间质干细胞;甲胎蛋白类;肝细胞生长因子;骨髓间充质干细胞;半乳糖凝集素-3;诱导;肝样分化
骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)是一类具有自我复制功能和多向分化潜能的成体干细胞[1],在一定条件下可以诱导分化为成骨细胞、脂肪细胞、神经细胞、心肌细胞,以及肝细胞等[2-6]。由于其可以定向分化为肝样细胞,参与肝脏的损伤修复、细胞更新、功能重建等病理生理过程[7],在肝病治疗中的具有巨大应用潜能。半乳糖凝集素-3(Gal-3)是半乳糖凝集素家族中的一员,参与多种生理和病理过程,包括细胞生长、增殖、凋亡、分化、炎性反应及新生血管形成和肿瘤浸润与转移等[8]。有研究发现Gal-3在缺血性脑组织中神经元再生和血管内皮细胞的增殖分化过程中起重要作用[9-10]。但尚不明确其在BMSCs向肝样细胞转化过程中的作用。因此本研究通过将不同浓度的Gal-3联合肝细胞生长因子(HGF)加入BMSCs培养液中诱导培养BMSCs向肝样细胞定向分化,以探索该方法的可行性及相关条件。
1材料与方法
1.1材料健康SD雄性大鼠,体质量80~100 g,由南方医科大学实验动物中心供应。大鼠肝脏细胞IAR20购自上海一研生物;Murine HGF、Human Gal-3购自peprotech公司;胎牛血清、DMEM-F12培养基、青链霉素、磷酸盐缓冲溶液(PBS)均购自Hyclone公司;抗大鼠CD29-FITC、CD34-FITC、CD44-FITC、CD90-FITC购自eBioscience公司,抗大鼠CD45及羊抗鼠免疫球蛋白G(IgG)荧光二抗购自Bioss公司;兔抗大鼠甲胎蛋白(AFP)单克隆一抗购自Abcam公司,兔抗大鼠清蛋白(ALB)单克隆一抗购自Santa公司。
1.2方法
1.2.1大鼠BMSCs的分离、培养及鉴定SD大鼠颈椎脱臼处死,无菌条件下提取股骨、胫骨骨髓液,采用Percol 1液分离获取细胞,以5×106/mL接种于50 mL塑料培养瓶中,置于37 ℃,5% CO2的培养箱内培养。48 h首次换液,去除未贴壁的细胞,以后每隔 2~3天换液1次。直至细胞长满至80%~90%,按1∶3传代。取P3细胞,制备单细胞悬液(5万~10万),分别加入抗大鼠CD29-FITC、CD34-FITC、CD44-FITC、CD90-FITC、CD45,避光孵育30 min,PBS冲洗离心,重悬细胞后上流式细胞仪。其中CD45培养瓶需要在孵育结束后加入二抗继续孵30 min。
1.2.2实验分组及诱导分化培养取生长状态良好的P3代细胞,根据SD大鼠BMSCs完全培养基加入不同浓度Gal-3分组。A组:0 μg/mL Gal-3+20 ng/mL HGF;B组:0.1 μg/mL Gal-3+20 ng/mL HGF;C组:0.5 μg/mL Gal-3+20 ng/mL HGF;D组:1.0 μg/mL Gal-3+20 ng/mL HGF;E组:2.0 μg/mL Gal-3+20 ng/mL HGF;阳性对照组:SD大鼠肝脏细胞IAR20。
1.2.3细胞形态学观察各组在诱导后第7、14、21、28天倒置显微镜观察细胞形态学变化。

1.2.5细胞免疫荧光染色分别于诱导后第7、14、21、28天收集细胞,制备爬片,行免疫荧光细胞化学染色。一抗为兔抗鼠ALB(1∶400)、AFP(1∶320),以IAR20细胞为阳性对照。荧光显微镜观察拍照。

2结果
2.1大鼠BMSCs分离培养及流式鉴定结果分离培养的BMSCs呈集落、漩涡状生长,外观呈长梭形,有伪足(图1)。流式细胞术检测结果显示间充质干细胞标记分子CD29、CD44和CD90阳性,造血系干细胞标记分子CD34和CD45为阴性,见图2。

A:漩涡状生长;B:长梭形。
图1SD大鼠BMSCs形态观察(×100)
2.2诱导后细胞形态学观察结果分组诱导培养7 d后,部分细胞伪足变短,呈短梭形改变;诱导培养14~21 d后,变成纺锤、不规则圆形或多角形,细胞变平变薄,部分细胞开始小范围的呈岛状连接;培养至28 d时,细胞类似肝细胞样,形成岛状连接成片,可见许多双核细胞和多核细胞,与大鼠原代肝脏细胞IAR20相似。其中以C组转化成IAR20相似细胞比例最高,见图3。B、D、E组细胞形态变化程度居于A、C组间,因此不单列图做说明。

图2 流式细胞术检测BMSCs表面标记分子
2.3Q-PCR检测AFP、ALB mRNA表达结果取相对定量的方法检测目的基因的表达变化,按照2-ΔΔCT法对数据进行统计分析。结果显示不同浓度的Gal-3+HGF组与诱导培养时间对于AFP、ALB的mRNA 表达存在交互效应(P<0.01)。随着时间的延长,7、14、21及28 d 4个时间段 AFP、ALB的mRNA表达差异有统计学意义(P<0.01);同时不同浓度的Gal-3联合HGF诱导骨髓干细胞表达AFP、ALB差异有统计学意义(P<0.01)。本研究还发现与阳性对照组比较,随着培养时间的延长,C组AFP、ALB mRNA表达明显增加,28 d时,C组AFP、ALB的mRNA表达量最高,见表1~2、图4~5。
2.4细胞免疫荧光染色结果与阳性对照组比较,随着培养时间的延长,各组AFP及ALB 荧光染色阳性率明显增高,同时以28 d时间点各组染色阳性率最高;并且在28 d时间点各组比较发现,C组AFP及ALB的荧光染色阳性率最高,见图4、5。B、D、E组AFP、ALB的免疫荧光染色大致等同于C组,但阳性率低于C组,因此不单列图做说明。

A:A组诱导培养后28 d;B:C组诱导培养后28 d;C:阳性对照组。

图3 诱导培养后细胞形态学变化(×100)
a:主效应的F统计量和P值;b:交互效应的F统计量和P值。c:P<0.05,与阳性对照组比较。

表2 不同时段 ALB Q-PCR 2-ΔΔCT值
a:主效应的F统计量和P值;b:交互效应的F统计量和P值。c:P<0.05,与阳性对照组比较。
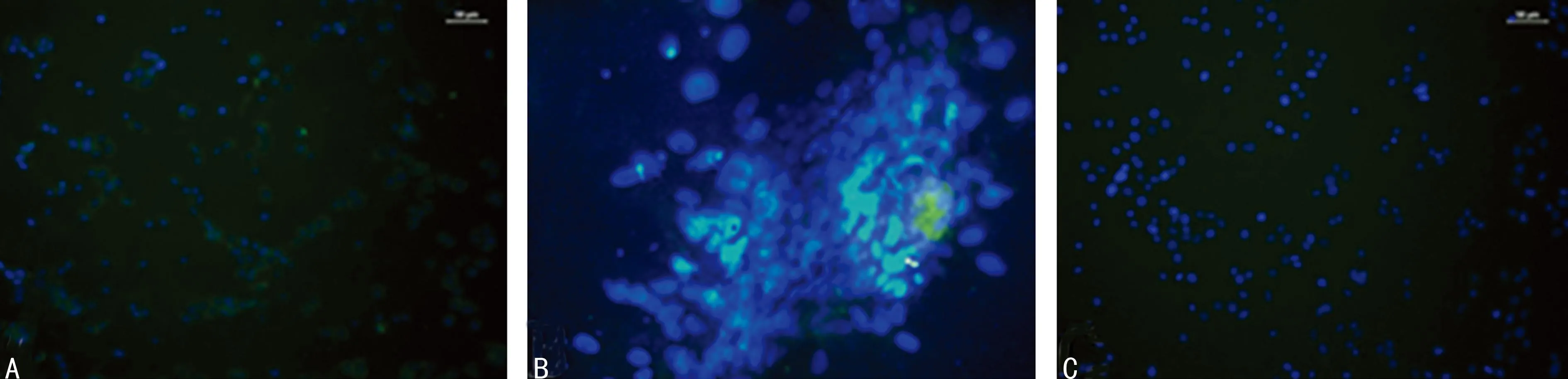
A:A组诱导培养后28 d;B:C组诱导培养后28 d;C:阳性对照组。
图4诱导BMSCs培养28 d AFP荧光染色(×200)
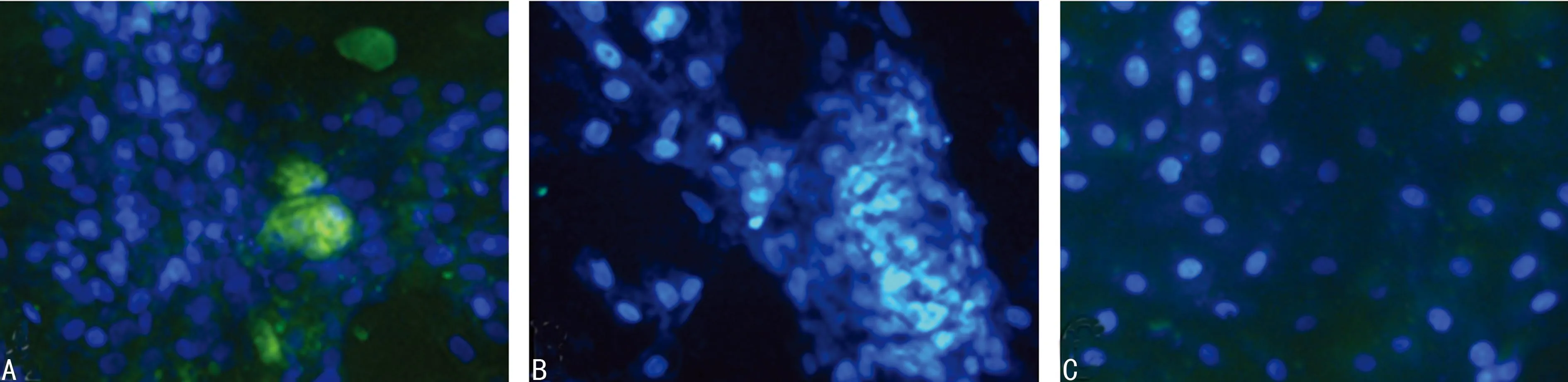
A:A组诱导培养后28 d;B:C组诱导培养后28 d;C:阳性对照组。
图5诱导BMSCs培养28 d ALB荧光染色(×200)
3讨论
原位肝移植作为治疗各种终末期肝病的方法存在供体短缺、免疫排斥、费用昂贵等各种限制,干细胞移植由于其治疗操作简单,可重复进行,免疫源性弱,治疗费用低等优点在肝脏疾病替代治疗领域和组织工程领域存在重要研究价值[11]。BMSCs是存在于骨髓的有多向分化潜能的成体干细胞,具有供源丰富,易于获得,有自体供源,避免免疫排斥等优点,成为干细胞移植治疗的理想种子细胞[12]。本实验采用贴壁培养法分离提纯大鼠BMSCs,流式细胞术鉴定结果显示其高表达间充质干细胞标志CD29、CD44和CD90,不表达造血干细胞标志CD34和CD45[13],为后续实验提供纯度高、活性好的细胞来源,有利于诱导培养进行。
目前,体内外诱导BMSCs向肝样细胞定向分化并具有肝细胞的合成和分泌功能的研究很多[14],如何高效获得大量功能性肝样细胞是BMSCs体外研究的努力方向。现有研究发现在BMSCs向肝样细胞诱导分化过程中起重要作用的生长因子和细胞因子很多,其中应用最为广泛的是HGF。HGF主要在肝脏枯否细胞与肝窦内皮细胞中产生,当其浓度小至1 ng/mL时,对肝细胞就有促进有丝分裂作用,是正常肝细胞最强的促有丝分裂剂。Okumoto等[15]将HGF作为诱导因子诱导大鼠BMSCs分化,21 d后细胞增殖形成克隆,表达所有肝细胞特异性基因。此外,细胞因子的种类、浓度、作用时间和作用时段等都会影响BMSCs的分化、增殖甚至分化后细胞的生物学特性。由于肝损伤时肝细胞再生修复过程中其微环境中的影响是多因素的,而HGF在肝损伤微环境中的变化又是最突出的,本实验选择采用20 ng/mL HGF作为基础诱导剂,不仅提高分化效率,便于本研究对诱导效果的观察研究,更能体现肝细胞再生修复过程中复杂的影响因素。
Gal-3是一种具有独特的嵌合体结构的β-半乳糖苷结合蛋白,主要定位于细胞质,也见于细胞核、细胞表面和细胞外环境,其功能多样性[16],通过其糖识别域(CRD)与细胞表面的糖蛋白或糖脂结合,参与多种生理和病理过程,包括细胞生长、增殖和凋亡、细胞黏附及血管形成和肿瘤浸润与转移等。Gal-3在促进多种细胞的再生和修复中起重要的作用[8]。有研究发现在体外实验中,剂量依存性的Gal-3可以刺激BMSCs向血管内皮细胞分化,且10 mg/L浓度的Gal-3诱导效果最明显[10]。Gal-3和肝细胞再生修复的关系也很密切。Yamazaki等[17]以四氯化碳(CCl4)肝损伤大鼠模型为研究对象,发现在肝脏修复过程中Gal-3通过激活酪氨酸激酶信号通路而促进肝脏细胞的增殖。杨永峰等[18]的研究提示急性肝衰竭时患者体内的Gal-3水平与患者的临床预后密切相关。Ulu等[19]发现在肝癌和病毒性肝炎肝损伤患者血清中Gal-3水平明显升高。鉴于Gal-3与干细胞分化和肝细胞再生修复有密切相关性,本研究推测Gal-3可能通过诱导BMSCs定向分化为肝样细胞从而修复损伤的肝功能,而且其诱导效率同样存在剂量依赖性和时间依从性。为了验证这一假说,本研究采用不同浓度的Gal-3联合HGF诱导BMSCs向肝样细胞转化。实验结果显示,不同浓度的Gal-3联合HGF均能诱导BMSCs定向分化为肝样细胞,而且诱导得到的细胞能表达肝细胞特异性产物ALB和AFP,其中0.5 μg/mL Gal-3联合20 ng/mL HGF剂量组进行28 d培养后诱导效率最高。相对于单独使用HGF进行诱导培养,加入Gal-3后诱导效率明显提高,分化后的细胞功能及活性也明显增强。
实验结果还发现了0.5 μg/mL浓度条件下Gal-3的诱导作用最强,为下一步探索单独使用Gal-3能否高效的诱导大鼠BMSCs向肝样细胞分化及其与20 ng/mL HGF诱导分化作用差异比较等问题奠定了实验条件和基础。
综上所述,Gal-3是一个非常有潜力的强有力的促进BMSCs向肝样细胞分化的因子,0.5 μg/mL Gal-3+20 ng/mL HGF能高效诱导大鼠BMSCs定向分化为肝样细胞。但是Gal-3能否单独起到诱导作用及其与经典诱导剂HGF的诱导分化作用差异,以及其是通过何种机制促使BMSCs的诱导分化等问题还需要进一步的实验探索研究。
参考文献
[1]Hajifathali A,Saba F,Atashi A,et al.The role of catecholamines in mesenchymal stem cell fate[J].Cell Tissue Res,2014,358(3):651-665.
[2]Kim JY,Kim MR,Kim SJ.Modulation of osteoblastic/odontoblastic differentiation of adult mesenchymal stem cells through gene introduction:a brief review[J].J Korean Assoc Oral Maxillofac Surg,2013,39(2):55-62.
[3]Hang HL,Xia Q.Role of BMSCs in liver regeneration and metastasis after hepatectomy[J].World J Gastroenterol,2014,20(1):126-132.
[4]Li R,Liang L,Dou Y,et al.Mechanical strain regulates osteogenic and adipogenic differentiation of bone marrow mesenchymal stem cells[J].Biomed Res Int,2015:873251.
[5]Luchetti F,Canonico B,Bartolini DA,et al.Melatonin regulates mesenchymal stem cell differentiation:a review[J].J Pineal Res,2014,56(4):382-397.
[6]Parivar KB,Baharara J.Sheikholeslami A.Neural differentiation of mouse bone marrow-derived mesenchymal stem cells treated with sex steroid hormones and basic fibroblast growth factor[J].Cell J,2015,17(1):27-36.
[7]Stock P,Brückner S,Winkler S,et al.Human bone marrow mesenchymal stem cell-derived hepatocytes improve the mouse liver after acute acetaminophen intoxication by preventing progress of injury[J].Int J Mol Sci,2014,15(4):7004-7028.
[8]Dumic J,Dabelic S,Flögel M.Galectin-3:an open-ended story[J].Biochim Biophys Acta,2006,1760(4):616-635.
[9]Yan YP,Lang BT,Vemuganti R,et al.Galectin-3 mediates post-ischemic tissue remodeling[J].Brain Res,2009,1288:116-124.
[10]Wan SY,Zhang TF,Ding Y.Galectin-3 enhances proliferation and angiogenesis of endothelial cells differentiated from bone marrow mesenchymal stem cells[J].Transplant Proc,2011,43(10):3933-3938.
[11] 郑玉宝,高志良.干细胞移植在肝衰竭治疗的现况及前景[J].临床内科杂志,2014,31(8):523-525.
[12]崔红强,吴绍华.骨髓间充质干细胞研究进展[J].西南军医,2009,11(4):715-717.
[13]祝旭龙,颜谭,姚维杰,等.大鼠骨髓间充质干细胞的分离与培养方法优化[J].南方医科大学学报,2014,34(11):1621-1626,1631.
[14]Oh SH,Miyazaki M,Kouchi H,et al.Hepatocyte growth factor induces differentiation of adult rat bone marrow cells into a hepatocyte lineage in vitro[J].Biochem Biophys Res Commun,2000,279(2):500-504.
[15]Okumoto K,Saito T,Hattori E,et al.Differentiation of rat bone marrow cells cultured on artificial basement membrane containing extracellular matrix into a liver cell lineage[J].J Hepatol,2005,43(1):110-116.
[16]徐跃,杨仙玉.半乳糖凝集素-3及其相关抑制剂的研究进展[J].中国生化药物杂志,2011,32(5):417-420.
[17]Yamazaki K,Kawai A,Kawaguchi M,et al.Simultaneous induction of galectin-3 phosphorylated on tyrosine residue,p21(WAF1/Cip1/Sdi1),and the proliferating cell nuclear antigen at a distinctive period of repair of hepatocytes injured by CCl4[J].Biochem Biophys Res Commun,2001,280(4):1077-1084.
[18]杨永峰,郑以山,董磊,等.血清半乳糖凝集素-3水平与肝衰竭预后相关性[J].肝脏,2013,18(7):461-462.
[19]Ulu M,Alacacioglu A,Yuksel E,et al.Prognostic significance of serum galectin-3 levels in patients with hepatocellular cancer and chronic viral hepatitis[J].Saudi J Gastroenterol,2015,21(1):47-50.
doi:·论著·10.3969/j.issn.1671-8348.2016.15.005
*基金项目:国家高技术发展研究计划“863”项目(2012AA020505);广东省自然科学基金项目(2014A030313279);广东省省级科技计划项目(2014B020227002)。
作者简介:吴增城(1989-),住院医师,在读硕士,主要从事肝组织损伤修复研究。△通讯作者,E-mail:pmxwxy@sohu.com。
[中图分类号]Q254
[文献标识码]A
[文章编号]1671-8348(2016)15-2043-05
(收稿日期:2015-11-15修回日期:2016-02-01)
Gal-3 united HGF induce the differentiation of rats BMSCs into hepatocyte-like cells*
Wu Zengcheng1,Kang Liming1,2,Li Yang1,2,Guo Bin1,Feng Lei1,Peng Qing1,Pan Mingxin1△
(1.SecondDepartmentofHepatobiliarySurgery,ZhujiangHospital,SouthernMedicalUniversity/StateKeyLaboratoryofOrganFailureResearch/Co-InnovationCenterforOrganFailureResearch/GuangdongProvincialResearchCenterofArtificialOrganandTissueEngineering,Guangzhou,Guangdong510282,China;2.DepartmentofHepatobiliangSurgery,PuerPeople′sHospital,Puer,Yunnan665000,China)
[Abstract]ObjectiveTo explore the feasibility and optimum concentration of direct differentiation of rats BMSCs into hepatocyte-like cells induced by Gal-3 joint HGF and identify the induced cells.MethodsRats BMSCs were separated used gradient centrifugation and adherence culture,and then identified by flow cytometry.The third generation cells were divided into 5 groups.Group A:0 μg/mL Gal-3+20 ng/mL HGF;group B:0.1 μg/mL Gal-3+20 ng/mL HGF;group C:0.5 μg/mL Gal-3+20 ng/mL HGF;group D:1.0 μg/mL Gal-3+20 ng/mL HGF;group E:2.0 μg/mL Gal-3+20 ng/mL HGF;positive control group:primary rat hepatic cells IAR20.The morphology observation,Q-PCR and immunofluorescent staining were applied respectively after induced 7,14,21,28 d to identify the cells differentiation.ResultsAfter induction,the morphological characteristics gradually transformed into hepatocyte-like cells,similar to primary rat hepatic cells IAR20,the translation rate of group C in the 28-days time period was the highest;Immunohistochemical examination demonstrated that fluorescence staining positive rate of ALB and AFP in each group increased over induced time,and group C was the highest in the 28-days time period.Q-PCR demonstrated that the expression of ALB and AFP mRNA in group C increased over induced time,and peaked in the 28-days time period.ConclusionGal-3 joint HGF could induce the differentiation of rats BMSCs into hepatocyte-like cells which secrete hepatocyte specific product AFP and ALB,and the induction efficiency is related to the induction time and the concentration of Gal-3.
[Key words]mesenchymal stem cells;alpha-fetoproteins;hepatocyte growth factor;bone marrow-derived mesenchymal stem cells;Gal-3;induce;hepatocyte-like differentiation

