利用分子信标检测microRNA并成像肺癌干细胞的实验研究*
朱海振,耿 涛,李雪涛,林 盛,韩 静,江飞龙,陈光朋,谭诗生△,陈正堂▲
(1.贵州省人民医院肿瘤科,贵阳 550002;2.第三军医大学新桥医院全军肿瘤研究所,重庆 400037;3.泸州医学院附属医院肿瘤科,四川泸州 646000)
利用分子信标检测microRNA并成像肺癌干细胞的实验研究*
朱海振1,耿涛1,李雪涛2,林盛3,韩静2,江飞龙2,陈光朋2,谭诗生1△,陈正堂2▲
(1.贵州省人民医院肿瘤科,贵阳 550002;2.第三军医大学新桥医院全军肿瘤研究所,重庆 400037;3.泸州医学院附属医院肿瘤科,四川泸州 646000)
[摘要]目的利用miR-155分子信标(MB)检测CD133+CD326+肺癌干细胞(LCSCs)中高表达的miR-155并成像肺癌干细胞。方法采用对A549细胞逆向诱导及紫杉醇富集的方法,通过流式细胞仪从A549细胞中分选出CD133+CD326+细胞,并对其干性进行鉴定。以壳聚糖纳米(CS)作为载体转染miR-155 MB,激光共聚焦显微镜检测miR-155 MB对LCSCs中miR-155的识别功能并成像,并采用实时荧光定量PCR(qRT-PCR)进一步验证。结果分选的CD133+CD326+细胞在干细胞培养基中成球生长,干性相关基因CD133、CD326、OCT-4、Nanog表达为A549细胞的3.27、3.39、6.01、3.42倍(P<0.05),在细胞数为1×104数量下仍具备成瘤能力。CS转染miR-155 MB后在A549及LCSCs中均可看到较强的红色荧光,以LCSCs中荧光信号最强(P<0.05),且荧光信号强弱趋势与qRT-PCR检测的miR-155的表达趋势较一致。结论利用miR-155 MB能够检测LCSCs中高表达的miR-155并使其成像,为监测并发现肺癌干细胞提供新思路。
[关键词]肿瘤干细胞;肺肿瘤;A549;分子信标
近年来,我国肺癌发病率呈快速增长趋势[1]。目前临床上尚缺乏特异的、敏感的肺癌早期诊断分子靶标。肿瘤干细胞被认为是肿瘤产生、发展、复发、转移的根源,寻找肺癌干细胞有可能成为早期诊断的新突破点[2]。大量研究表明微小RNA(miRNA)广泛参与了肿瘤的发生、发展、转移等,识别肺癌干细胞相关miRNA并使之成像有可能成为肺癌早期诊断的重要策略[3]。分子信标(MB)是一种分子内互补形成发卡结构的荧光标记的寡核苷酸序列,是一个非常敏感的检测DNA、RNA和miRNA的方法,已被广泛用于基因定量分析、疾病诊断和活体成像等研究领域[4]。因此,本研究拟利用miR-155 MB检测CD133+CD326+肺癌干细胞(LCSCs)中高表达的miR-155并成像LCSCs,为监测并发现LCSCs提供新的理论依据。
1材料与方法
1.1材料A549肺腺癌细胞系购自美国典型菌种保藏中心(ATCC)。选择6周龄健康裸鼠,由第三军医大学新桥医院动物中心提供。主要试剂:PRMI-1640、DMEM/F12培养基购自Hyclone公司;重组人胰岛素、重组人碱性成纤维生长因子(bFGF)、牛血清清蛋白(BSA)粉剂购自美国Sigma公司;重组人表皮生长因子(EGF)购自美国Pepro Tech公司;标准胎牛血清(FBS)购自天津灏洋;鼠抗人CD133-PE、CD326-FITC流式抗体购自德国美天旎;山羊抗人CD326一抗购自美国Santa Cruz;兔抗人CD133购自美国abcam;逆转录及实时荧光定量PCR(qRT-PCR)试剂盒购自日本 TaKaRa公司;CD133、CD326、OCT-4、Nanog引物,部分碱基经过锁核酸修饰的miR-155 MB,阴性对照随机序列分子信标(RS MB)即不和任何基因组序列结合的RS MB由上海生工合成;hsa-miR-155引物购于广州锐博生物公司;壳聚糖纳米(CS)由四川广汉恒宇新材料公司惠赠。
1.2方法
1.2.1CD133+CD326+细胞的分选及培养CD133+CD326+细胞培养液DMEM/F12的配置:500 mL的DMEM/F12培养基内加入2 g BSA,500 μL(50 μg/μL)重组人胰岛素,500 μL(20 ng/μL)EGF,500 μL(10 ng/μL)bFGF,5 mL青霉素-链霉素双抗。根据本课题组前期研究报道的分选干细胞[2]的方法,对A549细胞进行逆向诱导及紫杉醇富集,富集后根据抗体说明书,加入相对应的鼠抗人CD133-PE和CD326-FITC流式抗体,浓度为1∶11,37 ℃水浴锅内孵育30 min,无菌磷酸盐缓冲液(PBS)充分洗涤后,避光流式细胞仪上机分选,分选后置入干细胞培养液中培养并进行形态学观察。
1.2.2免疫荧光取成球生长的CD133+CD326+细胞悬液,滴在载玻片并进行甩片,800 r/min,离心5 min,4%的多聚甲醛固定10 min,漂洗后滴加0.1%的聚乙二醇辛基苯基醚(Triton)液,洗涤后滴加5%BSA封闭液,37 ℃孵育20 min,加入PBS稀释的一抗兔抗人CD133和山羊抗人CD326,浓度均为1∶200,于4 ℃冰箱孵育过夜,充分漂洗后加入羊抗兔CD133-FITC及驴抗山羊CD326-CY3二抗,二抗的浓度均为1∶400,37 ℃孵育30 min,漂洗后4′,6-二脒基-2-苯基吲哚(DAPI)染细胞核,抗荧光淬灭剂封片,激光共聚焦显微镜观察CD133和CD326的表达并拍照。
1.2.3干性基因检测根据干细胞相关基因Oct-4、Nanog、CD133、CD326序列设计qRT-PCR引物,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,引物均由上海生工合成,序列如下:GAPDH上游5′-CCA CTC CTC CAC CTT TGA C-3′,下游5′-CCA CTC CTC CAC CTT TGA C-3′;CD326上游5′-AGT AAA AGT TTG CGG ACT GCA C-3′,下游5′-CTG GAA ATA ACC AGC ACA ACA A-3′;CD133上游5′-TCT CTA TGT GGT ACA GCC G-3′,下游5′-TGA TCC GGG TTC TTA CCT G-3′;Nanog上游5′-ATT TGC GGC CGC ATG AGT GTG GGT CTT C-3′,下游5′-CGG GAT CCT CAT ATT TCA CCT GGT GGA G-3′;Oct-4上游5′-AAG CTG CTG AAA CAG AAG AGG-3′,下游5′-ACA CGG TTC TCA ATG CTA GTC-3′。常规Trizol试剂提取A549、CD133+CD326+细胞总RNA,逆转录成cDNA及qRT-PCR操作均按照Takara试剂说明书操作。每个目的基因及内参做3个复孔。以GAPDH基因为内参基因,以CD133、CD326、Nanog、Oct-4作为目的基因,以A549细胞相对应的表达量为1,计算CD133+CD326+细胞中干性相关基因的表达相对于A549细胞的倍数关系,实验重复3次。
1.2.4裸鼠成瘤实验雄性裸鼠18只,分为6组,每组3只,分别注射A549细胞数目为1×104、1×105和1×106,注射CD133+CD326+细胞数目为1×103、1×104和1×105。选取对数生长期生长状态良好且能传代的A549及CD133+CD326+细胞,无菌PBS充分洗涤后计数细胞数目,于小鼠右下背部皮下注射相对应数目的CD133+CD326+细胞及A549细胞,每只总体积为150 μL。随后每3天观察细胞成瘤情况。
1.2.5激光共聚焦检测对miR-155的识别成像功能及荧光强度分析取对数生长期的A549、LCSCs种板于激光共聚焦专用培养皿内,参考本课题组前期研究文献[5]方法,按照WCS∶WMB质量比为7∶1的比例将MB和CS混合,漩涡震荡60 s,室温静置30 min,自组装方法合成CS-mir-155 MB及CS-RS MB,miR-155 MB和RS MB的终浓度为200 nmol/L,37 ℃细胞培养箱内孵育120 min,无菌PBS充分漂洗后加入300 μL Hoechst 33342染细胞核,37 ℃ 20 min,漂洗后加入200 μL无菌PBS,激光共聚焦显微镜观察并拍照。拍照后,每个培养皿内加入1 mL细胞裂解液,使细胞充分裂解。取96孔黑板,每组加入100 μL细胞裂解液,设置6个复孔,Varioskan Flash多功能酶标仪检测各组Cy5的荧光强度。
1.2.6qRT-PCR验证常规Trizol试剂提取A549、LCSCs总RNA, 逆转录成cDNA及qRT-PCR操作均按照Takara试剂说明书操作。每个目的基因及内参做3个复孔。以U6基因为内参基因,以miR-155作为目的基因,以A549细胞miR-155表达量为1,计算LCSCs中miR-155的表达相对于A549细胞的倍数关系,实验重复3次。
2结果
2.1A549及CD133+CD326+细胞形态学观察倒置显微镜下观察到普通A549细胞为贴壁生长状态,细胞形态为多角形、梭形。分选的CD133+CD326+细胞在干细胞培养基中培养后成球形生长,每个细胞球可见到由几个到几十个细胞融合而成球,细胞膜圆整,细胞质折光度较好,见图1。
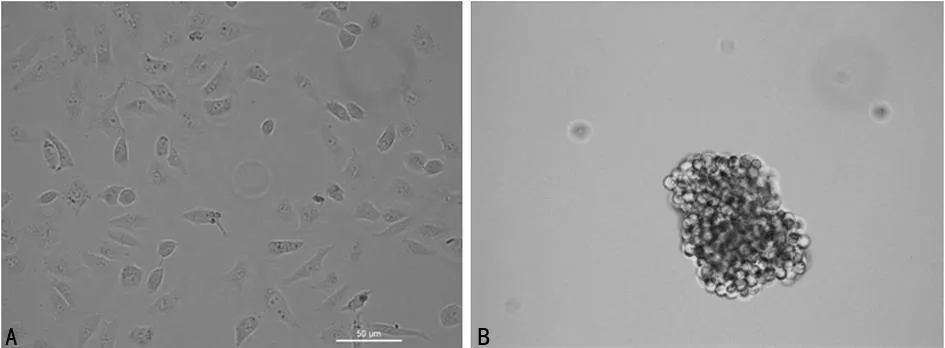
A:A549细胞;B:CD133+CD326+细胞。
图1A549细胞及CD133+CD326+细胞形态学观察(×200)
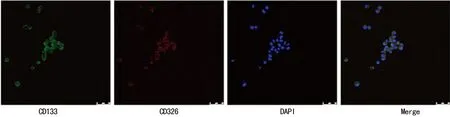
图2免疫荧光检测CD133+CD326+细胞中CD133和CD326的表达(×400)
2.2免疫荧光结果分选的成球干细胞既有表达CD133的绿色荧光信号,又有表达CD326的红色荧光信号,二者在细胞膜和细胞质都有表达,蓝色表示细胞核染色,见图2。
2.3干性基因检测结果成球生长的CD133+CD326+细胞高表达干性基因CD133、CD326、OCT-4和Nanog,为普通A549细胞的3.27、3.39、6.01、3.42倍,差异具有统计学意义(P<0.05),分选的CD133+CD326+细胞具有干细胞特性,见图3。
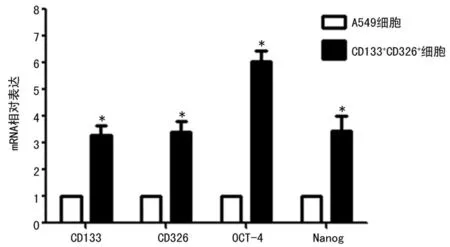
*:P<0.05,与A549细胞比较。
图3qRT-PCR检测A549及CD133+CD326+细胞中干性基因的表达
2.4裸鼠成瘤实验在注射皮下肿瘤细胞15 d后可看到皮下移植瘤的产生。CD133+CD326+细胞在细胞数为1×105的数量下可以成瘤,进一步降低细胞数目为1×104数量下仍具备成瘤能力,1×103数量下细胞未能成瘤;而A549细胞能够成功致瘤所需细胞数目为1×106,见表1。

表1 裸鼠皮下移植瘤成瘤实验
2.5miR-155MB对miR-155的识别成像功能检测及qRT-PCR验证在有miR-155 MB存在的条件下,各组细胞均可检测到较强的红色荧光信号,大部分定位在细胞质,少数定位在细胞核,其中LCSCs红色荧光强度最强。而在阴性对照CS-RS MB中未检测到明显红色荧光信号,见图4A。 A549、LCSCs在CS转染miR-155 MB平均荧光强度分别为27.78和64.64,比较差异具有统计学意义(P<0.05),见图4B。qRT-PCR检测发现A549、LCSCs中均有miR-155的表达,LCSCs的miR-155的表达是A549细胞的2.63倍,差异具有统计学意义(P<0.05),见图4C。在荧光强度分析中,LCSCs中miR-155的表达是A549细胞的2.33倍,荧光强弱趋势与qRT-PCR中miR-155的表达趋势较一致。

A:激光共聚焦检测对miR-155的识别并成像(×800);B:荧光强度分析;C:qRT-PCR检测。*:P<0.05,与A549细胞比较。
图4成像后荧光强度分析及qRT-PCR检测miR-155的表达
3讨论
目前我国肺癌发病率和病死率均居肿瘤首位,大多数患者确诊时已属ⅢB或Ⅳ期,失去了手术机会,5年生存率低于20%[6]。肺癌的早期诊断可以使患者能够在早期得到合理地诊治,大大降低治疗成本及病死率,因此寻求早期诊断的生物学标志物是提高患者存活率的关键,也是当今肺癌研究的重要任务。
现有研究表明肿瘤干细胞是所有肿瘤产生、发展、复发的根源,研究发现多种实体瘤组织及肿瘤患者血液中存在着肿瘤干细胞,这些肿瘤干细胞是肿瘤发生、发展、浸润、转移和复发的根源[7]。因此寻找肺癌干细胞有可能成为早期诊断一个新的突破点,为肺癌的早期诊断提供新方法[8]。如果能够直接携带荧光物质靶定肺癌干细胞,将有望达到早期诊断肺癌的目的。
CD133已被研究证实可以作为大多数实体肿瘤干细胞分离和鉴定的通用分子标记物,其主要特点是在干细胞样细胞中高表达,而在完全分化细胞中几乎不表达;但也有研究认为把CD133作为肺癌干细胞的分子标记并不确切,需要联合其他标记才有助于肺癌干细胞的检测,肺癌、结肠癌、乳腺癌等肿瘤干细胞中也高表达CD326分子,这些细胞特别容易引发肿瘤[9-10]。因此,本研究基于以上研究背景,根据本课题组前期采用对A549细胞逆向诱导及紫杉醇富集的方法,从A549细胞系中分选出CD133+CD326+细胞,发现其在干细胞培养基中呈球形,悬浮生长。通过免疫荧光检测悬浮的成球细胞均有CD133和CD326的表达,为CD133+CD326+细胞。qRT-PCR结果表明CD133+CD326+细胞高表达干细胞相关基因Oct-4、Nanog、CD133、CD326,且较普通A549细胞表达高。裸鼠成瘤实验表明CD133+CD326+细胞致瘤能力更强,具有干细胞的特征。
miRNA是一类内源性、单链非编码小分子RNA,通过调控信号通路对肿瘤细胞的发生、增殖、凋亡、侵袭等重要生物学过程发挥作用[11]。miR-155是miRNA中常见的一种小分子RNA,与肿瘤的增殖、凋亡、转移、不良预后等密切相关[12]。现有研究表明,miR-155在肺癌组织中显著高表达,检测肺组织内的miR-155表达水平能区分肺癌患者与非肺癌患者,而且肺癌组织中miR-155高表达的患者,其生存期更短[13]。表明肺癌细胞或肺癌干细胞中高表达的miR-155分子有可能成为肺癌早期诊断的分子靶标。本研究也发现miR-155在分选的CD133+CD326+肺癌干细胞中高表达。
MB是一个非常敏感的检测DNA、RNA和miRNA的方法,为通过识别基因分子并成像肿瘤细胞提供了可能。壳聚糖为一种天然阳离子多糖,而基因分子本身带有负电荷,二者可以通过静电作用自组装方式形成核壳结构,并被广泛用于介导质粒、siRNA等基因转染,CS已作为理想的基因载体广泛应用于细胞和动物水平实验[14]。因此,本研究利用CS作为miR-155 MB载体,激光共聚焦检测表明在有miR-155 MB存在的条件下,A549、LCSCs中可检测到较强的红色荧光信号,且以LCSCs红色荧光强度最强,而阴性对照RS MB未检测到明显红色荧光信号。荧光强度分析表明以肺癌干细胞中荧光信号最强,同时通过qRT-PCR进一步检测表明用CS转染MB后的荧光强弱趋势与qRT-PCR中miR-155的表达趋势较一致,表明可以利用miR-155 MB通过检测细胞高表达的miR-155并成像肺癌干细胞,可以有效地达到识别肿瘤干细胞的目的,从而为肺癌的早期诊断提供新思路、新方法。
参考文献
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2]林盛,张振华,饶明月,等.A549肺腺癌始动细胞的富集和鉴定[J].重庆医学,2013,42(34):4108-4111.
[3]Jackstadt R,Hermeking H.MicroRNAs as regulators and mediators of c-MYC function[J].Biochim Biophys Acta,2015,1849(5):544-553.
[4]Lee JH,Kim JA,Kwon MH,et al.In situ single step detection of exosome MicroRNA using molecular beacon[J].Biomaterials,2015,54:116-125.
[5]Zhu HZ,An JH,Yao Q,et al.Chitosan combined with molecular beacon for mir-155 detection and imaging in lung cancer[J].Molecules,2014,19(9):14710-14722.
[6]Zeng H,Zheng R,Guo Y,et al.Cancer survival in China,2003-2005:a population-based study[J].Int J Cancer,2015,136(8):1921-1930.
[7]Banerjee J,Papu John AM,Schuller HM.Regulation of nonsmall-cell lung cancer stem cell like cells by neurotransmitters and opioid peptides[J].Int J Cancer,2015,137(12):2815-2824.
[8]Loureiro R,Mesquita KA,Oliveira PJ,et al.Mitochondria in cancer stem cells:a target for therapy[J].Recent Pat Endocr Metab Immune Drug Discov,2013,7(2):102-114.
[9]Zhou X,Li D,Wang X,et al.Galectin-1 is overexpressed in CD133+human lung adenocarcinoma cells and promotes their growth and invasiveness[J].Oncotarget,2015,6(5):3111-3122.
[10]Lin S,Sun JG,Wu JB,et al.Aberrant MicroRNAs expression in CD133+/CD326+human lung adenocarcinoma initiating cells from A549[J].Mol Cells,2012,33(3):277-283.
[11]Piva R,Spandidos DA,Gambari R.From MicroRNA functions to MicroRNA therapeutics:novel targets and novel drugs in breast cancer research and treatment (Review)[J].Int J Oncol,2013,43(4):985-994.
[12]He J,Zhang F,Wu Y,et al.Prognostic role of MicroRNA-155 in various carcinomas′results from a meta-analysis[J].Dis Markers,2013,34(6):379-386.
[13]Geng Q,Fan T,Zhang B,et al.Five MicroRNAs in plasma as novel biomarkers for screening of early-stage non-small cell lung cancer[J].Respir Res,2014,15(1):149.
[14]Raftery R,O′Brien FJ,Cryan SA.Chitosan for gene delivery and orthopedic tissue engineering applications[J].Molecules,2013,18(5):5611-5647.
doi:·论著·10.3969/j.issn.1671-8348.2016.15.003
*基金项目:国家高技术发展研究计划“863”项目(2007AA02Zl29);国家自然科学基金面上项目(81071786)。
作者简介:朱海振(1984-),住院医师,博士,主要从事肿瘤干细胞、miRNA研究。△通讯作者,E-mail:tssh18018@126.com;▲ 共同通讯作者,E-mail:czt05@163.com。
[中图分类号]R734.2
[文献标识码]A
[文章编号]1671-8348(2016)15-2036-04
(收稿日期:2015-11-15修回日期:2016-01-21)
Using molecular beacon for detecting microRNA and imaging lung cancer stem cells research*
Zhu Haizhen1,Geng Tao1,Li Xuetao2,Lin Sheng3,Han Jing2,Jiang Feilong2,ChenGuangpeng2,TanShisheng1△,ChenZhengtang2▲
(1.DepartmentofOncology,GuizhouProvincialPeople′sHospital,Guiyang,Guizhou550002,China;2.InstituteofCancer,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China;3.DepartmentofOncology,theAffiliatedHospitalofLuzhouMedicalCollege,Luzhou,Sichuan646000,China)
[Abstract]ObjectiveTo detect the miR-155 in the CD133+ CD326+ cells(LCSCs) and imaging them by using the miR-155 molecular beacon (MB).MethodsA549 cells were cultured in the serum-free stem cell medium and treated by paclitaxel until new spheroids emerged;then we sorted the CD133+ CD326+ cells by flow cytometry and identified their stem characteristics.Chitosan nanoparticles(CS) were adopted to deliver the miR-155 MB.The laser confocal microscopy was used to detect and image the miR-155 in LCSCs.The miR-155 expression level was verified by quantitative Real-Time PCR (qRT-PCR).ResultsThe LCSCs formed the sphere in stem cell culture medium,the stem genes (CD133,CD326,OCT-4,Nanog) expression levels were 3.27,3.39,6.01,3.42 times higher than those of A549 cells(P<0.05).1×104 cells formed the subcutaneous transplanted tumors.The red fluorescence was detected in the A549 and LCSCs when CS transfect the miR155 MB,and the fluorescent signal of LCSCs was the highest(P<0.05).The fluorescence intensity was proximately consistent with the level of miR-155 expression determined by qRT-PCR.ConclusionUsing the miR-155 MB could detect the miR-155 in the LCSCs and image them.It might be a new idea for monitoring the lung cancer stem cell.
[Key words]neoplastic stem cell;lung neoplasms;A549;molecular beacon

