IGF-1和IGFBP-3基因多态性与前列腺癌易感性的相关性
董宇宁, 张 磊, 张其杰, 汪 倩, 范书伊, 张征委, 曹 强, 钱 健,李 普, 邵鹏飞, 居小兵
前列腺癌专题
IGF-1和IGFBP-3基因多态性与前列腺癌易感性的相关性
董宇宁,张磊,张其杰,汪倩,范书伊,张征委,曹强,钱健,李普,邵鹏飞,居小兵
第一作者: 董宇宁,男,硕士研究生,研究方向:泌尿系统肿瘤
【摘要】目的探讨中国人群中IGF-1和IGFBP-3多态性与前列腺癌易感性的相关性。方法采用以医院为基础的病例对照研究模式,应用TaqMan探针法对IGF-1和IGFBP-3的9个SNPs进行基因分型,检测664例患者和702例对照者的基因型,分层分析与前列腺癌发生有关的可能因素。结果前列腺癌组和对照组进行比较时,rs6218,rs35767和rs5742612的基因型和等位基因频率分布存在显著差异(P=0.005、0.005和0.020)。在综合分析中,具有2~6个风险等位基因的个体患前列腺癌的风险显著高于具有0~1个风险等位基因的个体。研究还发现,组合风险等位基因与前列腺癌风险之间的关联主要表现在以下几组:年龄>71岁(OR=1.41,95%CI=1.05~1.91,P=0.020),不吸烟(OR=1.68,95%CI=1.21~2.32,P=0.002),不喝酒(OR=1.32,95%CI=1.02~1.61,P=0.002),前列腺癌家族史(OR=1.28,95%CI=1.02~1.71,P=0.022)。结论在中国人群中,3个单核苷酸多态性(rs6218,rs35767和rs5742612)和具有2~6个风险等位基因的联合基因型可能与前列腺癌的易感性相关,而与前列腺癌的进展无关。
【关键词】基因检测;多态性;IGF-1;IGFBP-3;前列腺癌;易感性
在西方国家中,前列腺癌居于男性癌症死亡率的第二位。2012年,美国有28 170人死于前列腺癌,估计有241 740个新确诊的前列腺癌病例[1]。流行病学研究曾经证实,在亚洲人群中,前列腺癌的发病率要低很多[2]。然而,随着生活方式越来越西方化,近年来中国的前列腺癌的发病率明显升高[3]。年龄、民族/种族、遗传背景、环境因素和类固醇激素水平被认为与前列腺癌的发病风险有关[4]。虽然许多人都暴露于这些危险因素中,但只有少数人发展为前列腺癌。这表明,遗传变异可能与前列腺的癌变相关[5]。
胰岛素样生长因子(IGFs)是胰岛素相关肽中的一个大家族,包括IGF-Ⅰ和IGF-Ⅱ以及他们的细胞表面受体(IGF-ⅠR和IGF-ⅡR)、胰岛素样生长因子结合蛋白(IGFBP)、IGFBP蛋白酶和其他几种与胰岛素样生长因子结合蛋白相互作用的分子[6]。他们都参与调节细胞的增殖、分化和凋亡[7]。胰岛素样生长因子结合蛋白参与了多种不同的通路,控制细胞的增殖和存活,包括:RAS/RAF/丝裂原活化蛋白激酶(MAPK)[8],磷脂酰肌醇3-激酶(PI3K)/Akt[9]和核因子-κB(NF-κB)[10]。IGF-1位于12号染色体上,是一含有70个氨基酸的肽。IGFBP-3位于7号染色体上,是一含有264个氨基酸的肽。IGF-1和IGFBP-3主要由肝脏产生[11]。大多数循环IGF-1结合于IGFBP-3;与此同时,IGFBP-3调节IGF-1的生物活性。有研究表明,IGF-1在有丝分裂和抗凋亡中发挥重要作用[7],而IGFBP-3可能通过抑制生长[12]发挥抗增殖和促凋亡作用。流行病学研究也已证实,IGF-1和IGFBP-3的基因突变与多种癌症发病风险的增加有关,包括前列腺癌、结肠癌、肺癌、乳腺癌等[13-16]。
鉴于IGF-1和IGFBP-3在肿瘤组织中的重要作用,我们推测这两个基因的遗传变异可能对前列腺癌的发病风险产生影响。在本研究中,我们使用候选基因法来调查中国人群中的前列腺癌的遗传危险因素。IGF-1中的5个单核苷酸多态性(SNPs)(rs6214,rs6218,rs35767,rs5742612,rs5742714)和IGFBP-3中的4个单核苷酸多态性(rs2132572,rs2854744,rs2854746,rs9282734)被筛选出来,进而得以分析他们与前列腺癌发病风险之间的关系,现将结果报道如下。
1材料与方法
1.1研究对象2003年12月至2010年3月期间在南京医科大学第一附属医院就诊的664例前列腺癌患者,均经病理证实。对照样本702例来自于通过直肠指诊(DRE)认定没有前列腺癌的常规患者。每个受试者的详细资料和流行病学危险因素(包括年龄、烟草使用、酒精使用、癌症家族病史)都被详细采集。在本研究中,每天都吸烟且超过1年的人被定义为吸烟者;其他人群被定义为不吸烟者。每星期至少饮酒3次且超过6个月的人被定义为饮酒者;其他人群被定义为不饮酒者。肿瘤家族史是指一级亲属(父母、兄弟姐妹或孩子)患有肿瘤。疾病分期由病理结果、盆腔电脑断层扫描、磁共振成像和核素骨扫描决定。采用国际肿瘤淋巴结转移(TNM)分类和WHO指南确定肿瘤分期。根据美国癌症联合委员会颁布的TNM分类系统将病期分为早期肿瘤和晚期肿瘤。早期前列腺癌是指那些可以被临床诊断,但是没有扩散到前列腺之外的前列腺癌(T1~2N0M0);晚期前列腺癌是指肿瘤已经扩散到前列腺之外(T3~4NxMx,TxN1Mx或TxNxM1)。血清PSA水平由病理科医生检测,将受试者分为两组:PSA>20 mμg/ml和PSA≤20 mμg/ml。在得到受试者的书面知情同意书之后,抽取每一位受试者5 ml血液用于基因组提取。本研究得到南京医科大学伦理委员会批准。
1.2SNP的筛选基于HapMap数据(http://hapmap.ncbi.nlm.nih.gov/)和PubMed数据(http://www.ncbi.nlm.nih.gov/projects/SNP/),我们选择了IGF-1的4个单核苷酸多态性(rs6214,rs6217,rs6218,rs35767)和IGFBP-3的2个单核苷酸多态性(rs2132572,rs9282734)。所有这些基因的次要等位基因频率(MAF)均超过5%的汉族人口。考虑到rs6217的完整的连锁不平衡(r2=1),我们仅选取rs6218进行基因分型。最后,我们选取了IGF-1中的1个SNP(rs5742714)和IGFBP-3中的两个SNP(rs2854744,rs2854746),他们最近被证实与中国人口中的一些恶性肿瘤密切相关[17-19]。
1.3基因分型我们使用蛋白酶消化和苯酚/氯仿提取技术从抗凝外周血的白细胞中提取基因组DNA。通过TaqMan SNP基因分型技术进行基因分型。扩增条件:50℃ 2 min,95℃ 10 min,随后95℃ 15 s、60℃,进行40个循环。根据制造商的指令,使用384-well ABI 7900HT荧光实时定量PCR系统(Applied Biosystems,Foster City,CA,USA)进行基因分型检测;使用序列检测系统软件(SDS 2.3;应用生物系统)来自动收集和分析数据并进行基因型的检测。每一块板都包括4个对照组,以确保基因分型的准确性。两个人以一种双盲的方式单独进行基因分型,以确保质量控制。约5%的样品被随机选取进行反复基因分型,结果100%一致。
1.4统计学方法使用统计分析系统软件(版本9.1.3;SAS研究所,Inc.,Cary,NC,USA)进行数据分析。χ2检测被用来分析前列腺癌组和对照组之间在人口统计变异值、吸烟指数、吸烟状况、酒精使用情况、肿瘤家族史和基因型频率等方面在频率分布上的差异。采用非条件Logistic回归分析,通过比值比(ORs)95%可信区间(CIs)评估多态性和前列腺癌风险之间的关系。所有的比值比根据年龄、吸烟、饮酒状况及家族史进行校正。所有的统计分析均为两方面的。以P<0.05被认为有统计学意义。
2结果
2.1研究人群特征表1概述了前列腺癌组和对照组的人口学特征和临床资料。在年龄方面,前列腺癌组和对照组之间没有明显差异(P=0.76)。然而,在前列腺癌组中,吸烟者和饮酒者所占的比例明显高于对照组(吸烟者58.0%∶50.4%,P<0.01;饮酒者29.7%∶24.5%,P=0.03)。此外,在前列腺癌组中,具有肿瘤家族史的患者所占的比例也明显高于对照组(P<0.01)。在前列腺癌组中,有389(58.6%)例患者的PSA水平<20 ng/ml。Gleason评分<7, =7和>7的患者数目及其所占的百分比分别是225例(33.9%)、220例(33.1%)和219例(33.0%)。此外,393例(59.2%)患者处于局限期,271例(40.8%)患者处于进展期。
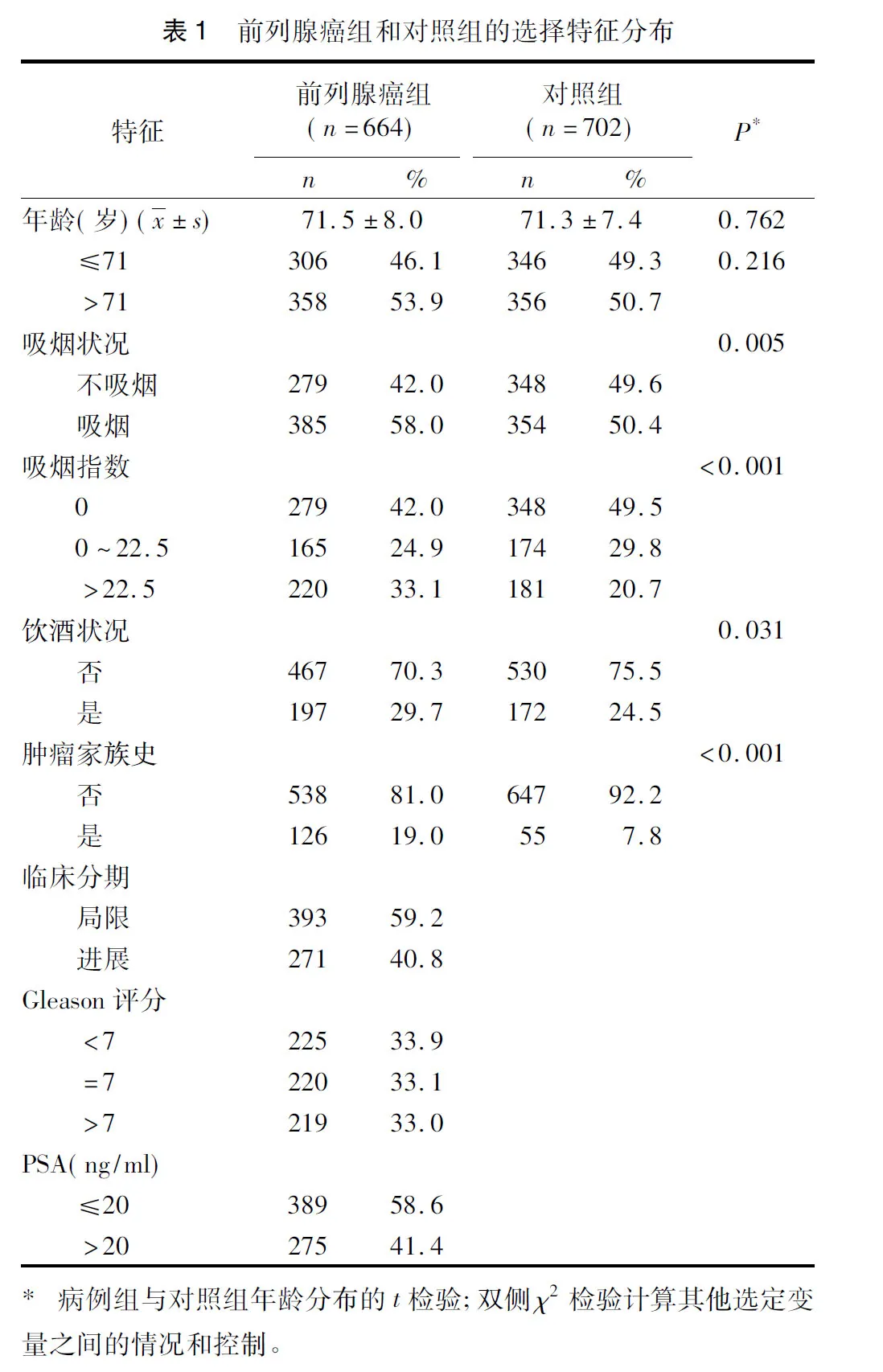
2.2前列腺癌组和对照组之间的IGF-1和IGFBP-3基因型分布表2中概述了前列腺癌组和对照组的9个多态性的基因型频率和等位基因频率,以及他们与前列腺癌发病风险之间的关系。在对照组中观察到的多态性的基因型频率符合Hardy-Weinberg平衡(HWE)(P>0.05)。如表2所示,我们观察到rs6218,rs35767和rs5742612的基因型频率和等位基因频率的分布在前列腺癌组和对照组之间存在着明显的差异。对于rs6218多态性,在前列腺癌组中,TT、TC和CC基因型的百分比分别为50.1%、43.7%和6.2%;在对照组中分别为58.3%、35.0%和6.7%。对于rs35767,在前列腺癌组中,TT、TC和CC基因型的百分比分别为36.5%、48.6%和14.9%;在对照组中分别为43.3%、46.6%和10.1%(P<0.01)。同样的,对于rs5742612,在前列腺癌组中,TT、TC和CC基因型的百分比分别为44.1%、44.0%和11.9%;在对照组中分别为51.4%、39.3%和9.3%(P=0.02)。基于Logistic回归分析,当使用rs6218 TT基因型为参照时,与TT基因型相比较,rs6218的TC基因型与CC基因型之比与前列腺癌风险的升高明显相关(OR=1.37,95%CI=1.10~1.70)。同样的,当与CC基因型相比较时,在联合基因型rs35767中CT基因型与TT基因型之比与前列腺癌风险的升高明显相关(OR=1.35,95%CI=1.08~1.69)。对于rs5742612,当与TT基因型相比较时,TC基因型(OR=1.30,95%CI=1.03~1.64)、CC基因型(OR=1.44,95%CI=0.99~2.09)和TC基因型/CC基因型(OR=1.33,95%CI=1.07~1.66)与前列腺癌风险的升高之间具有统计学意义。
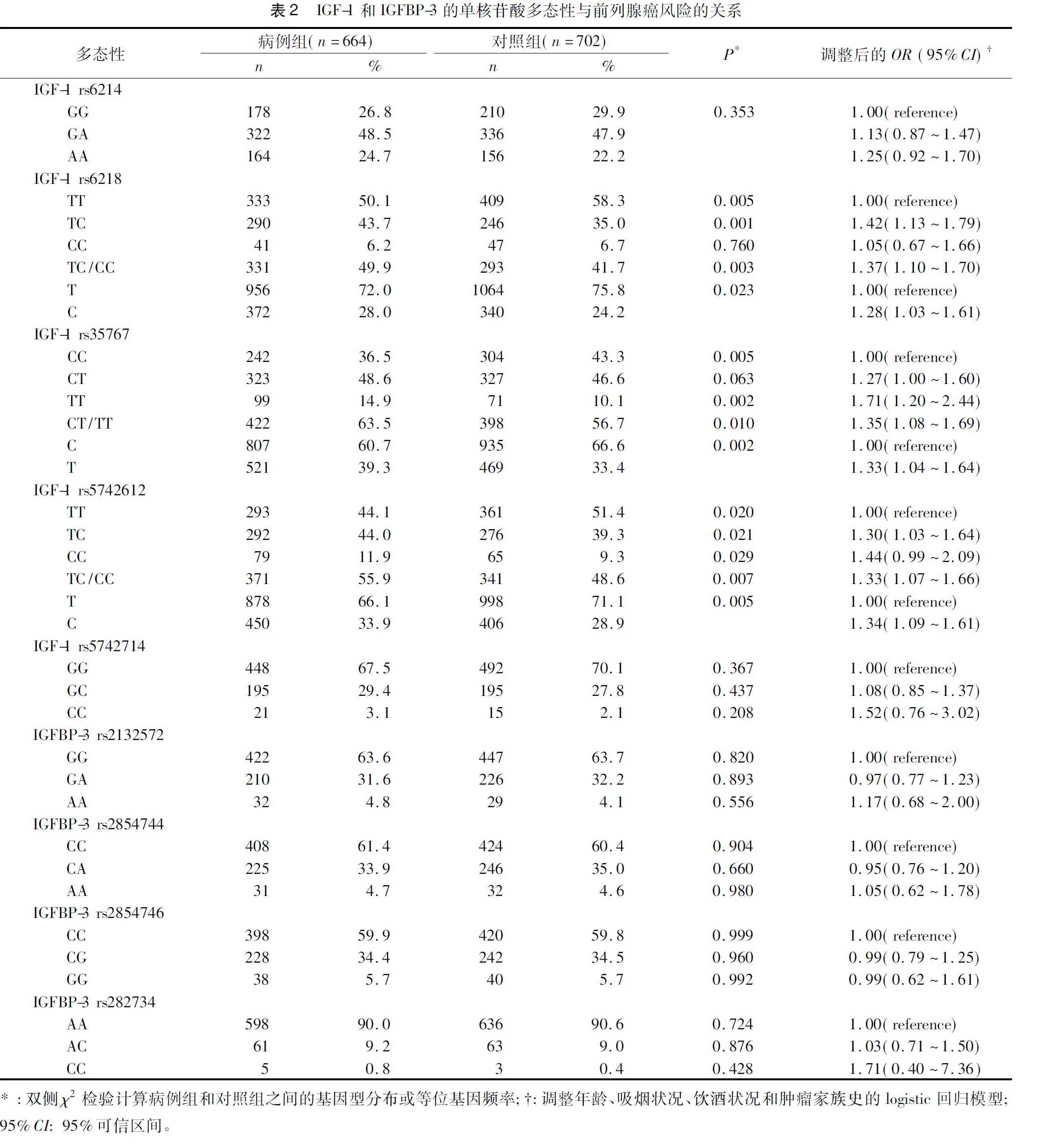
2.33个多态性与前列腺癌易感性的综合分析因为这3个单核苷酸多态性(rs6218,rs35767和rs5742612)似乎与前列腺癌的风险增加相关,基于风险等位基因的数量,我们把他们结合起来并且评估多态性对前列腺癌风险的潜在影响。如表3所示,在风险等位基因的综合分析中,观察到了统计学意义(P<0.01)。此外,根据风险等位基因的数目,我们将其分为2组。我们发现,在具有2~6个风险等位基因的人群中,前列腺癌的发病风险明显高于那些携带0~1个风险等位基因的人群(OR=1.30,95%CI=1.05~1.62,P=0.01)。
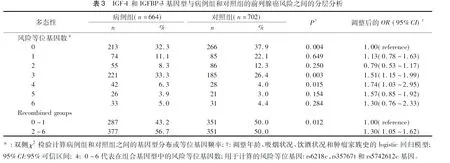
2.4联合基因型与前列腺癌风险的分层分析通过年龄、吸烟状况、吸烟指数、饮酒状况及家族史等因素评估3个多态性的联合等位基因对前列腺癌发病风险的影响。如表4所示,我们发现,关联主要表现有以下几种:年龄>71岁(OR=1.41,95%CI=1.05~1.91,P=0.02)、吸烟(OR=1.68,95%CI=1.21~2.32,P<0.01)、糖尿病(OR=1.32,95%CI=1.02~1.71,P<0.01)和无肿瘤家族史(OR=1.28,95%CI=1.02~1.61,P=0.02)。我们进一步研究联合风险等位基因和前列腺癌临床病理特征之间的关联(表5),发现联合基因型与前列腺癌的进展之间无统计学意义。
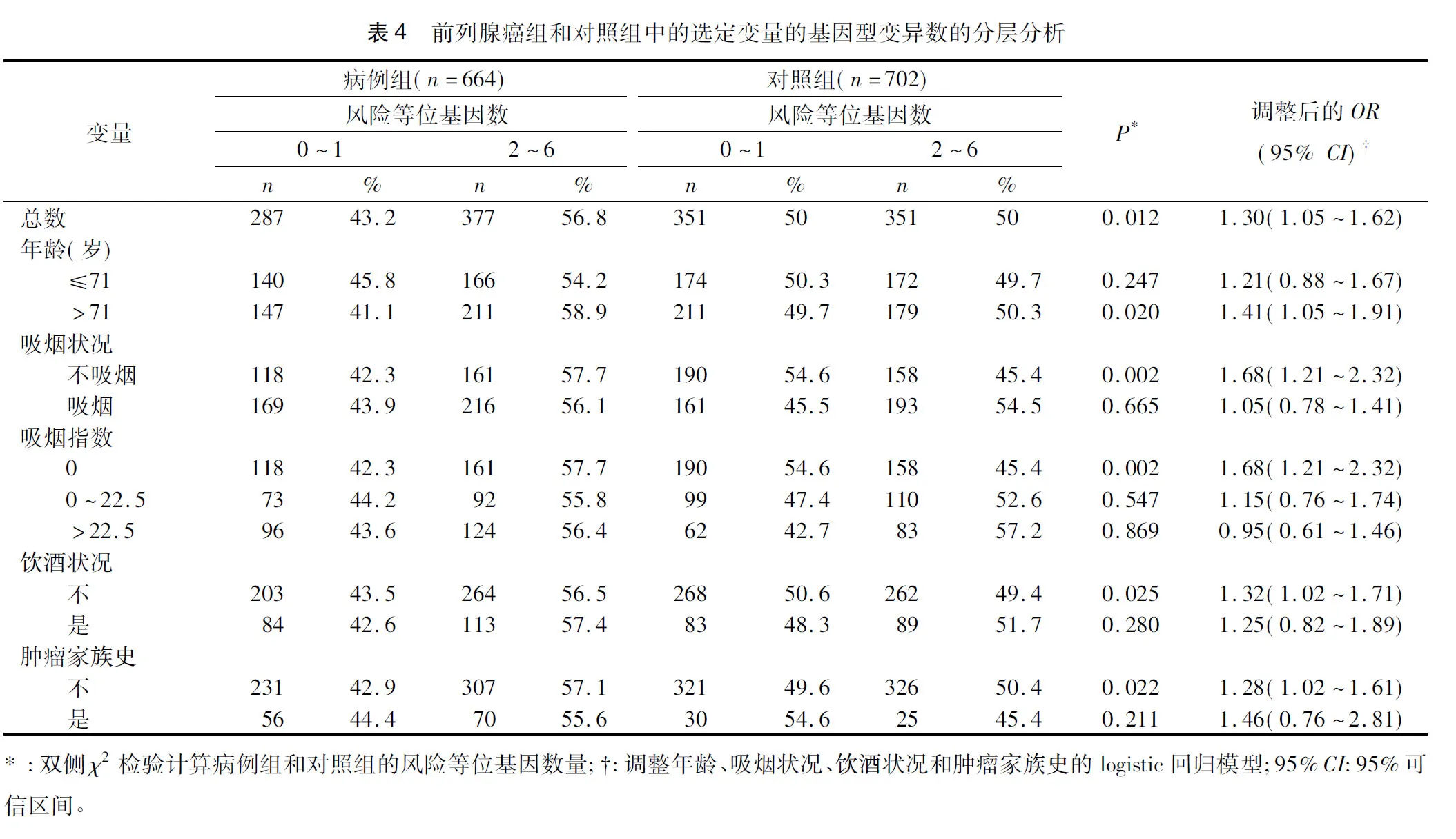

表5 IGF-1和IGFBP-3基因多态性与前列腺癌的临床病理特征的关系
*:调整年龄、吸烟状况、饮酒状况和肿瘤家族史的logistic回归模型;95%CI:95%可信区间;OR:比值比。
3讨论
体内和体外的大量的流行病学和实验证据表明,IGF通路在前列腺癌发生和进展中发挥着重要作用,包括细胞代谢、分化、增殖、转化、抗细胞凋亡、血管生成、肿瘤骨转移和雄激素非依赖性进展[7,20-21]。人体内几乎所有的细胞都可以合成和释放IGF-1,包括前列腺组织[22]。作为一个强有力的促细胞分裂剂,通过促进DNA合成、加快细胞周期进程和抑制细胞凋亡,IGF-1在正常细胞和肿瘤细胞中发挥着促进细胞分裂的作用[23]。IGFBP-3是IGFBP最主要的存在形式,结合了超过90%的IGF-1,从而确定IGF-1的生物利用度[24]。IGF-1和IGFBP-3基因多态性已被证实在许多种族中与前列腺癌发病风险相关,包括白种人、非洲裔美国人和日本人[25]。此外,许多研究表明,前列腺癌的风险增加与较高的IGF-1循环浓度或较低的IGFBP-3循环浓度相关[26-27]。因此,我们研究在中国人群中IGF-1和IGFBP-3单核苷酸多态性对前列腺癌发病风险的影响。
在本研究中,我们评估9种IGF-1和IGFBP-3基因多态性与前列腺癌的发生和进展之间的关系。我们发现在IGF-1中的3种单核苷酸多态性(rs6218,rs35767和rs5742612)与前列腺癌发病风险的升高有关。并且这种风险的增加在携带有rs6218 TC/CC基因型、rs35767 CT/TT基因型或者rs5742612 TC/CC基因型的前列腺癌患者中表现明显。在老年人(>71岁)、非吸烟者、非饮酒者和那些没有肿瘤家族史的前列腺癌患者中,这些风险等位基因的存在对前列腺癌的进展构成了一个相当大的威胁。然而,在其他的单核苷酸多态性和前列腺癌风险之间,我们没有发现任何统计学联系。
最近,IGF-1和IGFBP-3基因多态性与各种癌症(包括前列腺癌)发病风险之间的关系已被使用单氨基酸突变的遗传方法和分子流行病学研究所证实[17-18,28-31]。在我们的研究中,关于IGF-1单核苷酸多态性的结论被前人的众多研究结果所支持。此外,我们的研究结果表明,IGFBP-3基因多态性的基因型分布在前列腺癌组和对照组之间没有差异。Schumacher等人[32]的报道称,IGFBP-3基因多态性变异(rs2854744)与白种人中前列腺癌的风险没有关联。同样,Johansson等人[33]也认为rs2854744与瑞典人口中前列腺癌的发病率和存活率之间没有联系。这些结果与我们目前得到的结论一致。据我们所知,这是评价IGF-1和IGFBP-3基因多态性与中国人口中前列腺癌风险之间的遗传关联的首次研究。
IGF-1由肝脏和前列腺组织产生,与前列腺癌的发生相关。流行病学研究表明,多个种族中,高水平的IGF-1可增加前列腺癌的发病风险[33-34]。我们注意到,IGF-1的水平在不同的族群之间存在差异,在中国人群中也发现了类似的结果[35]。虽然IGF-1水平受多种因素的调节,大约一半的个体间血清IGF-1变异由遗传决定[36]。考虑到3种IGF-1 SNPs和前列腺癌风险的关系,我们认为这些基因变异可能与IGF-1的调节相关。我们需要更多的证据和研究去明确这3种多态性与IGF-1水平之间的关系。
在本项研究中,我们观察到rs6218c、rs35767t和rs5742612c等位基因与前列腺癌发病风险的增加相关,这表明,在中国人群中,rs6218c、rs35767t和rs5742612c等位基因是前列腺癌的风险等位基因。为了获得候选基因遗传易感性的综合估计,我们对组合等位基因进行分析后发现,在具有2~6个风险等位基因的人群中,前列腺癌的发病风险明显高于那些携带0~1个风险等位基因的人。同时发现在年龄超过71岁的人群中,等位基因对前列腺癌具有重要影响。这一发现被一项回顾性研究结果所支持:链接的脱氧核糖核酸损伤随着年龄增长而累积[37]。此外,我们还发现,前列腺癌的发病率在不吸烟者和不饮酒者中明显升高。我们知道,血液中高浓度的胰岛素样生长因子可能会促进前列腺癌的发生。Morimoto等人[38]先前的研究报道称,循环IGF-1会受到生活方式因素的影响。对于不吸烟者和不饮酒者发生前列腺癌的风险较高这一现象的一个可能的解释是,环境效应掩盖了遗传效应。
本项研究尚具有局限性。首先是样本量的适中限制了组合分析与分层分析的统计学强度;其次是缺乏肿瘤危险因素的详细信息,如饮食、体力活动和职业暴露等,进一步限制了对环境因素和前列腺癌发病风险之间关系的评估;第三是研究对象是以医院为基础的回顾性研究,因此固有的选择偏差不能完全排除。此外,考虑到直肠指诊的局限性,在对照组中可能存在一些错误的分类。然而,在前列腺癌组和对照组中,9种多态性的基因型频率符合HWE,这表明选择偏倚并不明显。
总之,本研究证据阐明了IGF-1和IGFBP-3 SNPs在前列腺癌发生和发展中所发挥的遗传效应,IGF-I中的三种多态性(rs6218,rs35767和rs5742612)以及他们的联合基因可能会增加中国人口中前列腺癌的风险。我们下一步将进行扩大样本量和更多的环境和生存因素的流行病学研究,以确认我们的研究结果。
参考文献:
[1]SIEGEL R, NAISHADHAM D, JEMAL A.Cancer statistics for Hispanics/Lations, 2012[J]. CA Cancer J Clin,2012,62(5):283-298.
[2]QUINN M, BABB P.Patterns and trends in prostate cancer incidence, survival, prevalence and mortality.Part I:international comparisons[J].BJU Int,2002,90(2):162-173.
[3]MCCRACKEN M, OLSEN M, CHEN M S Jr, et al.Cancer incidence, mortality, and associated risk factors among Asian Americans of Chinese, Filipino, Vietnamese, Korean, and Japanese ethnicities[J]. CA Cancer J Clin,2007,57(4):190-205.
[4]BOSTWICK D G, BURKE H B, DJAKIEW D, et al.Human prostate cancer risk factors[J]. Cancer,2004,101(10 Suppl):2371-2490.
[5]DIANAT S S, MARGREITER M, ECKERSBERGER E, et al.Gene polymorphisms and prostate cancer: the evidence[J]. BJU Int,2009,104(11):1560-1572.
[6]JONES J I,CLEMMONS D R.Insulin-like growth factors and their binding proteins: biological actions[J]. Endocr Rev,1995,16(1): 3-34.
[7]KHANDWALA H M,MCCUTCHEON I E,Flyvbjerg A,et al.The effects of insulin-like growth factors on tumorigenesis and neoplastic growth[J]. Endocr Rev,2000,21(3):215-244.
[8]MARONI P D, KOUL S, MEACHAM R B, et al.Mitogen Activated Protein kinase signal transduction pathways in the prostate[J].Cell Commun Signal,2004,2(1):5.
[9]MCINTOSH J,DENNISON G,HOLLY J M,et al.IGFBP-3 can either inhibit or enhance EGF-mediated growth of breast epithelial cells dependent upon the presence of fibronectin[J]. J Biol Chem,2010,285(50):38788-38800.
[10]VIVANCO I, SAWYERS CL.The phosphatidylinositol 3-Kinase AKT pathway in human cancer[J]. Nat Rev Cancer,2002,2(7):489-501.
[11]POLLAK M.Insulin-like growth factor physiology and neoplasia[J].Growth Horm IGF Res,2000,10 Suppl A:S6-S7.
[12]FIRTH S M, BAXTER R C.Cellular actions of the insulin-like growth factor binding proteins[J]. Endocr Rev,2002,23(6):824-854.
[13]CHAN J M, STAMPFER M J, GIOVANNUCCI E, et al.Plasma insulin-like growth factor-I and prostate cancer risk: a prospective study[J].Science,1998,279(5350):563-566.
[14]HANKINSON S E,WILLETT W C,COLDITZ G A,et al.Circulating concentrations of insulin-like growth factor-I and risk of breast cancer[J].Lancet,1998,351(9113):1393-1396.
[15]MA J,GIOVANNUCCI E,POLLAK M,et al.RESPONSE:Re:Prospective study of colorectal cancer risk in men and plasma levels of insulin-like growth factor (IGF)-I and IGF-binding protein-3[J].J Natl Cancer Inst,1999,91(23):620-625.
[16]YU H, SPITZ M R, MISTRY J,et al.Plasma levels of insulin-like growth factor-I and lung cancer risk: a case-control analysis[J].J Natl Cancer Inst,1999,91(2): 151-156.
[17]ZHANG M, HU Z, HUANG J,et al.A 3′-untranslated region polymorphism in IGF1 predicts survival of non-small cell lung cancer in a Chinese population[J].Clin Cancer Res,2010,16(4):1236-1244.
[18]DEMING S L, REN Z, WEN W,et al.Genetic variation in IGF1, IGF-1R, IGFALS, and IGFBP3 in breast cancer survival among Chinese women: a report from the Shanghai Breast Cancer Study[J].Breast Cancer Res Treat,2007,104(3): 309-319.
[19]QIAN B, ZHENG H, YU H, et al.Genotypes and phenotypes of IGF-I and IGFBP-3 in breast tumors among Chinese women[J].Breast Cancer Res Treat,2011,130(1): 217-226. doi: 10.1007/s10549-011-1552-9.
[20]YU H, ROHAN T.Role of the insulin-like growth factor family in cancer development and progression[J]. J Natl Cancer Inst,2000,92(18): 1472-1489.
[21]PEEHL D M,COHEN P,ROSENFELD R G.The role of insulin-like growth factors in prostate biology[J]. J Androl,1996,17(1):2-4.
[22]ROSEN C J.Serum insulin-like growth factors and insulin-like growth factor-binding proteins: clinical implications[J].Clin Chem,45(8 Pt 2): 1384-1390.
[23]QU B H, KARAS M, KOVAL A, et al.Insulin receptor substrate-4 enhances insulin-like growth factor-I-induced cell proliferation[J].J Biol Chem,1999,274(44): 31179-31184.
[24]SAMANI A A, YAKAR S, LEROITH D, et al.The role of the IGF system in cancer growth and metastasis: overview and recent insights[J].Endocr Rev,2007,28(1):20-47.
[25]CHENG I,STRAM D O,PENNEY K L,et al.Common genetic variation in IGF1 and prostate cancer risk in the Multiethnic Cohort[J].J Natl Cancer Inst,2006,98(2): 123-134.
[26]CHEN W,WANG S,TIAN T,et al.Phenotypes and genotypes of insulin-like growth factor 1, IGF-binding protein-3 and cancer risk: evidence from 96 studies[J]. Eur J Hum Genet,2009,17(12):1668-1675.
[27]STATTIN P,RINALDI S,BIESSY C,et al.High levels of circulating insulin-like growth factor-Ⅰ increase prostate cancer risk: a prospective study in a population-based nonscreened cohort[J]. J Clin Oncol,2004,22(15): 3104-3112.
[28]TERRY K L,TWOROGER S S,GATES M A,et al.Common genetic variation in IGF1, IGFBP1 and IGFBP3 and ovarian cancer risk[J].Carcinogenesis,2009,30(12): 2042-2046. doi: 10.1093/carcin/bgp257.[29]ZECEVIC M,AMOS C I,GU X,et al.IGF1 gene polymorphism and risk for hereditary nonpolyposis colorectal cancer[J]. J Natl Cancer Inst,2006,98(2):139-143.
[30]LIN J K,SHEN M Y, LIN T C,et al.Distribution of a single nucleotide polymorphism of insulin-like growth factor-1 in colorectal cancer patients and its association with mucinous adenocarcinoma[J].Int J Biol Markers,2010,25(4):195-199.
[31]MCGRATH M,LEE I M,BURING J,et al.Common genetic variation within IGFⅠ,IGFⅡ,IGFBP-1,and IGFBP-3 and endometrial cancer risk[J].Gynecol Oncol,2011,120(2):174-178.doi: 10.1016/j.ygyno.2010.10.012.
[32]SCHUMACHER F R,CHENG I,FREEDMAN M L,et al.A comprehensive analysis of common IGF1, IGFBP1 and IGFBP3 genetic variation with prospective IGF-I and IGFBP-3 blood levels and prostate cancer risk among Caucasians[J]. Hum Mol Genet,2010,19(15):3089-3101.
[33]JOHANSSON M,MCKAY J D,RINALDI S,et al.Genetic and plasma variation of insulin-like growth factor binding proteins in relation to prostate cancer incidence and survival[J].Prostate,2009,69(12): 1281-1291.
[35]彭黎明,唐书强,胥劲,等.IGF-1定量检测及其在前列腺癌诊断中的价值[J].华西医科大学学报,2002,33(1): 137-139.
[36]HARRELA M, KOISTINEN H, KAPRIO J, et al.Genetic and environmental components of interindividual variation in circulating levels of IGF-Ⅰ, IGF-Ⅱ, IGFBP-1, and IGFBP-3[J]. J Clin Invest,1996,98(11):2612-2615.
[37]MASLOV A Y, VIJG J.Genome instability, cancer and aging[J]. Biochim Biophys Acta,2009,1790(10):963-969.
[38]MORIMOTO L M,NEWCOMB P A,WHITE E,et al.Variation in plasma insulin-like growth factor-1 and insulin-like growth factor binding protein-3: genetic factors[J]. Cancer Epidemiol Biomarkers Prev,2005,14(6):1394-1401.
基金项目:吴阶平基金资助项目(320.6750.13116)
作者单位:210029江苏南京,南京医科大学第一临床医学院(董宇宁,张磊,张其杰,汪倩,范书伊,张征委); 南京医科大学第一附属医院泌尿外科(曹强,钱健,李普,邵鹏飞,居小兵)
通讯作者:居小兵,男,主任医师,硕士研究生导师,研究方向:肾上腺疾病、泌尿系统肿瘤,E-mail:doctorjxb73@163.com
doi:10.3969/j.issn.1674-4136.2016.02.005
文章编号:1674-4136(2016)02-0084-08
Corresponding author:JU Xiaobing,E-mail:doctorjxb73@163.com
[收稿日期:2016-04-08][本文编辑:李筱蕾]
Genetic polymorphisms in IGF-1 and IGFBP-3 are associated with prostate cancer in the Chinese population
DONGYuning1,ZHANGLei1,ZHANGQijie1,WANGQian1,FANShuyi1,ZHANGZhenwei1,CAOQiang2,QIANJian2,LIPu2,SHAOPengfei2,JUXiaobing2.
(1.TheFirstClinicalMedicalCollegeofNanjingMedicalUniversity,Nanjing210029,China;2.DepartmentofUrology,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China)
Abstract:ObjectiveTo investigate the association between the functional polymorphisms in IGF-1 and IGFBP-3 and the risk of prostate cancer (PCa) in the Chinese population. MethodsWe obtained information on demographic factors by a personal interview. This hospital-based case-control study included 664 PCa patients and 702 cancer-free controls. Nine SNPs in IGF-1 and IGFBP-3 were genotyped using the TaqMan assay.ResultsThe genotype and allele frequency distribution of rs6218, rs35767 and rs5742612 were significantly different when comparing PCa cases to controls(P=0.005, 0.005 and 0.020,respectively). In the combined analysis, individuals with 2~6 risk alleles had an elevated risk of PCa compared to those with 0~1 risk alleles. We also found that the association between the combined risk alleles and the risk of PCa appeared stronger in the following subgroups: individuals older than 71 years of age (OR=1.41,95%CI=1.05~1.91,P=0.020), nonsmokers (OR=1.68, 95%CI=1.21~2.32,P=0.002), nondrinkers(OR=1.32, 95%CI=1.02~1.61,P=0.002), and those with a negative family history of PCa (OR=1.28, 95%CI=1.02~1.71,P=0.022).Conclusions The three SNPs (rs6218,rs35767 and rs5742612) and the joint genotypes with 2~6 risk alleles, may contribute to the susceptibility to PCa, but not the progression, in the Chinese population.
Keywords:Gene detection;Polymorphism;IGF-1;IGFBP-3;Prostate cancer;Susceptibility

