Ad-HGF转染骨髓间充质干细胞及体外检测
周 华王广文孔祥骞王 默金 星*吴学君山东大学附属省立医院血管外科,济南 500青州市人民医院血管外科,青州 6500
·基础研究 ·
Ad-HGF转染骨髓间充质干细胞及体外检测
周 华1王广文2孔祥骞1王 默1金 星1*吴学君1
1山东大学附属省立医院血管外科,济南 250021
2青州市人民医院血管外科,青州 262500
目的 探讨重组腺病毒载体的HGF体外转染兔骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)可行性,然后利用流式细胞仪检测目的基因的转染效率,ELISA和免疫组化检测转染后外源基因HGF的表达。方法 携带HGF(hepatocyte growth factor)基因和绿色荧光蛋白(green fluorescene protein,GFP)的重组腺病毒载体Ad-HGF、Ad-GFP,均由兰州军区总医院哈小琴教授提供。以不同感染复数(multiple of infection,MOI)的GFP载体转染BMSCs,流式细胞检测表达GFP阳性细胞率。以MOI=150时Ad-HGF转染BMSCs,ELISA检测和免疫细胞化学检测HGF表达;流式细胞仪检测HGF-BMSC细胞表面标志物和诱导分化培养,以确定基因转染后细胞生物学特性有无变化;同时transwell检测HGF介导BMSCs细胞迁移能力。结果 在Ad-GFP以不同MOI转染兔BMSCs 48 h后,GFP的细胞阳性表达率具有明显差异(P<0.05)。在MOI=150时,表达GFP阳性细胞率>98%;在MOI>150时,表达GFP阳性细胞率不具有明显差异(P>0.05)。因此,选择MOI=150时转染BMSCs。以MOI=150将Ad-HGF转染兔BMSCs后,ELISA法和免疫细胞化学法检测结果均显示:HGF蛋白在细胞培养液和胞浆内均具有丰富的表达,表明Ad-HGF转染BMSCs高效,HGF蛋白在BMSCs中高表达。流式细胞仪检测和诱导分化培养结果显示,腺病毒感染和HGF基因修饰不改变BMSC表型和分化潜能。同时实验结果显示,HGF对BMSC具有极强的趋化作用。结论 Ad-GFP转染BMSCs可行,在MOI=150时转染BMSCs,可以获得最高的转染效率,转染效率>98%,转染24 h即可见绿色荧光,2~4 d转染率最高;表明重组腺病毒作为载体转染BMSCs,具有高转染率和稳定表达。HGF腺病毒表达载体Ad-HGF转染BMSCs不改变BMSCs的固有特性;经过ELISA和免疫组化检测,BMSCs可以高表达HGF蛋白。HGF对BMSC具有明显的趋化作用。
骨髓间充质干细胞;HGF基因;转染
腺病毒作为基因转染的载体之一,无随机插入的危险性,具有病毒颗粒稳定和宿主范围广的特点。基因转染的BMSCs可以将治疗性蛋白输入特定的器官或者组织以满足基因治疗的特定需要,安全性高;它在体内同时以治疗性材料和持续输送靶基因产物,例如促血管新生的生长因子,到缺血组织中载体,2种角色发挥作用,与单纯的细胞治疗或者基因治疗相比,更具优越性。以BMSCs为种子细胞,联合基因治疗和细胞治疗是研究的新思路和趋势。
肝细胞生长因子(hepatocyte growth factor,HGF)是一个由728个氨基酸构成的异构二聚体蛋白质,通过其受体c-met起作用,具有促新生血管生成、抗血管内皮细胞凋亡、调节细胞免疫和减轻移植物抗宿主病等重要的生物学功能[1-10]。HGF促血管生长的作用比VEGF更强[11,12]。研究表明,BMSCs能够表达HGF的受体(c-met),外源性HGF对BMSCs迁移具有极强的趋化作用[13-15]。BMSCs分泌的HGF是修复组织损伤的重要作用因子之一[16,17]。为研究联合应用HGF和BMSC治疗肢体缺血性疾病的可行性,应用Ad-HGF基因转染BMSC,鉴定转染HGF基因后BMSCs-HGF的生物学特性和安全性,获得以下结论:⑴ HGF腺病毒表达载体Ad-HGF转染BMSCs,不改变BMSCs的固有特性;⑵ 经过ELISA和免疫组化检测,BMSCs可以高表达HGF蛋白,为相关后期临床研究奠定理论基础。
1 材料和方法
1.1 材料
1.1.1 携带HGF基因和GFP重组腺病毒载体
携带人HGF基因的腺病毒载体(Ad-HGF)和携带GFP基因的腺病毒基因载体(Ad-GFP)均由兰州军区总医院哈小琴教授提供,其医疗团队通过细胞内质粒DNA同源重组的方法构建,为El、E3区缺失的5型重组腺病毒载体。
1.1.2实验动物
纯系新西兰大白兔购自山东省农业科学院。动物均为6~8个月龄,体重为(3.0±0.5)kg,雌雄不限,均颗粒饲料,自由饮水,单笼喂养。所有所用新西兰大白兔均受到实验者人道主义对待,符合美国NIH颁布的《实验动物管理和使用指南》要求。此外本实验方案获得了山东大学附属省立医院实验动物伦理委员会的批准。
1.1.3 试剂
驴抗兔Ⅰ型胶原免疫组化试剂盒、DAB显色试剂盒、重组人肝细胞生长因子抗体和HGF-ELISA检测试剂盒。
1.2 方法
1.2.1 病毒滴度测定
取10 ul腺病毒稀释在990 ul的DMEM中(102倍稀释),在充分混匀后再取100 ul液体稀释于900 ul DMEM中(103倍稀释),依此方法进行一系列稀释,最后稀释倍数为1012。将293细胞接种在6孔培养板上,数量为1×106细胞/孔,培养24~36 h,可以细胞长至90%融合,吸出各孔中培养液,各孔中分别滴加102~1012倍病毒稀释液,在培养2 h后进行细胞病变效应(cytopathic effect,CPE)分析。具体方法为:从各孔中吸出病毒液稀释,每孔加入2 m1含10%胎牛血清的完全培养基。在培养36~48 h后显微镜下观察细胞状态,目标倍数即为100%发生细胞病变效应的稀释倍数,根据下附公式计算病毒的感染滴度。
计算公式:感染滴度(pfu/ml)=(1×106细胞/孔)×稀释倍数×10/病毒液体积。
1.2.2 MOI对转染效率的影响
在Ad-GFP转染BMSCs后,流式细胞仪检测MOI对转染效率的影响如下:
⑴ 取第3代培养的BMSCs,以1.5×105/L的浓度接种于6孔培养板中,在37oC,5%CO2饱和湿度培养箱中培养24 h;
⑵ 吸弃上清,加无血清培养基1 ml/孔,培养20 min;
⑶ 分别按照10、50、100、150、200和300的MOI加入Ad-GFP,共设置6个MOI,每个MOI设置3个复孔;
⑷ 每个孔中加完全培养基1 ml,37oC孵育2 h;
⑸ 弃去上清,每个孔中加完全培养基1.5 ml,在37oC、5% CO2饱和湿度培养箱中培养48 h;
⑹ 胰酶消化细胞,每个孔细胞加400 ul 2%甲醛-PBS固定液重悬;
⑺ 流式细胞仪检测Ad-GFP感染BMSCs的感染效率,选取最佳MOI,在后续试验中用此MOI感染细胞。
1.2.3 重组腺病毒Ad-HGF感染兔BMSCs
方法同1.2.2将第3代BMSCs以1.5×105/L的浓度接种于6孔板中,在37oC、5%CO2饱和湿度培养箱中培养24 h,根据1.2.2实验结果,重组腺病毒Ad-HGF以MOI为150 pfu/细胞感染BMSC,具体过程同1.2.2。
1.2.4 ELISA法检测感染后HGF表达
取对数生长期第3代BMSC,接种于6孔板,生长24 h后Ad-HGF以MOI=150 pfu/细胞进行感染,转染后每48 h收集1次培养液上清(-80oC冻存),每次更换新鲜培养基,连取5次,利用HGF-ELISA试剂盒检测培养液上清中HGF的含量。
1.2.5 免疫细胞化学检测HGF蛋白的表达
在BMSC中免疫细胞化学检测HGF蛋白的表达如下:
⑴ 以1×105/L的浓度接种于6孔板,培养箱中培养24 h;
⑵ 将Ad-HGF病毒以MOI=150转染细胞;
⑶ 在48 h后胰酶消化细胞,以5×105/L的浓度滴加于硅化玻片上,置于37oC、5% CO2孵箱中过夜;
⑷ 取出玻片,PBS洗涤3 min×3次,用l0%多聚甲醛固定30 min,再用PBS液冲洗3 min,于4oC冰箱内保存备用;
⑸ 取出4oC冰箱内保存的细胞爬片,每张细胞爬片滴加3% H2O2去离子水以消除内源性过氧化物酶,室温下避光孵育15 min,PBS液冲洗5 min×3次;
⑹ 于爬片表面滴加封闭血清,置入37oC孵箱中孵育15 min,甩去多余液体,不冲洗;
⑺ 每张玻片上滴加50 ul anti-h HGF单克隆抗体,4oC过夜;
⑻ PBS洗5 min×3次,除去PBS,于爬片表面滴加50 ul生物素标记的二抗,37oC孵箱孵育15 min,PBS洗5 min×3次;
⑼ 在去除PBS液后,于爬片表面滴加辣根酶标记的链霉卵白素稀释液,37oC孵育15 min,PBS溶液洗5 min×3次;
⑽ 除去PBS液,于爬片表面滴加新鲜配制的DAB溶液,显微镜下控制DAB显色,蒸馏水洗涤,终止反应;
⑾ 苏木素复染3 min,自来水冲洗,盐酸乙醇分化,自来水冲洗返蓝;
⑿ 梯度酒精脱水,二甲苯透明,中性树胶封片;
⒀ 显微镜下观察。
1.2.6 流式细胞仪检测HGF-BMSCs细胞表面标志
利用重组腺病毒Ad-HGF以MOI=150 pfu/细胞感染第3代对数生长期BMSCs 48 h后,将HGF-BMSCs细胞用0.25%胰蛋白酶消化后进行细胞计数,调整密度为5×107/m1。不同离心管中加0.1 ml细胞悬液,各离心管中分别加入待检一抗,37oC孵育30 min,PBS缓冲液冲洗3 min×3次,加入FITC标记的二抗,37oC孵育30 min,PBS缓冲液冲洗3 min×3次,1000 rpm离心5 min,弃上清,0.5 ml PBS缓冲液将细胞重悬备流式细胞仪进行检测。1.2.7 HGF-BMSCs成骨分化能力鉴定
取对数生长期第3代BMSC,接种于6孔板,1×105细胞/孔,在生长24 h后Ad-HGF以MOI=150 pfu/细胞进行感染。在感染48 h后进行成骨诱导分化;诱导分化3周后行Ⅰ型胶原免疫组化染色。
1.2.8 HGF介导BMSCs细胞迁移分析
HGF介导BMSCs细胞迁移分析[18],具体操作如下:⑴ 在迁移孔下槽中加入转移介质,将Transwells沉入介质中,放置于37oC温箱孵育30 min;⑵ 用胰蛋白酶消化人BMSCs,将细胞浓度调整为1×106/ml;取出迁移板,在每个迁移孔上槽中滴加100 ul细胞悬液,37oC孵育1 h;⑶在迁移孔下槽中分别加入不同浓度HGF(0、10、25、50、100 ng/ml),37oC孵育2 h;⑷ 将Transwells转移至加有2%多聚甲醛的孔中,固定10 min;⑸ 用0.5%结晶紫染10 min;⑹ 轻轻抹去膜上未迁移的细胞,置于光镜下观察结果并且计数,随机选取5个视野计数,取平均值。
1.3 统计学分析
所用统计软件为SPSS 11.0版。设定P<0.05时,具有统计学意义。所有相关数据以(均值±标准差)表达,以不同MOI的Ad-GFP转染兔BMSCs 48 h后,利用完全随机资料的方差分析GFP阳性细胞率。
2 结果
2.1 Ad-GFP转染BMSCs的形态学观察
荧光显微镜观察结果,绿色荧光表达在Ad-GFP感染BMSCs后24h开始出现,2~4d表达强度最高(图1)。上述结果表明腺病毒载体基因能够有效转染BMSCs。

图1 Ad-GFP感染BMSCs 48 h后绿色荧光表达
2.2 不同MOI Ad-GFP对BMSCs转染效率的影响
流式细胞术检测Ad-GFP以不同的MOI转染兔BMSCs后48hGFP的表达,检测有GFP表达的阳性细胞率,结果见(图2,3)。统计结果显示:随着MOI增加表达GFP细胞阳性率随之增加,但是当MOI>150,其表达率差异不具有统计学意义;Ad-GFP以MOI=150转染BMSC阳性率最高,表达GFP阳性率>98%。因此,选择150作为转染BMSCs的MOI。
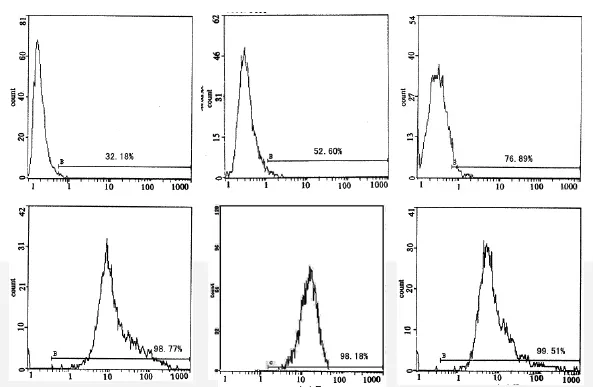
图2 流式细胞检测不同MOI值AD-GFP转染后细胞阳性率
2.3 ELISA法检测感染后HGF表达
Ad-HGF以MOI=150pfu/细胞感染BMSC,HGFELISA试剂盒检测培养上清中HGF含量,结果如图4所示。BMSCs-HGF在感染后48h表达量最高,平均值为(98.18±1.38)ng/ml,并且在10d内可以持续表达,其中随后呈现下降趋势。结果表明,感染Ad-HGF可以使BMSCs短时间内高表达HGF,同时具有一定的时间变化规律。

图3 不同MOI转染兔BMSCs后表达GFP阳性细胞率(均数±标准差,n=3)
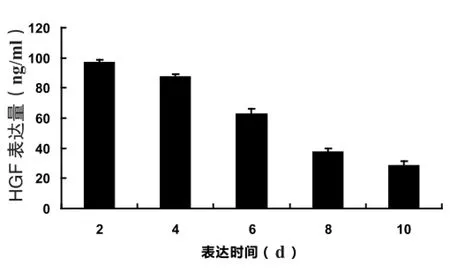
图4 ELISA法检测Ad-HGF转染BMSCs后不同时间表达HGF的量
2.4 免疫细胞化学检测HGF蛋白在HGF-BMSCs中的表达
Ad-HGF以MOI=150转染兔BMSCs后制备细胞爬片,免疫细胞化学染色检测到BMSC胞浆内有HGF蛋白阳性表达,结果证明Ad-HGF可以有效转染BMSCs,并且有HGF蛋白的高表达(图5)。

图5 免疫组化检测HGF蛋白在HGF-BMSCs中的表达
2.5 流式细胞检测HGF-BMSCs细胞表面特异抗原结果
Ad-HGF以MOI=150 pfu/细胞感染BMSC后48 h,应用流式细胞仪对HGF-BMSCs的特异细胞表面抗原进行检测分析显示,转染Ad-HGF的BMSCs均表达CD44、CD29阳性,而不表达CD34、CD45,这和第1部分结果相同,说明腺病毒感染和HGF基因修饰不改变BMSC表型。
2.6 HGF-BMSCs诱导分化成骨能力结果
为了明确Ad-HGF感染对BMSCs细胞分化潜能的影响,对HGF-BMSCs进行体外成骨诱导培养试验。诱导3周后行Ⅰ型胶原免疫细胞化学染色,结果显示Ⅰ型胶原表达阳性(图6),说明HGF-BMSCs和BMSCs具有相同成骨分化能力,转染HGF基因不影响BMSCs的分化潜能。
2.7 HGF介导BMSCs细胞迁移能力分析
为了明确Ad-HGF感染的BMSCs移植入体内后,过表达分泌的HGF是否对BMSC具有趋化作用,是否能够将BMSCs集聚在局部缺血组织中发挥治疗作用,本研究应用Transwells法检测了HGF对BMSC的趋化作用,结果显示在加入HGF后穿过膜微孔的BMSCs数量比无HGF趋化的对照组明显增多(图7)。然后利用直线相关回归对相关细胞计数进行数据分析,结果显示相关系数r=0.99,P<0.01,充分说明HGF剂量和迁移的BMSCs数之间呈正相关(图8)。

图6 HGF-BMSCs成骨诱导后Ⅰ型胶原免疫细胞化学染色

图7 Tranwell检测HGF对BMSC的趋化作用

图8 HGF趋化的BMSCs计数与HGF浓度之间的关系
3 讨论
腺病毒载体基因由5个部分组成,包括El(ElA、ElB)、E2A、E2B、E3和E4等,其中El和腺病毒载体复制有关,去除El可以引起复制缺陷,E3区缺失可以使其能够逃避宿主的免疫系统。目前基因治疗中所应用的腺病毒载体为重组腺病毒,去除整个E1A、部分E1B基因和E3后,由外源性DNA代替。重组腺病毒可以在许多细胞中表达外源基因,适用于体内基因治疗,表达效价高,容纳大量的外源基因,并且其DNA不能够整合于靶细胞DNA中,因此安全性高[19]。重组腺病毒作为重组基因的转染中介,其安全性和有效性在早期临床实验中已经得到初步证实[20-22]。
本实验选用El、E3区缺失的5型重组腺病毒载体,通过检测其活性滴度达5×1010pf/ml。同时本实验表明Ad-GFP可以高效率转染BMSCs,绿色荧光在转染后24h开始出现,2~4d荧光强度最强。
HGF是一个由728个氨基酸构成的异构二聚体蛋白质,通过其受体c-met起作用,具有促新生血管生成、抗血管内皮细胞凋亡、调节细胞免疫和减轻移植物抗宿主病等重要的生物学功能[1-10]。HGF促血管生长的作用比VEGF更强[11,12]。研究表明,BMSCs能够表达HGF的受体(c-met),外源性HGF对BMSCs迁移具有极强的趋化作用[13-15]。BMSCs分泌的HGF是组织损伤修复时重要的作用因子之一[16,17]。HGF半衰期很短,不能够长时间发挥效应,解决这个问题的有效办法是应用基因转染将HGF基因转入BMSCs。Ad-HGF所使用的治疗基因HGF是人源性,依照基因序列设计引物,从人胎盘cDNA库中扩增得到。利用Ad-HGF感染BMSCs,将HGF基因释放到宿主细胞核中,利用细胞自分泌功能,完成HGF局部高表达,综合HGF的促血管新生能力、抗细胞凋亡作用和促干细胞趋化联合BMSCs的多向分化功能,共同促进血管新生,为治疗肢体缺血性疾病提供一条有效的途径。腺病毒载体HGF(Ad-HGF)基因转染BMSCs移植治疗缺血性疾病的理论依据为:⑴ 将HGF基因导入MSCs细胞内,借助细胞作为基因的载体,作为工程细胞的MSCs可以缓慢释放HGF,使得HGF基因能够在短时间内稳定表达,克服了单纯的HGF治疗时半衰期短,必须反复用药的弊端,减少治疗所需BMSCs数量,有利于干细胞的定向分化功能;⑵ 将HGF基因转染的BMSCs移植到机体局部缺血区域,既可以直接诱导分化为血管内皮细胞促血管新生,又能够表达血管新生所需相关生长因子,生长因子除可以直接促血管内皮的生长,还有骨髓动员作用,骨髓动员增强了基因的作用,因而多途径地促进血管新生,对移植的干细胞存活率和改善肢体缺血均具有重要意义;⑶ 减少治疗所需MSCs细胞数量,有利于细胞的定向诱导分化;⑷ 采用腺病毒载体HGF基因转染MSCs后移植,可以有效避免干细胞移植和基因治疗分别进行时,由于病毒直接暴露于治疗对象的免疫系统,激发治疗对象免疫反应而产生毒性;⑸ Ad-HGF基因转染MSCs移植增加了转染效率,增加了可控性。
本实验将Ad-GFP以不同MOI感染BMSCs,流式细胞仪检测表明Ad-GFP可以高效地感染BMSCs,在MOI=150时感染效率最高,可以>98%。遂将Ad-HGF 以MOI=150感染BMSCs,ELISA法检测HGF表达量。结果显示,HGF-BMSCs在10 d内可以持续表达HGF,其中转染后48 h表达量最高,平均值为(98.18±1.38)ng/ml,其后HGF表达呈现下降趋势。实验结果表明,转染Ad-HGF的BMSCs短时间内可以高表达HGF,并且其表达具有时间变化规律。与此同时利用流式细胞法检测HGFMSCs细胞表面特异性抗原,和未转染基因的BMSCs相似,仍然表达CD44、CD29阳性,不表达CD34、CD45,说明HGF基因转染不改变BMSCs表性特征。同时又观察了HGF-MSCs的多向分化潜能,对HGF-BMSCs进行体外成骨诱导培养3周后,行Ⅰ型胶原免疫细胞化学染色,显示HGF-BMSCs具有和BMSCs相同成骨诱导分化能力,HGF基因转染不影响BMSCs的分化潜能。综合上述2个方面表明,腺病毒载体HGF基因转染不改变BMSCs的生物学特性。同时为了明确Ad-HGF感染的BMSCs注入体内后,过表达分泌HGF是否将BMSC聚集在缺血组织局部发挥治疗作用,检测HGF对BMSC的趋化作用,发现HGF可以明显诱导BMSC迁移,而且存在剂量依赖关系。
本部分实验结果表明,HGF-BMSC保持了BMSCs特性,并且可以高效表达HGF,而HGF又对BMSC具有明显的趋化作用。由此可以推断,HGF-BMSC移植后在缺血局部高表达HGF,并且将BMSC迁移聚集在缺血部位发生作用,促进血管新生。
[1]Bussolino F, Di RM, Ziche M, et al. Hepatocyte growth factor is a potent angiogenic factor which stimulates endothelial cell motility and growth. J Cell Biol, 1992, 119 (3): 629-641.
[2]Ma H, Calderon TM, Fallon JT, et al. Hepatocyte growth factor is a survival factor for endothelial cells and is expressed in human atherosclerotic plaques. Atherosclerosis,2002, 164 (1): 79-87.
[3]Bardelli A, Longati P, Albero D, et al. HGF receptor associates with the anti-apoptotic protein BAG-1 and prevents cell death. EMBO, 1996, 15 (22): 6205-6212.
[4]Fan S, Ma YX, Mang JA, et al. The cytokine hepatocyte growth factor /scatter factor inhibits apoptosis and enhances DNA repair by a common mechanism involving signaling through phosphatidyl inositol 3' kinase. Onocgene, 2000, 19 (18): 2212-2223.
[5]Ratajczak MZ, Marlicz W, Ratajczak J, et al. Effect of hepatocyte growth factor on early human haemopoietic cell development. Br J Haematol, 1997, 99 (1): 228-236.
[6]Ohmichi H, Matsumoto K, Nakamura T. In vivo mitogenic action of HGF on lung epithelial cells: pulmotrophic role in lung regeneration. Am J Physiol, 1996, 270 (6): 1031-1039.
[7]Kato Y, Yu D, Lukish JR, et al. Influence of luminal hepatocyte growth factor on small intestine mucosa in vivo. J Surg Res, 1997, 71 (1): 49-53.
[8]Kawaida K, Matsumoto K, Shimazu H, et al. Hepatocyte growth factor prevents acute renal failure and accelerates renal regeneration in mice. Proc Natl Acad Sci USA, 1994,91 (10): 4357-4361.
[9]Yoshimura R, Watanabe Y, Kasai S, et al. Hepatocyte growth factor (HGF) as a rapid diagnostic marker and its potential in the prevention of acute renal rejection. Transpl Int, 2002, 15 (4): 156-162.
[10]Ueki T, Kaneda Y, Tsutsui H, et al. Hepatoeyte growth factor gene therapy of liver cirrhosis in rats. Nat Med, 1999, 5 (2): 226-230.
[11]Van BE, Witzenbichler B, Chen D, et al. Potentiated angiogenic effect of scatter factor/hepatocyte growth factor via induction of vascular endothelial growth factor: the case for paracrine amplification of angiogenesis. Circulation,1998, 97 (4): 381-390.
[12]Hayashi S, Morishita R, Higaki J, et al. Autocrine-paracrine effects of overexpression of hepatocyte growth factor gene on growth of endothelial cells. Biochem Biophys Res Commun, 1996, 220 (3): 539-545.
[13]Takai K, Hara J, Matsumoto K, et al. Hepatocyte growth factor is constitutively produced by human bone marrow stormal cells and indirectly promotes hematopoiesis. Blood,1997, 89 (5): 1560-1565.
[14]Neuss S, Becher E, Woltje M, et al. Functional expression ofHGF and HGF receptor/c-met in adult human mesenchymal stem cells suggests a role in cell mobilization,tissue repair,and wound healing. Stme Cells, 2004, 22 (3): 405-414.
[15]Qian LW, Mizumoto K, Maehara N, et al. Co-cultivation of pancreatic cancer cells with orthotopic tumor-derived fibroblasts: fibroblasts stimulate tumor cell invasion via HGF secretion whereas cancer cells exert a minor regulative effect on fibroblasts HGF production. Cancer Lett, 2003, 190 (1): 105-112.
[16]Chen X, Li Y, Wang L, et al. Ischemic rat brain extracts induce human marrow stromal cell growth factor production. Neuropathology, 2002, 22 (4): 275-279.
[17]Chen X, Katakowski M, Li Y, et al. Human bone marrow stromal cell cultures conditioned by traumatic brain tissue extracts: growth factor production. J Neurosci Res, 2002, 69 (5): 687-691.
[18]Tarui T, Majumdar M, Miles LA, et al. Plasmin-induced migration of endothelial cells. A potential target for the antiangiogenic action of angiostatin. J Biol Chem, 2002, 277(37): 33564-33570.
[19]Mah C, Byrne BJ, Flotte TR. Virus-based gene delivery systems. Clin Pharmacokinet, 2002, 41 (12): 901-911.
[20]Losordo DW, Vale PR, Symes JF, et al. Gene Therapy for Myocardial Angiogenesis: initial clinical results with direct myocardial injection of phVEGF 165 as sole therapy for myocardial ischemia. Circulation, 1998, 98 (98): 2800-2804.
[21]Rosengart TK, Lee LY, Patek SR, et al. Angiogenesis gene therapy: phase I assessment of direct intra myocardial administration of an adenovirus vector expressing VEGF 121 cDNA to individuals with clinically significant severe coronary artery disease. Circulation, 1999, 100 (5): 468-474.
[22]Mack CA, Patel SR, Schwarz EA, et al. Biologic bypass with the use of adenovirus-mediated gene transfer of the complementary deoxyribonucleic acid for vascular endothelial growth factor 121 improves myocardial perfusion and function in the ischemic porcine heart. J Thorac Cardiovasc Surg, 1998, 115 (1): 168-177.
Preparation of BMSCs transduced with Ad-HGF and invitro experiment
ZHOU Hua1WANG Guang-wen2KONG Xiang-qian1WANG Mo1JIN Xing1*WU Xue-jun11Department of Vascular Surgery, Provincial Hospital affiliated to Shandong University, Jinan 250021, China
2Department of Vascular Surgery, People's Hospital, Qingzhou 262500, China
Objectives Rabbit bone marrow mesenchymal stem cells (BMSCs) were causing transdution with hepatocytegrowth factor (HGF) by adenovirus vector. With the fowing of cytometry, transduction efficiency could be detected. Transgene expression of HGF invitro were evaluated by using ELISA and immunohistochemical methods. Methods BMSCs were plated and cultivated in 6 holes plate by using a density of 1.5×105/per hole after digested with pancreatic enzyme. 50 ul Ad-GFP with 6 different MOI (multiple of infection) was put into each hole to transduce BMSCs,with 3 duplicated holes for each MOI. BMSCs were transduced with Ad-hgf at MOI=150. BMSCs were added to silicificated slice and cultivated after digested with pancreatic enzyme. Afterwards BMSCs were detected with ELISA and immunohistochemical methods. Furthermore, transwell was used to detect the efficiency of BMSC migration mediated by HGF. Results 48 h after BMSCs transduction with Ad-GFP at different MOI, percentage of GFP-positive cells showed significant difference (P<0.05). Percentage of GFP-positive cells increased as MOI increased. However there was no significant difference (P>0.05) when MOI was bigger than 150. When MOI=150, GFP-positive cells were over 98%. Consequently MOI=150 was ideal for BMSCs transduction. When BMSCs were transduced with Ad-HGF at MOI=150, the results of ELISA and immunohistochemistry indicated that Ad-HGF might effectively transducer BMSCs. Besides, the transduced BMSCs revealed that the high HGF expression was of great efficiency. The result indicated that the migration of BMSCs was promoted by HGF as well. Conclusions Ad-GFP transduced BMSCs is feasible. As MOI=150, GFP-positive cells were bigger than 98%. There were GFP-positive cells only 24 h after transduction with peak percentage from 2 d to 7 d. The results turn out that adenovirus vector possesses high effieiency transduction and stable gene expression. Results of ELISA and immunohistochemitry testify that Ad-HGF could effectively transduce BMSCs and that transduce BMSCs possesses high efficiency of HGF gene expression invitro.
bone mesenchymal stem cells; HGF; transfection
Q78
A
2096-0646.2016.02.03.19
金星,E-mail:jinxing_888@163.com

